Экосистемы, 30: 106–113 (2022) https://ekosystems.cfuv.ru
![]()
УДК 576.895.122:594 (262.5)
Helicometra fasciata (Rud., 1819) sensu stricto
(Trematoda: Opecoelidae): морфология, поведение
Корнийчук Ю. М.
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
Экспериментально установлена принадлежность церкарий, эмитируемых брюхоногими моллюсками Steromphala adriatica (Philippi, 1844) (syn.: Gibbula adriatica (Philippi, 1844) с крымского участка шельфовой зоны Черного моря (район Севастополя), к виду Helicometra fasciata (Rud., 1819) sensu stricto. На оригинальном материале описан морфологический облик разновозрастных церкарий этой трематоды, приведены размеры тела и органов личинок и их морфологические рисунки. Описано поведение зрелых церкарий, эмитируемых моллюсками
- морскую воду и показано, что заражение церкариями вторых промежуточных хозяев, черноморских креветок и крабов, осуществляется в результате использования церкариями комплекса «засадных» поведенческих реакций – «позы ожидания», «исследовательских» и последующей атаки хозяина без его активного преследования, что соответствует типичной для короткохвостных церкарий трематод «стратегии пассивного ожидания».
Ключевые слова: Чёрное море, Helicometra fasciata, трематоды, церкарии, поисковое поведение, Steromphala adriatica.
ВВЕДЕНИЕ
Helicometra fasciata (Rud., 1819) sensu lato – одна из наиболее типичных трематод черноморских биоценозов цистозиры (Гаевская, Корнийчук, 2003); её жизненный цикл в Чёрном море изучен (Корнийчук, 2006, 2008а, 2008б, 2009). Позднее было показано, однако, что в Чёрном море существуют как минимум два вида трематод, по морфологическим признакам соответствующие описанию H. fasciata, но отличающиеся первичной структурой участка гена сох1, степенью развития гонад и протяженностью желточных полей, а также проявляющие различную гостальную специфичность по отношению к окончательным хозяевам, рыбам (Катохин, Корнийчук, 2020).
Таким образом, необходима верификация видовой принадлежности различных стадий жизненного цикла черноморских хеликометр; морфологические особенности церкарий Helicometra требуют детализации, также нет опубликованных сведений о поведении личинок.
Цель настоящей работы – экспериментально и сравнительным путём установить систематическое положение церкарий Helicometra от черноморских брюхоногих моллюсков Steromphala adriatica (Philippi, 1844), дать их морфологическую характеристику и описать поведение эмитированных моллюсками зрелых личинок.
МАТЕРИАЛ И МЕТОДЫ
Гастропод S. adriatica собирали ручным скребком с причальной стенки в бухте Карантинная (г. Севастополь) на глубине до 1,5 м, креветок Palaemon elegans Rathke, 1836 – там же, при помощи ручного сачка.
Паразитологические вскрытия моллюсков проводили в общепринятом порядке; строение церкарий разной степени зрелости исследовали в капле воды на живых объектах, в том числе обездвиженных нагреванием, и на окрашенных раствором Люголя, а также на окрашенных уксусным кармином тотальных бальзамовых препаратах (Быховская-Павловская, 1985). Размеры тела и органов живых личинок (N=15 экз.) приведены в миллиметрах.
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Церкарии трематоды Helicometra fasciata (Rud., 1819)
sensu stricto (Trematoda: Opecoelidae): морфология, поведение
![]()
Для выяснения видовой принадлежности церкарий, эмитируемых моллюсками S. adriatica, был проведен лабораторный эксперимент. В аквариум с морской водой на 1 сутки были помещены два моллюска S. adriatica, активно выделяющих церкарий, и 20 сеголеток креветок P. elegans длиной 26–32 мм. По данным предварительных контрольных вскрытий, креветки указанного размера были свободны от заражения метацеркариями трематод. Температура морской воды во время опыта изменялась от +20 до +23 С. В отдельном аквариуме содержали 6 собачек-сфинксов Aidablennius sphynx (Valenciennes, 1836) длиной 54– 62 мм, которые, по нашим данным, в природных условиях заражены маритами рода Helicometra чрезвычайно слабо (индекс обилия – 0,07 экз./особь). Через 2, 6, 10, 15 и 20 суток после заражения церкариями вскрывали по 3 экз. креветок. Кусочки торакальной мускулатуры креветок с метацеркариями скармливали отсаженной в отдельный микроаквариум собачке-сфинксу, содержимое кишечника которой просматривали спустя 3 суток под стереомикроскопом.
Для изучения поведения церкарий использовали вышедших в воду зрелых личинок; температура воды в микроаквариуме при проведении лабораторных экспериментов соответствовала таковой воды в море в период отбора проб хозяев (сентябрь). Свежесобранных моллюсков выдерживали в чашках Петри в течение суток, после чего особей, эмитирующих церкарий, отсаживали по одному в микроаквариумы диаметром 6,5 и высотой 3,5 мм. Морскую воду в микроаквариумах меняли один раз в сутки, моллюсков трижды в сутки отсаживали на 2 часа в чашку Петри с кусочками талломов свежесобранной ульвы и цистозиры для кормления. За поведением церкарий наблюдали непосредственно в микроаквариуме; скорость движения личинок определяли, используя миллиметровую сетку на его дне.
Камеральную обработку материала проводили с использованием стереомикроскопов МБС-10, МБИ 11У4.2, Биолам Д-12 и рисовального аппарата РА-4.
РЕЗУЛЬТАТЫ
Морфология церкарий. Ранние эмбрионы церкарий, находящиеся в дочерних спороцистах (рис. 1а), имеют маленький зернистый хвост и тонкостенный, с узким щелевидным просветом, выделительный пузырь; железы проникновения не видны. Ротовая присоска оформляется раньше брюшной и у самых мелких зародышей хорошо заметна только одна присоска.
По мере роста эмбрионов увеличиваются относительные размеры экскреторного пузыря, утолщаются его стенки, закладываются железы проникновения и стилет (рис. 1б). Расстояние от головного конца до центра брюшной присоски таких зародышей составляет 63–65 % длины собственно тела личинки (без хвоста).
Почти совершенно созревшие эмбрионы (рис. 1в) размерами собственно тела (без учета зачатка хвоста) 0,150–0,192×0,060–0,066 отличаются крупным светлым выделительным пузырем, внутренняя полость которого отчетливо не видна. Передний отдел хвостового придатка церкарии состоит из хорошо заметных светлых клеток с крупными ядрами.
Полностью зрелые выходящие в морскую воду церкарии относятся к котиломикроцеркному типу (рис. 1г). Тело зрелых личинок цилиндрическое, размерами 0,198–0,300×0,066–0,072; хвостовой придаток почти шаровидный (0,042–0,048×0,052–0,060),
- функционирующей как присоска мускулистой задней частью. Ядра крупных (из-за чего хвост личинки под микроскопом кажется зернистым) клеток передней части хвоста заметны плохо. Хвостовой придаток церкарии интенсивно окрашивается раствором Люголя, что указывает на сосредоточение в нем значительных запасов гликогена личинки.
Ротовая присоска церкарии удлиненно-овальная, размером 0,054–0,057×0,042–0,048, вооружена стилетом (рис. 2а), имеющим форму усеченного конуса с обращенной к заднему концу тела личинки вершиной, на широком плато которого помещаются два слегка наклоненных в противоположные стороны конических острия, расположенные во фронтальной плоскости. Основание стилета погружено в мускулатуру присоски (рис. 2б).
107
Корнийчук Ю. М.
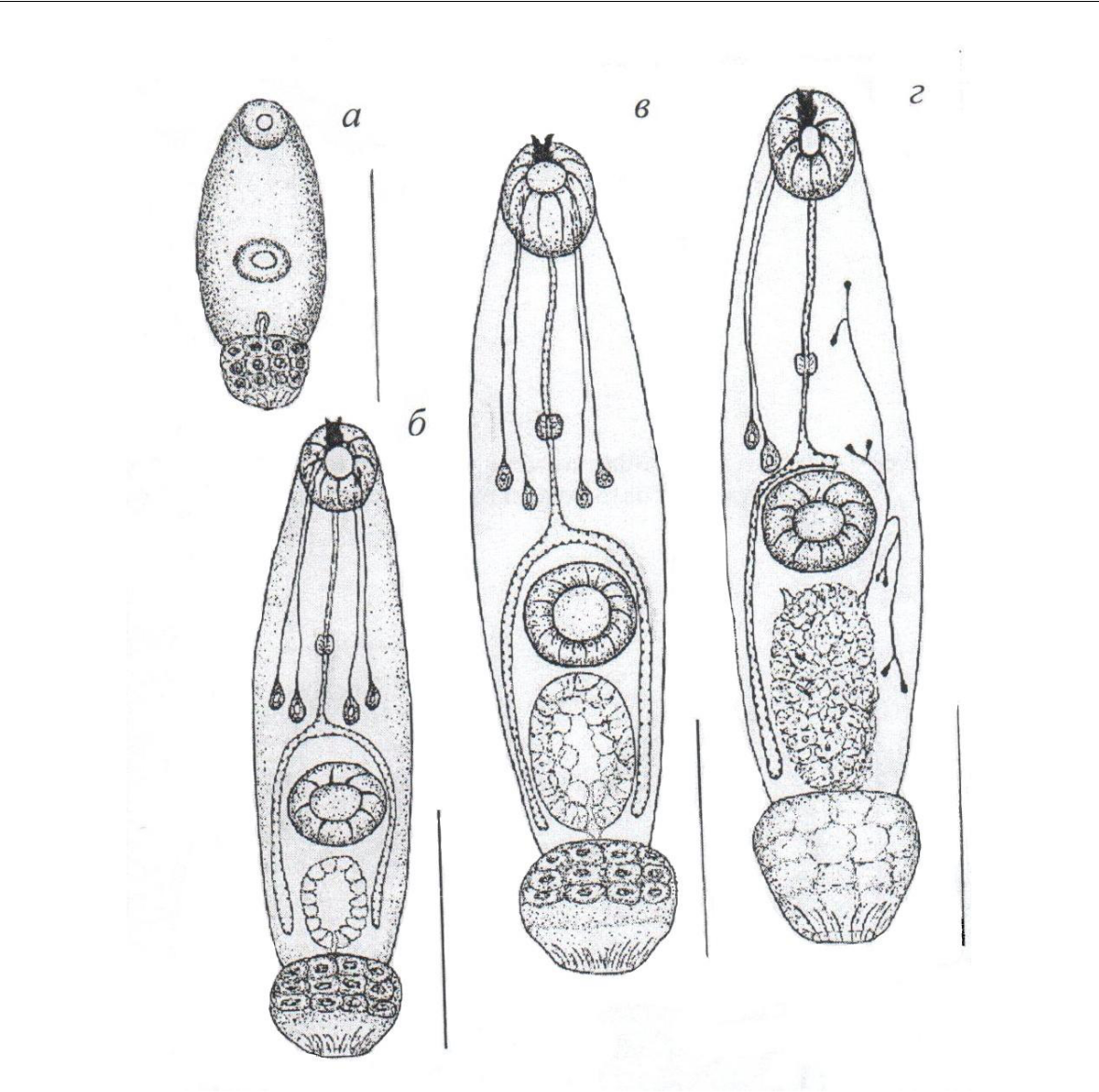
Рис. 1. Церкарии разной степени зрелости из моллюска Steromphala adriatica
- – ранний эмбрион церкарии; б, в – более зрелые личинки; г – зрелая церкария, выходящая в воду. Масштабная линейка – 0,05 мм.
Брюшная присоска почти округлая, 0,048–0,054 в диаметре. Обе присоски содержат значительные количества гликогена, однако окрашиваются раствором Люголя менее интенсивно, чем хвостовой придаток.
Выделительный пузырь зрелых личинок округлый или овальный, размерами 0,048– 0,060×0,042–0,054, расположен между брюшной присоской и хвостом церкарии. У зрелых личинок он желто-коричневого цвета, у не вполне еще сформированных зародышей церкарий
– беловато-желтый. Стенки пузыря образованы крупными клетками с большими пузырчатыми ядрами. От задней его части по направлению к хвосту отходит узкий проток, хорошо заметный у ранних эмбрионов и незрелых церкарий. В антеро-латеральные углы выделительного пузыря впадают основные собирательные каналы. Формула экскреторной системы личинки: 2 [(2+2)+(2+2)] (на рисунке 1г показана половина этой части выделительной системы личинок, для наглядности). Выделительный пузырь зрелых личинок
108
Церкарии трематоды Helicometra fasciata (Rud., 1819)
sensu stricto (Trematoda: Opecoelidae): морфология, поведение
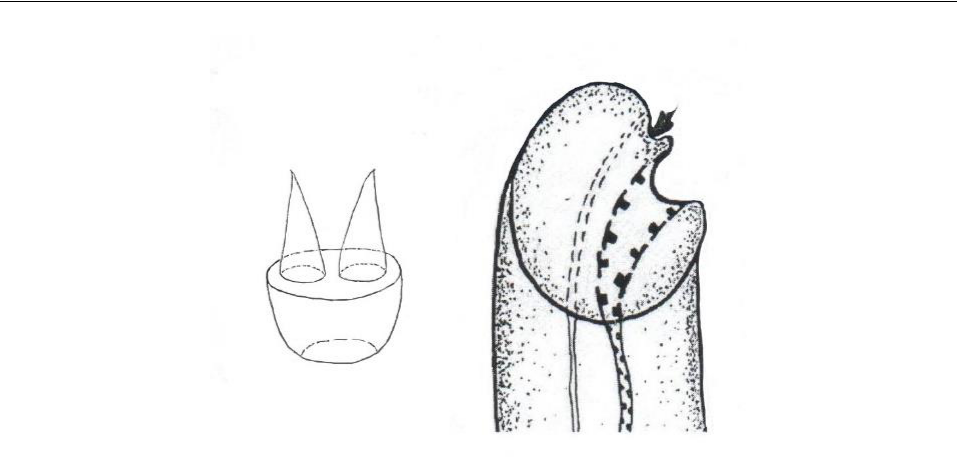
a б
Рис. 2. Стилет (а) и его положение внутри
ротовой присоски (б) церкарии из моллюска Steromphala adriatica
занимает значительную часть задней половины их тела, что приводит к смещению брюшной присоски (у зрелых особей она располагается постэкваториально, ее центр удален от переднего конца тела личинки на расстояние, составляющее 68–69 % длины тела без хвоста).
Вооружение тегумента отсутствует.
Половой зачаток при световом микроскопировании не виден.
Пищеварительная система представлена префаринксом, фаринксом, пищеводом и кишечными ветвями, тянущимися почти до заднего конца тела церкарии. Бифуркация кишечника не достигает переднего края брюшной присоски.
Стилетных желез две пары, они расположены между фаринксом и передним краем брюшной присоски. Задний край латеральной пары клеток этих желез находится на уровне переднего края ядер клеток внутренней пары. Протоки стилетных желез открываются у основания стилета.
Поведение церкарий. Вышедшие из моллюска церкарии перемещаются по субстрату, фиксируя на нем свое тело попеременно брюшной и ротовой присосками. Такое поведение личинок на начальном этапе дисперсии способствует их рассредоточению и увеличению шансов на встречу со вторым промежуточным хозяином. Церкарии в возрасте 1–3 ч. способны перемещаться с максимальной скоростью 0,6 мм/сек.
Периодически церкарии прикрепляются к субстрату хвостовым придатком, при этом тело их вытянуто, передняя часть его наклоняется из стороны в сторону (типичная «поза ожидания») и время от времени совершает разнонаправленные «сканирующие» вращения и наклоны большей амплитуды в стороны от вертикальной оси (комплекс «исследовательских» реакций). В течение нескольких минут церкария совершает описанные движения, будучи прикрепленной к субстрату, затем переползает в сторону и снова принимает «позу ожидания».
Ползающая церкария не реагирует на колебания воды. Воздействия на личинку, прикрепившуюся к субстрату, неспецифических гидродинамических возмущений (ток воды из микропипетки, покачивание чашки Петри с церкариями) вызывают резкое поначалу увеличение частоты и амплитуды «сканирующих» движений, однако они остаются ненаправленными. Церкарии не совершают попыток переползти в направлении источника колебаний и через некоторое время вновь возвращаются в «позу ожидания». Очевидно, отсутствие реакции атаки в ответ на неспецифические раздражители экономит энергетические ресурсы личинки.
109
Корнийчук Ю. М.
![]()
Слабые колебательные движения иглы в непосредственной близости от прикрепившейся хвостом личинки вызывают ее направленную реакцию: «сканирующие» движения совершаются преимущественно в направлении источника колебаний. Вероятно, в естественных условиях церкарии подобным образом реагируют на токи воды, создаваемые при плавании и дыхательных движениях близко проплывающих вторых промежуточных хозяев, затем следует атака, завершающаяся прикреплением к хозяину и ее последующим заражением.
-
- личинок в возрасте более 1 суток поза ожидания модифицируется: тело прикрепившейся к субстрату церкарии сжато, только в ответ на колебания воды оно распрямляется, и личинка совершает несколько нерезких «сканирующих» наклонов; скорость передвижения личинок падает до 0,2 мм/сек. и увеличивается доля времени, проводимого личинкой в «позе ожидания» – за счет сокращении длительности периодов переползания и «сканирования». LD50=4 сут., максимальную продолжительность жизни имеют 4 % церкарий;
- конце периода активности личинки вяло реагируют лишь на непосредственное прикосновение, но уже не на вибрацию воды.
Эксперимент по выяснению видовой принадлежности церкарий. Эмитируемые моллюсками S. adriatica церкарии заразили каменных креветок и сформировали в их торакальной мускулатуре метацеркарии с полями желточных фолликул, тянущимися до уровня брюшной присоски.
Заразить собачку-сфинкса удалось только 20-дневными метацеркариями: в кишечнике рыбы было обнаружено три экз. ювенильных марит H. fasciata, желточные поля которых также простирались не далее уровня середины брюшной присоски.
ОБСУЖДЕНИЕ
Результаты эксперимента по заражению креветок позволяют идентифицировать эмитируемых черноморскими моллюсками S. adriatica церкарий как Helicometra fasciata sensu stricto, поскольку именно этот вид из комплекса H. fasciata sensu lato характеризуется короткими желточными полями, заканчивающимися на уровне от середины брюшной присоски червя до ее переднего края (Stossich, 1904).
Мариты H. fasciata s. str. описаны от средиземноморских рыб семейства Labridae (Stossich, 1904; Palombi, 1929; Gargouri et al., 2010), наиболее часто – от зеленушек-рулен Symphodus tinca (Linnaeus 1758). В Чёрном море также отмечается спонтанная зараженность S. tinca маритами H. fasciata с короткими желточными полями (Корнийчук, 2000, 2009); установлено также что мариты Helicometra от S. tinca отличаются от марит из прочих черноморских рыб-хозяев структурой гена сох1 (Катохин, Корнийчук, 2020). Заметим, однако, что у рулен известна не только H. fasciata с короткими желточными полями, но встречаются также и H. fasciata s. lato.
Церкарии котиломикроцеркного типа характерны для практически всех представителей семейства Opecoelidae, за единственным исключением – Helicometra gibsoni Meenakshi, Madhavi & Swarnkumari, 1993 (Meenakshi et al., 1993). Основными диагностическими признаками церкарий этой группы являются число стилетных желез, форма хвоста и стилета (Palombi, 1938; Dollfus, 1960).
-
- Чёрном море известны три котиломикроцеркные церкарии – (1) Cercaria сaradagi Dolgikh, 1966 из гастропод Steromphala divaricata (Linnaeus, 1758) (=Gibbula divaricata) и Gibbula euxinixa (найдены в акватории Карадагского природного заповедника), (2) Cercaria cotylicerca В Dollfus, 1960, эмитируемые S. divaricata в акваториях Карадагского заповедника
- Севастополя (бухты Омега и Карантинная), и (3) Cercaria gibbulae Dolgikh, 1966 от
Steromphala albida (Gmelin, 1791) (=Gibbula albida) (Долгих, 1966) из прибрежья Балаклавы.
Все эти личинки ни при их описании, ни впоследствии не были сопоставлены маритам каких-либо видов трематод. Заметим, что упоминаемый в работах А. В. Долгих (1966) и А. В. Гаевской (2015) моллюск G. euxinixa не может быть соотнесен с известными
110
Церкарии трематоды Helicometra fasciata (Rud., 1819)
sensu stricto (Trematoda: Opecoelidae): морфология, поведение
![]()
представителями морских Gastropoda (https://www.marinespecies.org/aphia.php?p=taxdetails&id=138590).
C. gibbulae имеют одновершинный стилет и 22–24 стилетных железы (Долгих, 1966) и тем отличаются от исследуемых нами личинок, от C. сaradagi и C. cotylicerca В.
Описанная нами церкария наиболее сходна с C. сaradagi: обе они имеют по две пары желез проникновения и обе отличаются от C. cotylicerca В отсутствием мышечного валика вокруг брюшной присоски. Четыре острия стилета в первоописании C. сaradagi (Долгих, 1966) мы склонны считать ошибкой: стилет описываемой нами формы (рис. 2) тоже мог бы быть сочтен четырехвершинным, если рассматривать его проекцию на плоскость. В таком случае стилет описываемой нами церкарии такой же формы, что и у C. сaradagi, причем обе эти личинки отличаются от C. cotylicerca В, имеющей одновершинный стилет (Dollfus, 1960).
Обследованные нами церкарии не имели тегументальных шипиков, о наличии которых у C. caradagi сообщает А. В. Гаевская (2015), причисляя при этом C. caradagi к семейству Opecoelidae. Но невооруженный тегумент является одним из диагностических признаков трематод семейства Opecoelidae (Определитель…, 1975) и это противоречие, в сочетании с отсутствием упоминания тегументальных шипиков в первоописании и на рисунке личинки, ранее данных этим же автором (Долгих, 1966), позволяет нам предположить ошибочность позднейшего указания на их наличие (Гаевская, 2015).
Таким образом, мы отмечаем макроморфологическое соответствие церкарий H. fasciata
- str. и C. сaradagi.
- Чёрном море в качестве вторых промежуточных хозяев H. fasciata s. lato известны каменные креветки P. elegans (Корнийчук, 2008б), травяные креветки Palaemon adspersus Rathke, 1836 (Мордвинова, 1980; Корнийчук, 2008б, Лозовский, 2016) и зеленые крабы Carcinus aestuarii Nardo, 1847 (Корнийчук, Лозовский, 2005). Результаты нашего исследования однозначно определяют в качестве вторых промежуточных хозяев H. fasciata s. str. в Чёрном море пока что только каменных креветок P. elegans. Заражение этих ракообразных церкариями H. fasciata s. str. осуществляется в результате использования личинками трематоды комплекса «засадных» (Прокофьев, 1994) поведенческих реакций – «позы ожидания» (Гинецинская, 1968), «исследовательских» и атаки хозяина без его активного преследования, что соответствует типичной для короткохвостных церкарий семейства Opecoelidae «стратегии пассивного ожидания» (Прокофьев, Галактионов, 2009).
ЗАКЛЮЧЕНИЕ
Экспериментально установлена принадлежность церкарий, эмитируемых черноморскими брюхоногими моллюсками Steromphala adriatica (Phil.) (syn.: Gibbula adriatica (Phil.) из внутренних бухт Севастополя к виду Helicometra fasciata (Rud., 1819) s. str.
На оригинальном материале описан морфологический облик разновозрастных церкарий этой трематоды, приведены зоологические рисунки и размеры тела и органов личинок.
Описано поведение зрелых церкарий H. fasciata s. str., эмитируемых моллюсками S. adriatica в морскую воду, и установлено, что заражение ими вторых промежуточных хозяев, черноморских креветок и крабов, осуществляется в результате использования церкариями комплекса «засадных» поведенческих реакций – «позы ожидания», «исследовательских» и последующей атаки хозяина без его активного преследования, что соответствует типичной для короткохвостных церкарий трематод семейства Opecoelidae «стратегии пассивного ожидания».
Работа выполнена в рамках госзадания ФИЦ ИнБЮМ по теме «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана», гос. рег. № 121030100028-0.
111
Корнийчук Ю. М.
![]()
Список литературы
Быховская-Павловская И. Е. Паразиты рыб: руководство по изучению. – Л: Наука: Ленингр. отд. – 1985. –
- с. https://doi.org/10.21072/bykhovskaya-pavlovskaya-1985
Гаевская А. В. Трематодофауна моллюсков прибрежных вод юго-восточного Крыма (Чёрное море) // 100 лет Карадагской научной станции им. Т. И. Вяземского: сборник научных трудов / [Ред. А. В. Гаевская, А. Л. Морозова]. – Симферополь, Нова Орiанда, 2015. – С. 605–625.
Гаевская А. В., Корнийчук Ю. М. Паразитические организмы как составляющая экосистем черноморского побережья Крыма / Современное состояние биоразнообразия прибрежных вод Крыма (черноморский сектор) / [Ред.: В. Н. Еремеев, А. В. Гаевская]. – Севастополь: ЭКОСИ-Гидрофизика, 2003. – С. 425–490. https://doi.org/10.21072/966-02-3133-4
Гинецинская Т. А. Трематоды, их жизненные циклы, биология и эволюция. – Л.: Наука, 1968. – 411 c. Долгих А. В. Личинки трематод семейства Opecoelidae Ozaki, 1925 – паразиты черноморских моллюсков //
Зоологический журнал. – 1966. – Т. 45, вып. 2. – С. 295–297.
Катохин А. В., Корнийчук Ю. М. Генотипирование черноморских трематод семейства Opecoelidae по митохондриальным маркерам // Морской биологический журнал. – 2020. – Том 5, № 4. – С. 15–27. https://doi.org/10.21072/mbj.2020.05.4.02
Корнийчук Ю. М. Дополненное описание гермафродитного поколения трематоды черноморских рыб Helicometra fasciata (Trematoda, Opecoelidae) // Вестник зоологии. – 2009. – Отд. вып. № 23. – С. 63–68.
Корнийчук Ю. М. О морфологической изменчивости черноморских представителей рода Helicometra (Trematoda: Opecoelidae) // Экология моря. – 2000. – Вып. 51. – С. 40–44.
Корнийчук Ю. М. Партеногенетические поколения Helicometra fasciata Rud.,1819 (Trematoda: Opecoelidae) в черноморских моллюсках Gibbula adriatica // Паразитология. – 2008а. – Т. 42, № 1. – C. 41–52.
Корнийчук Ю. М. Сезонная динамика численности и качественного состава гемипопуляции метацеркарий трематоды Helicometra fasciata на юго-западном шельфе Крыма // Экология моря. – 2008б. – Вып. 75. – С. 9–15.
Корнийчук Ю. М. Черноморские молюски Gibbula adriatica (Phil.) – звено жизненного цикла трематоды Helicometra fasciata (Rud., 1819) // Еколого-функціональні та фауністичні аспекти дослідження молюсків, їх роль у біоіндикації стану навколишнього середовища. – Житомiр, 2006. – Вип. 2. – С. 146–149.
Корнийчук Ю. М., Лозовский В. Л. Черноморский зелёный краб Carcinus aestuarii – новый дополнительный хозяин трематоды Helicometra fasciata // Морской экологический журнал. – 2005. – Т. 4, № 2. – С. 38.
Лозовский В. Л. О зараженности черноморских креветок Palaemon adspersus метацеркариями трематод Helicometra fasciata и Gynaecotyla adunca // Современные проблемы теоретической и морской паразитологии: сборник научных статей / [Ред.: К. В. Галактионов, А. В. Гаевская]. – Севастополь: Изд-ль Бондаренко Н. Ю. – 2016. – С. 98–99.
Мордвинова Т. Н. Гельминтофауна высших ракообразных Крымского побережья северо-западной части Черного моря (систематика, фаунистика, экология): автореф. дисс… канд. биол. наук. – М. – 1980. – 22 с.
Определитель паразитов позвоночных Черного и Азовского морей / [Ред.: В. Н. Грезе, С. Л. Делямуре, В. М.
Николаева]. – Киев: Наукова думка, 1975. – 551 с. https://doi.org/10.21072/Guide_parasites_vertebrate_Black_Azov_Seas
Прокофьев В. В. «Засадный» тип поведения церкарий некоторых морских трематод // Зоологический журнал. – 73 (5). – 1994. – C. 13– 20.
Прокофьев В. В., Галактионов К. В. Стратегии поискового поведения церкарий трематод // Труды Зоологического института РАН. – 2009. – Том 313, № 3. – С. 308–318.
Dollfus R.-Ph. Recherches expérimentales sur Nicolla Gallica (R.-Ph. Dollfus 1941) R.-Ph. Dollfus 1958, sa cercaire cotylicerque et sa métacercaire progénétique. Observations sur la famille des Coitocaecidæ Y. Ozaki 1928, s.f. Coitocaecinæ F. Poche 1926 Trematoda podocotyloidea et sur les cercaires cotylicerques d’eau douce et marines // Annales de parasitology humanie et comparée – 1960. – Vol. 35, N 1–2. – P. 65–115. https://doi.org/10.1051/parasite/1959345595 Gargouri Ben Abdalah L., Elbohli S., Maamouri F. Digenean diversity in labrid fish from the Bay of Bizerte in
Tunisia // Journal of Helminthology. – 2010. – 84(01). – P. 27–33. doi:10.1017/s0022149x09990022
Meenakshi M., Madhavi R., Swarnakumari V. G. M. The life-cycle of Helicometra gibsoni n. sp. (Digenea:
Opecoelidae) // Systematic Parasitology. – 1993. – Vol. 25, N 1. – P. 63–72.
Palombi A. Gli stadi larvali dei trematodi del Golfo di Napoli. Secondo contributo allo studio della morfologia biologia e sistematica della cercarie marine: il gruppo delle Cercarie cotylocerche // Rev. Parasit. – Roma, 1938. – 2. – P. 189–206.
Palombi A. Ricerche sul ciclo evolutivo di Helicometra fasciata (Rud.). Revisione delle specie del genere Helicometra Odhner // Pubblicazioni della Stazione Zoologica di Napoli. –1929. – IX. – P. 1–55.
Stossich M. Al cuni distomi della collezione elmintologica del museozoologico di Napoli // Annuario del Museo Zoologico della R. Università di Napoli, Nuova Serie. – 1904. – Vol. 1. – P. 1–14.
112
Церкарии трематоды Helicometra fasciata (Rud., 1819)
sensu stricto (Trematoda: Opecoelidae): морфология, поведение
![]()
Kornyychuk Yu. M. The cercariae of Helicometra fasciata (Rud., 1819) sensu stricto (Trematoda:
Opecoelidae): morphology and behavior // Ekosistemy. 2022. Iss. 30. P. 106–113.
The gastropods Steromphala adriatica (Philippi, 1844) (syn.: Gibbula adriatica (Philippi, 1844) from the North Black Sea (Crimean shelf zone, near Sevastopol) were found to emit cercariae; the taxonomic position of these larvae was stated experimentally as Helicometra fasciata (Rud., 1819) sensus tricto. The original data on H. fasciata s. str. cercariae morphological details and dimensions of larvae body and organs are provided as well as appropriate morphological drawings are given. The behavior of H. fasciata s. str. cercariae emitted by mollusks into the sea water is described and the larvae are confirmed to use a complex of ambuscade behavioral reactions – “waiting posture”, “exploratory” reactions and subsequent attack of the host without its active pursuit to infect the second intermediate hosts, Black Sea shrimps and crabs; this kind of behavior is emphasized as typical for “passive waiting strategy” of Opecoelidae short-tailed cercariae.
Key words: Black Sea, Helicometra fasciata, trematodes, cercariae, host-search behavior, Steromphala adriatica.
Поступила в редакцию 18.04.22
Принята к печати 03.06.22
113

