Экосистемы, 33: 7–20 (2023) https://ekosystems.cfuv.ru
![]()
УДК [595.36-15:57.06] (292.471-751.2)
Бондаренко Л. В., Тимофеев В. А.
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
bondarenko.luda@gmail.com; tamplier74@mail.ru
На основании литературных и собственных данных в период с 1938 по 2021 годы на скальном субстрате в акватории Карадагского природного заповедника с учётом визуальных наблюдений обнаружены 75 видов Arthropoda. Malacostraca представлены 67 видами. Наиболее многочисленным по таксономическому составу является отряд Amphipoda.За прошедшие десятилетия как в качественном составе, так и в количественных показателях макрозообентоса скал Карадага произошли существенные изменения. 12 видов Malacostraca отмечены на скальном субстрате только в 30-е годы ХХ столетия. Ракообразные родов Biancolina, Hippolyte, Pisidia, Xantho
- Stenosoma с 70-х годов представлены другими видами. Следует отметить появление в бентосных пробах 2021
года трёх видов бокоплавов: Colomastix pusilla Grube, 1861, Microdeutopus versiculatus (Spence Bate, 1857),
Monocorophium acherusicum (Costa, 1853), декаподы Processa edulis (Risso, 1816) и танаидового рака Tanais dulongii (Audouin, 1826). Наибольшее количество руководящих видов отмечено в 2021 году, их число выросло почти в 3 раза по сравнению с 30-ми годами, количество редких видов сократилось на 20 %. Наибольшая плотность поселения раков, 94 % которой составили амфиподы, наблюдалась в 2021 году. Высокий показатель биомассы отмечен в 1938–40 годах, основной вклад в который (65 %) внесли декаподы и амфиподы. Трофическая структура таксоцена Malacostraca в разные периоды исследований с учётом десятиногих раков, обнаруженных при визуальном наблюдении, представлена фито-, детрито-, полифагами и организмами пищевой спектр которых не изучен.
Ключевые слова: таксоцен Malacostraca, скальные субстраты, численность, биомасса, Карадаг.
ВВЕДЕНИЕ
Бентосные представители Arthropoda представляют собой одно из важнейших звеньев трофических цепей в море и заселяют практически все донные биотопы, включая скальные. Анализируя видовой состав и количественные параметры высших ракообразных, обитающих
- акватории Карадага, стоит рассматривать скалы как одну из стаций (Реймерс, 1988; Гиляров, 1989), которая характеризуется особыми экологическими условиями, необходимыми для существования вида, и используется либо в ограниченный период времени, либо для определённых целей.
Исследование зообентоса, обитающего на жёстких субстратах в Чёрном море в акватории Карадагской биостанции проведено в 1938–1940 годах группой исследователей под руководством И. В. Шаронова (Шаронов, 1952). В результате было дано полное описание видового состава сообщества биотопа скал и каменистых россыпей, а также проведён количественный учёт зообентоса, включая ракообразных, на глубинах от 0 до 2 м. Используя ту же методику, в акватории Карадагского природного заповедника в 1976–1978 годах (Синегуб, 2004) и в 2009–2012 годах (Болтачева и др., 2015) осуществлён сбор макрозообентоса естественных твёрдых субстратов (скал) с глубин от 0 до 5 м. Результаты этих исследований показали, что за прошедшие годы в сообществе скал Карадага произошли значительные изменения в таксоцене Malacostraca.
Цель нашей работы – изучить современное состояние высших ракообразных естественных твёрдых субстратов в акватории Карадагского природного заповедника и провести сравнительный анализ многолетних изменений таксономического состава и количественного развития Malacostraca скал исследуемой акватории.
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Бондаренко Л. В., Тимофеев В. А.
![]()
МАТЕРИАЛЫ И МЕТОДЫ
Работа основана на материалах бентосной съёмки, выполненной в районе Карадагского природного заповедника в 2021 году. Отобраны 24 пробы макрозообентоса, обитающего на скалах Маяк, Лев и Золотые ворота на глубинах от 0 до 5 м. Для сбора использовали бентосные рамки площадью 0,04 м2, обшитые мельничным газом. Промывали пробы через сито с диаметром ячеи 0,5 мм и фиксировали 4 % раствором нейтрализованного формалина. Визуальные наблюдения прибрежных участков проводили с применением водолазного снаряжения. Сбор десятиногих ракообразных осуществляли ручным способом. После таксономической идентификации особей декапод без повреждений возвращали в естественную среду обитания. Видовую идентификацию и выделение трофических групп осуществляли с помощью литературных источников (Определитель фауны…, 1969; Грезе, 1985; Grintsov, Sezgin, 2011; Аносов, 2016; Гринцов, 2022). Таксономическая принадлежность приводилась в соответствии с базами данных World Register of Marine Species (2022).
Необходимо отметить, что в местах сбора материала на скалах зарегистрированы макрофиты родов Cystoseira, Treptacantha, Phyllophora и представители Chlorophyta.
При описании количественного развития фауны высших ракообразных использованы показатели численности (N, экз./м2), биомассы (В, г/м2) и индекса функционального обилия (ИФО) в выражении:
ИФО = N0,25 × B0,75,
где: N – численность вида, экз./м2; B – биомасса вида, г/м2.
Ранжированная кривая доминирования-разнообразия видов строилась по расчётным значениям их индексов плотности (ИП) (Ревков, Болтачева, 2022):
ИП=ИФО×р,
где p – встречаемость вида (0–1).
Для сравнения сходства фауны рассчитывали коэффициент Чекановского – Съёренсена:
i = 2a/b+c,
где: а – число общих видов; b и c – число видов в сравниваемых списках.
Полученные материалы сравнивали с количественными данными 1938–1940 (Шаронов, 1952), 1976–1978 (Синегуб, 2004) и 2009–2012 годов (Болтачева и др., 2015). В работе И. В. Шаронова (Шаронов, 1952) автор не привёл полного списка видов, однако он сохранён
- рукописном варианте (Шаронов, рукопись) и был использован нами для сравнительного анализа количественного распределения ракообразных в разные периоды исследований.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
- акватории Карадагского природного заповедника на скальных субстратах в июле 2021 года обнаружено 37 видов Arthropoda. Представители классов Copepoda, Ostracoda, Hexapoda (Chironomidae) и Arachnida (Acari) до вида не идентифицированы. Каждый из этих таксонов рассматривали как один вид (табл. 1).
8
Таксоцен Malacostraca скальных субстратов акватории Карадагского природного заповедника
![]()
Таблица 1
Видовой состав и количественные показатели Arthropoda на скалах Карадага в разные
периоды исследований
| 1938–1940 годы | 1976–1978 годы | 2009–2012 годы | 2021 год | ||||||||
| Таксоны* | (Болтачева и др., | (собственные | |||||||||
| (Шаронов, 1952) | (Синегуб, 2004) | ||||||||||
| 2015). | данные) | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||
| N | B | N | B | N | B | N | B | ||||
| ARTHROPODA | |||||||||||
| Acari gen. sp. | 1 | 0,00004 | 165 | 0,004 | |||||||
| Pantopoda | |||||||||||
| Acheliae chinata Hodge, 1864 | <1 | 0,001 | |||||||||
| Tanystylum conirostre | 53 | 0,02 | 55 | 0,023 | |||||||
| (Dohri, 1881) | |||||||||||
| Amphipoda | |||||||||||
| Ampithoe ramondi Audouin, 1826, | 1369 | 0,544 | 599 | 0,4 | 345 | 0,2 | 1657 | 0,843 | |||
| (Ampithoe vaillanti Lucas, 1864) | |||||||||||
| Apherusa bispinosa (Bate, 1857) | 4,5 | 0,002 | 24 | 0,034 | 72 | 0,03 | 146 | 0,038 | |||
| Apohyale prevostii (Milne- | |||||||||||
| Edwards,1830), | 918 | 1,921 | 63 | 0,06 | |||||||
| (Hyale nilssoni Rathke, 1843) | |||||||||||
| Apohyale perieri (Lucas, 1846) | 43 | 0,086 | 27 | 0,02 | 113 | 0,064 | |||||
| (Hyale perieri (Lucas, 1846)) | |||||||||||
| Amphitholina cuniculus | |||||||||||
| (Stebbing, 1874) | 32,7 | 0,006 | |||||||||
| (Biancolina cuniculus | |||||||||||
| (Stebb., 1874)) | |||||||||||
| Biancolina algicola Della Valle, | 2 | 0,001 | 5 | 0,002 | |||||||
| 1893 | |||||||||||
| Caprella acanthifera Leach, 1814 | |||||||||||
| (Caprella acanthifera ferox | 312 | 0,158 | 533 | 0,07 | 2582 | 0,285 | |||||
| (Czernjavski, 1868)) | |||||||||||
| Caprella danilevskii Czerniavskii, | 610,8 | 0,198 | |||||||||
| 1868 | |||||||||||
| Caprella mitis Mayer, 1890 | 77,6 | 0,042 | |||||||||
| Caprella liparotensis | 108,4 | 0,064 | 19 | 0,004 | 2542 | 0,395 | |||||
| Haller, 1879 | |||||||||||
| Caprella sp. | 632 | 0,3 | 6 | 0,001 | |||||||
| Chaetogammarus olivii | |||||||||||
| (H. Milne Edwards, 1830) | 17 | 0,034 | 3 | 0,002 | |||||||
| (Echinogammarus olivii | |||||||||||
| (Milne-Edwards, 1830)) | |||||||||||
| Colomastix pusilla Grube, 1861 | 1 | 0,00005 | |||||||||
| Cymadusa crassicornis (Costa, | |||||||||||
| 1853), (Grubia сrassicornis | 675,4 | 0,39 | |||||||||
| (A.Costa, 1853) | |||||||||||
| Dexamine spinosa | 16 | 0,014 | 125 | 0,06 | 236 | 0,124 | |||||
| (Montagu, 1813) | |||||||||||
| Erichthonius difformis | 1485 | 0,516 | 75 | 0,1 | 30 | 0,006 | 9 | 0,002 | |||
| M.- Edwards, 1830 | |||||||||||
| Gammarellus carinatus | 470 | 3,34 | |||||||||
| (Rathke, 1837) | |||||||||||
9
Бондаренко Л. В., Тимофеев В. А.
![]()
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
| Hyale pontica (Rathke, 1837) | 1377 | 2,882 | 1 | 0,001 | 47 | 0,04 | ||||
| Hyale sp. | 46 | 0,01 | ||||||||
| Melita palmata (Montagu, 1804) | 6 | 0,028 | 13 | 0,01 | 1 | 0,0001 | ||||
| Microdeutopus gryllotalpa | 7 | 0,004 | 97 | 0,03 | 446 | 0,108 | ||||
| Costa, 1853 | ||||||||||
| Microdeutopus sp. | 24 | 0,003 | 14 | 0,003 | ||||||
| Microdeutopus versiculatus | 1 | 0,0007 | ||||||||
| (Spence Bate, 1857) | ||||||||||
| Monocorophium insidiosum | 1 | 0,001 | ||||||||
| (Crawford, 1937) | ||||||||||
| Monocorophium acherusicum | 1 | 0,0001 | ||||||||
| (Costa, 1853) | ||||||||||
| Nototropis guttatus Costa, 1853 | 4 | 0,002 | ||||||||
| Nototropis massiliensis | 3 | 0,001 | ||||||||
| (Bellan-Santini, 1975) | ||||||||||
| Perioculodes longimanus | 1 | 0,001 | ||||||||
| (Bate & Westwood, 1868) | ||||||||||
| Pleonexes helleri (Karaman, 1975) | ||||||||||
| (Ampithoe helleri | 16 | 0,01 | 240 | 0,276 | ||||||
| G. Karaman, 1975) | ||||||||||
| Pleonexes gammaroides Bate, | ||||||||||
| 1857 (Ampithoe gammaroides | 306,3 | 0,084 | ||||||||
| (Bate, 1857)) | ||||||||||
| Protohyale (Protohyale) | ||||||||||
| schmidtii (Heller, 1866) | 531 | 0,659 | 241 | 0,2 | 1160 | 1,117 | ||||
| (Hyale schmidtii (Heller, 1866)) | ||||||||||
| Plumulojassa ocia (Spence Bate, | 125 | 0,047 | 91 | 0,02 | 820 | 0,159 | ||||
| 1862) (Jassa ocia (Bate, 1862)) | ||||||||||
| Stenothoe monoculoides | 11,4 | 0,002 | 3688 | 0,586 | 428 | 0,04 | 2201 | 0,179 | ||
| (Montagu, 1815) | ||||||||||
| Decapoda | ||||||||||
| Athanas nitescens Leach, 1814 | 4,2 | 0,126 | 87 | 0,757 | 6 | 0,1 | 19 | 0,049 | ||
| Brachynotus sexdentatus | 1 | 0,01 | ||||||||
| Risso, 1827 | ||||||||||
| Diogenes pugilator (Roux, 1829) | ||||||||||
| (Diogenes varians | 0,5 | 0,019 | <1 | 0,006 | 3 | 0,057 | ||||
| (Costa, 1838)) | ||||||||||
| Carcinus maenas (Linnaeus, | 0,5 | 0,054 | ||||||||
| 1758) | ||||||||||
| Eriphia verrucosa (Forskål, 1775) | ||||||||||
| (Eriphia spinifrons | 7,4 | 6,499 | 5 | 0,146 | ||||||
| (Herbst, 1785)) | ||||||||||
| Eualus gaimardii (H. Milne | ||||||||||
| Edwards, 1837) | 13,1 | 0,413 | ||||||||
| (Hippolyte gracilis (Hell.) | ||||||||||
| Hippolyte leptocerus (Heller, | ||||||||||
| 1863) (Hippolyte longirostris | 2 | 0,023 | ||||||||
| (Czerniavsky, 1868)) | ||||||||||
| Macropodia czernjawskii | ||||||||||
| (Brandt, 1880), | ||||||||||
| (Macropodia aegyptia | 1 | 0,094 | < 1 | 0,007 | 1 | 0,019 | ||||
| (M.Edw.), Macropodia rostrata | ||||||||||
| (Linnaeus, 1761)) | ||||||||||
10
Таксоцен Malacostraca скальных субстратов акватории Карадагского природного заповедника
![]()
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
| Pachygrapsus marmoratus | 2,1 | 2,824 | 12 | 0,24 | 1 | 0,005 | ||||
| (Fabricius, 1793) | ||||||||||
| Palaemon elegans Rathke, 1837, | 7,9 | 5,11 | 3 | 0,032 | ||||||
| (Leander squilla (L.)) | ||||||||||
| Pilumnus spinulosus Kessler, 1861 | ||||||||||
| (Pilumnus hirtellus (Linnaeus, | 1 | 0,042 | 42 | 6,377 | 30 | 1,6 | 30 | 1,631 | ||
| 1758)) | ||||||||||
| Pisidia longicornis (Linnaeus, | ||||||||||
| 1767), (Porcellana longicornis | 4,2 | 0,061 | ||||||||
| (Pen.)) | ||||||||||
| Pisidia bluteli (Risso, 1816) | 196 | 5,236 | 29 | 0,7 | 71 | 1,664 | ||||
| (Pisidia longimana (Risso, 1815)) | ||||||||||
| Processa edulis (Risso, 1816) | 7 | 0,279 | ||||||||
| Xantho hydrophilus (Herbst, 1790) | 2,1 | 2,294 | ||||||||
| Xantho poressa (Olivi, 1792) | <1 | 0,083 | ||||||||
| Tanaidacea | ||||||||||
| Chondrochelia savignyi | ||||||||||
| (Kroyer, 1842) | ||||||||||
| (Paratanais savigni Krog, 1842, | 1 | 0,0005 | 35 | 0,015 | 43 | 0,01 | 357 | 0,072 | ||
| Leptochelia savignyi (Kroyer, | ||||||||||
| 1842)) | ||||||||||
| Tanais dulongii (Audouin, 1826) | 1 | 0,0002 | ||||||||
| Cumacea | ||||||||||
| Nannastacus euxinicus | 1 | 0,001 | 45 | 0,005 | ||||||
| Bacescu, 1951 | ||||||||||
| Cumella (Cumella) limicola | <1 | 0,001 | 1 | 0,001 | ||||||
| G.O.Sars, 1879 | ||||||||||
| Isopoda | ||||||||||
| Dynamene bidentata (Adams, | ||||||||||
| 1800) (Naesa bidentata | 25,8 | 0,025 | 231 | 0,291 | 15 | 0,005 | 161 | 0,212 | ||
| (Adams)) | ||||||||||
| Idotea balthica (Pallas, 1772) | ||||||||||
| (Idotea balthica basteri | 83,1 | 0,368 | 2 | 0,008 | 1 | 0,0007 | ||||
| (Pallas, 1772)) | ||||||||||
| Gnathia oxyurae (Lilljeborg, | 3 | 0,002 | ||||||||
| 1855) | ||||||||||
| Stenosoma acuminatum | ||||||||||
| Leach, 1814 | 20,5 | 0,049 | ||||||||
| (Idotea acuminate White) | ||||||||||
| Stenosoma capito (Rathke, 1837) | 9 | 0,047 | 3 | 0,005 | 1 | 0,0003 | ||||
| Sphaeroma serratum | 7,9 | 0,011 | ||||||||
| (Fabricius, 1787) | ||||||||||
| Mysida | ||||||||||
| Leptomysis lingvura | <1 | 0,001 | ||||||||
| (Sars G.O., 1866) | ||||||||||
| Mysida gen. sp. | 4 | 0,0024 | ||||||||
| Siriella jaltensis Czerniavsky, | ||||||||||
| 1868 (Siriella jaltensis jaltensis | 2 | 0,005 | ||||||||
| Czerniavsky, 1868) | ||||||||||
11
Бондаренко Л. В., Тимофеев В. А.
![]()
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||
| Balanomorpha | |||||||||||
| Amphibalanus improvisus | |||||||||||
| (Darwin, 1854), | 10 | 0,37 | 158 | 11,595 | 6 | 0,1 | 1 | 0,058 | |||
| (Balanus improvisus Darwin, | |||||||||||
| 1854) | |||||||||||
| Chthamalus stellatus | 28 | 0,78 | |||||||||
| (Poli, 1791) | |||||||||||
| Copepoda | |||||||||||
| Copepoda gen. sp. | 63 | 0,00014 | |||||||||
| Ostracoda | |||||||||||
| Ostracoda gen. sp. | 13 | 0,0018 | |||||||||
| Insecta | |||||||||||
| Chironomidae lar gen. sp. | 75,9 | 0,011 | 1 | 0,001 | 20 | 0,002 | |||||
Примечание к таблице. * – в колонке «Таксоны» указаны современные названия видов, рядом в скобках названия, используемые ранее. N – средняя численность, экз./м²; B – средняя биомасса, г/м².
Malacostraca представлены 31 видом из пяти отрядов: Amphipoda, Decapoda, Isopoda, Tanaidacea и Cumacea. Наиболее многочисленным по количеству видов является отряд амфипод, на долю которого приходится 58 % отмеченных в исследуемом районе видов высших ракообразных. Руководящие виды (встречаемость >50 %) (Воробьёв, 1949)
представлены амфиподами Ampithoe ramondi, Apherusa bispinosa, C. acanthifera,
C. liparotensis, D. spinosa, M. gryllotalpa, Pleonexes helleri, Plumulojassa ocia,
Protohyale schmidtii, S. monoculoides, танаидовым раком Ch. savignyi, изоподой D. bidentata и десятиногим раком P. longimana. К характерным видам (встречаемость – 25–50 %) можно отнести B. algicola, E. difformis, N. euxinicus, A. nitescens, P. spinulosus. Редкими, встречаемость которых составила менее 25 %, отмечены 12 видов: 5 бокоплавов, 3 десятиногих рака, 2 изоподы, 1 танаидовый рак и мизида.
Видовой состав Decapoda в наших количественных пробах представлен шестью видами. Это можно объяснить тем, что представители этого отряда очень подвижны и редко попадают
- сборы, проводимые с помощью бентосных рамок. Дополнительную информацию об этих животных дали визуальные наблюдения, в результате которых список Decapoda можно
| пополнить 11 видами: | P. elegans, | Palaemon adspersus Rathke, | 1836, | H. leptocerus, | ||||
| Clibanarius erythropus | (Latreille, | 1818), | Liocarcinus depurator | (Linnaeus, | 1758), | |||
| Liocarcinus vernalis | (Risso,1827), | Carcinus aestuarii Nardo, | 1847, | B. sexdentatus, | ||||
| Eriphia verrucosa (Forskål, | 1775), P. marmoratus и X. poressa. Таким образом, количество | |||||||
| видов Malacostraca возросло до 42. | ||||||||
Средние показатели численности и биомассы представителей Arthropoda составили 13193±8804 экз./м2 и 7,67±3,62 г/м2 (средняя ± доверительный интервал) соответственно. Высшие ракообразные формируют 97,6 % численности (12877±8692 экз./м2) и 98,8 % биомассы (7,58±3,64 г/м2). Плотность поселения амфипод составляет более 94 % общей численности высших раков (рис. 1).
Максимальная плотность Malacostraca отмечена в акватории скалы Маяк (27816±12875экз./м2). Наибольший вклад в численность (54 %) внесли представители рода Caprella.
Биомасса сформирована декаподами (49 % общей биомассы) и амфиподами (47 %). Существенный вклад в данный показатель внесли Pilumnus spinulosus, Pisidia longimana, A. ramondi и Protohyale schmidtii. Наибольший показатель биомассы отмечен на скале Золотые ворота (77 %).
12
Таксоцен Malacostraca скальных субстратов акватории Карадагского природного заповедника
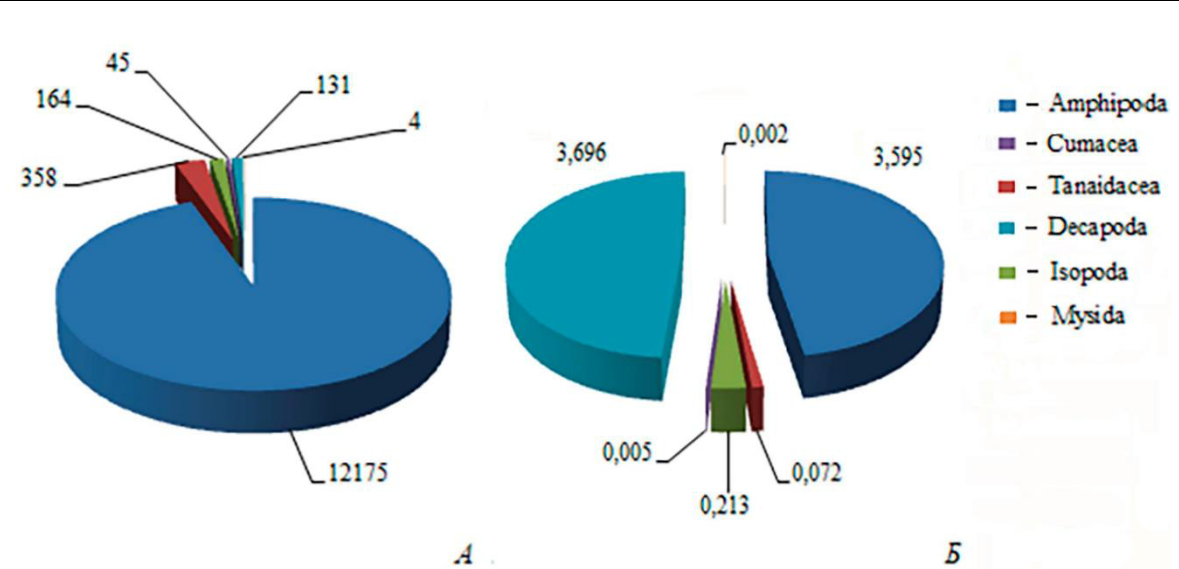
Рис. 1. Численность (экз./м2) (А) и биомасса (г/м2) (Б) представителей Malacostraca на скальных субстратах в акватории Карадага
- результате сравнительного анализа выявлено, что в период с 1938 по 2021 годы на скальном субстрате в акватории Карадагского природного заповедника с учётом визуальных наблюдений обнаружены 75 видов Arthropoda. Malacostraca представлены 67 видами. По количеству видов доминировали представители отрядов Amphipoda и Decapoda. Наиболее многочисленным во все периоды исследований является отряд Amphipoda. Из 40 видов этого отряда, отмеченных для акватории Карадага Л. А. Прокудиной (1952), 33 вида обнаружены на скальных субстратах в период с 30-х годов ХХ столетия по 2021 год. В настоящее время в Чёрном и Азовском морях зарегистрировано 140 видов амфипод, у побережья Крыма – 71 вид (Гринцов 2022). В разные периоды исследований количество видов амфипод составляло от 40 до 70 % общего количества видов Malacostraca на скалах Карадага (рис. 2).
После исключения синонимов и определения современного статуса для сомнительных видов было установлено, что современная фауна Азово-Черноморского бассейна состоит из 52 видов Decapoda (Anosov et al., 2012), из них 22 вида обнаружены с 30-х годов на скалах Карадага. Количество видов декапод с 1938 по 2021 годы составило от 15 до 40 % общего количества видов Malacostraca (рис. 2).
Амфиподы Ampithoe ramondi, Apherusa bispinosa, E. difformis, S. monoculoides,
десятиногие раки A. nitescens, P. spinulosus, танаидовый рак Ch. savignyi и изопода D. bidentata обнаружены в бентосных пробах во все временные периоды. Тогда как 12 видов высших ракообразных отмечены на скальных субстратах Карадага только в 30-е годы ХХ столетия. Наиболее полно в этот период отображён род Caprella (4 вида). Отсутствие в современных пробах Gammarellus carinatus, вероятно, связано с сезонной миграцией вида (Грезе, 1985), для которого зимний период наиболее благоприятен для размножения. Он появляется в прибрежной зоне в ноябре и исчезает в мае и особенно богато представлен среди зарослей Scytosiphon lomentaria (Шаронов, 1952). Cymadusa crassicornis – вид
немногочисленный, крупных популяций не образует, обитает преимущественно в зарослях цистозиры (Грезе, 1985). Ракообразные родов Biancolina, Hippolyte, Pisidia, Xantho и Stenosoma с 70-х годов представлены видами, которые по Определителю фауны Чёрного и Азовского морей (1969) являются синонимами видов, отмеченных в 30-е годы, в то время как по современной классификации они являются самостоятельными видами (WoRMS).
Следует отметить появление в бентосных пробах 2021 года единичных экземпляров трёх видов бокоплавов: C. pusilla, Microdeutopus versiculatus, Monocorophium acherusicum, декаподы P. edulis и танаидового рака T. dulongii.
13
Бондаренко Л. В., Тимофеев В. А.
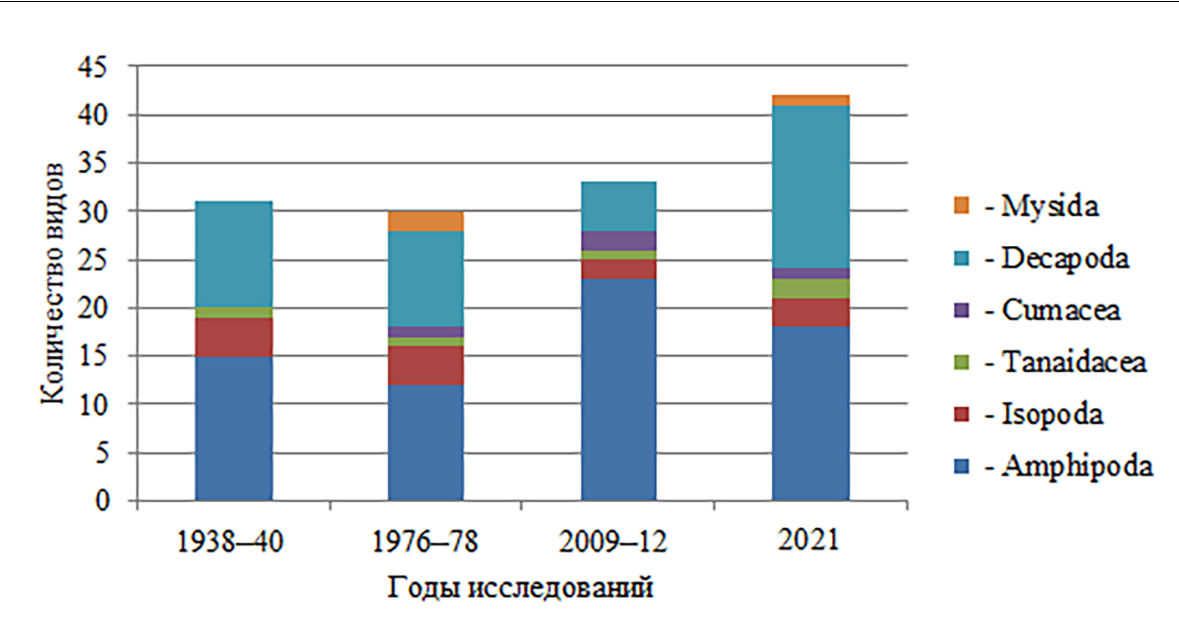
Рис. 2. Представленность отрядов Malacostraca на скальных субстратах в акватории Карадага в разные периоды исследований
C. pusilla – редкий вид-комменсал, живёт в губках (Грезе, 1985). По данным В. А. Гринцова (2022) в Азово-Черноморском бассейне отмечен у побережья Крыма. P. edulis
– десятиногий рак, который ранее в акватории Карадага не встречался (Виноградова, 1951). Не отмечен он также и для скал Карадага (Синегуб, 2004; Болтачева и др., 2015). Личинки этого вида были обнаружены в акватории Карадага в планктоне в 1999 году, взрослый экземпляр найден в 2002 году (Гринцов и др., 2004). Остальные три вида – типичные представители бентосного сообщества разных биотопов, в том числе скал (Прокудина, 1952; Маккавеева, 1979; Грезе, 1985; Гринцов, 2004; Бондаренко и др., 2009; Бондаренко и др., 2018; Гринцов, 2018).
Наибольшее количество руководящих видов отмечено в 2021 году, их число выросло почти в 3 раза по сравнению с 30-ми годами, тогда как количество редких видов уменьшилось на 20 % (рис. 3). Число характерных видов изменялось от 10 (1938–40 гг.) до 12 (2009–12 гг.)
и до 6 (1976–78 и 2021 гг.).
По соотношению руководящих, характерных и редких видов структура таксоцена Malacostraca в 2021 году более близка к таковой 1976–1978 годов.
Индекс общности Чекановского – Съёренсена варьировал от 0,43 до 0,66. Наименьшее сходство фаун (0,43–0,48) отмечено при сравнении видового состава ракообразных 30-х годов с таковым 70-х, 2009–2012 и 2021 годов.
Качественный состав декапод, с учётом визуальных наблюдений, в 2021 году представлен 17 видами. Из 11 видов, обнаруженных в 1930-е и десяти – в 1970-е годы, в пробах 2009–2012 годов встретились лишь шесть. Причём это были мелкие по размерам раки. Возросли показатели встречаемости и численности ранее редкого краба P. spinulosus (от 1 до 30 экз./м2). Этот вид населяет и размножается преимущественно в зарослях филлофоры, в последние годы замещающей сообщество Cystoseira на небольших глубинах в акватории Карадага (Терентьев, 2002; Костенко и др., 2008) Встречаемость филлофоры и её продукционные характеристики существенно повысились в мелководной зоне (глубина 0,5– 1 м) (Мильчакова, 2015). Возросли встречаемость и численность редких в 1930-е годы ракообразных A. bispinosa (от 1 до 146 экз./м2) и Ch. savignyi (от 1 до 357 экз./м2), являющихся обычными обитателями бурых и красных водорослей и предпочитающих селиться на филлофоре. Представители данного рода водорослей в наших пробах присутствовали в качестве обрастания на скалах Карадага.
14
Таксоцен Malacostraca скальных субстратов акватории Карадагского природного заповедника
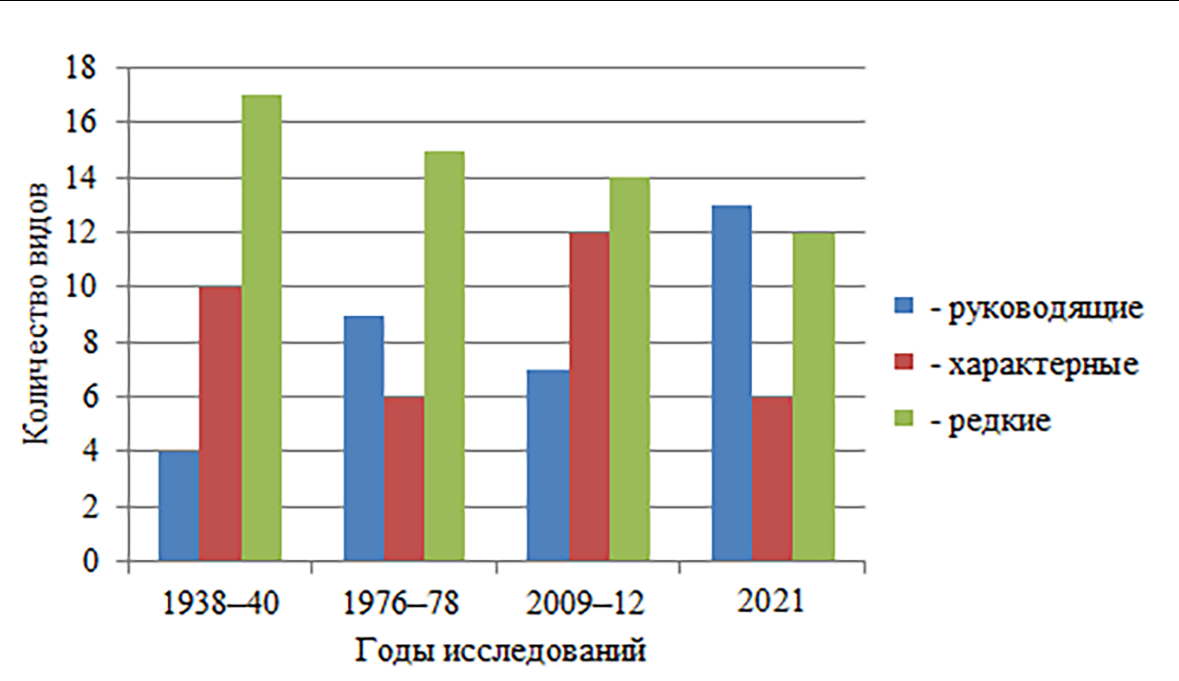
Рис. 3. Структура встречаемости видов Malacostraca на скальных субстратах в акватории Карадага в разные периоды исследований
Анализ количественного развития Malacostraca показал, что наибольшая плотность поселения ракообразных наблюдалась в 2021 году (рис. 4). Сформирована она амфиподами рода Caprella и S. monoculoides (57 % численности Malacostraca), которые являются постоянным компонентом сообщества цистозиры. В 2009–2012 годах 41 % численности составили эти же виды S. monoculoides и C. acanthifera. В 70-е – 59 % приходилось на
- monoculoides. Тогда как в 30-е годы это были амфиподы A. ramondi, E. difformis и H. pontica (52 %).
По сравнению с данными, представленными Шароновым (1952, рукопись), на порядок увеличились показатели численности 9 видов амфипод, а также Ch. savignyi, N. euxinicus и D. bidentata, тогда как плотность поселения I. balthica снизилась с 83 до 1 экз./м2, E. difformis
– с 1485 до 9 экз./м2 и H. pontica – с 1377 до 47 экз./м2. В пробах 2021 года последний вид не обнаружен (табл. 1). Он обычен в зоне заплеска, на скалах преимущественно среди талломов макрофитов рода Ceramium. В 2002 году амфипода H. pontica встречалась в акватории Карадага на водорослях на глубинах 3–9 м в чистой и загрязнённой зонах (Гринцов, 2004).
Данные виды являются постоянными компонентами цистозировых биоценозов, которые в течение последних десятилетий подвергаются значительной трансформации (Костенко и др., 2008).
Существенные изменения отмечены и для биомассы ракообразных. В 30-е годы основной вклад в этот показатель внесли декаподы Pachygrapsus marmoratus, Palaemon elegans, X. hydrophilus (36 % биомассы Malacostraca) и амфиподы A. prevostii, G. carinatus, H. pontica (29 %). В 70-е – Pilumnus spinulosus, Pisidia longimana (75 %), в 2009–2012 годы – P. spinulosus (49 %), в 2021 году – P. spinulosus и P. longimana (43 %). Во все периоды исследований общая биомасса формировалась десятиногими ракообразными и только в 30-е годы кроме Decapoda вклад в данный показатель внесли амфиподы A. prevostii (1,92 г/м2), G. carinatus (3,34 г/м2) и H. pontica (2,88 г/м2).
Использование интегрального подхода оценки значимости вида по индексу плотности (ИП – оценочный эквивалент энергетической роли гидробионтов) позволило определить лидеров. Из десяти видов, возглавивших ранжированный ряд по индексу плотности в периоды исследований с 1976 по 2021 годы выделено пять общих: A ramondi, Protohyale schmidtii,
15
Бондаренко Л. В., Тимофеев В. А.
![]()
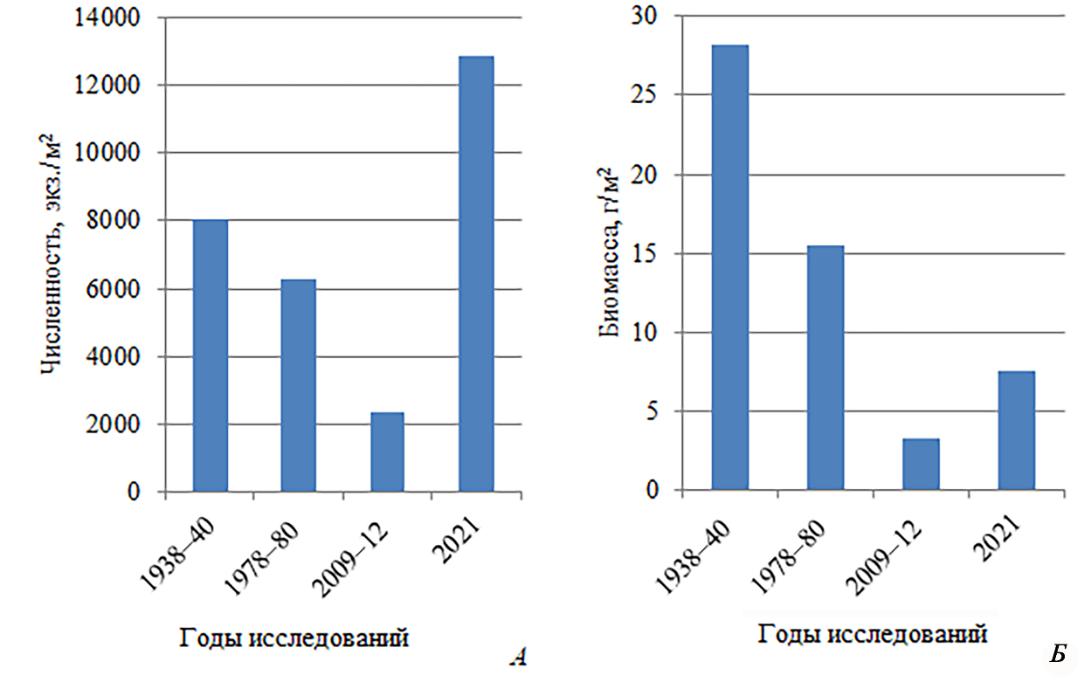
Рис. 4. Численность (А) и биомасса (Б) Malacostraca на скальных субстратах в акватории Карадага в разные периоды исследований
S. monoculoides, Pilumnus spinulosus, Pisidia longimana. Тогда как с 1938 по 2021 годы общим является лишь один вид – амфипода A. ramondi (рис. 5), встречаемость которой возросла от 48 % (30-е гг.) до 100 % (2021 г.). Увеличились также численность и биомасса этого вида (табл.1). A. ramondi обычен среди зарослей макрофитов прибрежной зоны. Вдоль берегов Чёрного моря отмечен преимущественно в зарослях цистозиры, используя водоросль не только в качестве пищи, но и как материал для построения трубки (Грезе, 1985). По данным Е. Б. Маккавеевой (1979) плотность поселения этого вида может достигать 400 экз./кг водоросли, а в биотопе скал – 1025 экз./м2, что сопоставимо с нашими данными (табл. 1).
Трофическая структура таксоцена Malacostraca в разные периоды исследований с учётом визуальных наблюдений представлена фито-, детрито-, полифагами и организмами пищевой спектр которых не изучен (рис. 6).
Выявлено, что к 2021 году сокращается количество видов-фитофагов и увеличивается процент видов, относящихся к детритофагам и полифагам. Снижение роли фитофагов в сообществе скал может быть связано с деградацией цистозировых фитоценозов на малых глубинах и трансформацией их в фитоценозы бурых многолетников с зелёными и красными водорослями (Терентьев, 2002; Костенко и др., 2008). Эколого-фитоценотический оптимум цистозиры зафиксирован в верхней сублиторальной зоне на глубине от 0,1 до 1 м, тогда как ранее он находился в диапазоне 3–5 м (Мильчакова, 2015). Растительность приобрела мозаичный характер за счет возрастания роли зелёных водорослей в составе коренных цистозировых и филлофоровых фитоценозов.
Однако, при уменьшении количества видов-фитофагов (рис. 6), плотность поселения у 54 % растительноядных ракообразных увеличивается (рис. 7).
Возможно, это связано с тем, что в верхней сублиторальной зоне охраняемых природных акваторий наблюдаются элементы восстановительной сукцессии цистозировых фитоценозов (Мильчакова, 2015). На современном этапе в районе Карадага на глубине 0,5–5 м выявлены растительные ассоциации, среди которых доминируют цистозировая и цистозирово-филлофоровая (Костенко, 2018).
16
Таксоцен Malacostraca скальных субстратов акватории Карадагского природного заповедника
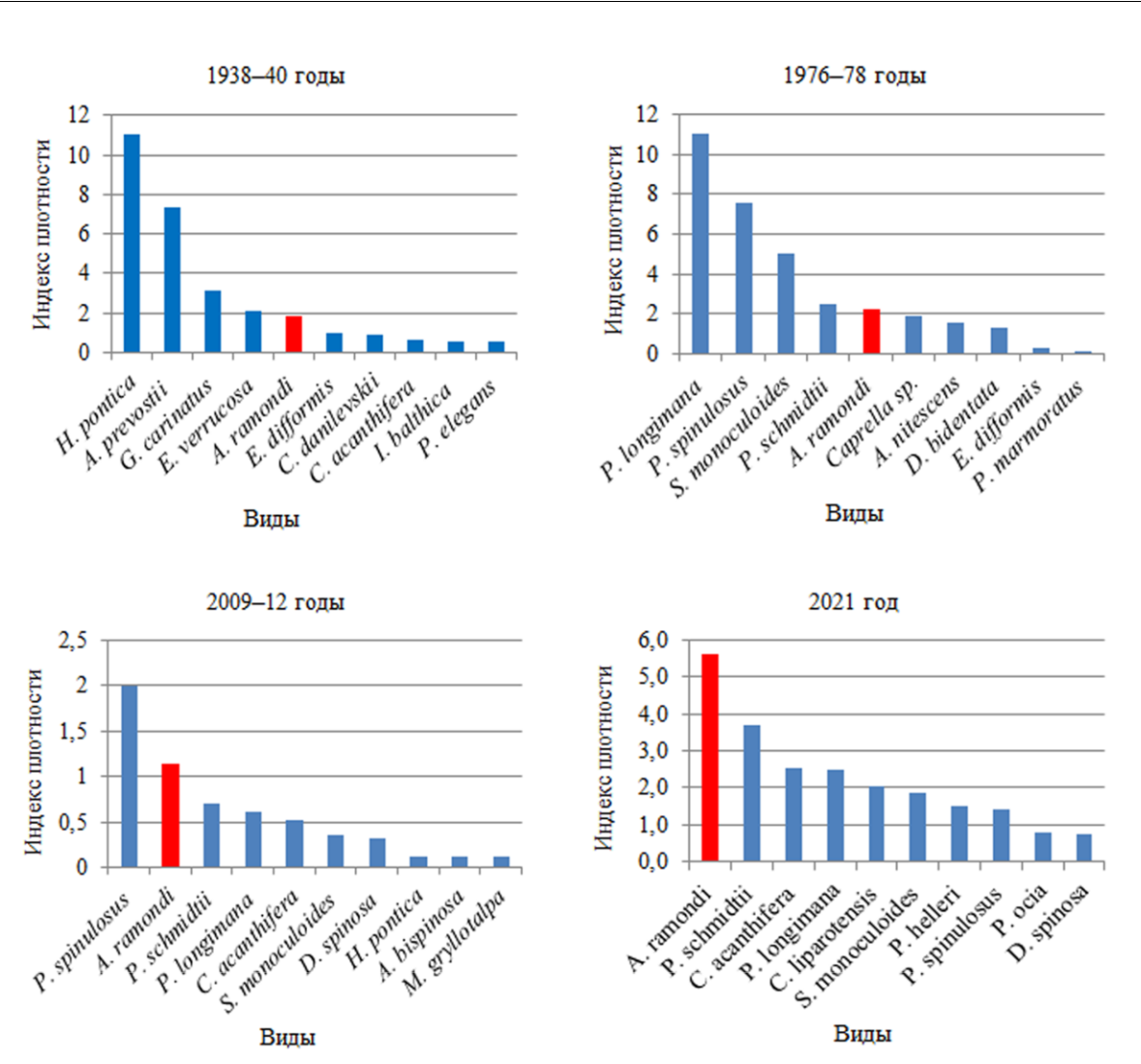
Рис. 5. Ранжированный ряд видов Malacostraca на скальных субстратах в акватории Карадага по индексу плотности в разные периоды исследований
ЗАКЛЮЧЕНИЕ
- период с 1938 по 2021 годы на скальном субстрате в акватории Карадагского природного заповедника с учётом визуальных наблюдений обнаружены 75 видов Arthropoda. Malacostraca представлены 67 видами. Наиболее многочисленным по таксономическому составу во все периоды исследований является отряд Amphipoda.
Анализ полученных результатов показал, что за прошедшие десятилетия, как в качественном составе, так и в количественных показателях ракообразных скального субстрата произошли существенные изменения. 12 видов Malacostraca отмечены на скалах Карадага только в 30-е годы ХХ столетия. Ракообразные родов Biancolina, Hippolyte, Pisidia, Xantho и Stenosoma с 70-х годов представлены другими видами. Следует отметить появление в бентосных пробах 2021 года единичных экземпляров трёх видов бокоплавов:
Colomastix pusilla, Microdeutopus versiculatus, Monocorophium acherusicum, декаподы Processa edulis и танаидового рака Tanais dulongii.
Наибольшее количество руководящих видов отмечено в 2021 году, их число выросло почти в 3 раза по сравнению с 30-ми годами. Количество редких видов сократилось на 20 %.
17
Бондаренко Л. В., Тимофеев В. А.
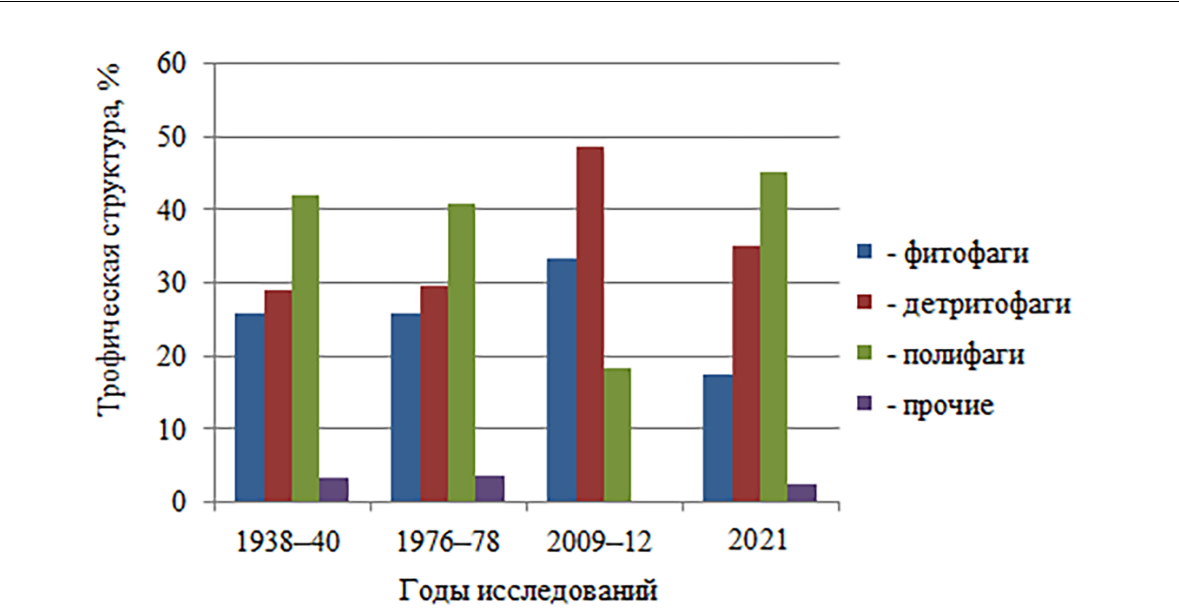
Рис. 6. Трофическая структура таксоцена Malacostraca на скальных субстратах в акватории Карадага в разные периоды исследований
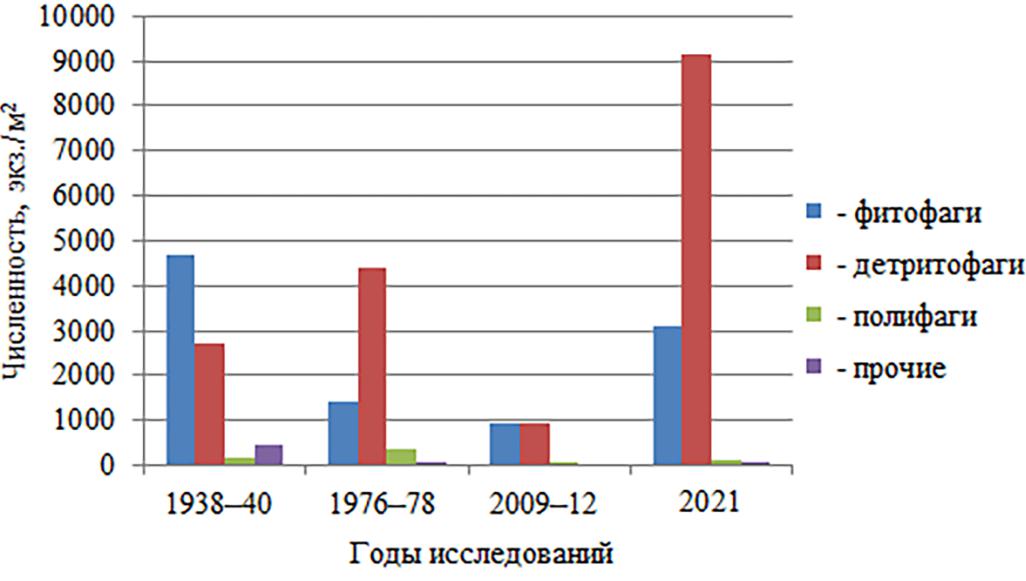
Рис. 7. Численность представителей трофических групп Malacostraca на скальных субстратах в акватории Карадага в разные периоды исследований
Наибольшая плотность поселения раков, 94 % которой составили амфиподы, наблюдалась в 2021 году. Высокий показатель биомассы отмечен в 1938–40 годах, основной вклад в который (65 %) внесли декаподы и амфиподы.
Снижение доли фитофагов в сообществе скал может быть связано с трансформацией цистозировых фитоценозов на малых глубинах. Увеличение плотности поселения у 54 % растительноядных ракообразных возможно связано с процессом восстановительной сукцессии этих фитоценозов.
18
Таксоцен Malacostraca скальных субстратов акватории Карадагского природного заповедника
![]()
Таким образом, видовое богатство и разнообразие представителей Malacostraca скальных субстратов акватории Карадагского природного заповедника остаётся на высоком уровне, во многом, вероятно, благодаря заповедному статусу акватории, существующему с 1979 года.
Благодарности. Авторы выражают благодарность сотрудникам отдела Экологии бентоса ФГБУН ФИЦ ИнБЮМ к. б. н., с. н. с. М. В. Макарову; к. б. н., с. н. с. В. Г. Копий; к. б. н., н. с. М. А. Ковалёвой, м. н. с. отдела оптики и биофизики моря ФГБУН ФИЦ МГИ А. А. Латушкину за помощь в сборе материала, а также вед. инж. отдела Экологии бентоса ФГБУН ФИЦ ИнБЮМ И. Н. Аннинской за помощь в обработке проб.
Статья подготовлена в рамках Государственного задания ФГБУН ФИЦ «Институт биологии южных морей имени А. О. Ковалевского РАН» «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана», № 121030100028-0.
Список литературы
Аносов С. Е. Характеристика фауны Азово-Черноморского бассейна. Качественные и количественные изменения за последнее столетие: дис. … канд. биол. наук: спец. 03.02.10 Гидробиология. – М.: ФГБНУ «ВНИРО», 2016. – 169 с.
Болтачева Н. А., Ковалева М. А., Макаров М. В., Бондаренко Л. В. Многолетние изменения макрофауны скал в зоне верхней сублиторали у Карадага (Чёрное море) // 100 лет Карадагской научной станции имени Т. И. Вяземского (сб. научн. тр.). – Симферополь: Н. Оріанда, 2015. – С. 546–566.
Бондаренко Л. В., Тимофеев В. А., Гринцов В. А. Malacostraca рыхлых грунтов Карадагского природного заповедника // Экология моря. – 2009. – Вып. 77. – С. 38–43.
Бондаренко Л. В., Болтачева Н. А., Гринцов В. А.Таксономический состав макрозообентоса // Биология Чёрного моря у берегов Юго-Восточного Крыма / [Ред. Н. С. Костенко]. – Симферополь : ИТ «АРИАЛ», 2018. – С. 77–83.
Виноградова З. А. Материалы о плодовитости десятиногих раков (Decapoda) Чёрного моря // Труды Карадагской биологической станции. – 1951. – Вып. 11. – С. 69–91.
Воробьёв В. П. Бентос Азовского моря // Труды Азово-Черноморского научно-исследовательского института морского рыбного хозяйства и океанографии. – 1949. – Вып. 13. – С. 5–95.
Гиляров М. С. Биологический энциклопедический словарь. – Рипол Классик, 1989. – 864 с.
Грезе И. И. Фауна Украины. Бокоплавы. Высшие ракообразные. Т. 26. Вып. 5. – Киев: Наукова думка, 1985. –
- с.
Гринцов В. А. Отряд клешненосные ослики – Tanaidacea // Карадаг. Гидробиологические исследования: (сб. науч. тр. Посвящённый 90-летию Карадагской научной станции имени Т. И. Вяземского и 25-летию Карадагского природного заповедника НАНУ). – Симферополь, 2004. – Т. 2. – С. 387.
Гринцов В. А. Отряд амфиподы или разноногие раки (бокоплавы) // Карадаг. Гидробиологические исследования: (сб. науч. тр. Посвящённый 90-летию Карадагской научной станции имени Т. И. Вяземского и 25-летию Карадагского природного заповедника НАНУ). – Симферополь, 2004. – Т. 2. – С. 391–397.
Гринцов В. А., Мурина В. В., Киселева Г. А., Безвушко А. И. Отряд десятиногие раки // Карадаг. Гидробиологические исследования: (сб. науч. тр. Посвящённый 90-летию Карадагской научной станции имени
- И. Вяземского и 25-летию Карадагского природного заповедника НАНУ). – Симферополь, 2004. – Т. 2. – С. 378–
383.
Гринцов В. А. Макрозообентос твёрдых естественных и искусственных субстратов // Биология Чёрного моря у берегов Юго-Восточного Крыма / [Ред. Н. С. Костенко]. – Симферополь : ИТ «АРИАЛ», 2018. – С. 262–272.
Гринцов В. А. Амфиподы Чёрного моря. – Севастополь: ФИЦ ИнБЮМ, 2022. – 475 с.
Костенко Н. С., Дикий Е. А., Заклецкий А. А. Тенденции многолетних изменений фитоценозов «цистозирового пояса» Карадагского природного заповедника (Крым, Чёрное море) // Морской экологический журнал. – 2008. – 7, № 3. – С. 25–36.
Костенко Н. С. История гидробиологических исследований у берегов Юго-Восточного Крыма // Биология Чёрного моря у берегов Юго-Восточного Крыма / [Ред. Н. С. Костенко]. – Симферополь: ИТ «АРИАЛ», 2018. – С.
8–38.
Маккавеева Е. Б. Беспозвоночные зарослей макрофитов Чёрного моря. – К.: Наук. думка, 1979. – 229 с. Мильчакова Н. А. Состояние макрофитобентоса Карадагского природного заповедника и прилегающих
особо охраняемых природних территорий (Крым, Чёрное море) // 100 лет Карадагской научной станции имени
- И. Вяземского: (сб. научн. тр.) – Симферополь: Н. Орианда, 2015. – С. 506–523.
Определитель фауны Чёрного и Азовского морей / [Под ред. Ф. Д. Мордухай-Болтовского]. – Киев: Наукова думка, 1969. – Т. 2. – 536 с.
19
Бондаренко Л. В., Тимофеев В. А.
![]()
Прокудина Л. А. Каталог фауны и флоры Чёрного моря района Карадагской биологической станции // Труды Карадагской биологической станции. – 1952. – Вып. 12. – С. 116–127.
Реймерс Н. Ф. Основные биологические понятия и термины. – М.: Просвещение, 1988. – 319 с.
Ревков Н. К., Болтачева Н. А. Восстановление биоценоза черноморского гребешка Flexopecten glaber (Bivalvia: Pectinidae) у берегов Крыма (район Ласпи) // Экологическая безопасность прибрежной и шельфовой зон моря. –2022. – № 4. – С. 90–103. doi:10.22449/2413-5577-2022-4-90-103.
Синегуб И. А. Макрофауна зоны верхней сублиторали скал в Чёрном море у Карадага // Карадаг. Гидробиологические исследования: (сб. науч. тр. Посвящённый 90-летию Карадагской научной станции имени
- И. Вяземского и 25-летию Карадагского природного заповедника НАНУ). – Симферополь, 2004. – Т. 2. – С. 121–
133.
Терентьев А. С. Распределение крабов Pilumnus hirtellus (Decapoda, Xanthidae) на малом филлофорном поле в Каркинитском заливе Чёрного моря // Vestnik zoologii. – 2002. – 36, № 5. – С. 69–72.
Шаронов И. В. Фауна скал и каменистих россыпей у Карадага // Труды Карадагской биологической станции. – 1952. – Вып. 12. – С. 68–77.
Шаронов И. В. Население скал и каменистих россыпей открытых берегов Чёрного моря у Карадага // Библиотека Карадагской биологической станции. – Рукопись. – 24 с.
Anosov S. E., Spiridonov V. A., Marin I. N. A revised check-list of the Black Sea Decapoda // Abstracts of contributions presented at the TCSSM 2012 and the 10thCCDM (June 3-7, 2012). – Athens, Greece, 2012. – 124 р.
Grintsov V., Sezgin M. Manual for identification of Amphipoda from the Black Sea. – Sevastopol: DigitPrint, 2011. – 151 p.
WoRMS Editorial Board: World Register of Marine Species. Available at:http://www.marinespecies.org doi:10.14284/170 (accessed 19.12.2022).
Bondarenko L V., Timofeev V. A. Taxocene Malacostraca of rock substrates in the water area of Karadag Nature Reserve // Ekosistemy. 2023. Iss. 33. P. 7–20.
According to literature review and our own data, taking into account visual observations, 75 Arthropoda species were found on the rocky substrate in the waters of Karadag Nature Reserve between 1938 and 2021. Malacostraca were represented by 67 species. The Amphipoda was the most numerous in terms of taxonomic composition. Over the past decades, both qualitative and quantitative indicators of the macrozoobenthos of Karadag rocks have undergone significant changes. Twelve species of Malacostraca were recorded on the rocky substrate only in the 30s of the twentieth century. Crustaceans of the Biancolina, Hippolyte, Pisidia, Xantho and Stenosoma have been represented by other species since the 70s. Of note were the emergence of three species of amphipods in benthic samples from 2021: Colomastix pusilla Grube, 1861, Microdeutopus versiculatus (Spence Bate, 1857), Monocorophium acherusicum (Costa, 1853), the decapod Processa edulis (Risso, 1816) and the tanaid crayfish Tanais dulongii (Audouin, 1826). The highest number of leading species was recorded in 2021, with a nearly threefold increase compared to the 1930s, while the number of rare species decreased by 20 %. The highest crayfish settlement density, 94 % of which were amphipods, was observed in 2021. A high biomass was recorded in 1938–40, with Decapoda and Amphipoda making the main contribution (65 %). The trophic structure of the Malacostraca taxocene in the different study periods, taking into account visual observations, was represented by phyto-, detritus-, polyphagous and organisms whose food spectrum was not studied.
Key words: Malacostraca taxocene, rocks substrates, abundance, biomass, Karadag.
Поступила в редакцию 22.01.23
Принята к печати 20.02.23
20

