Экосистемы, 32: 106–120 (2022) https://ekosystems.cfuv.ru
![]()
УДК [574.5:581.526.44](262.54.04)
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Макаров М. В., Ковалёва М. А.
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
verakopiy@gmail.com; bondarenko.luda@gmail.com; tamplier74@mail.ru; podzorova@imbr-ras.ru; mihaliksevast@inbox.ru; kovalmargarita@mail.ru
- основу работы положены материалы, собранные на мелководье Керченского пролива и прибрежной зоны Таманского полуострова в сентябре 2019 года. Фитоценоз представлен макрофитами Ericaria crinita, Ulva sp., Zostera sp., Stuckenia sp., Ceramium sp., Ruppia sp., Zannichelia sp., зарослями Ruppia sp.+Zostera sp. и Cystoseira sp.+Cladophora sp.+Polysiphonia sp. В акватории Камыш-Бурунской бухты обнаружено 6 видов макрофитов, поселка Сенной – 2 вида, портов Крым и Кавказ – по одному виду. В их зарослях обнаружены 56
видов макрозооэпифитона, включающих Polychaeta (13 видов), Crustacea (23), Mollusca (14) и не идентифицированных до вида представителей таксонов Ascidiidae, Chirоnomidae, Platyhelminthes, Nemertea и Actiniidae. Максимальное количество видов макрозообентоса отмечено на E. crinita (39), далее следуют заросли
Ruppia sp.+Zostera sp. (23), Cystoseira sp.+Cladophora sp.+Polysiphonia sp.(22), Ulva sp. (21), Stuckenia sp. и Zostera sp. (по 19), Zannichelia sp. (17), Ceramium sp. (15), Ruppia sp. (4). Высокий показатель коэффициента
Чекановского—Сёренсена отмечен для зооэпифитона, обнаруженного в зарослях
Cystoseira sp.+Cladophora sp.+Polysiphonia sp. – Stuckenia sp. (0,8), Stuckenia sp. – Ruppia sp.+Zostera sp. (0,7) и
Ulva sp. – Stuckenia sp. (0,7). Наименее сходны по видовому составу животные, обитающие в скоплениях
| макрофитов Ceramium sp. – | Ruppia sp. | (0,1), | Ceramium sp. – Zostera sp. (0,2), | Ceramium sp. – |
| Cystoseira sp.+Cladophora sp.+Polysiphonia sp. | (0,2). | Средние значения численности и | биомассы всего | |
| макрозооэпифитона составили | 10762±4080 экз./кг | и 107,644±61,089 г/кг соответственно. Максимальная | ||
численность гидробионтов отмечена в зарослях макрофитов Cystoseira sp.+Cladophora sp.+Polysiphonia sp. (29978 экз./кг), биомасса – в Ceramium sp. (165,208 г/кг). Макрозооэпифитон фитоценозов представлен фитофагами, детритофагами, полифагами и плотоядными. Наибольшее количество видов относится к фитофагам, самая малочисленная группа – детритофаги.
Ключевые слова: макрофиты, макрозооэпифитон, численность, биомасса, Керченский пролив, Чёрное море.
ВВЕДЕНИЕ
Основными первичными продуцентами органического вещества в прибрежных морских экосистемах являются бурые, красные, зелёные многоклеточные водоросли и травы, обеспечивающие бентосное сообщество органическим веществом. Зарослевые биоценозы имеют наиболее динамичную структуру, поскольку находятся под прессом не только природных, но и антропогенных факторов. Верхние отделы береговой зоны (супралитораль, псевдолитораль и верхняя сублитораль) испытывают максимальное опреснение, воздействие волн и загрязнение, и именно для малых глубин (до 3–5 м) характерно наибольшее разнообразие макрофитов (Никитина, Лисовская, 2013).
Динамика подводной растительности во многом определяет изменения в донных сообществах, их распределение и запасы. Сообщества морских трав и водорослей рассматриваются как индикаторы долговременных климатических и антропогенных изменений в водоёмах (Minicheva, 2018). Макрофиты – особенный компонент биоценозов, выполняющий функцию субстрата и биотического компонента одновременно. На их талломах поселяются эпифитные водоросли, сессильные и эррантные животные – панцирные, двустворчатые и брюхоногие моллюски, мшанки, губки, полихеты, ракообразные (Зернов, 1913; Маккавеева, 1979). В зарослях макрофитов создаются благоприятные условия для обитания большого количества организмов разнообразной трофической принадлежности.
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Макрозооэпифитон макрофитов мелководья Керченского пролива
и прибрежной зоны Таманского полуострова
![]()
Известно, что животные используют макрофиты не только как убежище, источник питания и среду для размножения, но и их биотическое взаимодействие способствуют процессу оплодотворения водорослей (Маккавеева, 1979; Colin et al., 2022)
Макрозообентос, обитающий в зарослях макрофитов (зооэпифитон) у берегов Крыма и Кавказа исследован неполно. Наиболее изучены гидробионты, обитающие на цистозире, в меньшей мере, на зостере и некоторых других макрофитах (Маккавеева, 1979; Киселева, 2009; Макаров, 2018; Макаров и др., 2020; Макаров и др., 2022). Зооэпифитон исследовали в районах западного, юго-западного, южного берегов Крыма и в акватории Карадага (Маккавеева, 1979, 1992; Киселева, 2009). В Керченском проливе и прилегающей к нему юго-восточной части Азовского моря макрозообентос в эпифитоне макрофитов ранее не изучали, за исключением исследований в районе мыса Такиль летом 2013 года (Макаров, 2020). Гидрологический и гидрохимический режимы Керченского пролива оказывают влияние на формирование качественного и количественного состава флоры и фауны Азовского и Чёрного морей. Изучение аквальных экосистем пролива для выявления их современного состояния и прогнозирования природных и антропогенных изменений весьма актуально. Важнейшим компонентом морских экосистем, влияющим на численность и состав морской и прибрежной биоты, является макрофитобентос (Садогурский, 2006).
Учитывая огромное значение Керченского пролива для функционирования экосистем Азово-Черноморского бассейна, цель нашего исследования заключается в изучении видового состава и количественных параметров макрозообентоса фитоценозов Керченского пролива и прибрежной части Таманского полуострова для проведения дальнейших мониторинговых исследований.
МАТЕРИАЛ И МЕТОДЫ
-
- основу работы положены материалы, собранные на мелководье Керченского пролива
- прибрежной зоны Таманского полуострова в сентябре 2019 года (рис. 1).
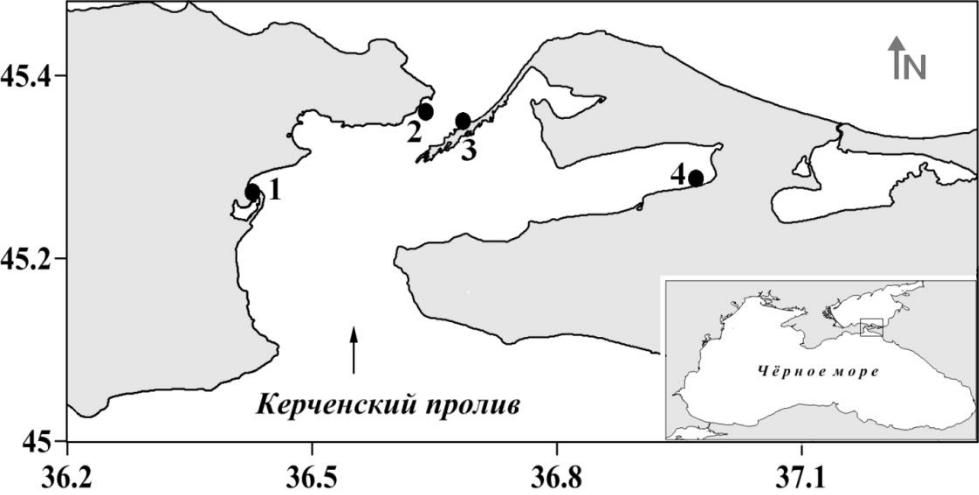
Рис. 1. Карта-схема отбора проб на мелководье Керченского пролива и в прибрежной зоне Таманского полуострова (сентябрь, 2019 г.)
Условные обозначения: 1 – Камыш-Бурунский залив, 2 – Порт Крым, 3 – порт Кавказ, 4 – п. Сенной.
Сбор исследуемого материала осуществляли с помощью мешка из мельничного газа на глубинах 0,5–1 м в двух повторностях, всего отобрана 21 проба. Фиксацию осуществляли 4 % раствором нейтрализованного формалина, в лабораторных условиях промывали через сито с размером ячеи 0,5 мм, разбирали по крупным таксономическим группам. Макрофиты взвешивали на весах «Sartorius PT-600» с точностью до 0,1 г.
107
Копий В. Г., Бондаренко Л. В., Тимофеев В. А.,
Подзорова Д. В., Макаров М. В., Ковалёва М. А.
![]()
При описании количественного развития макрозооэпифитона применены показатели численности (N, экз./кг) и биомассы (В, г/кг). Видовую идентификацию и выделение трофических групп осуществляли с помощью литературных источников (Определитель…, 1972; Киселева, 1981, 2004; Чухчин, 1984; Грезе, 1985; Grintsov, Sezgin, 2011). Для определения видовой принадлежности макрофитов использовали определители А. Д. Зиновой (1967) и Н. И Рубцова (1972). Виды Cystoseira crinitta и Cystoseira barbata сложно было выделить в ассоциации Cystoseira sp.+Cladophora sp.+Polysiphonia sp. В современной номенклатуре они относятся к разным родам, поэтому мы использовали прежнее название рода Cystoseira. Таксономическую принадлежность приводили в соответствие с базами данных World Register of Marine Species (2022).
Для определения фаунистического сходства в сравниваемых списках использовался индекс Чекановского-Сёренсена (Сёмкин, Горшков, 2010):
i 2a / b c ,
где: a – число общих видов; b и c – число видов в сравниваемых списках.
Коэффициент Чекановского-Сёренсена может изменяться от 0 (отсутствие сходства) до 1 (полное сходство).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика района объектов исследования. Камыш-Бурунская бухта – акватория Аршинцевской косы, грунт представлен заиленным песком, местами с ракушей и фрагментами бетонных конструкций. Температура воды на момент сбора макрозооэпифитона составила 22 °С, солёность – 17,7 ‰. В акватории обнаружены фитоценозы Zostera sp.,
Ulva sp. (=Enteromorpha sp.) и ассоциации Ruppia sp.+Zostera sp., Cystoseira sp.+Cladophora sp.+Polysiphonia sp., Zannichelia sp.+Stuckenia sp.
Cladophora sp. – род нитчатых зелёных водорослей. Талломы кладофор представляют собой длинные разветвлённые нити. Обитает на скалах, камнях, ракушках и песке. Является эпифитом цистозиры (Зинова, 1967; Калугина-Гутник, 1975; Milchakova, 2011).
Ulva sp. (=Enteromorpha sp.). В районах Керченского пролива в настоящее время происходит увеличение разнообразия зелёных водорослей. Распространённым родом зелёных водорослей в исследуемом районе является Ulva sp. Представители данного рода характеризуются трубчатым талломом, часто ветвящимся, сначала всегда прикреплённым к субстрату узким стебельком, позднее может оторваться и свободно плавать. Обитают на твёрдых грунтах. В распреснённых и загрязнённых участках прибрежной зоны образуют заросли (Зинова, 1967; Калугина-Гутник, 1975; Степаньян, 2020; Milchakova,2011).
Cystoseira sp. Имеет кустистый, разветвлённый таллом высотой 10–120 см. Обитает на камнях или скалах на глубинах от 0,5 до 10 м, редко до 30 м (Зинова, 1967; Калугина-Гутник, 1975; Milchakova, 2011). Виды рода Cystoseira относятся к многолетним медленно растущим олигосапробам, образующим в Чёрном море коренные фитоценозы. Большинство сопутствующих водорослей (Polysiphonia, Ceramium, Laurencia, Callithamnion, Cladophora, Ulva и др.) являются короткоживущими, поселяющимися под пологом видов Cystoseira или на их слоевищах (Зинова, 1967; Евстигнеева, 1993; Степаньян, 2020).
Polysiphonia sp. – род нитчатых красных водорослей. Имеют кустистое слоевище высотой до 30 см, разветвлённое в верхней части. Растёт на литорали и сублиторали на каменистых грунтах, скалах, ракушках. Представители данного рода обнаружены нами в ассоциации цистозиры, так как являются её эпифитами (Зинова, 1967; Калугина-Гутник, 1975; Milchakova, 2011).
Ruppia sp. – представитель морских трав с нитевидными сильноветвистыми побегами длиной 20–40 см. Обитает на илисто-песчаных грунтах, ракушечнике с примесью гравия на глубинах от 0,1 до 7 м. Устойчива к волновой активности. Переносит солёность от 3 до 19 ‰ (Определитель…, 1972а; Milchakova, 2011).
108
Макрозооэпифитон макрофитов мелководья Керченского пролива
и прибрежной зоны Таманского полуострова
![]()
Stuckenia sp. имеет сильно разветвлённые стебли длиной до 1,5 м. Растение имеет длинные узкие линейные листья до 15 см длиной и менее 2 мм шириной. Устойчиво к эвтрофикации, обитает в пресной и солоноватой воде, является космополитом, встречается на всех континентах (Определитель…, 1972а; Milchakova, 2011).
Zostera sp. – морская трава, имеет крупные побеги с линейными листьями от 1 до 2 м длины. Обитает на илисто-песчаных грунтах. Образует заросли в защищённых бухтах, заливах и лагунах. Устойчивость к эвтрофированию обеспечивает этому виду доминирование
- районах с повышенной антропогенной нагрузкой и нестабильным составом донных осадков. Переносит солёность от 3 до 19 ‰. Растения Zostera богаты белком (Определитель…, 1972а;
Калугина-Гутник, 1975; Савенок, Шишлова, 2008; Milchakova, 2011; Широян, 2022).
Zannichellia sp. имеет нитевидный стебель, 20–50 см длиной, ветвистый, листья линейные. Обитает в пресной, солоноватой и морской воде, защищённой от волновой активности, при солёности от 3 до 19,0 ‰, в основном на илистых, илисто-песчаных грунтах на глубинах от 0,2 до 1 м (Определитель…, 1972а; Milchakova, 2011).
Порт Крым – небольшой порт, который находится у самого узкого места Керченского пролива. Грунт представлен песком, ракушей и валунами. Акватория порта Крым окружена молами, защищающими её от волн и льда. В его акватории обнаружен биоценоз
Ericaria crinita (Duby) Molinari&Guiry, 2020 (=Cystoseira crinita Duby 1830), которая является массовым и доминирующим видом многих естественных биоценозов. Черноморская водоросль E. crinita используется как интегральный показатель загрязнения среды тяжёлыми металлами (Бурдин и др., 1980). Обитает на камнях или скалах до глубины 30 м, на открытых берегах с волновой активностью. Слоевища крупные, разветвлённые, высотой 10–120 см
(Зинова, 1967; Калугина-Гутник, 1975; Milchakova, 2011).
Побережье у посёлка Сенной представлено плотным мелким песком. Температура воды 24 °С, солёность – 16,7 ‰. На рыхлых грунтах хорошо развита водная растительность, представленная морскими травами Zostera sp. и Ruppia sp., характерными для данной акватории (Лисовская, Степаньян, 2009).
Порт Кавказ – грунт представлен песком, ракушей и валунами, обросшими водорослями. Температура воды на момент сбора проб составила 19,5 °С, солёность – 15,8 ‰. В данной акватории отмечен Ceramium sp. – водоросль небольшого размера, встречается в виде пучков плотно разветвлённых и прикреплённых ризоидами. Обычно заселяет скалы, гальку, водоросли. Обитает на мелководье до глубины 11 м (Зинова, 1967; Широян, 2022). Быстро разрастается на новых поверхностях (Brown et al., 2001).
Фактор, определяющий возможность обитания макрофитобентоса, – доступные для колонизации твёрдые субстраты. Большинство макроводорослей закрепляется на твёрдых субстратах, некоторые виды способны активно занимать рыхлые грунты, но прикрепление всё равно происходит к твёрдым субстратам (частицы песка, раковины, другие водоросли) (Степаньян, 2020). Фитоценоз исследуемого нами мелководья Керченского пролива и прибрежной зоны Таманского полуострова представлен макрофитами E. crinita, Ulva sp.,
Zostera sp., Stuckenia sp., Ceramium sp., Ruppia sp., Zannichelia sp., зарослями
Ruppia sp.+Zostera sp. и Cystoseira sp.+Cladophora sp.+Polysiphonia sp. Известно (Зинова, 1967), что цистозира является идеальным субстратом для поселения множества гидробионтов, включая водоросли родов Cladophora и Polysiphonia.
Качественный состав макрозооэпифитона. В исследованной акватории обнаружено 56 видов макрозооэпифитона, включающих Polychaeta (13 видов), Crustacea (23), Mollusca (14) и неидентифицированные до вида представители таксонов Ascidiidae, Chirоnomidae, Platyhelminthes, Nemertea и Actiniidae (табл. 1а и 1б).
Наибольшее количество видов макрозообентоса (40) обнаружено в акватории Камыш-Бурунской бухты: Polychaeta (9 видов), Crustacea (18), Mollusca (10) и не идентифицированные до вида представители таксонов Ascidiidae, Chirоnomidae, Nemertea. Высокий показатель коэффициента Чекановского—Сёренсена отмечен для зооэпифитона, обнаруженного в районах Камыш-Бурунской бухты – порта Крым (0,68), которые расположены вдоль крымского
109
Копий В. Г., Бондаренко Л. В., Тимофеев В. А.,
Подзорова Д. В., Макаров М. В., Ковалёва М. А.
![]()
Таблица 1а
Средние значения численности (N, экз./кг) и биомассы (B, г/кг) макрозооэпифитона в
сообществах макрофитов мелководья Керченского пролива и прибрежной зоны Таманского
полуострова
| Макрофиты | |||||||||||||||||||
| Виды макрозооэпифитона | |||||||||||||||||||
| Zostera | Ruppia sp. | Stuckenia | Zannichelia | Ulva sp. | |||||||||||||||
| sp. | sp. | sp. | |||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | ||||||||||||||
| POLYCHAETA | |||||||||||||||||||
| Capitella capitata (Fabricius, 1780) | 6 | – | – | – | – | ||||||||||||||
| 0,011 | |||||||||||||||||||
| Harmothoe imbricata (Linnaeus, | – | – | – | 370 | – | ||||||||||||||
| 1767) | 1,481 | ||||||||||||||||||
| Leiochone leiopygos (Grube, 1860) | 11 | – | – | – | – | ||||||||||||||
| 0,033 | |||||||||||||||||||
| Nereididae Blainville, 1818 | – | 47 | – | – | 61 | ||||||||||||||
| 0,099 | 0,061 | ||||||||||||||||||
| Phyllodoce mucosa Örsted, 1843 | 11 | – | – | – | – | ||||||||||||||
| 0,027 | |||||||||||||||||||
| Platynereis dumerilii | 82 | 39 | – | – | |||||||||||||||
| (Audouin& Milne Edwards, 1833) | 0,202 | – | 0,019 | ||||||||||||||||
| Salvatoria clavata (Claparède, | – | – | – | – | 61 | ||||||||||||||
| 1863) | 0,015 | ||||||||||||||||||
| Итого | 110 | 47 | 39 | 370 | 122 | ||||||||||||||
| 0,273 | 0,099 | 0,019 | 1,481 | 0,076 | |||||||||||||||
| ARTHROPODA | |||||||||||||||||||
| Ampithoe ramondi Audouin, 1826 | – | – | 408 | 3148 | 672 | ||||||||||||||
| 0,398 | 1,685 | 0,563 | |||||||||||||||||
| Apherusa bispinosa (SpenceBate, | 6 | – | 175 | 3889 | — | ||||||||||||||
| 1857) | 0,002 | 0,054 | 1,019 | ||||||||||||||||
| Caprella acanthifera Leach, 1814 | 147 | – | 1456 | 3889 | 1181 | ||||||||||||||
| 0,024 | 0,334 | 1,019 | 0,195 | ||||||||||||||||
| Cumella (Cumella) limicola Sars, | 6 | – | – | – | – | ||||||||||||||
| 1879 | 0,003 | ||||||||||||||||||
| Dexamine spinosa (Montagu, 1813) | 89 | – | 1029 | 4815 | 93 | ||||||||||||||
| 0,02 | 0,637 | 2,611 | 0,042 | ||||||||||||||||
| Echinogammarus sp. | 6 | – | – | – | – | ||||||||||||||
| 0,001 | |||||||||||||||||||
| Echinogammarus foxi | – | – | – | 556 | 232 | ||||||||||||||
| (Schellenberg, 1928) | 0,259 | 0,144 | |||||||||||||||||
| Ericthonius difformis | 2273 | 988 | – | 926 | 61 | ||||||||||||||
| MilneEdwards, 1830 | 0,508 | 0,214 | 0,167 | 0,012 | |||||||||||||||
| Gammarus insensibilis Stock, 1966 | – | – | 175 | – | – | ||||||||||||||
| 0,425 | |||||||||||||||||||
| Idotea balthica (Pallas, 1772) | 3 | – | – | – | 77 | ||||||||||||||
| 0,001 | 0,067 | ||||||||||||||||||
| Iphinoe elisae Băcescu, 1950 | 5 | – | – | – | — | ||||||||||||||
| 0,001 | |||||||||||||||||||
| Lekanesphaera hookeri (Leach, | — | – | – | – | 1570 | ||||||||||||||
| 1814) | 8,583 | ||||||||||||||||||
110
Макрозооэпифитон макрофитов мелководья Керченского пролива
и прибрежной зоны Таманского полуострова
![]()
Таблица 1а (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | |||||||||||||||||||||
| Microdeutopus sp. | 541 | – | – | – | — | |||||||||||||||||||||
| 0,084 | ||||||||||||||||||||||||||
| Microdeutopus gryllotalpa Costa, | 59 | – | 5398 | 1149 | 553 | |||||||||||||||||||||
| 1853 | 0,012 | 1,221 | 2,833 | 0,47 | ||||||||||||||||||||||
| Monocorophium acherusicum | – | – | 19 | 186 | 47 | |||||||||||||||||||||
| (Costa, 1853) | 0,008 | 0,037 | 0,001 | |||||||||||||||||||||||
| Mysida sp. | – | – | – | 186 | – | |||||||||||||||||||||
| 0,167 | ||||||||||||||||||||||||||
| Plumulojassa ocia (SpenceBate, | 270 | – | – | – | – | |||||||||||||||||||||
| 1862) | 0,027 | |||||||||||||||||||||||||
| Stenosoma capito (Rathke, 1836) | 3 | – | 19 | – | – | |||||||||||||||||||||
| 0,001 | 0,167 | |||||||||||||||||||||||||
| Stenothoe monoculoides | 23 | – | 311 | 1111 | 291 | |||||||||||||||||||||
| (Montagu, 1813) | 0,002 | 0,031 | 0,093 | 0,037 | ||||||||||||||||||||||
| Chironomidae | – | – | – | 107 | 370 | |||||||||||||||||||||
| 0,014 | 0,093 | |||||||||||||||||||||||||
| Итого | 3431 | 988 | 8990 | 20225 | 4884 | |||||||||||||||||||||
| 0,686– | 0,214 | 3,275 | 9,983 | 10,128 | ||||||||||||||||||||||
| MOLLUSCA | ||||||||||||||||||||||||||
| Arcuatula senhousia (Benson, | – | – | 97 | 3 | – | |||||||||||||||||||||
| 1842) | 0,51 | 0,035 | ||||||||||||||||||||||||
| Cerastoderma glaucum (Bruguière, | – | – | 194 | – | 229 | |||||||||||||||||||||
| 1789) | 29 | 36,5 | ||||||||||||||||||||||||
| Modiolula phaseolina (Philippi, | – | – | 291 | – | 47 | |||||||||||||||||||||
| 1844) | 68 | 9,25 | ||||||||||||||||||||||||
| Mytilaster lineatus (Gmelin, 1791) | – | – | 117 | – | 61 | |||||||||||||||||||||
| 9,7 | 0,3 | |||||||||||||||||||||||||
| Итого | 8 | 699 | 3 | 337 | ||||||||||||||||||||||
| 0 | 0,008 | 107,21 | 0,035 | 46,05 | ||||||||||||||||||||||
| Bittium reticulatum (daCosta, 1778) | – | 8 | 97 | 3 | – | |||||||||||||||||||||
| 0,008 | 0,51 | 0,035 | ||||||||||||||||||||||||
| Rissoa membranacea (J. Adams, | 9 | 112 | 913 | 150 | 1224 | |||||||||||||||||||||
| 1800) | 0,27 | 2,954 | 14,72 | 2,36 | 16,405 | |||||||||||||||||||||
| R. parva (da Costa, 1778) | – | – | 233 | – | 75 | |||||||||||||||||||||
| 1,417 | 0,46 | |||||||||||||||||||||||||
| R. venusta Philippi, 1844 | – | – | 136 | 1 | 474 | |||||||||||||||||||||
| 1,417 | 0,006 | 1,5 | ||||||||||||||||||||||||
| Setia turriculata Monterosato, 1884 | – | – | 214 | – | 198 | |||||||||||||||||||||
| 0,21 | 0,195 | |||||||||||||||||||||||||
| Tritia sp. | – | – | – | 1 | – | |||||||||||||||||||||
| 0,062 | ||||||||||||||||||||||||||
| Итого | 9 | 123 | 1593 | 155 | 1971 | |||||||||||||||||||||
| 0,27 | 2,964 | 18,274 | 2,463 | 18,56 | ||||||||||||||||||||||
| Actiniidae Rafinesque, 1815 | 22 | – | – | – | – | |||||||||||||||||||||
| 0,367 | ||||||||||||||||||||||||||
| Ascidia gen. sp. Linnaeus, 1767 | – | – | 58 | 926 | – | |||||||||||||||||||||
| 0,232 | 444,444 | |||||||||||||||||||||||||
| ВСЕГО | 3572 | 1166 | 11379 | 21679 | 7314 | |||||||||||||||||||||
| 1,596 | 3,285 | 129,01 | 458,406 | 74,814 | ||||||||||||||||||||||
Примечание к таблице. B числителе дроби – численность (экз./кг), в знаменателе – биомасса (г/кг).
111
Копий В. Г., Бондаренко Л. В., Тимофеев В. А.,
Подзорова Д. В., Макаров М. В., Ковалёва М. А.
![]()
побережья Керченского пролива. В порту Крым на каменистом субстрате обильно произрастает Е. crinita, разветвленный таллом которой является убежищем для многих видов гидробионтов.
- акватории Камыш-Бурунской бухты видовое богатство гидробионтов связано с разнообразием макрофитов, обнаруженных в данной акватории. Наименьшее видовое сходство (0,19) зарегистрировано между акваториями порта Кавказ (Керченский пролив) – пос. Сенной (Таманский залив). По-видимому, это связано с наличием разных макрофитов: в акватории посёлка Сенной обнаружены морские травы, в акватории порта Кавказ – красные водоросли рода Ceramium.
Наибольшее видовое разнообразие макрофитов обнаружено в акватории Камыш-Бурунской бухты (6), п. Сенной (2) и по одному виду в акваториях портов Крым и Кавказ. Максимальное количество видов макрозообентоса отмечено на E. crinita (39), далее следуют
| заросли | Ruppia sp.+Zostera sp. (23), Cystoseira sp.+Cladophora sp.+Polysiphonia sp. | (22), |
| Ulva sp. | (21), Stuckenia sp. и Zostera sp. (по 19), Zannichelia sp. (17), Ceramium sp. | (15), |
| Ruppia sp. (4). | ||
Таблица 1б
Средние значения численности (N, экз./кг) и биомассы (B, г/кг) макрозооэпифитона в
сообществах макрофитов мелководья Керченского пролива и прибрежной зоны Таманского
полуострова
| Макрофиты | |||||||||||||||
| Виды макрозооэпифитона | |||||||||||||||
| Ericaria | Ceramium | Ruppia sp.+ | Cystoseira sp.+ | ||||||||||||
| crinita | Cladophora sp.+ | ||||||||||||||
| sp. | Zostera sp. | ||||||||||||||
| Polysiphonia sp. | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | |||||||||||
| POLYCHAETA | |||||||||||||||
| Alitta succinea (Leuckart, 1847) | 72 | 115 | 9 | – | |||||||||||
| 0,978 | 0,082 | 0,044 | |||||||||||||
| Fabricia sabella (Müller, 1774) | 11 | – | – | 69 | |||||||||||
| 0,001 | 0,021 | ||||||||||||||
| Ficopomatus enigmaticus (Fauvel, | 21 | – | 42 | – | |||||||||||
| 1923) | 0,015 | 0,042 | |||||||||||||
| Nereididae Blainville, 1818 | 18 | 41 | – | – | |||||||||||
| 0,003 | 0,027 | ||||||||||||||
| Nereiphylla pusilla (Claparède, | 46 | – | – | 35 | |||||||||||
| 1870) | 0,009 | 0,035 | |||||||||||||
| Platynereis dumerilii | 54 | – | 183 | 139 | |||||||||||
| (Audouin& Milne Edwards, 1833) | 0,224 | 1,721 | 3,056 | ||||||||||||
| Polydora cornuta Bosc, 1802 | 208 | – | – | – | |||||||||||
| 0,012 | – | ||||||||||||||
| Salvatoria clavata (Claparède, | 207 | – | – | – | |||||||||||
| 1863) | 0,011 | ||||||||||||||
| Streblospio gynobranchiata | – | – | – | 69 | |||||||||||
| Rice&Levin, 1998 | 0,007 | ||||||||||||||
| Итого | 637 | 156 | 234 | 312 | |||||||||||
| 1,253 | 0,109 | 1,807 | 3,119 | ||||||||||||
| Nemertea | 3 | – | – | 69 | |||||||||||
| 0,001 | 0,069 | ||||||||||||||
| Platyhelminthes | 52 | – | – | – | |||||||||||
| 0,021 | |||||||||||||||
112
Макрозооэпифитон макрофитов мелководья Керченского пролива
и прибрежной зоны Таманского полуострова
![]()
| Таблица 1б (продолжение) | |||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | |||||||||||||
| ARTHROPODA | |||||||||||||||||
| Amphibalanus improvisus | 15 | 101 | 34 | – | |||||||||||||
| (Darwin, 1854) | 0,099 | 2,605 | 0,184 | ||||||||||||||
| Ampithoe ramondi Audouin, 1826 | 170 | 14 | 346 | 1319 | |||||||||||||
| 0,312 | 0,003 | 0,418 | 0,398 | ||||||||||||||
| Apherusa bispinosa (SpenceBate, | 16 | – | 158 | 486 | |||||||||||||
| 1857) | 0,008 | 0,041 | 0,132 | ||||||||||||||
| Apohyale perieri (Lucas, 1846) | – | 862 | – | – | |||||||||||||
| 0,458 | |||||||||||||||||
| Caprella acanthifera Leach, 1814 | 18 | – | 776 | 4514 | |||||||||||||
| 0,008 | 0,189 | 0,334 | |||||||||||||||
| Cumella (Cumella limicola Sars, | – | – | – | 69 | |||||||||||||
| 1879 | 0,003 | ||||||||||||||||
| Dexamine spinosa (Montagu, 1813) | 39 | – | 1042 | 4306 | |||||||||||||
| 0,035 | 0,656 | 0,637 | |||||||||||||||
| Echinogammarus sp. | 3 | – | – | – | |||||||||||||
| 0,001 | |||||||||||||||||
| Echinogammarus foxi | – | 331 | – | – | |||||||||||||
| (Schellenberg, 1928) | 0,202 | ||||||||||||||||
| Ericthonius difformis | 237 | – | 515 | – | |||||||||||||
| MilneEdwards, 1830 | 0,046 | 0,17 | |||||||||||||||
| Gammarus insensibilis Stock, 1966 | – | – | 122 | 3056 | |||||||||||||
| 0,3975 | 0,425 | ||||||||||||||||
| Idotea balthica (Pallas, 1772) | 176 | 180 | 12 | – | |||||||||||||
| 1,55 | 0,818 | 0,018 | |||||||||||||||
| Iphinoe elisae Băcescu, 1950 | – | – | – | – | |||||||||||||
| Lekanesphaera hookeri (Leach, | 7 | 2626 | – | – | |||||||||||||
| 1814) | 0,059 | 20,197 | |||||||||||||||
| Melita sp. | 2 | – | – | – | |||||||||||||
| 0,001 | |||||||||||||||||
| Microdeutopus sp. | – | 96 | – | – | |||||||||||||
| 0,015 | |||||||||||||||||
| Microdeutopus gryllotalpa Costa, | 496 | 148 | 6006 | 2167 | |||||||||||||
| 1853 | 0,303 | 0,059 | 1,658 | 1,221 | |||||||||||||
| Monocorophium acherusicum | 1 | – | – | – | |||||||||||||
| (Costa, 1853) | 0,001 | ||||||||||||||||
| Pleonexes helleri (Karaman, 1975) | 22 | – | – | – | |||||||||||||
| 0,062 | |||||||||||||||||
| Plumulojassa ocia (SpenceBate, | 42 | – | – | – | |||||||||||||
| 1862) | 0,008 | ||||||||||||||||
| Stenosoma capito (Rathke, 1836) | 26 | – | 132 | – | |||||||||||||
| 0,323 | 0,252 | ||||||||||||||||
| Stenothoe monoculoides | 526 | 270 | 481 | 1319 | |||||||||||||
| (Montagu, 1813) | 0,305 | 0,037 | 0,048 | 0,031 | |||||||||||||
| Chironomidae | 20 | 54 | – | – | |||||||||||||
| 0,006 | 0,005 | ||||||||||||||||
| Итого | 1796 | 4682 | 9624 | 17236 | |||||||||||||
| 3,127 | 24,399 | 4,0315 | 3,181 | ||||||||||||||
| MOLLUSCA | |||||||||||||||||
| Anadara kagoshimensis (Tokunaga, | – | 17 | – | – | |||||||||||||
| 1906) | 0,8 | ||||||||||||||||
113
Копий В. Г., Бондаренко Л. В., Тимофеев В. А.,
Подзорова Д. В., Макаров М. В., Ковалёва М. А.
![]()
| Таблица 1б (продолжение) | |||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | |||||||||||||||
| Arcuatula senhousia (Benson, | 3 | – | 17 | 69 | |||||||||||||||
| 1842) | 0,381 | 0,289 | 0,486 | ||||||||||||||||
| Cerastoderma glaucum (Bruguière, | 6 | – | 181 | 1389 | |||||||||||||||
| 1789) | 0,952 | 36,3 | 20,8 | ||||||||||||||||
| Modiolula phaseolina (Philippi, | – | – | 42 | 1042 | |||||||||||||||
| 1844) | 3,65 | 6,25 | |||||||||||||||||
| Mytilaster lineatus (Gmelin, 1791) | 248 | 1265 | 217 | 1389 | |||||||||||||||
| 1,976 | 31,9 | 0,67 | 3,47 | ||||||||||||||||
| Mytilus galloprovincialis Lamarck, | 6 | 33 | – | – | |||||||||||||||
| 1819 | 0,381 | 108 | |||||||||||||||||
| Итого | 263 | 1315 | 457 | 3889 | |||||||||||||||
| 3,69 | 140,7 | 40,909 | 31,006 | ||||||||||||||||
| Bittium reticulatum (da Costa, | – | – | 17 | 69 | |||||||||||||||
| 1778) | 0,289 | 0,486 | |||||||||||||||||
| Corambe obscura (A. E. Verrill, | 1 | – | – | – | |||||||||||||||
| 1870) | 0,01 | ||||||||||||||||||
| Rissoa membranacea (J. Adams, | 28 | – | 1738 | 278 | |||||||||||||||
| 1800) | 0,421 | 15 | 4,0 | ||||||||||||||||
| R. parva (da Costa, 1778) | 12 | – | 261 | 2569 | |||||||||||||||
| 0,044 | 1,23 | 4,03 | |||||||||||||||||
| R. venusta Philippi, 1844 | 32 | – | 85 | 278 | |||||||||||||||
| 0,257 | 0,44 | 0,76 | |||||||||||||||||
| Setia turriculata Monterosato, 1884 | 6 | – | 49 | 5278 | |||||||||||||||
| 0,006 | 0,049 | 5,28 | |||||||||||||||||
| Tritia neritea (Linnaeus, 1758) | – | – | 25 | – | |||||||||||||||
| 4,315 | |||||||||||||||||||
| Tritia sp. | – | – | 68 | – | |||||||||||||||
| 1,975 | |||||||||||||||||||
| Итого | 79 | 0 | 2243 | 8472 | |||||||||||||||
| 0,738 | 23,298 | 14,556 | |||||||||||||||||
| Actiniidae Rafinesque, 1815 | 100 | – | – | – | |||||||||||||||
| 0,212 | |||||||||||||||||||
| Ascidia gen. sp. Linnaeus, 1767 | 7 | – | – | – | |||||||||||||||
| 2,671 | |||||||||||||||||||
| ВСЕГО | 2957 | 6153 | 12558 | 29978 | |||||||||||||||
| 11,713 | 165,208 | 70,0455 | 51,931 | ||||||||||||||||
Примечание к таблице. B числителе дроби – численность (экз./кг), в знаменателе – биомасса (г/кг).
Амфиподы M. gryllotalpa и S. monoculoides обнаружены на всех макрофитах, кроме Ruppia sp., гастропода R. membranacea не обнаружена на Ceramium sp.
Высокий показатель коэффициента Чекановского—Сёренсена отмечен для зооэпифитона, обнаруженного в зарослях Cystoseira sp.+Cladophora sp.+Polysiphonia sp. – Stuckenia sp. (0,8), Stuckenia sp. – Ruppia sp.+Zostera sp. (0,7) и Ulva sp. – Stuckenia sp. (0,7). Наименее сходны по видовому составу животные, обитающие в скоплениях макрофитов Ceramium sp. – Ruppia sp.
(0,1), Ceramium sp. – Zostera sp. (0,2), Ceramium sp. – Cystoseira sp.+Cladophora sp.+Polysiphonia sp. (0,2).
- фитоценозе морских трав обнаружено 40 видов макрозообентоса, в зарослях водорослей – 48. Для них отмечено высокое фаунистическое сходство видов, коэффициент Чекановского-Сёренсена составил 0,7.
Annelida представлены Polychaeta, Platyhelminthes и Nemertea. В видовом составе полихет зарегистрировано 13 видов, относящихся к 4 отрядам: Capitellida (2 вида), Phyllodocida (7), Sabellida и Spionida – по 2 вида. Наибольшее количество видов (8) отмечено на E. crinita, в
зарослях цветковых растений – 7, в ассоциации Cystoseira sp.+Cladophora sp.+
114
Макрозооэпифитон макрофитов мелководья Керченского пролива
и прибрежной зоны Таманского полуострова
![]()
Polysiphonia sp. – 4, в зелёных и красных водорослях – по 2 вида. Для всех зарегистрированных видов полихет свойственно обитание в обрастаниях прибрежных скал, камней и на макрофитах. Три вида полихет оказались редкими и встречены только один раз: H. imbricata на многолетних водных растениях Zannichelia sp., Ph. mucosa на Zostera sp., S. gynobranchiata – в ассоциации водорослей Cystoseira sp.+Cladophora sp.+Polysiphonia sp.
Crustacea представлены 23 видами, относящимися к 5 отрядам: Amphipoda (17 видов), Isopoda (3), Cumacea (1) и по одному виду Balanomorpha, Mysida. Наибольшее количество видов (20) отмечено в зарослях цветковых растений, в бурых водорослях – 16, зелёных ― 10, красных – 9, в зарослях водорослей Cystoseira sp.+Cladophora sp.+Polysiphonia sp. – 8. Более чем на 50 % видов макрофитов идентифицированы типичные обитатели этих зарослей:
A. ramondi, A. bispinosa, C. acantifera, D. spinosa, E. difformis, I. balthica, M. gryllotalpa. Редкими оказались A. perieri, C. limicola, I. elisae, P. helleri, P. ocia, представители родов Melita и Mysida.
Mollusca представлены 14 видами, относящимися к 7 отрядам: Littorinimorpha и Mytilida (по 4 вида), Arcida, Caenogastropoda, Cardiida, Neogastropoda, Nudibranchia (по 1 виду).
Наибольшее количество видов отмечено в эпифитоне цветковых растений Ruppia sp.+Zostera sp. (10 видов), в бурых водорослях – 9, в зелёных водорослях и в зарослях Cystoseira sp.+Cladophora sp.+Polysiphonia sp. – по 8 видов, в красных – 3 вида.
Двустворчатые моллюски A. senhousia, C. glaucum, M. lineatus и гастропода R. venusta обнаружены более чем на 50 % видов макрофитов. Двустворчатый моллюск A. kagoshimensis встречен только в зарослях Ceramium sp., а гастропода C. obscura –только в зарослях E. crinita.
Представители типа Actiniidae и Ascidia встречены в зарослях цветковых растений и
среди E. crinita, Nemertea – в фитоценозе E. crinita и в зарослях
Cystoseira sp.+Cladophora sp.+Polysiphonia sp. Chironomidae обнаружены на всех макрофитах, кроме фитоценоза Cystoseira sp.+Cladophora sp.+Polysiphonia sp. Platyhelminthes обнаружены только в зарослях E. сrinita.
Количественное развитие. Средние значения численности и биомассы всего макрозооэпифитона составили 10762±4080 экз./кг (средняя±доверительный интервал) и 107,644±61,089 г/кг соответственно. Наибольшая численность и биомасса
макрозооэпифитона зарегистрированы в акватории Камыш-Бурунской бухты (95350 экз./кг и 783,87 г/кг соответственно), наименьшие – в акватории посёлка Сенной (2428 экз./кг и 4,441 г/кг соответственно). На всех участках значительный вклад в общую численность вносили ракообразные (от 61 до 87 % общей численности макрозооэпифитона). Основная роль в формировании биомассы в акватории Камыш-Бурунской бухты принадлежит асцидии (57 % общей биомассы), на остальных участках – моллюскам (от 38 до 85 % общей биомассы).
Максимальная численность гидробионтов отмечена в зарослях макрофитов Cystoseira sp.+Cladophora sp.+Polysiphonia sp. (29978 экз./кг; 58 % – ракообразные), биомасса
– в Ceramium sp. (165,208 г/кг; 27 % – моллюски).
Средняя численность полихет в зарослях макрофитов варьировала от 39 экз./кг (Stuckenia sp.) до 637 экз./кг (E. crinita). Биомасса изменялась от 0,019 г (Stuckenia sp.) до 3,119 г/кг в зарослях макрофитов Cystoseira sp.+Cladophora sp.+Polysiphonia sp. Основной вклад в формирование численности внесли спионида P. cornuta и силлида S. clavata (по 33 % общей численности полихет), биомассы – нереида P. dumerilii (98 %общей биомассы полихет).
Ранжированный ряд по численности возглавляет P. dumerilii (55 экз./кг), далее следуют
- imbricate (41 экз./кг), S. clavata (30 экз./кг) и P. cornuta (30 экз./кг). Ранжированный ряд по биомассе также возглавляет P. dumerilii (0,58 г/кг), далее следуют H. imbricata (0,165 г/кг) и
A. succinea (0,123 г/кг).
Средняя численность ракообразных в зарослях макрофитов варьировала от 988 экз./кг (Ruppia sp.) до 20225 экз./кг (Zannichelia sp.). Биомасса изменялась от 0,214 г/кг (Ruppia sp.) до 24,399 г/кг (Ceramium sp.). Основной вклад в формирование этих показателей вносят Amphipoda: 93 % общей численности и 45 % биомассы Malacostraca.
115
Копий В. Г., Бондаренко Л. В., Тимофеев В. А.,
Подзорова Д. В., Макаров М. В., Ковалёва М. А.
![]()
Ранжированный ряд по численности возглавляет M. gryllotalpa (1775 экз./кг), его вклад в общую численность составил 22 %. Далее следуют C. acanthifera (1331 экз./кг), D. spinosa (1268 экз./кг). Ранжированный ряд по биомассе возглавляет изопода L. hookeri (3,204 г/кг), её вклад в общую биомассу составил 49 %. Далее следуют амфиподы M. gryllotalpa (0,864 г/кг)
- D. spinosa (0,515 г/кг).
Средняя численность моллюсков в сообществах макрофитов варьировала от 9 экз./кг (Zostera sp.) до 12361 экз./кг (Cystoseira sp.+Cladophora sp.+Polysiphonia sp.). Биомасса изменялась от 0,27 г/кг (Zostera sp.) до 140,7 г/кг (Ceramium sp). На Zostera sp. идентифицирован только один вид гастроподы R. membranacea, брюхоногие моллюски обнаружены в зарослях Ruppia sp., двустворчатые моллюски – в Ceramium.
Ранжированный ряд по численности возглавляет S. turriculata (638экз./кг), его вклад в общую численность составил 27 %. Далее следуют R. membranacea (495 экз./кг), M. lineatus (366 экз./кг) и R. parva (350 экз./кг). Ранжированный ряд по биомассе возглавляет C. glaucum (13,727 г/кг), его вклад в общую биомассу составил 27 %. Далее следуют митилиды M. galloprovincialis (12,04 г/кг) и M. phaseolina (9,68 г/кг).
Трофическая принадлежность. Талломы макрофитов обладают сбалансированным содержанием углеводов, белков, липидов, биологически активных веществ и микроэлементов, что делает их важным пищевым ресурсом для животных разных систематических групп (Растительные ресурсы…, 1994; Растительные ресурсы…, 2014; Чемерисa, Бобровa, 2020). Производимая макрофитами фитомасса эффективно включена в круговорот органического вещества.
Население фитоценозов исследуемой акватории обладает широким пищевым спектром:
фитофаги, детритофаги, полифаги, плотоядные и сестонофаги (рис. 2).
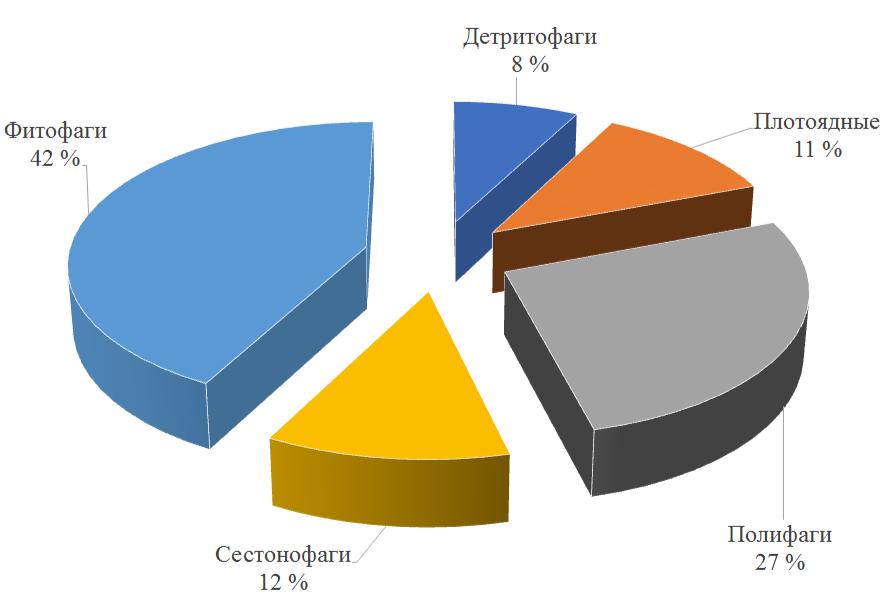
Рис. 2. Трофическая структура зооэпифитона биоценозов макрофитов вдоль мелководья Керченского пролива и прибрежной зоны Таманского полуострова
Среди трофических групп сестонофаги выделены отдельно, так как известно, что биологическая фильтрация в прибрежных водах не только является одним из основных способов получения пищи, но и представляет собой глобальную многоступенчатую систему
116
Макрозооэпифитон макрофитов мелководья Керченского пролива
и прибрежной зоны Таманского полуострова
![]()
процесса самоочищения среды. Бентосные организмы, наряду с макрофитами, также принимают активное участие в биологической очистке природных вод (Капков и др., 2016).
Наибольшее количество видов относится к фитофагам (22), среди них 70 % принадлежит ракообразным. Значительную роль в формировании численности играет амфипода M. gryllotalpa (36 % общей численности фитофагов), биомассы – изопода L. hookeri (56 %). Самая малочисленная группа – детритофаги (4), в которую входят только ракообразные.
- видовом составе зооэпифитона на всех видах макрофитов более 50 % гидробионтов – фитофаги (рис. 3).
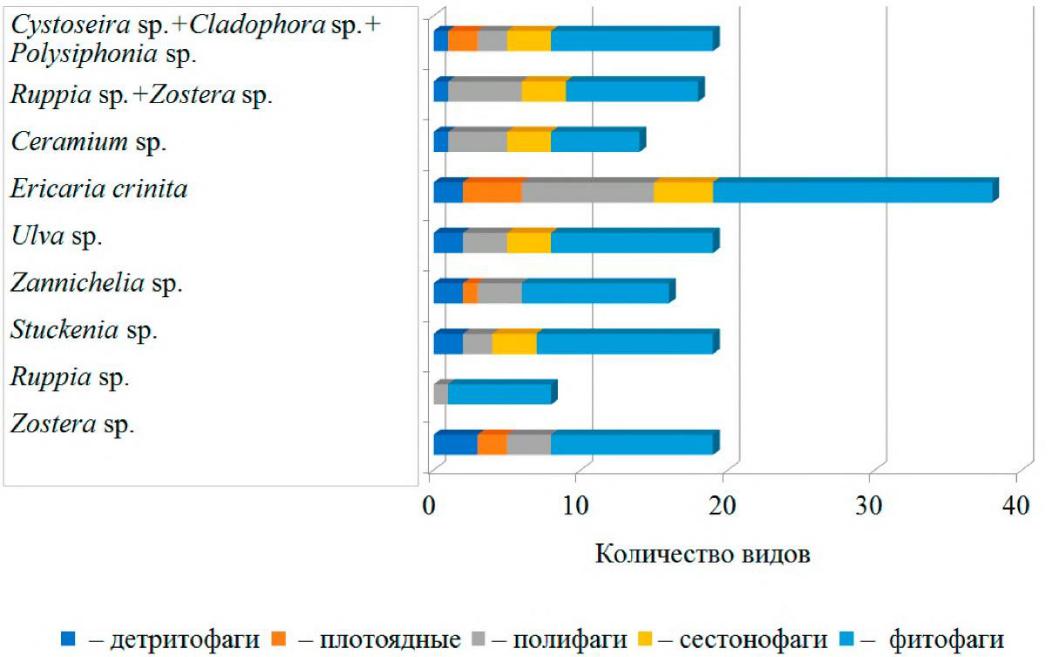
Рис. 3. Представленность трофических группировок в зарослях макрофитов вдоль мелководья Керченского пролива и прибрежной зоны Таманского полуострова
Плотность поселения фитофагов была наивысшей в зарослях всех видов макрофитов и составляла от 44 до 98 % их численности. Сформирован данный показатель в основном ракообразными.
По биомассе доминировали сестонофаги и фитофаги. Основная роль в формировании этого показателя принадлежит моллюскам.
Таким образом, наибольшее количество видов макрозооэпифитона обнаружено в биоценозе E. crinita, в ассоциации водорослей Cystoseira sp.+Cladophora sp.+Polysiphonia sp. количество видов сокращается. По-видимому, основной причиной является избирательная способность гидробионтов, связанная с их чувствительностью к действию выделяемых красными водорослями метаболитов (Капков и др., 2016). Известно (Титлянов и др., 2011), что они накапливают полифенольные и фенольные вещества, многие из этих соединений ядовиты для животных. Поэтому в исследуемой нами акватории в биоценозе Ceramium sp. количество видов в 2,6 раза меньше чем в зарослях бурой водоросли E. crinita. Снижение
| видового | разнообразия | гидробионтов | в | ассоциации | Cystoseira sp.+ |
| Cladophora sp.+Polysiphonia sp. | можнообъяснитьналичиемкраснойводоросли | ||||
| Polysiphonia sp. Однако, наибольшие количественные показатели | зооэпифитона | ||||
зарегистрированы именно в этой ассоциации. Можно предположить, что численность и биомасса зооэпифитона формируются за счёт более выносливых и адаптированных к обитанию в биоценозах красных водорослей гидробионтов, но в литературе такие данные не обнаружены.
117
Копий В. Г., Бондаренко Л. В., Тимофеев В. А.,
Подзорова Д. В., Макаров М. В., Ковалёва М. А.
![]()
Ранее было показано, что существенную роль в распределении видов играет разветвлённость слоевища макрофитов, создавая для обитателей большое количество экологических ниш, дополнительную поверхность для прикрепления животных и их пищи (Маккавеева, 1979). При равных условиях в зарослях более разветвлённых макрофитов не только видовое разнообразие больше, но и количественные показатели возрастают с увеличением разветвлённости талломов. Разветвлённость слоевища особое влияние оказывает на ту часть животных зарослей, которые питаются диатомовыми обрастаниями. Показано, что на прибрежной цистозире в Чёрном море среднегодовая биомасса диатомового оброста составляла 300 г/кг, а фитофагов – 50 г/кг. Тогда как на менее разветвлённой филлофоре оброста в 4 раза, а фитофагов в 2,5 раза меньше (Маккавеева, 1979).
ЗАКЛЮЧЕНИЕ
Фитоценоз мелководья Керченского пролива и прибрежной зоны Таманского полуострова представлен макрофитами E. crinita, Ulva sp., Zostera sp., Stuckenia sp.,
Ceramium sp., Ruppia sp., Zannichelia sp., зарослями Ruppia sp.+Zostera sp. и Cystoseira sp.+Cladophora sp.+Polysiphonia sp.
Обнаружено 56 видов макрозооэпифитона, включающих Polychaeta (13 видов), Crustacea (23), Mollusca (14) и неидентифицированные до вида представители таксонов Ascidiidae, Chirоnomidae, Platyhelminthes, Nemertea и Actiniidae. Максимальное количество видов гидробионтов отмечено на E. crinita (39), далее следуют заросли Ruppia sp.+Zostera sp. (23), Cystoseira sp.+Cladophora sp.+Polysiphonia sp. (22), Ulva sp. (21), Stuckenia sp. и Zostera sp. (по 19), Zannichelia sp. (17), Ceramium sp. (15), Ruppia sp. (4). Средние значения численности и биомассы всего макрозооэпифитона составили 10762±4080 экз./кг и 107,644±61,089 г/кг соответственно. Максимальная численность гидробионтов отмечена в зарослях макрофитов Cystoseira sp.+Cladophora sp.+Polysiphonia sp. (29978 экз./кг), биомасса – в Ceramium sp. (165,208 г/кг).
Макрозооэпифитон фитоценозов представлен фитофагами, детритофагами, полифагами
- плотоядными. Наибольшее количество видов относится к фитофагам (22), самая малочисленная группа – детритофаги (4).
Благодарности. Авторы выражают благодарность канд. биол. наук Е. А. Колесниковой за помощь в определении макрофитов.
Статья подготовлена в рамках Государственного задания ФГБУН ФИЦ «Институт биологии южных морей имени А. О. Ковалевского РАН» «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана», № 121030100028-0.
Список литературы
Бурдин К. С., Гусев М. В., Крупина М. В., Савельев И. Б. Изучение возможностей использования макроводоросли Cystoseira crinita в качестве организма-монитора загрязнения Чёрного моря тяжелыми металлами // Вестник Московского университета. Серия 16: Биология. – 1980. – № 3. – С. 3–10.
Грезе И. И. Высшие ракообразные. Бокоплавы. Фауна Украины. – Киев: Наукова думка, 1985. – Т. 26, вып.
- –172с
Евстигнеева И. К. Видовой состав и количественная характеристика эпифитов Cystoseira crinita Bory // Альгология. – 1993. – Т. 3, № 4. –С. – 52–57.
Зернов С. А. К вопросу об изучении жизни Чёрного моря. Записки Императорской Академии Наук. – CПб:
Типография императорской академии наук, 1913. – Т. 32, № 1. – 300 с.
Зинова А. Д. Определитель зеленых, бурых и красных водорослей южных морей СССР. – М. – Л.: Наука,
1967. – 398 с.
Калугина-Гутник А. А. Фитобентос Черного моря. – Киев: Наукова думка, 1975. – 248 с.
Капков В. И., Шошина Е. В., Беленикина О. А. Биоремедиация морских прибрежных экосистем: использование искусственных рифов // Вестник МГТУ. Труды Мурманского государственного технического университета. – 2016. – Т. 19, № 1/2. – С. 286–295.
118
Макрозооэпифитон макрофитов мелководья Керченского пролива
и прибрежной зоны Таманского полуострова
![]()
Киселева Г. А. Видовой состав и динамика макрозообентоса в ассоциациях водорослей Карадагского природного заповедника // Экосистемы, их оптимизация и охрана. – 2009. – Вып. 20. – С. 57–66.
Киселева М. И. Бентос рыхлых грунтов Чёрного моря. – Киев: Наукова думка, 1981. – 163 с.
Киселева М. И. Многощетинковые черви (Polychaeta) Чёрного и Азовского морей. – Апатиты: Изд-во Кольского науч. центра РАН, 2004. – 409 с.
Лисовкая О. А., Степаньян О. В. Разнообразие макроводорослей прибрежья Таманского п-ова (Россия) в летний период // Альгология. – 2009. – Т. 19, № 4. – С. 341–348.
Макаров М. В. Таксоцен Mollusca в эпифитоне морской травы Zostera sp. в акватории бухты Казачья (Черное море) // Экологическая безопасность прибрежной и шельфовой зон моря. – 2018. – Вып. 3. – С. 92–97. doi: 10.22449/2413-5577-2018-3-92-97.
Макаров М. В., Бондаренко Л. В., Копий В. Г. Донная фауна бухты Круглой (Чёрное море, Крым). Сообщение 1. Эпифитон макрофитов // Труды Карадагской научной станции имени Т. И. Вяземского – природного заповедника РАН. – 2022. – Т. 7, № 1 (21). – С. 11–26. https://doi.org/10.21072/eco.2022.21.02.
Макаров М. В., Копий В. Г., Бондаренко Л. В., Витер Т. В., Подзорова Д. В. Макрозообентос зарослей водорослей Cystoseira crinita Duby, 1830 у берегов Крыма и Кавказа (Чёрное море) // Ученые записки Крымского федерального университета имени В. И. Вернадского. Биология. Химия. – 2020. – Т. 6 (72), № 3. – С. 97–116. DOI: 10.37279/2413-1725-2020-6-3-97-116.
Маккавеева Е. Б. Беспозвоночные зарослей макрофитов Чёрного моря. – Киев: Наукова думка, 1979. – 229 с. Маккавеева Е. Б. Многолетние изменения эпифитона в Севастопольских бухтах // Многолетние изменения
зообентоса Черного моря. – К.: Наукова думка, 1992. – С. 184–213.
Никитина В. Н., Лисовская О. А. Макрофитобентос верхних отделов береговой зоны российского побережья Черного моря. – СПб: СПбГУ, 2013. – 132 с.
Определитель фауны Чёрного и Азовского морей. Т. 3 / [Под ред. Ф. Д. Мордухай-Болтовского]. – Киев:
Наукова думка, 1972. –– 340 с.
Растительные ресурсы России и сопредельных государств: Цветковые растения, их химический состав,
использование. Т. 8. Сем. Butomaceae–Typhaceae / [Отв. ред. П. Д. Соколов]. – СПб: Наука, 1994. – С. 12–14.
Растительные ресурсы России: Дикорастущие цветковые растения, их компонентный состав и биологическая
активность. Т. 6. Сем. Butomaceae–Typhaceae / [Отв. ред. А. Л. Буданцев]. – СПб–М.: КМК, 2014. – С. 19–23.
Определитель высших растений Крыма / [Под. ред. Н. И. Рубцова]. – Л.: Наука, 1972а. – 550 с.
Савенок Н. В., Шишлова М. А. Zostera marina как биоиндикатор морской среды // Успехи современного естествознания. – 2008. – № 6. – С. 136.
Садогурский С. Е. Макрофитобентос водоемов острова Тузла и прилегающих морских акваторий (Керченский пролив, Украина) // Альгология. – 2006. – Т. 16, №3. – С. 337–354.
Сёмкин Б. И., Горшков М. В. Об оценке сходства и различия в серии флористических и фитоценотических описаний // Комаровские чтения. – 2010. – Вып. 57. – С. 203–220.
Степаньян О. В. Макрофитобентос Чёрного и Азовского морей: флористические и экологические аспекты
(обзор) // Наука юга России. – 2020. – Т. 16, № 4. – С. 26–38. DOI: 10.7868/S25000640200404
Титлянов Э. А., Титлянова Т. В., Белоус О. С. Полезные вещества морских красных водорослей (Rhodophyta):
химическая структура и содержание // Известия ТИНРО. – 2011. – Т. 165. – С. 305–317.
Чемерисa Е. В., Бобровa А. А. Продуктивность рдестов (Potamogeton, Stuckenia, Potamogetonaceae) в реках севера Европейской России // Водные ресурсы. – 2020. – Т. 47, № 1. – С. 114–120.
Чухчин В. Д. Экология брюхоногих моллюсков Чёрного моря. – Киев: Наук. думка, 1984. – 176 с.
Широян А. Г. Диатомовые водоросли эпифитона макрофитов Крымского прибрежья Чёрного моря: дис. … канд. биол. наук: спец. 1.5.16 Гидробиология. – Севастополь: Институт биологии южных морей им. А. О. Ковалевского РАН, 2022. – 167 с.
Brown C. J., Eaton R. A., Thorp C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation // Marine Pollution Bulletin. – 2001. – 42. – P. 1103–1113.
Colin A., Faure J. Coudret C., Destombe, Valero M. Pollinators of the sea: A discovery of animal-mediated
fertilization in seaweed // Science 28 Jul. – 2022. – Vol 377, iss. 6605. – P. 528–530. DOI: 10.1126/science.abo6661
Grintsov V., Sezgin M. Manual for identification of Amphipoda from the Black Sea. – Sevastopol: Digit Print, 2011. – 151 p.
Milchakova N. A. Marine plants of the Black Sea. An illustrated field Guide. – Sevastopol: Digit Print Press, 2011. – 144 p.
Minicheva G. G., Bolshakov V. N., Kalashnik E. S., Zotov A. B., Marinets A. V. Assessment of the reactions of algal communities to influence of climatic factors in the North-Western Black Sea ecosystem // International Journal on Algae. – 2018. – 20 (2). – P. 121–134. DOI:10.1615/InterJAlgae.v20.i2.20
119
Копий В. Г., Бондаренко Л. В., Тимофеев В. А.,
Подзорова Д. В., Макаров М. В., Ковалёва М. А.
![]()
Kopiy V. G., Bondarenko L. V, Timofeev V. A., Podzorova D. V., Makarov M. V., Kovaleva M. A. Macrozooepiphyton of macrophytes of the shallow waters of the Kerch Strait and the coastal zone of the Taman Peninsula // Ekosistemy. 2022. Iss. 32. P. 106–120.
The research was based on materials collected in the shallow waters of the Kerch Strait and the coastal zone of the Taman Peninsula in September 2019. Phytocenosis was represented by macrophytes of E. crinita, Ulva sp., Zostera sp., Stuckenia sp., Ceramium sp., Ruppia sp., Zannichelia sp., thickets of Ruppia sp. + Zostera sp. and Cystoseira sp. + Cladophora sp. + Polysiphonia sp. Six species of macrophytes were found in the waters of the Kamysh-Burun Bay, two species – near the village of Sennoy, and one species was found in each port: in Port Krym and Port Kavkaz. Fifty six species of macrozooepiphyton were found in the thickets of macrophytes, including Polychaeta (13 species), Crustacea (23), Mollusca (14) and representatives of the taxa Ascidiidae, Chironomidae, Platyhelminthes, Nemertea, and Actiniidae that were not identified to species. The maximum number of macrozoobenthos species was recorded on thickets of E. crinita (39), followed by thickets of Ruppia sp. + Zostera sp. (23), Cystoseira sp. + Cladophora sp. + Polysiphonia sp. (22), Ulva sp. (21), Stuckenia sp. and Zostera sp. (19 each), Zannichelia sp. (17), Ceramium sp. (15), Ruppia sp. (4). A high index of the Czekanowski–Sørensen coefficient was registered for the zooepiphyton found in the thickets of Cystoseira sp. + Cladophora sp. + Polysiphonia sp. – Stuckenia sp. (0.8), Stuckenia sp. – Ruppia sp. + Zostera sp. (0.7) and Ulva sp. – Stuckenia sp. (0.7). Animals were least similar in species composition in the macrophyte communities Ceramium sp. – Ruppia sp. (0.1), Ceramium sp. – Zostera sp. (0.2), Ceramium sp. – Cystoseira sp. + Cladophora sp. + Polysiphonia sp. (0.2). The mean abundance and biomass values of all macrozooepiphyton were 10762±4080 ind./kg and 107.644±61.089 g/kg, respectively. The maximum abundance of hydrobionts was recorded in the macrophytes Cystoseira sp. + Cladophora sp. + Polysiphonia sp. (29978 ind./kg) and the biomass in Ceramium sp. (165.208 g/kg). The macrozooepiphyton of the phytocenoses is represented by phytophages, detritophages, polyphages and carnivores. The largest number of species belongs to phytophages, the smallest group is detritophages.
Key words: macrophytes, macrozooepiphyton, abundance, biomass, Kerch Strait, Black Sea.
Поступила в редакцию 28.10.22
Прията к печати 30.12.22
120

