Экосистемы, 33: 32–37 (2023) https://ekosystems.cfuv.ru
![]()
УДК 577.29:573.6:57.021
Гальчинский Н. В.1, Усеинов Р. Ж.1, Новиков И. А.1, Оберемок В. В.1, 2
- Крымский федеральный университет имени В. И. Вернадского Симферополь, Республика Крым, Россия
pcr.product@gmail.com, useinovrefat@gmail.com, i.nowikow2012@mail.ru
- Ордена Трудового Красного Знамени Никитский ботанический сад – Национальный научный центр РАН Ялта, Республика Крым, Россия
voloberemok@gmail.com
Изменение климата создает благоприятные условия для роста популяций насекомых-вредителей. В настоящее время в мире наблюдается увеличение числа вспышек насекомых-вредителей, связанное с многолетним повышением средней температуры климатических систем. Ущерб, наносимый вредителем цитрусовых австралийским желобчатым червецом Icerya purchasi Maskell, в последние годы тоже увеличивается. Борьба с этим видом крайне затруднена, поскольку не все современные химические инсектициды способны контролировать его численность. Кроме этого, использование химических инсектицидов для борьбы с этим вредителем нежелательно, так как плоды цитрусовых употребляют в пищу, а химические средства кумулятивно накапливаются в организме
- наносят системный вред здоровью человека. Таким образом, изменение климата вызывает потребность как сельского, так лесного хозяйства в безопасных и эффективных инсектицидах с низким углеродным следом и длительным операционным сроком действия, таких как инсектициды на основе олигонуклеотидов (олигонуклеотидных инсектицидов) ДНК-инсектицидов, разработанных на основе дезоксирибонуклеиновой кислоты. В этой статье мы впервые демонстрируем успешное использование короткого одноцепочечного фрагмента гена 28S рибосомальной РНК (рРНК), который мы назвали Авжеч-11, для борьбы с австралийским желобчатым червецом и предлагаем использование олигонуклеотидных инсектицидов с нулевым углеродным следом для крупномасштабного внедрения в сельском и лесном хозяйстве.
Ключевые слова: Icerya purchasi, австралийский желобчатый червец, олигонуклеотидные инсектициды, ДНК-инсектициды, олинциды, изменение климата, углеродный след, защита растений.
ВВЕДЕНИЕ
Повышение околоземной температуры связано с глобальным изменением климата. Это влечет за собой изменение структуры природных сообществ, в том числе численности популяций насекомых-вредителей сельскохозяйственных культур за счет увеличения количества генераций, а также увеличивает риск миграции инвазивных вредителей (Biber-Freudenberger et al., 2016; Shabani et al., 2016; Pareek et al., 2017). В последние годы именно значительное повышение температуры (Wells, Tonkyn, 2018) оказало влиние на состояние экосистем, так как насекомые являются пойкилотермными организмами, температура тела которых зависит от температуры окружающей среды. Таким образом, температура, вероятно, является наиболее важным фактором окружающей среды, влияющим на поведение, распространение, развитие и размножение насекомых (Kocmánková et al., 2010). Следовательно, основные факторы изменения климата (повышение содержания CO2 в атмосфере, повышение температуры и снижение влажности почвы) могут существенно повлиять на динамику популяций насекомых-вредителей и на урожай (Fand et al., 2012). Вышеописанные изменения способствуют распространению многих видов насекомых-вредителей в новые географические регионы, а также облегчают их перемещение из одного региона в другой.
Выбросы парниковых газов, связанные с применением инсектицидов против инвазивных видов насекомых-вредителей, представляют собой ущерб для окружающей среды, который
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Контроль австралийского желобчатого червеца (Icerya purchasi Maskell) при помощи инновационного олигонуклеотидного инсектицида Авжеч-11
![]()
практически не учитывается (Heimpel et al., 2013). Однако недавние исследования показывают, что деятельность человека, такая как производство и использование инсектицидов, в значительной степени способствовала повышению околоземной температуры за счет выбросов парниковых газов: диоксида углерода (CO2), метана (CH4) и закиси азота (N2O) (Heimpel et al., 2013; Kaliappan et al., 2019; Yoro, Daramola, 2020).
-
- качестве решения мы предлагаем использование олигонуклеотидных инсектицидов (Oberemok et al., 2018) с нулевым углеродным следом для борьбы с насекомыми-вредителями. Современный твердофазный синтез олигонуклеотидных инсектицидов (олинцидов) на ДНК-синтезаторах с использованием фосфорамидитов не приводит к накоплению парниковых газов, таких как оксид азота, озон, метан или углекислый газ. Синтез ДНК происходит в безвоздушной среде в растворе ацетонитрила с использованием катализаторов. Основными веществами, используемыми для синтеза олигонуклеотидов, являются амидиты, тетразол, 1-метилимидазол, триэтиламин, уксусно-пропионовый ангидрид, пиридин, йод, уксусная и трихлоруксусная кислоты, дихлорметан, ацетонитрил. По сравнению с химическими инсектицидами, наиболее часто используемыми для борьбы с австралийским желобчатым червецом Icerya purchasi Maskell (Hemiptera: Monophlebidae), ДНК-инсектициды не оставляют углеродного следа.
- этом исследовании мы впервые применили олигонуклеотидный инсектицид Авжеч-11
- нулевым углеродным следом для борьбы с серьезным вредителем цитрусовых I. purchasi в качестве альтернативы неоникотиноидам (например, тиаметоксаму), производство которых сопровождается значительным выбросом углекислого газа в атмосферу (Cech et al., 2022).
Цель наших исследований – оценить инсектицидный потенциал олигонуклеотидного инсектицида с нулевым углеродным следом Авжеч-11 в регуляции численности австралийского желобчатого червеца.
МАТЕРИАЛ И МЕТОДЫ
Эксперимент по выявлению эффективности ДНК-инсектицида Авжеч-11 в отношении австралийского желобчатого червеца I. purchasi, поражающего австралийский лавр (чубушник) Pittosporum tobira Thunb. (Apiales: Pittosporaceae) был проведен в периоды с октября по февраль в 2020 и в 2021 годах. Эксперимент был проведен в трех повторностях. Эксперимент проводился на территории Никитского ботанического сада (Ялта, Крым).
Для выбора последовательности Авжеч-11 (5′ ACA CCG ACG AC 3′) был использован алгоритм веб-приложения BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi). Последовательность была синтезирована на ДНК-синтезаторе АSМ-800Е (БИОССЕТ, Россия). Затем её использовали в качестве контактного олинцида, растворенного в деионизованной воде в концентрации 100 нг/мкл, который наносили с помощью ручного распылителя на листья P. tobira (1 мг ДНК-инсектицида на 1 м2 листьев). В качестве контроля использовалась группа, обработанная деионизированной водой. В ходе трех повторных экспериментов было обработано 3111 насекомых, которые были включены в статистическую выборку для определения смертности. Было проведено три эксперимента по исследованию экспрессии гена 28S рРНК у насекомых из разных групп в трехкратной повторности (Ребриков и др., 2009).
Для сравнения эффективности олигонуклеотидного инсектицида Авжеч-11 в отношении I. purchasi с коммерчески доступным химическим инсектицидом в качестве стандарта использовали неоникотиноидный инсектицид Актара® (тиаметоксам, 1 г/л). Авжеч-11 применяли к целевому растению P. tobira.
Суммарную РНК выделяли из личинок I. purchasi с помощью реагента ExtractRNA (Евроген, Россия) согласно инструкции производителя. Для получения повторностей для каждой обработки проводили три независимых экстракции. Качество и концентрацию выделенной тотальной РНК оценивали с помощью спектрофотометра NanoDrop Lite (Thermo Fisher Scientific, США). Качество выделенной тотальной РНК оценивали, загружая 5 мкл элюированного объема в гель с содержанием агарозы 1,8 %, и проводили электрофорез в трис-
33
Гальчинский Н. В., Усеинов Р. Ж., Новиков И. А., Оберемок В. В.
![]()
боратном буфере (ТВЕ) с напряжением 10 В/см в течение 40 минут. Выделение РНК проводили с использование 25 мг личинок для каждой группы эксперимента. Количество, интенсивность и характер полос РНК были одинаковыми во всех экспериментальных группах, что подтверждает качество и воспроизводимость выделения РНК из материала насекомых.
Для обратной транскрипции использовали 0,1 мкг тотальной РНК I. purchasi с обратным праймером Авжеч-R (5′ GCA AGT GCA CAA CTT GAA CG 3′) и набор MMLV Reverse Transcriptase (Евроген, Россия), осуществляя реакцию по методике производителя. Далее для оценки уровня представленности транскриптов 28S рРНК (Paule, White, 2000) в исследуемых образцах проводили ПЦР в реальном времени на амплификаторе LightCycler® (Roche, Швейцария) с геноспецифичными праймерами Авжеч-F 5′ AGG ATT CAC ACG GTG GAG TC 3′ и Авжеч-R 5′ GCA AGT GCA CAA CTT GAA CG 3′ с использованием набора FastStart SYBR Green Master Mix (Roche, Швейцария) в соответствии с инструкциями производителя.
Для статистического анализа стандартную ошибку среднего определяли и оценивали с помощью t-критерия Стьюдента; p<0,05 и p<0,01 считались значимыми. Для оценки достоверности различий между средними показателями групп использовали непараметрический критерий хи-квадрат Пирсона (χ2) с поправкой Йейтса (GraphPad Software, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
- результате проделанного эксперимента была обнаружена смертность личинок в группах Контроль, Актара® и Авжеч-11, соответственно, на третьи, седьмые и десятые сутки после обработки. Авжеч-11 по сравнению с контролем показал достоверный инсектицидный эффект на третьи (χ2=53,6, p<0,01, N=724, df=1), седьмые (χ2=42,3, p<0,01, N=642, df=1) и
десятые (χ2=96,5, p<0,01, N=545, df=1) сутки. В то же самое время, Актара® по сравнению с контролем показал более умеренный инсектицидный эффект на третьи (χ2=19,8, p<0,01, N=631, df=1), 7-е (χ2=12,7, p<0,01, N=649, df=1) и десятые (χ2=3,2, p<0,01, N=634, df=1) сутки (табл. 1).
Таблица 1
Эффективность применения ДНК-инсектицидов в отношении личинок Icerya purchasi
| Сутки | Смертность, % | |||
| Контроль (вода) | Актара® (тиаметоксам) | Авжеч-11 | ||
| Третьи | 14±2,8 | 28,7±3,5** | 42,3±2,2** | |
| Седьмые | 20,1±6,3 | 33,7±2,5* | 45±4,7** | |
| Десятые | 23,7±9 | 35,3±2,1 | 70,5±0,8** |
Примечание к таблице. * – достоверное различие (p<0,05) по сравнению с контрольной группой; ** – достоверное различие (p<0,01) по сравнению с контрольной группой.
Мы оценили специфичность действия ДНК-инсектицида Авжеч-11 на экспрессию 28S рРНК вредителя. Снижение экспрессии гена-мишени является золотым стандартом для доказательства специфичности действия антисмысловых олигонуклеотидов (Dias, Stein, 2002). Концентрация 28S рРНК у насекомых, обработанных Авжеч-11, была ниже в 1,4 раза по сравнению с контрольной группой на третьи сутки и значительно ниже – в 6,4 раза по сравнению с контрольной группой на седьмые сутки (рисунок 1). Это свидетельствует о том, что целевая 28S рРНК разрушается и фрагмент Авжеч-11 снижает её концентрацию по механизму действия РНКаза H зависимых антисмысловых олигонуклеотидов (Dias, Stein, 2002; Oberemok et al., 2018).
34
Контроль австралийского желобчатого червеца (Icerya purchasi Maskell) при помощи инновационного олигонуклеотидного инсектицида Авжеч-11
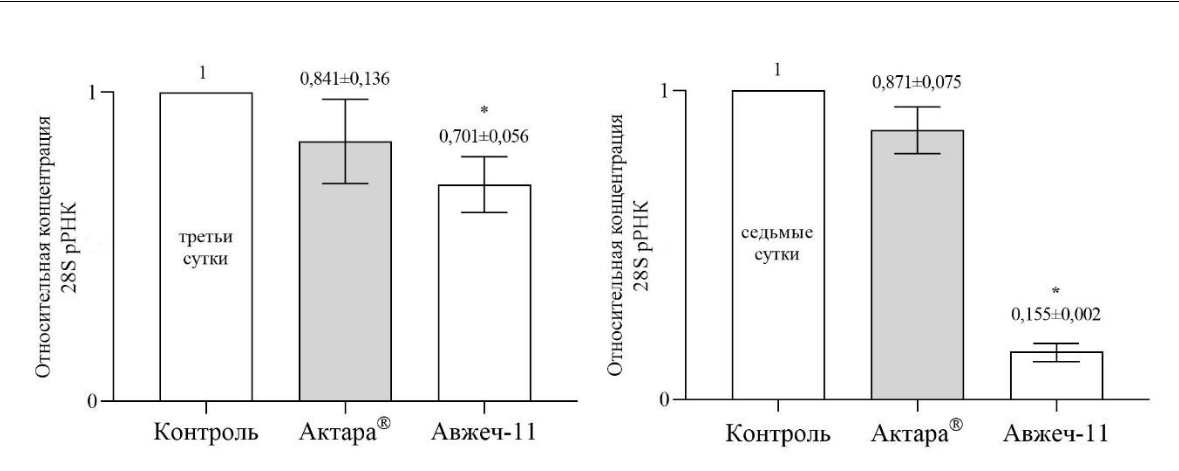
Рис. 1. Относительная концентрация 28S рРНК в Icerya purchasi на третьи и седьмые сутки после обработки Актарой® и Авжеч-11
Данные представляют собой средние значения и стандартные ошибки концентраций рибосомальной РНК для 3 повторов относительно контрольной (обработанной водой) группы. Значения для контроля равны 1 (100 %); * – достоверное различие по сравнению с контрольной группой (p<0,01).
Более высокие температуры создают дисбаланс в природных системах, вызывая новые вспышки насекомых-вредителей. В свою очередь, это приводит к увеличению частоты использования инсектицидов и увеличению норм их применения, поскольку необходимо контролировать большее количество вредителей (Matzrafi, 2019). Еще одним негативным последствием, которое может возникнуть в результате повышения температуры, является снижение эффективности биологической борьбы на основе безвредных естественных врагов насекомых-вредителей, что может стать серьезной проблемой для будущих программ по защите растений (Skendžić et al., 2021). Современные инсектициды влияют на изменение климата в основном во время их производства, сопровождающегося выделением парниковых газов. Высокий уровень парниковых газов в атмосфере привел к глобальному потеплению, таянию ледниковых щитов, повышению уровня моря, возникновению экстремальных погодных явлений, изменению характера осадков и так далее (Kumar, 2012). Однако, несмотря на доступность инсектицидов с пониженным риском и более низким уровнем выбросов парниковых газов, многие специалисты по борьбе с вредителями продолжают полагаться на пиретроиды, органофосфаты и неоникотиноиды из-за их широкого спектра действия и более низкой стоимости.
Многие тактики борьбы с вредителями, снижающие потребность в применении химических инсектицидов, также могут способствовать дальнейшему сокращению выбросов парниковых газов (Heimpel et al., 2013). По нашему мнению, одним из решений сокращения выбросов парниковых газов в современных усилиях по борьбе с насекомыми-вредителями является использование разработанных нами олинцидов, которые имеют нулевой углеродный след.
Использование олигонуклеотидных инсектицидов (ДНК-инсектицидов) также могло бы решить проблему возникновения устойчивости насекомых к инсектицидам. Применение
коротких одноцепочечных фрагментов высококонсервативных участков последовательностей генов насекомых-вредителей должно замедлить развитие устойчивости
- олинцидам, поскольку исследования показали, что потенциальные мутации, ответственные за изменения в генах-мишенях, происходят с очень низкой скоростью в консервативных частях генов (Жимулёв, 2007). Таким образом, даже если мы не сможем остановить генетические процессы, ведущие к устойчивости к инсектицидам, мы можем замедлить ее появление, используя ДНК-инсектициды, основанные на очень консервативных областях функционально важных генов, таких как 5,8S, 18S и 28S рРНК гены (Oberemok et al., 2019;
Gal’chinsky et al., 2020, Useinov et al., 2020).
35
Гальчинский Н. В., Усеинов Р. Ж., Новиков И. А., Оберемок В. В.
![]()
ЗАКЛЮЧЕНИЕ
Олигонуклеотидный инсектицид Авжеч-11 проявил более высокий инсектицидный эффект против I. purchasi по сравнению с классическим инсектицидом Актара®. Таким образом, высокая эффективность олигонуклеотидных инсектицидов, а также их нулевой углеродный след во время производства делают их перспективными кандидатами для крупномасштабного использования для борьбы с насекомыми-вредителями в эпоху глобального потепления.
Исследование выполнено в рамках государственного задания «Разработка олигонуклеотидных конструкций для получения избирательных и высокоэффективных препаратов для медицины и сельского хозяйства» (регистрационный номер FZEG-2021-0009).
Список литературы
Жимулёв И. Ф. Общая и молекулярная генетика / [Ред. Е. С. Беляева, А. П. Акифьева]. Новосибирск:
Сиб. унив. изд-во, 2007. – 479 с.
ПЦР «в реальном времени» / [Ред. Д. В. Ребриков]. – М.: БИНОМ. Лаборатория знаний, 2009. – 223 с. Biber-Freudenberger L., Ziemacki J., Tonnang H. E., Borgemeister C. Future Risks of Pest Species under Changing
Climatic Conditions // PLOS ONE. – 2016. – Vol. 11, N 4. – P. e0153237.
Cech R., Leisch F., Zaller J. G. Pesticide Use and Associated Greenhouse Gas Emissions in Sugar Beet, Apples, and Viticulture in Austria from 2000 to 2019 // Agriculture. – 2022. – Vol. 12, N 6. – P. 879.
Dias N., Stein C. A. Antisense oligonucleotides: Basic concepts and mechanisms // Molecular Cancer Therapeutics. – 2002. – Vol. 1, N 5. – P. 347–355.
Fand B. B., Kamble A. L., Kumar M. Will climate change pose serious threat to crop pest management: A critical review? // International Journal of Scientific and Research Publications. – 2012. – Vol. 2, N 11. – P. 1–14.
Gal’chinsky N., Useinov R., Yatskova E., Laikova K., Novikov I., Gorlov M., Trikoz N., Sharmagiy A., Plugatar, Y., Oberemok V. A breakthrough in the efficiency of contact DNA insecticides: rapid high mortality rates in the sap-sucking insects Dynaspidiotus britannicus Comstock and Unaspis euonymi Newstead // Journal of Plant Protection Research. – 2020. – Vol. 60, N 2. – P. 220 223.
Heimpel G. E., Yang Y., Hill J. D., Ragsdale D. W. Environmental consequences of invasive species: greenhouse gas emissions of insecticide use and the role of biological control in reducing emissions // PLOS ONE. – 2013. – Vol. 8, N 8. – P. e72293.
Kaliappan S. B., Gunasekaran Y., Smyrna R., Meena R. S. Soil and Environmental Management. In: Meena R., Kumar S., Bohra J. and Jat M. (Ed.), Sustainable management of soil and environment. Singapore: Springer. 2019. P. 1– 28.
Kocmánková E., Trnka M., Juroch J., Dubrovský M., Semerádová D., Mozny M., Žalud Z. A. Impact of climate change on the occurrence and activity of harmful organisms // Plant protection science. – 2010. – Vol. 45. – P. 48–52.
Kumar S. V. Climate change and its impact on agriculture: a review // International Journal of Agriculture Environment and Biotechnology. – 2012. – Vol. 4, N 2. – P. 297–302.
Matzrafi M. Climate change exacerbates pest damage through reduced pesticide efficacy // Pest Management Science. – 2019. – Vol. 75, N 1. – P. 9 13.
Oberemok V. V., Laikova K. V., Repetskaya A. I., Kenyo I. M., Gorlov M. V., Kasich I. N., Krasnodubets A. M., Gal’chinsky N. V., Fomochkina I., Zaitsev A. S., Bekirova V. V., Seidosmanova E., Dydik K. I., Meshcheryakova A. O., Nazarov S., Smagliy N. N., Chelengerova E. L., Kulanova A. A., Deri K., Subbotkin M. V., Useinov R. Z., Shumskykh M. N., Kubyshkin A. A Half-Century History of Applications of Antisense Oligonucleotides in Medicine, Agriculture and Forestry: We Should Continue the Journey // Molecules. – 2018. – Vol. 23, N 6. – P. 1302.
Oberemok V. V., Laikova K. V., Gal’chinsky N. V., Useinov R. Z., Novikov I. A., Temirova Z. Z., Shumskykh M. N., Krasnodubets A. M., Repetskaya A. I., Dyadichev V., Fomochkina I. I., Bessalova E. Y., Makalish T. P., Gninenko Y., Kubyshkin A. V. DNA insecticide developed from the Lymantria dispar 5.8S ribosomal RNA gene provides a novel biotechnology for plant protection // Scientific Reports. – 2019. – Vol. – 9, N 1. – P. 6197.
Pareek A., Meena B. M., Sharma S., Teterwal M. L., Kalyan R. K., Meena B. L. Impact of climate change on insect pests and their management strategies. In: Kumar P.S., Kanwat M., Meena P.D., Kumar V., Alone R.A. (Ed.), Climate change and sustain-able agriculture, New India Publishing Agency. 2017. P. 253–286.
Paule M. R., White R. J. Transcription by RNA polymerases I and III // Nucleic Acids Research. – 2000. – Vol. 28, N 6. – P. 1283–1298.
Shabani F., Kumar L., Ahmadi M. A comparison of absolute performance of different correlative and mechanistic species distribution models in an independent area // Ecology and Evolution. – 2016. – Vol. 6, N 16. – P. 5973-5986.
Skendžić S., Zovko M., Živković I. P., Lešić V., Lemić D. The Impact of Climate Change on Agricultural Insect Pests // Insects. – 2021. – Vol. 12, N 5. – P. 440.
36
Контроль австралийского желобчатого червеца (Icerya purchasi Maskell) при помощи инновационного олигонуклеотидного инсектицида Авжеч-11
![]()
Useinov R., Gal’chinsky N., Yatskova E., Novikov I., Puzanova Y., Trikoz N., Sharmagiy A., Plugatar Y., Laikova K., Oberemok V. To bee or not to bee: creating DNA insecticides to replace non-selective organophosphate insecticides for use against the soft scale insect Ceroplastes japonicus Green // Journal of Plant Protection Research. – 2020. – Vol. 60, N 4. – P. 406–409.
Wells C. N., Tonkyn D. Changes in the Geographic Distribution of the Diana Fritillary (Speyeria diana:
Nymphalidae) under Forecasted Predictions of Climate Change // Insects. – 2018. – Vol. 9, N 3. – P. 94.
Yoro K. O., Daramola M. O. CO2 emission sources, greenhouse gases, and the global warming effect / In: Rahimpour M. R, Farsi M., Makarem M. A. (Ed.), Advances in Carbon Capture. Elsevier. – 2020. – P. 3–28.
Gal‘chinsky N. V., Useinov R. Z., Novikov I. A., Oberemok V. V. Control of the cottony cushion scale (Icerya purchasi Maskell) using the innovative oligonucleotide insecticide Avzhech-11 // Ekosistemy. 2023. Iss. 33. P. 32–37.
Climate change creates favourable conditions for growth of pest populations. Currently, there is an increase in the number of outbreaks of insect pests in the world associated with a long-term increase in the average temperature. The damage caused by the citrus pest Icerya purchasi Maskell has also increased in recent years. It is extremely difficult to control this pest species as not all modern chemical insecticides are able to combat it. Moreover, the use of chemical insecticides is undesirable, as chemical agents cumulatively accumulate in the body and cause systemic harm to human health. Thus, climate change causes the demand of both agriculture and forestry for safe and effective insecticides with a low carbon footprint and a long operational life, such as oligonucleotide insecticides (DNA insecticides). The authors first demonstrate the successful application of a short antisense single-stranded fragment of the 28S ribosomal RNA (rRNA) gene, which they called Avzhech-11, to combat Icerya purchasi Maskell. The use of zero-carbon oligonucleotide insecticides is offered for large-scale implementation in agriculture and forestry.
Key words: Icerya purchasi, cottony cushion scale, oligonucleotides insecticides, DNA insecticides, climate change, carbon footprint, antisense technologies, plant protection.
Поступила в редакцию 07.11.22
Принята к печати 01.12.22
37

