TAXOCENE MALACOSTRACA OF LASPI BAY WATER AREA (BLACK SEA)
JOURNAL: «EKOSISTEMY», Issue 25, 2021
Publication text (PDF): Download
UDK: 595.36(262.5):574.36
AUTHOR AND PUBLICATION INFORMATION
AUTHORS: Bondarenko L. V., Timofeev V. A. O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-25-41-48
PAGES: from 41 to 48
STATUS: Published
LANGUAGE: Russian
KEYWORDS: Malacostraca, taxonomic composition, abundance, biomass, Laspi Bay, Black Sea.
ABSTRACT (ENGLISH):
The water area of Laspi Bay is located between the Cape Aya Nature Reserve and the coastal-acval complex near Cape Sarich. The benthic samples were collected during the summer period 2016–2019. The taxonomic diversity and current condition of the higher crustaceans, which live on the loose littoral and sublittoral bottoms of the bay, was assessed. 41 species of Malacostraca have been identified. They belong to 6 groups. In bay other Arthropoda representatives were found: Amphibalanus improvisus (Darwin, 1854) and Harpacticoida. The average biomass of higher crustaceans was 0.454±0.228 g/m2. The main role in its formation is played by Decapoda and is dominated by Diogenes pugilator. The average number of Malacostraca was 280±158 ind./m2. The highest percentage of occurrence and high density of settlement were recorded for Amphipoda. The ranked series by density index was headed by D. pugilator, Echinogammarus foxi, Centraloecetes dellavallei and Echinogammarus karadagiensis. The highest numbers were recorded at stations in the flood zone (0–0.5 m). High abundance and biomass concentrations of Malacostraca were recorded at the stations with sand and pebbles.
ВВЕДЕНИЕ
Бухта Ласпи, протяжённость береговой линии которой составляет 12 км, расположена в юго-западной части Крымского полуострова. Значительная часть подводного берегового склона глубокая, выражена глыбово-валунным бенчем. Наиболее обширная центральная часть бухты занята наклонной равниной, сложенной песчаными и алевритовыми отложениями. Бухта относится к открытому типу. Гидродинамический режим её акватории обусловлен влиянием циркуляционных систем антициклонического типа, поступлением глубинных вод в поверхностные слои в результате сгонно-нагонных явлений и водообменом с открытым морем, что способствует динамической активности и аэрации вод (Панкеева, Миронова, 2019).
На побережье бухты расположено большое количество пансионатов и детских оздоровительных лагерей, что является определённой антропогенной нагрузкой на природный комплекс акватории. Известно, что за период с 1989 по 1998 год в районе от бухты Ласпи до мыса Сарыч исчезли 14 видов-индикаторов чистых биотопов, а общее число видов гидробионтов сократилось от 78 до 69. Также изменилось соотношение видов с разной устойчивостью к загрязнению (Петров, 2002). Кроме этого в сентябре 1999 года здесь потерпел аварию сухогруз «Кристина», что в определённой степени могло отразиться на структуре бентосного сообщества бухты (Нестерова, 2000).
Бухта находится между государственным природным заказником регионального значения «Мыс Айя» и гидрологическим памятником природы регионального значения «Прибрежный аквальный комплекс у мыса Сарыч». На протяжении длительного времени береговая зона бухты является объектом, представляющим интерес для развития рекреационной деятельности, которая, в той или иной степени, может оказывать влияние на экосистемы охраняемых акваторий. В связи с выше изложенным, в исследуемой акватории необходим постоянный мониторинг состояния структуры как макрозообентоса в целом, так и Malacostraca в частности.
Целью работы является оценка таксономического разнообразия и современного состояния высших ракообразных, обитающих на рыхлых грунтах литорали и сублиторали бухты Ласпи.
МАТЕРИАЛ И МЕТОДЫ
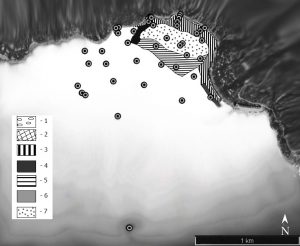
В основу работы легли результаты бентосных съёмок рыхлых грунтов акватории бухты Ласпи, выполненных в летние периоды 2016–2019 годов, включая прибрежные сборы и материал, собранный в 96 и 108 рейсах НИС «Профессор Водяницкий». Пробы отбирали на 46 станциях в диапазоне глубин от 0 до 60 м (рис. 1).
Рис. 1. Карта станций района исследований (характеристика распределения донных осадков по Т. В. Панкеевой и Н. В. Мироновой (2019) 1 – Глыбово-валунный бенч; 2 – Валунно-глыбовый бенч; 3 – Подводный береговой абразионный склон, сложенный псефитовыми отложениями; 4 – Подводный береговой абразионный склон, сложенный псефитовыми отложениями и алеврито-псаммитовым субстратом; 5 – Слабонаклонная аккумулятивная равнина, сложенная алеврито-псаммитовыми отложениями; 6 – Подводный береговой абразионный склон, сложенный псефитовыми отложениями с чередованием галечно-гравийных с битой ракушей; 7 – Слабонаклонная аккумулятивная равнина, сложенная псаммитовыми отложениями с выраженными крупными знаками ряби (рифели).
Сбор материала проводился водолазным методом с помощью ручного дночерпателя (S=0,04 м2) и дночерпателем «Океан 50» (S=0,25 м2) с НИС «Профессор Водяницкий» в 1–3 повторностях. При промывке проб использована система сит с минимальным диаметром ячеи фильтрации 0,5 мм.
Так как большинство видов десятиногих раков являются относительно крупными и подвижными, плохо поддающимися учёту при дночерпательных сборах, то основным методом их учёта было визуальное наблюдение с берега и под водой в диапазоне глубин от уреза воды до 26 м. Отлов фактического материала осуществлялся с помощью стандартных ручных орудий лова (сачки, краболовки, специализированный насос и др.). В исследованиях был применён метод трансект (Блинова и др., 2005). После соответствующих измерений живые особи Decapoda без повреждений возвращались в естественную среду обитания.
При описании количественного развития фауны высших ракообразных использованы показатели их развития по численности (N, экз./м2), биомассе (В, г/м2) и индексу функционального обилия (ИФО) в выражении:
ИФО = N0,25xB0,75, где N – численность вида, экз./м2, B – биомасса вида, г/м2.
Ранжированная кривая доминирования-разнообразия видов строилась по значениям индексов плотности (ИП) видов:
ИП = ИФО х Р, где Р – встречаемость вида (0–1).
Коэффициент общности Жаккара определяли по формуле:
Ko = c*100/(a+b+c), где a – число видов, обнаруженных в бентосных пробах в 1996 году, b – число видов, найденных в 2016–2019 годах, c – число видов в выше названные периоды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате анализа полученного материала в акватории б. Ласпи идентифицирован 41 вид Malacostraca, относящихся к 6 отрядам, включая десятиногих раков, не поддающихся учёту при дночерпательных сборах. Определение до вида представителей Mysida было затруднено вследствие отсутствия особей, пригодных для идентификации. Кроме высших ракообразных в акватории бухты обнаружены другие представители Arthropoda: Amphibalanus improvisus (Darwin, 1854) и Harpacticoida.
Высокий процент встречаемости отмечен для Amphipoda (45 %), далее cледуют Decapoda (32 %), Cumacea (9 %), Isopoda (7 %), Tanaidacea (5 %), Mysida (2 %). Преобладание числа видов амфипод над другими отрядами Malacostraca характерно как для побережья Крыма, так и для Чёрного моря в целом (табл. 1).
Таблица 1
Количество видов Malacostraca, обитающих в Чёрном море и у Крымского побережья
| Отряд | Чёрное море (Ревков, 2003; Аносов, 2016) | Побережье Крыма
(Ревков, 2003;Тимофеев и др., 2018; Статкевич, 2019) |
Бухта Ласпи
(собственные данные; Ревков, Николаенко, 2002) |
| Amphipoda | 111 | 59 | 20 |
| Tanaidacea | 6 | 4 | 1 |
| Isopoda | 29 | 20 | 4 |
| Cumacea | 23 | 15 | 9 |
| Decapoda | 41 | 35 | 16 |
| Mysida | 19 | 7 | 1 |
| Всего | 225 | 138 | 51 |
Количество видов, обнаруженных на станциях, колеблется от 1 до 7. Наибольшая их часть отмечена в биотопах, представленных песком (мелкий, крупный, заиленный) и галькой. Доминирующим по встречаемости видом оказался Diogenes pugilator (48 %) (табл. 2). Как было показано ранее (Ревков, Николаенко, 2002) этот рак-отшельник был отнесён к видам-субдоминантам в акватории бухты в результате анализа данных по макрозообентосу, собранному в 1996 году. К относительно редким, обнаруженным только на одной станции, относятся 10 видов, которые предпочитают илистый грунт или являются типичными зарослевыми формами. Диапазон глубин (h, м), на которых были обнаружены ракообразные, составил от 0 до 45 м.
Средний показатель биомассы ракообразных по всему полигону составил 0,454±0,228 г/м2 (среднее ± доверительный интервал). Основную роль в его формирование
Таблица 2
Видовой состав и количественные показатели Malacostraca в акватории бухты Ласпи
| Таксон | экз./м2 | г/м2 | Р, % | h, м |
| Amphipoda | ||||
| Ampelisca diadema (Costa, 1853) | 5 | 0,0061 | 22 | 8–45 |
| Ampelisca sevastopoliensis (Grintsov, 2010) | 1 | 0,0006 | 4 | 10–22 |
| Ampithoe ramondi Audouin, 1826 | 3 | 0,0004 | 7 | 0,5–15 |
| Apherusa bispinosa (Spence Bate, 1857) | 1 | 0,0003 | 2 | 1 |
| Bathyporeia guilliamsoniana (Spence Bate, 1857) | 5 | 0,0047 | 17 | 4–18 |
| Caprella acanthifera Leach, 1814 | 1 | 0,0001 | 4 | 0–40 |
| Centraloecetes dellavallei (Stebbing, 1899) | 24 | 0,0061 | 28 | 0–21 |
| Dexamine spinosa (Montagu, 1813) | 1 | 0,0001 | 4 | 1,5–11 |
| Echinogammarus foxi (Schellenberg, 1928) | 68 | 0,0328 | 11 | 0–13 |
| Echinogammarus karadagiensis (Grintsov, 2009) | 87 | 0,0468 | 4 | 0 |
| Echinogammarus sp. | 1 | 0,0001 | 2 | 1,5 |
| Megaluropus agilis Hoek, 1889 | 1 | 0,0003 | 7 | 5–9 |
| Melita palmata (Montagu, 1804) | 2 | 0,0002 | 2 | 0 |
| Microdeutopus sp. | 2 | 0,0006 | 11 | 1,5–14 |
| Microdeutopus versiculatus (Spence Bate, 1857) | 1 | 0,0007 | 2 | 17 |
| Nototropis guttatus Costa, 1853 | 10 | 0,0037 | 28 | 1–17 |
| Perioculodes longimanus (Spence Bate & Westwood, 1868) | 1 | 0,0001 | 4 | 9 |
| Decapoda | ||||
| Athanas nitescens (Leach, 1813 [in Leach, 1813-1814]) | 2 | 0,0057 | 2 | 13 |
| Decapoda juv. | 1 | 0,0002 | 2 | 1 |
| Diogenes pugilator (Roux, 1829) | 46 | 0,2359 | 48 | 1–45 |
| Pisidia longimana (Risso, 1816) | 0,3 | 0,0003 | 2 | 1,5 |
| Liocarcinus navigator (Herbst, 1794) | 1 | 0,0106 | 11 | 3–45 |
| Xantho poressa (Olivi, 1792) | 1 | 0,0933 | 4 | 13–45 |
| Cumacea | ||||
| Bodotria arenosa Goodsir, 1843 | 1 | 0,0001 | 4 | 1,5–11 |
| Cumella (Cumella) limicola Sars, 1879 | 5 | 0,0003 | 22 | 3–28 |
| Iphinoe elisae Băcescu, 1950 | 1 | 0,0001 | 7 | 9 |
| Isopoda | ||||
| Eurydice dollfusi Monod, 1930 | 1 | 0,0017 | 2 | 13 |
| Idotea balthica (Pallas, 1772) | 1 | 0,0001 | 2 | 0 |
| Stenosoma capito (Rathke, 1837) | 1 | 0,0002 | 4 | 3–17 |
| Tanaidacea | ||||
| Chondrochelia savignyi (Kroyer, 1842) | 3 | 0,0003 | 7 | 0–45 |
| Mysida | ||||
| Mysida sp. | 2 | 0,0016 | 7 | 3–10 |
Примечание к таблице. Виды Decapoda, не встреченные в дночерпательных пробах: Hippolyte leptocerus (Heller, 1863), Palaemon elegans Rathke, 1837, Upogebia pusilla (Petagna, 1792), Clibanarius erythropus Latreillе, 1818, Eriphia verrucosa Fоrskаl, 1775, Pachygrapsus marmoratus (Fabriсius, 1793), Pilumnus aestuarii Nardo, 1869 (Pilumnus hirtellus (Linnaeus, 1761)), Liocarcinus vernalis (Risso, 1816), Carcinus aestuarii Nardo, 1847. h – диапазон глубин, где данный вид обнаружен.
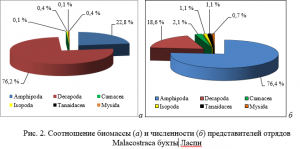
вносят десятиногие раки (76 % общей биомассы), среди которых доминирует D. pugilator. Далее следуют бокоплавы (21 % общей биомассы) (рис. 2а).
Средняя численность Malacostraca составила 280±158экз./м2. Наибольшая плотность поселения отмечена у амфипод (76 % общей численности) (рис. 2б), сформирована она представителями рода Echinogammarus (73 % общей численности амфипод). Средний показатель численности десятиногих раков, доминирующих по биомассе, в 4 раза ниже, чем у амфипод.
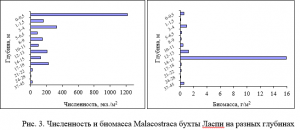
Следует отметить неравномерное распределение ракообразных в акватории бухты. Наибольшие показатели численности отмечены на станциях, приуроченных к зоне заплеска. На данном участке как численность, так и биомассу формируют бокоплавы рода Echinogammarus (рис. 3).
Основной вклад в формирование биомассы вносят относительно крупные представители отряда Decapoda, такие как D. pugilator, L. navigator и X. poressa. Причём D. pugilator присутствует в акватории бухты во все периоды исследования, начиная с 1983 года (Петухов и др., 1991; Ревков, Николаенко, 2002).
Зоны концентрации численности и биомассы высших ракообразных в акватории бухты приурочены к станциям, грунт которых представлен песком и галькой. Пик численности наблюдаем на глубине 0–0,5 м, где доминирует E. foxi, предпочитающий крупный песок и гальку. Пик биомассы отмечен на глубине 14–15 м, где грунт представлен мелким, крупным
песком и галькой. Сформирована биомасса на данной глубине десятиногими ракообразными D. pugilator и X. poressa.
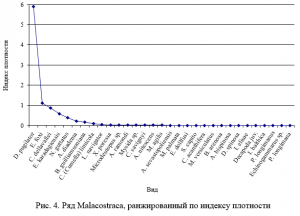
Ранжированный ряд по индексу плотности возглавляют D. pugilator, E. foxi, C. dellavallei и E. karadagiensis (рис. 4).
Поскольку грунт акватории бухты Ласпи представлен песком, галькой и битой ракушей, то и доминируют виды, предпочитающие этот биотоп. D. pugilator обычен в прибрежной зоне Чёрного моря до 40–42 м, предпочитает песчаный грунт с ракушей (Кобякова, Долгопольская, 1969). C. dellavallei, по данным И. И. Грезе (Грезе, 1985), в Чёрном море встречается редко, обитает на глубинах от 5 до 50 м среди зарослей макрофитов и на песчано-илисто-ракушечных грунтах. В наших пробах вид обнаружен на глубинах от 0 до 18 м, где грунт представлен песком. Численность и биомасса C. dellavallei варьирует в пределах от 13 до 313 экз./м2 и от 0,002 до 0,079 г/м2. Ранее этот вид нами обнаружен также в значительных количествах в акватории бухты Круглой на глубинах от 2 до 16 м на песчаном грунте. Показатель встречаемости вида в данной акватории, по материалам бентосных съёмок 2004–2013 годов, составил более 50 %, а численность и биомасса варьировали от 10 до 1025 экз./м2 и от 0,002 до 0,36 г/м2 соответственно. E. foxi и E. karadagiensis предпочитают галечно-песчаный грунт, в котором отсутствует фракция меньше 0,1 см, хотя особи E. foxi обитают и под камнями (Гринцов, 2016). В Средиземном море виды этого рода зарегистрированы также под камнями (Karaman, 1982) от супралиторали до инфралиторали (0–1 м) (Bellan-Santini,1998).
Сравнительный анализ видового состава таксоцена Malacostraca по данным бентосной съёмки 1996 года (Ревков, Николаенко, 2002) и 2016–2019 годов указывает на увеличение количества видов высших ракообразных в современный период. Если в пробах 20-летней давности было выявлено 29 видов высших ракообразных, то в настоящее время – 41. Интересно отметить, что в результате исследований, проведённых в бухте Ласпи в 1983 году, в макрозообентосе данной акватории зарегистрировано 49 видов донных животных, из них лишь 4 вида представлены высшими ракообразными: десятиногие раки D. pugilator, L. navigator (Macropipus arcuatus), Isopoda S. capito и Amphipoda G. carinatus (Петухов и др., 1991). Суммарный анализ литературных (Ревков, Николаенко, 2002) и собственных данных
указывает на относительное богатство фауны высших ракообразных бухты Ласпи, представленной 51 видом из шести отрядов. Показатель общности видов Жаккара (42 %) указывает на сходство фаун Malacostraca акватории бухты Ласпи в разные периоды исследований. К относительно редким в 1996 году (их присутствие на полигоне регистрируется на одной из 33 станций) относятся 10 видов ракоообразных: Leptochelia savignyi (8 экз./м2 станционная плотность), Pseudocumate nuicauda (8), Microdeutopus anomalus (13), Apherusa bispinosa (13), Corophium sp. (13), Orchomene humilis (13), Cumella pygmae aeuxinica (13), Eurydice spinigera (13), Schizorhynchus scabrous culus (13), Gammarellus sp. (25) (Ревков, Николаенко, 2002). По результатам 2016–2019 годов также 10 видов ракообразных: Apherusa bispinosa (50), Caprella acanthifera (50), Echinogammarus sp. (25), Melita palmata (100), Microdeutopus versiculatus (50), Perioculodes longimanus (13), Eurydice dollfusi (50), Idotea balthica (50), Athanas nitescens (100), Pisidia longimana (13). Показатель плотности редких видов в 2016–2019 годах оказался выше, чем в 1996 году и варьировал в разные годы от 13 до 100, тогда как в 1996 году – от 8 до 13 экз./м2. Их редкая встречаемость объясняется тем, что местообитанием 57 % видов являются макрофиты и обрастания скал, а 30 % редких видов обитают на илистых и песчано-илистых грунтах. В то время как на полигонах, анализируемых нами, как было сказано выше, доминируют песчаные, галечные и ракушечные грунты. Представители рода Gammarellus попали в список редких в связи с тем, что это холодолюбивые особи и с наступлением лета мигрируют на глубины до 50 м и лишь в зимне-весенний период их можно встретить в прибойной зоне в зарослях макрофитов (Грезе, 1985). Именно в этот период, в январе – мае 2015 года, Gammarelus carinatus обнаружен нами в бентосных пробах акватории Артбухты (Севастополь) с максимальной плотностью 278 экз./м2 (Макаров и др., 2019).
ЗАКЛЮЧЕНИЕ
Таким образом, в летние периоды 2016–2019 годов в акватории бухты Ласпи идентифицирован 41 вид Malacostraca из 6 отрядов. Кроме высших ракообразных в акватории бухты обнаружены другие представители Arthropoda: Amphibalanus improvisus (Darwin, 1854) и Harpacticoida. Высокий процент встречаемости отмечен для Amphipoda.
Средний показатель биомассы ракообразных по всему полигону составил 0,454±0,228 г/м2. Основную роль в его формирование вносят десятиногие раки, среди которых доминирует D. pugilator.
Средняя численность Malacostraca составила 280±158 экз./м2. Наибольшая плотность поселения отмечена у амфипод. Сформирована она представителями рода Echinogammarus.
Наибольшие показатели численности отмечены на станциях, приуроченных к зоне заплеска (0–0,5 м), биомассы – на глубине 14–15 м. Зоны высокой концентрации численности и биомассы Malacostraca в акватории бухты приурочены к станциям, грунт которых представлен песком и галькой.
Ранжированный ряд по индексу плотности возглавляют D. pugilator, E. foxi, C. dellavallei и E. karadagiensis.
Благодарности. Авторы выражают благодарность зав. отделом экологии бентоса ФИЦ ИнБЮМ А. Н. Петрову за организацию экспедиционных работ, ведущему научному сотруднику Н. К. Ревкову за ценные замечания и консультацию, а также остальным сотрудникам отдела за совместную работу и помощь в сборе материала.
Работа выполнена в рамках госзадания по теме «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана», № АААА-А18-118020890074-2.
REFERENCES
Аносов С. Е. Характеристика фауны Азово-Черноморского бассейна. Качественные и количественные изменения за последнее столетие: дис. … канд. биол. наук. – М.: ФГБНУ «ВНИРО», 2016. – 169 с.
Блинова Е. И., Вилкова О. Ю., Милютин Д. М., Пронина О. А., Штрик В. А. Методы ландшафтных исследований и оценки запасов донных беспозвоночных и водорослей морской прибрежной зоны // Изучение экосистем рыбохозяйственных водоёмов, сбор и обработка данных о водных биологических ресурсах, техника и технология их добычи и переработки. – 2005. – Вып. 3. – 134 с.
Грезе И. И. Фауна Украины. Высшие ракообразные. Бокоплавы. – Киев: Наукова думка 1985. – Т. 26, вып. 5. – 172 с.
Гринцов В. А. Динамика структуры популяций двух видов бокоплавов рода Echinogammarus (Gammaridae, Amphipoda) из бухты Ласпи (Крым, Чёрное море) // Морской биологический журнал.– 2016. – Том 1, № 3. – С. 22–26.
Кобякова З. И., Долгопольская М. А. Отряд десятиногие – Decapoda. Определитель фауны Чёрного и Азовского морей. – 1969. – Т. 2. – С. 270–299.
Макаров М. В., Бондаренко Л. В., Витер Т. В., Подзорова Д. В. Обрастания твёрдых искусственных субстратов в сезонном аспекте у побережья Севастополя (юго-западный Крым, Чёрное море) // Ученые записки Крымского федерального университета имени В. И. Вернадского Биология. Химия. – 2019. – Том 5 (71), № 2. – С. 116–131.
Нестерова Р. А. Оценка качества воды и грунта бухты Ласпи (Чёрное море) после аварии сухогруза «Кристина» // Экология моря. – 2000. – Т. 50. – С. 88–90.
Панкеева Т. В., Миронова Н. В. Пространственно-временные изменения макрофитобентоса акватории бухты Ласпи (Крым, Чёрное море) // Океанология. – 2019. – Т. 59, № 1. – С. 93–107.
Петров А. Н. Прибрежные акватории // Перспективы создания единой природоохранной сети Крыма. Симферополь: Крымучпедгиз, 2002. – С. 170–182.
Петухов Ю. М., Шаловенков Н. Н., Ревков Н. К., Петров А. Н. Анализ пространственного распределения макрозообентоса в черноморской бухте Ласпи с использованием методов многомерной статистики // Океанология. – 1991. – Т. 3, вып. 5. – С. 780–786.
Ревков Н. К.Таксономический состав донной фауны Крымского побережья Чёрного моря // Современное состояние биоразнообразия прибрежных вод Крыма (Черноморский сектор). – Севастополь: ЭКОСИ-Гидрофизика, 2003. – С. 209 – 218, 326 – 338.
Ревков Н. К., Николаенко Т. В. Биоразнообразие зообентоса прибрежной зоны южного берега Крыма (район бухты Ласпи) // Биология моря. – 2002. – Т. 28, № 3. – С. 170–180.
Статкевич С. В. Palaemon longirostris (Decapoda: Caridea) – чужеродный вид в Российском секторе Чёрного моря // Российский журнал биологических инвазий. – 2019. – № 2. – С. 87–91.
Тимофеев В. А., Симакова У. В., Спиридонов В. А. Первая находка восточной креветки Palaemon macrodactylus Rathbun, 1902 (Crustacea, Decapoda, Palaemonidae) в территориальных водах России в Черноморско-Азовском бассейне // Российский журнал биологических инвазий. – 2019. – № 1. – С. 110–119.
Bellan-Santini D. Ecology. The Amphipoda of the Mediterranean // Memoires de l’Institute oceanographique. –1998. – Vol. 13, pt. 4. – P. 869–894.
Karaman G. S. Genus Echinogammarus Stebbing. The Amphipoda of the Mediterranean // Memoires de l’Institute oceanographique. – 1982. – Vol. 13, pt. 1. – P. 271–282.