SEASONAL CONDITIONS OF PHYTO-FOULING OF A COASTAL PROTECTION HYDROTECHNICAL STRUCTURE (KRUGLAYA BAY, BLACK SEA)
JOURNAL: «EKOSISTEMY», Issue 25, 2021
Publication text (PDF): Download
UDK: 582.275+581.55+57.045]:627.2(262.5)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS: Evstigneeva I. K., Tankovskaya I. N. O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-25-49-59
PAGES: from 49 to 59
STATUS: Published
LANGUAGE: Russian
KEYWORDS: phytoperiphyton, species composition, ecological structure, phytomass, dominants, variability, season, hydraulic structures (the jetty), Crimea, the Black Sea.
ABSTRACT (ENGLISH):
The species composition, ecological and taxonomic structure, quantitative characteristics and variability of phyto-fouling of the coastal hydrotechnical structure (Kruglaya Bay, Sevastopol) in spring, summer and autumn were studied. The taxonomic composition of fouling is represented by 45 species of 29 genera, 19 families, 12 orders, 4 classes of the divisions Chlorophyta, Ochrophyta and Rhodophyta. The taxonomic leaders of the community are Rhodophyta, Cladophorales, Ceramiales, Ulvaceae, Cladophoraceae, Ceramiaceae, Ulva, Cladophora, Ceramium, ecological — marine, leading, annual and oligosaprobic species. The fouling is dominated by species with a high and medium frequency of occurrence. Most of the proportions of taxa and ecological groups are most resistant. The taxonomic diversity of the entire phyto-growth, its Rhodophyta, constant flora nucleus, minor species and some ecogroups, the occurrence of species, phytomass, the degree of community discreteness and the qualitative composition of its production dominants and subdominants are subject to seasonal fluctuations. Each season, the variability of the species composition corresponds to the norm for biological objects, the degree of variability of the phytomass is higher.
ВВЕДЕНИЕ
Действующая Федеральная целевая программа по социально-экономическому развитию Республики Крым и города Севастополя включает субсидирование берегозащитных мероприятий, осуществление которых должно основываться не только на генеральной схеме берегозащиты конкретного региона, но и учитывать научно-обоснованные рекомендации, выработанные на базе данных натурных наблюдений за состоянием прибрежной экосистемы (Удовик и др., 2017). Важной составляющей такой экосистемы является фитоперифитон искусственных субстратов и гидротехнических конструкций. Одним из признаков фитоценозов является способность их изменяться в течение года, находясь в различных состояниях в границах некоторой амплитуды сезонных и годичных вариаций абиотических и биотических факторов среды. Ранее было установлено, что сезонная смена макрофитов в Черном море выражена резко и обусловлена в основном температурным и световым режимом, наличием биогенов и особенностями онтогенеза самих водорослей (Калугина-Гутник, 1975). К сожалению, сезонная динамика фитообрастания в Черном море исследована мало, что, в частности, снижает объективность его типизации. Помимо этого, результаты фенологических наблюдений важны для практики многоцелевой марикультуры, индикации условий обитания гидробионтов и управления состоянием прибрежных экосистем, для создания базы данных, необходимых для разработки теоретических основ гидроботаники. В литературе имеются сведения о пространственной изменчивости фитообрастания ГТС, описание же сезонной динамики видового и экологического состава известно только для фитоперифитона в бухтах Ласпи и Карадагская (Евстигнеева, Танковская, 2010, 2014).
Актуальность проведения таких изысканий обоснована еще и тем, что изучению экосистемы бухты, функционирующей в условиях непосредственного прилегания к городским массивам и интенсивной рекреационной эксплуатации, уделялось мало внимания.
Поэтому целью работы стала оценка структурно-функциональной организации и изменчивости фитообрастания (ФО) берегового гидротехнического сооружения (ГТС) в разные периоды вегетации макроводорослей.
В задачи исследования входили определение видового состава и пропорций соподчиненных таксонов, описание экологической структуры, встречаемости и обилия макроводорослей обрастания ГТС, размещенного в бухте Круглая (г. Севастополь, «Парк Победы»), весной, летом и осенью.
МАТЕРИАЛ И МЕТОДЫ
Объектом исследования стали макроводоросли, колонизирующие одно из пляжеудерживающих сооружений (буна) в бухте Круглая, в районе пляжа «Парк Победы» (рис. 1). Бухта расположена на северном побережье Гераклейского полуострова между бухтами Двойная и Стрелецкая в черте города Севастополь. Бухта мелководная и только на ее входе глубина достигает 15 м. На западном береге бухты расположен городской пляж с сопутствующей инфраструктурой, функционирует лечебный госпиталь и аквапарк «Зурбаган». На восточном береге находятся вертолетный завод, яхт-клуб и дикий пляж. В бухту выведен аварийный сток канализационных вод, который часто бывает причиной для закрытия пляжа. Тем не менее, химический анализ морской воды не обнаружил признаков антропогенной нагрузки на всей изучаемой акватории (Ломакин, Чепыженко, 2019). Городской пляж «Парк Победы» расположен в центральной части открытого участка береговой зоны. Здесь отсутствуют собственные источники поступления пляжеобразующего материала, а для блокирования вдольберегового перемещения наносов в 70-х годах прошлого века была построена бетонная набережная с пятью пляжеудерживающими бунами длиной 60 м (Удовик и др., 2017).
Отбор проб фитообрастания (ФО) проводили с боковой стенки одного из пяти гидротехнических сооружений (ГТС) весной (апрель), летом (июль) и осенью (ноябрь) 2018 года специальным скребком с площадью захвата 0,1 м2 (Ильин, 1976). Станции отбора проб находились на одинаковом расстоянии от поверхности воды (приповерхностный горизонт высотой от 0 до 0,5 м). В каждый вегетационный период водорослей пробы собирали на 21 станции, равномерно расположенных вдоль буны. Общее количество проб равно 62.
В работе применена классификация Chlorophyta (Ch), Ochrophyta (Och) и Rhodophyta (Rh), принятая отечественными альгологами (Зинова, 1967; Калугина-Гутник, 1975), с учетом последних номенклатурных изменений (Guiry, Guiry, 2020). При анализе флористической структуры ФО ГТС применяли коэффициенты общности видов Жаккара Kj (%), дисперсности (рассеяния) фитоценоза (результат деления общего числа видов на среднее) и встречаемости видов R (%) видов (отношение числа станций, где зарегистрирован вид, к их общему числу), индекс Шеннона в модификации Вильма (Миркин и др., 1989; Розенберг, 2010; Шенников, 1964). При описании таксономической структуры учитывали сведения о пропорциях флоры и, в частности, родовой коэффициент (отношение вид / род). По индивидуальной фитомассе и с применением шкалы доминирования Г. Н. Любарского, базирующейся на данных об относительной фитомассе видов, определяли группы малозначимых и второстепенных видов, доминантов и содоминантов сообщества (Баканов, 2005). Виды по показателю их встречаемости на ГТС распределяли на группы постоянства (постоянные, добавочные, случайные) (Дажо, 1975), рассчитывали индекс гомотонности фитоценоза (J) (Миркин и др., 1989).
Экологический состав идентифицировали с учетом классификации макроводорослей, предложенной А. А. Калугиной-Гутник (Калугина-Гутник, 1975). Для описания изменчивости характеристик сообщества определяли лимиты, размах их вариации и среднее значение с доверительным интервалом (Лакин, 1973), а по коэффициенту вариации (Сv, %) определяли тип изменчивости биологических признаков («нормальный», «значительный», «большой», «очень большой», «аномально высокий») (Зайцев, 1990). Полученные данные
Рис. 1. Бухта Круглая а – буны пляжа «Парк Победы» (западный берег бухты Круглая); б – общий вид бухты Круглая; в – буна.
были сопоставлены с результатами флористических исследований обрастания ГТС в бухте Ласпи (Евстигнеева, Танковская, 2010).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общая характеристика ФО ГТС. За весь период исследований в обрастании ГТС были обнаружены макроводоросли 45 видов 29 родов, 19 семейств, 12 порядков, 4 классов отделов Chlorophyta (Ch), Ochrophyta (Och) и Rhodophyta (Rh). Видовое соотношение отделов свидетельствовало о примерно равном вкладе Ch и Och в таксономический состав ФО, гораздо меньшем, чем у Rh. Сопоставление полученных данных с результатами флористических исследований обрастания ГТС в бухте Ласпи (Евстигнеева, Танковская, 2010) показало отсутствие существенного различия и даже совпадение уровней ряда показателей у всего ФО и входящего в него Rh. Тем не менее, величины коэффициента Жаккара указывали на то, что качественные различия ФО в двух водоемах выражены сильнее. Попарное сравнение видового состава отделов в бухтах в один и тот же сезон позволило выявить лишь 42–44 % одинаковых видов. Отмечено несовпадение видовой пропорции отделов. Тем не менее, Rh в обрастании ГТС неизменно занимал позицию таксономического лидера, особенно по числу видов и родов. Och, уступая Rh, одновременно превосходил Ch по числу надвидовых таксонов. Основу таксономического разнообразия составляли Florideophyceae, Ceramiales, Corallinales, Ectocarpales Ulva, Cladophora и Ceramium. Пропорции порядков, семейств, родов и видов в отделах и во всем ФО в разной степени не совпадали. Наибольшим своеобразием отличалась таксономическая пропорция Ch, которому принадлежал и самый высокий родовой коэффициент (2,5). У Och он был наименьшим среди отделов (1,0).
Экологический анализ показал, что идентифицированные виды по встречаемости и продолжительности жизни в Черном море, по отношению к солености и сапробности воды относились к 12 экологическим группам. Наибольшим числом видов были представлены ведущая, однолетняя, олигосапробная и морская группы (47–58 % общего видового состава). Гидрохимические исследования показали, что значения солености в поверхностном слое бухты Круглая колеблются в узком диапазоне (17,72–18,11 ‰), означающем наличие хорошего водообмена с прилегающей частью моря и отсутствие постоянных источников распреснения вод (Павлова и др., 2001). Очевидно, с этим и связано высокое развитие водорослей морской группы. Доминирование видов олигосапробной принадлежности может быть связано как с особенностями водообмена, так и с тем обстоятельством, что наносы антропогенного происхождения аккумулируются только в мелководной кутовой части бухты, где в период интенсивного поверхностного стока увеличивается мутность воды, повышается содержание токсичных веществ и биогенов. На остальной акватории признаки антропогенной нагрузки отсутствуют (Ломакин, Чепыженко, 2019). Ранее было показано, что повышение концентраций биогенов в бухте в отдельные периоды возможно, но без достижения экологически опасных уровней (Куфтаркова и др., 2008). В таких условиях успешно развивается олигосапробная флора.
Исследования выявили различие в группировании по отделам видов разной экологической принадлежности и в степени редукции экоспектров (табл. 1).
Сравнительная характеристика сезонных состояний ФО ГТС. Для описания особенностей распределения видов обрастания в разные сезоны воспользуемся данными о
Таблица 1
Экологический состав фитообрастания гидротехнических сооружений в бухте Круглая
| Экогруппа | Chlorophyta | Ochrophyta | Rhodophyta | |||
| n* | %** | n | % | n | % | |
| Редкая | 6 | 43 | 1 | 11 | 3 | 14 |
| Ведущая | 5 | 36 | 7 | 78 | 15 | 68 |
| Сопутствующая | 3 | 21 | 1 | 11 | 4 | 18 |
| Однолетняя | 10 | 72 | – | – | 13 | 59 |
| Многолетняя | 1 | 7 | 5 | 56 | 6 | 27 |
| Сезонная | 3 | 21 | 4 | 44 | 3 | 14 |
| Полисапробная | 4 | 29 | – | – | 2 | 9 |
| Мезосапробная | 6 | 42 | 2 | 22 | 10 | 45 |
| Олигосапробная | 4 | 29 | 7 | 78 | 10 | 45 |
| Солоноватоводно-морская | 8 | 57 | 2 | 22 | 9 | 41 |
| Морская | 4 | 29 | 7 | 78 | 13 | 59 |
| Солоноватоводная | 2 | 14 | – | – | – | – |
| Всего видов | 14 | 9 | 22 | |||
Примечание к таблице. * – абсолютное число видов в группе, ** – доля видов от их общего числа в отделе (%).
встречаемости. На их основе было выделено константное ядро флоры, включающее 12 видов. То есть, в сообществе обрастания в любой сезон присутствовало по 27 % одинаковых видов. Больше всего видов со 100 %-ной встречаемостью было обнаружено среди Сh (36 % общего числа видов, которыми был представлен отдел), меньше всего – среди Och (11 %). Виды, входящие в константное ядро ФО, в основном относились к ведущим, морским, одно- и многолетним, олиго- и мезосапробным водорослям, занимающим первые позиции как в составе обрастания конкретного ГТС, так и во всем черноморском фитобентосе. Группирование видов на основе данных о межсезонной встречаемости в соответствии со шкалой Р. Дажо показало отсутствие случайной группы с показателем R менее 25 % и примерно равное распределение видов между постоянной (R>50 %) и добавочной (R=25–50 %). Постоянные виды господствовали среди Ch, добавочные – среди Och, обе группы примерно поровну были представлены среди Rh.
Данные о встречаемости видов были привлечены для расчета индекса гомотонности (J) сообщества. Для этого они были сгруппированы в 5 классов постоянства с последующим определением их соотношения (Миркин и др., 1989). Ненамного превышая 1 (J=1,1), оно свидетельствовало о межсезонной однородности ФО.
Степень сходства (различия) видового состава во времени была определена с помощью коэффициента общности, рассчитанного для каждой пары сезонов. Относительно высокое сходство Ch было установлено при сравнении видовых списков весной и летом, летом и осенью (54 и 50 %). Видовой состав Och особенно сильно отличался весной и летом (Kj=11 %), немногим меньше – в иные сравниваемые периоды (Kj=43 %). Весной и осенью среди Rh была обнаружена половина одинаковых видов, в остальные пары сезонов их число было ниже. Коэффициент общности для всего ФО в разные пары сезонов достигал 41–49 % с максимумом между весной и осенью.
Анализ данных о составе и структуре ФО в разные периоды вегетации водорослей позволил выделить признаки, устойчивые или подверженные изменчивости во времени. Было установлено, что в любой из исследованных периодов вегетации ФО характеризовалось одной и той же пропорцией соподчиненных таксонов (3 вида : 2 рода : 1 семейство : 1 порядок) и соотношением семейство : порядок (1 : 1) в отделах (табл. 2).
Таблица 2
Сезонные изменения числа видов и таксономических пропорций во флоре обрастания
| Отделы | Весна | Лето | Осень |
| Сh | 12 / 1:1:1:4* | 8 / 1:1:2:4 | 7 / 1:2:3:4 |
| Och | 7 / 1:1:2:2 | 3 / 1:1:1:1 | 3 / 1:1:1:1 |
| Rh | 17 / 1:1:2:3 | 10 / 1:2:3:3 | 15 / 1:2:3:4 |
| Весь ценоз | 1:1:2:3 | 1:1:2:3 | 1:1:2:3 |
| Видовое соотношение Ch : Och : Rh | 2:1:2,5 | 3:1:3 | 2:1:5 |
Примечание к таблице. Перед чертой правый слэш (/) – абсолютное число видов, за чертой – пропорция «порядок : семейство : род : вид».
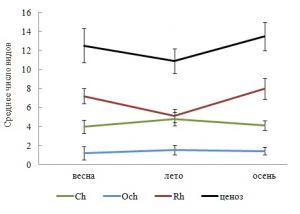
В любой период вегетации Rh занимал позицию таксономического лидера, а Och отличался малым разнообразием видов и упрощенной таксономической структурой. Неизменным оставался перечень базовых таксонов. Ежесезонно в ФО господствовали ведущие, однолетние, олигосапробные и морские виды, одинаковым числом видов были представлены постоянная и добавочная группы водорослей. Распределение видов по станциям всегда характеризовалось превосходством Rh по среднему числу видов и сохранением одного и того же типа вариаций этого показателя у Ch, Rh и фитообрастания в целом (рис. 2). Межсезонная изменчивость числа видов и, за небольшим исключением, внутрисезонная находилась в пределах «нормы» для признаков биологических объектов (табл. 3).
Рис. 2. Сезонные изменения среднего числа видов в отделах и ценозе
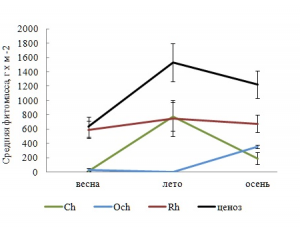
Имея самую высокую среднюю фитомассу, Rh в каждый сезон выполнял роль базового продуцента (рис. 3). Изменчивость его фитомассы и всего ценоза в исследованные периоды вегетации имела умеренный характер, тогда как у других отделов она была интенсивнее (табл. 3). В системе продукционного доминирования отсутствовали абсолютные доминанты и превалировали малозначимые виды с низкой относительной фитомассой. Вариабельность индекса Шеннона на станциях, независимо от сезона, была в пределах «нормы».
Рис. 3. Сезонные изменения средней фитомассы в отделах и ценозе
Сезонным колебаниям прежде всего было подвержено общее таксономическое разнообразие ФО с максимумом весной и минимумом летом. Осенью наблюдался второй пик разнообразия сообщества, не достигающий весеннего уровня. Такой ход изменений состава ФО не отличается от подобного в бентосных фитоценозах и соответствует сезонным особенностям окружающей среды. Весной с прогревом воды до +15 °С начинается массовое развитие однолетних и сезонно-летних видов, продолжается вегетация сезонно-зимних
Таблица 3
Типы изменчивости видового состава и фитомассы обрастания (по Г. Н. Зайцеву, 1990)
| Отдел | Внутрисезонная изменчивость | Межсезонная изменчивость | ||
| Весна | Лето | Осень | ||
| Число видов | ||||
| Ch | Верхняя норма | Верхняя норма | Нижняя норма | Нижняя норма |
| Och | Аномально высокая | Очень большая | Значительная | Нижняя норма |
| Rh | Верхняя норма | Верхняя норма | Верхняя норма | Нижняя норма |
| Весь ценоз | Верхняя норма | Нижняя норма | Нижняя норма | Нижняя норма |
| Фитомасса | ||||
| Ch | Аномально высокая | Значительная | Большая | Аномально высокая |
| Och | Аномально высокая | Аномально высокая | Очень большая | Аномально высокая |
| Rh | Значительная | Значительная | Верхняя норма | Нижняя норма |
| Весь ценоз | Значительная | Верхняя норма | Верхняя норма | Верхняя норма |
водорослей. Летом повышается не только температура воды, но и степень инсоляции. В теплый период года для бухты характерна двухслойная структура вод и слабое вентилирование придонного слоя, способствующего интенсивному расходованию кислорода в различных биолого-химических процессах (Orekhova, Konovalov, 2018). В это время на самых мелководных участках бухты и приповерхностных частях гидротехнических сооружений заросли водорослей подвергаются обнажению, снижается их фотосинтетическая активность, слоевища обесцвечиваются, происходит разрушение старых растений или опад генеративных ветвей, наблюдается массовое появление проростков малых размеров и массы, завершается вегетационный период у многих сезонных форм.
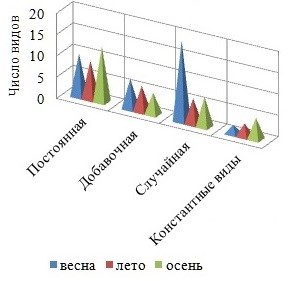
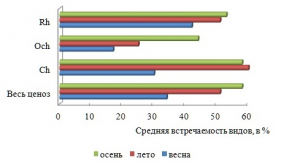
Осенью активизируется ветровое волнение, оказывающее элиминирующее воздействие на структуру фитоценоза, итогом которого может быть снижение видового разнообразия. Вместе с тем, поздней осенью, как и весной, процессы фотосинтеза протекают активно, у большинства многолетних форм развиваются репродуктивные органы, вновь появляются виды сезонно-зимней группы. Сезонная динамика сопровождается увеличением от весны к осени степени видового доминирования Rh и разнообразия константного ядра флоры, возрастает средняя встречаемость видов в каждом отделе (рис. 4, 5). Межсезонная изменчивость среднего числа видов в группах постоянства и показателя встречаемости представителей разных отделов является нормальной.
Рис. 4. Распределение видов между группами постоянства в разные сезоны
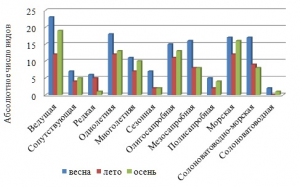
Другим проявлением динамики в указанном временном направлении является уменьшение величины родового коэффициента, снижение видового разнообразия малозначимых видов, а также таких экологических групп, как ведущая, редкая, солоноватоводно-морская и солоноватоводная (рис. 6). Межсезонная изменчивость среднего числа видов большинства экогрупп относится по типу к «нормальной» (Cv не выше 44 %).
Со временем уменьшается среднее число видов Rh и всего ФО, отмечено резкое снижение видового разнообразия коротковегетирующих компонентов ФО и мезосапробионтов летом. Изменениям подвергается и соотношение групп видов с разной степенью постоянства. Так, весной с активизацией ростовых процессов у многих видов, пополнением состава ФО сезонно-летними видами и исчезновением представителей сезонно-зимней группы в обрастании господствуют случайные виды, летом, по мере формирования более зрелого сообщества, доминирование переходит к постоянным видам, доля случайных и добавочных видов становится равно меньшей. Осенью с усилением ветро-волновой активности в обрастании превалируют постоянные виды с показателем встречаемости более 50 %. Динамика фитомассы фитоценоза и составляющих его отделов характеризуется летним максимумом и отсутствием сезонной приуроченности минимума.
Рис. 5. Средняя встречаемость видов в разные сезоны
Рис. 6. Экологический спектр групп в разные сезоны
Прослеживается сезонная динамика и качественных показателей. Так, константное ядро флоры обрастания весной было сформировано исключительно представителями Rh, летом – Ch, осенью максимально высокой встречаемостью отличались виды обоих отделов. Величина коэффициента дискретности (рассеяния) показывала, что со сменой сезонов трансформируется равномерность сложения ценоза обрастания. Это качество ценоза было наиболее выражено весной, в остальное время степень его выравненности была меньше. В большинстве случаев от весны к осени наблюдалось снижение интенсивности вариаций фитомассы по станциям.
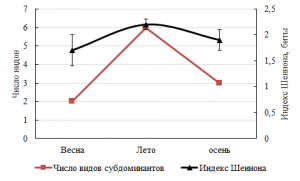
Сезонные преобразования претерпевает качественный состав доминантов и субдоминантов. Весенний период был отмечен продукционным господством Gelidium crinale (Hare ex Turner) (Rh), летний – Cladophoropsis membranacea (H. Bang ex C. Agardh) (Ch), осенний – Carpodesmia crinita (Duby) Orellana & Sansón in Orellana, Hernández & Sansón (Och) и вновь G. crinale. Субдоминантная группа характеризовалось наибольшим разнообразием летом, чему соответствовал и максимум индекса Шеннона (2,2±0,1) (рис. 7).
Рис. 7. Сезонное распределение видов субдоминантов и индекса Шеннона
ЗАКЛЮЧЕНИЕ
Гидроботанические исследования фитообрастания ГТС в бухте Круглая позволили впервые описать особенности его видовой структуры, таксономические пропорции, экологический состав, количественное соотношение видов разной экологической принадлежности, а также продукционный потенциал весной, летом и осенью. Фитообрастание в районе исследования представлено 45 видами 29 родов, 19 семейств, 12 порядков, 4 классов отделов Chlorophyta, Ochrophyta и Rhodophyta. Таксономическими лидерами сообщества являются Rhodophyta, Cladophorales, Ceramiales, Ulvaceae, Cladophoraceae, Ceramiaceae, Ulva, Cladophora, Ceramium, экологическими – морские, ведущие, однолетние и олигосапробные виды. В обрастании преобладают виды с высоким и средним показателем встречаемости.
Установлено, что большинство пропорций соподчиненных таксонов и характер распределения видов между отделами, экогруппами, группами постоянства и продукционного доминирования проявляют относительно высокую устойчивость.
Сезонным колебаниям подвержены таксономическое разнообразие ФО, Rhodophyta, константного ядра флоры, малозначимых видов, части экогрупп, встречаемость видов, соотношение групп постоянства, фитомасса, степень дискретности сообщества и качественный состав его продукционных доминантов и субдоминантов. Изменчивость числа видов в каждый сезон и между ними находится в пределах «нормы», установленной для биологических объектов, у фитомассы она интенсивнее.
Сочетание пространственно-временной устойчивости большинства пропорций таксонов и групп видов и изменяемости ряда качественных и количественных признаков ФО наглядно демонстрирует действие принципа «конгенерического гомотаксиса» в прибрежной экосистеме, элементами которой являются водоросли перифитона.
Работа выполнена в рамках госзадания ФГБУН ИМБИ. № АААА-А18-118021350003-6 «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса».
REFERENCES
Баканов А. И. Количественная оценка доминирования в экологических сообществах / [Ред. чл.-корр. РАН Г. С. Розенберг]. – Сборник научных трудов. Количественные методы экологии и гидробиологии. – Тольятти: СамНЦ РАН 2005. – С. 37–68.
Дажо Р. Основы экологии. – Москва: Изд-во Прогресс, 1975. – 245 с.
Зайцев Г. Н. Математика в экспериментальной ботанике. – Москва: Наука, 1990. – 96 с.
Зинова А. Д. Определитель зеленых, бурых и красных водорослей южных морей СССР. – Москва – Ленинград: Наука, 1967. – 397 с.
Евстигнеева И. К., Танковская И. Н. Макроводоросли перифитона и бентоса прибрежья бухты Ласпи (Крым, Чёрное море) // Экология моря. – 2010. – Спец. вып. 81: Биотехнология водорослей. – C. 40–49.
Евстигнеева И. К., Танковская И. Н. Макроводоросли биологического литоконтура акватории Карадагского природного заповедника (Крым) // Альгология. – 2014. – Т. 24, № 3. – С. 388–393.
Ильин И. Н. К методике изучения обрастания в океане // Океанология. – 1976. – Т. 16, вып. 6. – С. 1122–1125.
Калугина-Гутник А. А. Фитобентос Черного моря. – Киев: Наукова думка, 1975. – 248 с.
Куфтаркова Е. П., Родионова Н. Ю., Губанов В. И., Бобко Н. И. Гидрохимическая характеристика отдельных бухт Севастопольского взморья // Труды ЮгНИРО. – 2008. – Т. 46. – С. 110–117.
Лакин Г. Ф. Биометрия. – Москва: Высшая школа, 1980. – 293 с.
Ломакин П. Д., Чепыженко А. И. Течения и поля содержания общего взвешенного и растворенного органического веществ в водах Севастопольского взморья в августе 2019 года // Системы контроля окружающей среды. – 2019. – Вып. 4. – С. 60–65.
Миркин Б. М., Розенберг Г. С., Наумова Л. Г. Словарь понятий и терминов современной фитоценологии. – М.: Наука, 1989. – 223 с.
Павлова Е. В., Мурина В. В., Куфтаркова Е. А. Гидрохимические и биологические исследования в бухте Омега (Черное море, Севастопольский шельф) // Экологическая безопасность. – 2001. – № 2. – С. 159–176.
Розенберг Г. С. Информационный индекс и разнообразие: Больцман, Котельников, Шеннон, Уивер … // Самарская Лука: проблемы региональной и глобальной экологии. – 2010. – Т. 19 (2). – С. 4–25.
Удовик В. Ф., Харитонова Л. В., Горячкин Ю. Н. Мониторинг состояния городских пляжей Севастополя // Экологическая безопасность. – 2017. – № 4. – С. 86–94.
Шенников А. П. Введение в геоботанику [Ред. М. Х. Блюменталь]. – Ленинград: Изд-во Ленинградского университета, 1964. – 445 с.
Guiry M. D., Guiry G. M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway – http: // www.algaebase.org. – Searched on 2020.
Orekhova N. A., Konovalov S. K. Oxygen and sulfides in bottom sediments of the coastal Sevastopol region of Crimea // Oceanology. – 2018. – Т. 58, N 5. – С. 679–688.