DEFINITION OF ORCHIDS (ORCHIDACEAE) OF THE SOCHI BLACK SEA REGION BY MICROMORPHOLOGICAL CHARACTERISTICS OF SEEDS
JOURNAL: «EKOSISTEMY», Issue 23, 2020
Publication text (PDF):Download
UDK: 582.59:581.48
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Averyanova E. A.,
Sochi Institute of the People’s Friendship University of Russia, Sochi Branch of the Russian Geographical Society, Sochi, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2020-23-84-92
PAGES: from 84 to 92
STATUS: Published
LANGUAGE: Russian
KEYWORDS: Orchidaceae, orchid seeds, testa, embryo, seed morphology, seed identification, the key to determine orchids, Sochi Black Sea coast.
ABSTRACT (ENGLISH):
According to the results of preliminary studies of the micromorphology of orchids seeds in the Sochi Black Sea region, a key has been compiled to identify 25 species and subspecies from 13 genera by seed. The most valuable features of seed structure for diagnosis were identified from the previously described characteristics: seed shape, its length, the number of cells in testa, their shape in different parts of testa. Limodorum-type seeds have fusiform, linear or balloon-shape and Orchis-type seeds are pear-shaped or club-shaped. The shape of the cells is the same throughout the testa or contrasting one – elongated in the micropylar and medial parts and isodiametric at the chalazal pole. This trait also distinguishes the type of seed. Some genera are characterized by convoluted or smooth anticlinal cell walls. The periclinal walls of the cells have sculptural thickenings of different patterns, or no pattern. This feature consistently characterizes different genera and even species. Frequent or rare stripes of the sculpture, mostly straight or curved, forming gaps at the borders of cells or not – these features are species-specific. Relative sizes, in particular, the ratio of the length of a seed to the length of an embryo, as well as the proportion of sizes of parts of seed coats have great specificity. On the contrary, orientation of the strokes of the sculpture, the presence of suspension residues and the degree of homogeneity of an embryo are not reliable diagnostic features. The key is useful for field researches for studying the distribution of orchids in the period after flowering and until the seeds are completely dispersed.
ВВЕДЕНИЕ
Сочинское Причерноморье уникально для России по своим климатическим условиям. Это ценнейший в ботаническом отношении регион, характеризующийся полувлажным субтропическим климатом (средние температуры января +5 °С и июля +24 °С), с которым связано распространение лесов колхидского типа.
В последнее время в Сочинском Причерноморье произошли колоссальные изменения, отрицательно влияющие на природные территории. Это определяет актуальность изучения редких и исчезающих видов флоры и фауны региона, в том числе представителей семейства орхидей (Orchidaceae). Большинство видов этого семейства занесены в списки охраняемых растений, в том числе в Красные книги Российской Федерации (Красная книга…, 2008) и Краснодарского края (Красная книга…, 2017), а также охраняются международными документами. Все виды включены в приложение II Конвенции о международной торговле CITES (Convention on International…, 2006), а некоторые в Приложение I Бернской конвенции (Bern Convention…, 1998). Исследования биологии, экологии и распространения отдельных видов орхидей помогут в решении важных вопросов охраны и восстановления их популяций в окрестностях Большого Сочи и на всём Российском побережье Черного моря. Немаловажным аспектом исследований является изучение репродукции орхидей, включая микроморфологию семян.
Впервые выявили таксономическое значение семенных характеристик орхидей Х. Т. Клиффорд и В. К. Смит (Clifford, Smith, 1969). Позже Р. Л. Дресcлер (Dressler, 1981) предложил несколько схем классификации семян орхидей, основанных на морфологических признаках. Многие исследователи отмечают важность изучения семян для таксономии, филогении, фитогеографии и биологии орхидей (например, Arditti et al., 1980; Swamy et al., 2004; Gamarra et al., 2012; Barthlott et al., 2014; Galan et al., 2014; Verma et al., 2014; Güler, 2016; Şeker, Şenel, 2017 и др.). Сведений на эту тему в России было опубликовано не много (Широков и др., 2007; Шибанова, Долгих, 2010; Кириллова, 2015), а в Сочинском Причерноморье исследования семян орхидей до нас не проводили.
Цель исследований – выявление микроморфологических признаков семян орхидей наиболее ценных для их идентификации и составление определителя видов орхидей Сочинского Причерноморья по семенам.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены на территории Адлерского, Хостинского, Центрального и Лазаревского районов г. Сочи в период с 2011 по 2019 годы.
Морфология семян изучалась у 25 видов орхидей из 13 родов. Материал собирали в 2–4 и более ценопопуляциях каждого вида. Из одной популяции брали от 3 до 15 образцов. Зрелые семена извлекали из выполненных коробочек, измерения и фотографирование проводили под откалиброванным микроскопом Биолам с камерой Levenhuk800. Калибровку каждого объектива проводили с помощью объект-микрометра ОМП № 592190 (ГОСТ 7513–55). Измерения семян проводили в программе ToupView, обработку результатов проводили в программе Libre-Office-Calc. Результаты морфометрии семян разных видов, а также описание их основных качественных признаков опубликованы ранее (Аверьянова, 2015, 2018, 2019).
Проанализировано от 80 до 120 семян в каждом образце. Фотографии SEM были сделаны М. И. Антипиным на сканирующем электронном микроскопе Cambridge Instruments CamScan-S2 с ускоряющим напряженим 20 кВ и режимом регистрации вторичных электронов. Микроскоп расположен на биологическом факультете МГУ в Москве.
Одновходовый определительный ключ строился по традиционному дихотомическому принципу (Свиридов, 1994).
Названия орхидей даны по обзору П. Г. Ефимова (Efimov, 2020).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По классификации R. L. Dressler (1993) семена можно разделить на две группы – Orchis-тип (Anacamptis morio subsp. caucasica (K. Koch) H. Kretzschmar, Eccarius et H. Dietr., A. pyramidalis (L.) Rich., Dactylorhiza urvilleana (Steud.) Baumann et Künkele, Neotinea tridentata (Scop.) R. M. Bateman, Pridgeon & M. W. Chase, Ophrys apifera Huds., O. caucasica Woronow ex Grossh., O. oestrifera M. Bieb., Orchis mascula (L.) L., O. militaris subsp. stevenii (Rchb. f.) B. Baumann, H. Baumann, R. Lorenz & Ruedi Peter., O. provincialis Balb. ex Lam. & DC., O. punctulata Steven ex Lindl., O. purpurea subsp. сaucasica (Regel) B. Baumann, H. Baumann, Lorenz et Peter, Platanthera bifolia (L.) Rich., Serapias orientalis subsp. feldwegiana (H. Baumann et Künkele) Kreutz, Spiranthes spiralis (L.) Chevall., Steveniella satyrioides (Spreng.) Schltr.) и Limodorum-тип (Cephalanthera damasonium (Mill.) Druce, C. longifolia (L.) Fritsch, C. rubra Rich., Epipactis helleborine (L.) Crantz, E. leptochila subsp. neglecta Kümpel, E. pontica Taubenheim, Limodorum abortivum (L.) Sw., Neottia nidus-avis Guett., N. ovata (L.) Bluff & Fingerh.).
Основной метод изучения морфологии семян, на основе которого проведена данная работа – световая микроскопия. Она позволяет подробно изучить количественные и качественные характеристики семян. С помощью сканирующей электронной техники удаётся изучить тонкие детали скульптурной структуры наружных поверхностей клеток семенной оболочки (рис. 4 a, b). Тем не менее, возможности сканирующего электронного микроскопа не умаляют значения световой микроскопии, с помощью которой доступны наблюдения внутреннего устройства семенной оболочки, а также формы зародыша, наличия остатков суспензора и прочих значимых деталей. Сравнение возможностей световой и электронной микроскопии при изучении семян можно видеть на рисунке 1a и 1b.
Форма семенной оболочки значительно варьирует в одном плоде в зависимости от места, где располагалось семя на плаценте (рис. 1a). Наиболее ярко можно проследить морфологические признаки рода и вида у семян с полностью расправленными оболочками. У семян изогнутых, сжатых, укороченных теряется чёткость формы, сложнее наблюдать форму отдельных клеток, их границ, характер скульптурных утолщений. Эти отклонения значительно влияют и на количественные характеристики семян, в частности, на размеры. Укороченных и изогнутых семян в каждом плоде, пожалуй, не меньше, чем хорошо расправленных.
 |
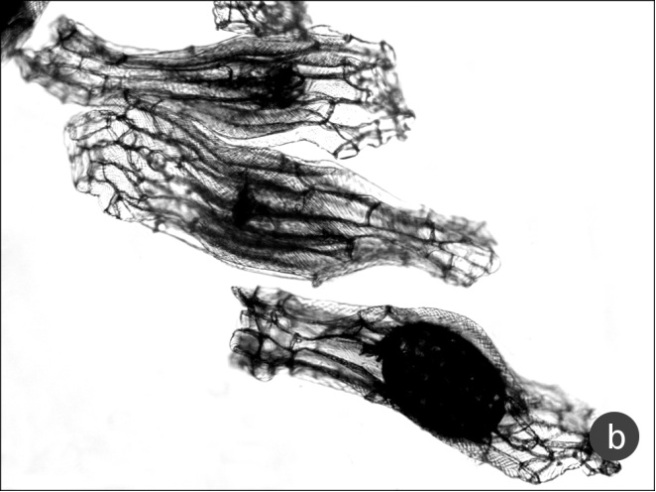 |
Рис. 1. Строение семян Anacamptis morio subsp. caucasica
a – фотография, сделанная на электронном сканирующем микроскопе; видны извитые антиклинальные стенки клеток, b – микрофотография, сделанная на световом микроскопе; видны детали строения зародыша, частые косые штрихи скульптуры.
Форма семени веретеновидной (рис. 2a) считается в случае плавного сужения оболочки семени к полюсам с максимальной шириной в области расположения зародыша. Линейное семя (рис. 2b) удлинённое, имеет поперечник, одинаковый почти на всём его протяжении, с резко обрубленным микропилярным концом и округлённым халазальным.
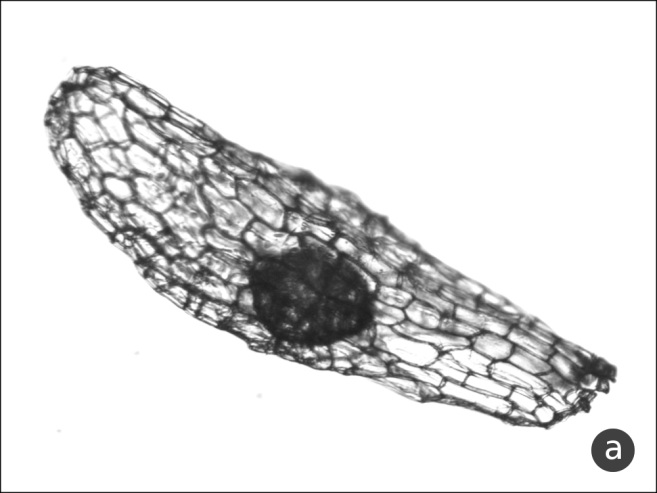
Баллонообразное семя (рис. 3a) имеет значительную ширину и плавное закругление к полюсам. Грушевидной (рис. 3b) мы считаем форму семени, при которой максимум ширины приходится на халазальную область, при этом оболочка значительно шире зародыша. Булавовидное семя (рис. 1b) также максимально в ширину в халазальной части, но ширина семенной оболочки почти не превышает ширину зародыша.
Довольно высокой специфичностью, на наш взгляд, обладает относительный размер зародыша (ОРЗ). Этот показатель, равный отношению длины семени к длине зародыша, демонстрирует стойкие различия не только на родовом уровне, но часто и на уровне вида.
У многих видов наружные поверхности периклинальных стенок клеток семенной оболочки снабжены утолщениями в виде более-менее густо расположенных прямых или изогнутых штрихов (рис. 4a). По отсутствию скульптурных утолщений (рис. 4b), в числе других качественных и количественных признаков, мы отличаем семена Limodorum-типа от семян Orchis-типа. При этом в последней группе описанные скульптурные утолщения могут присутствовать либо нет.
У видов родов Neotinea, Ophrys, Platanthera, Serapias, Steveniella, Anacamptis видны чёткие частые штрихи скульптурных утолщений (рис. 4a, 1b), у Spiranthes spiralis такие утолщения отличаются редкостью расположения (рис. 5a). У видов Dactylorhiza штрихи скульптуры также редкие (рис. 5b), могут присутствовать или нет. Род Orchis не имеет ярко
 |
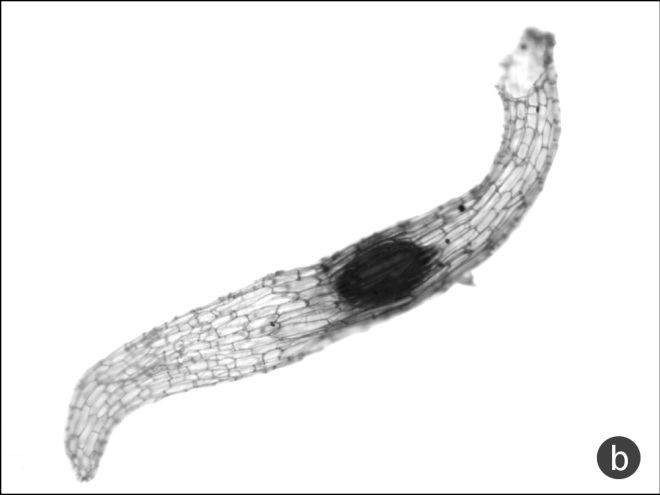 |
Рис. 2. Веретеновидная и линейная форма семян
a – веретеновидная (Epipactis pontica), b – линейная (Cephalanthera longifolia).
 |
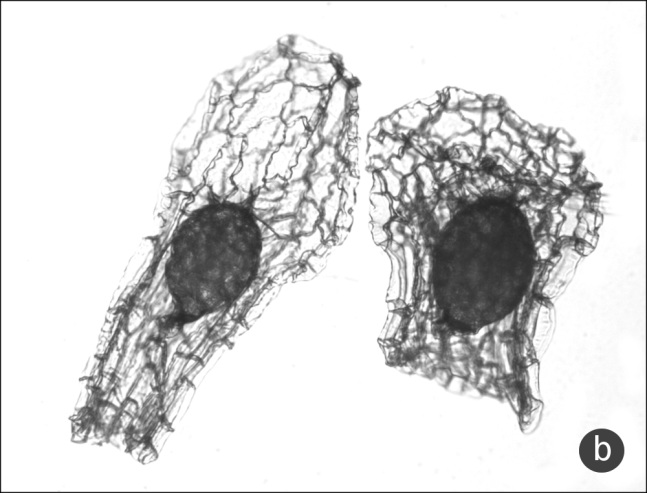 |
Рис. 3. Баллонообразная и грушевидная форма семени
a – баллонообразная форма (Neottia ovata), b – грушевидная форма (Orchis provincialis).
 |
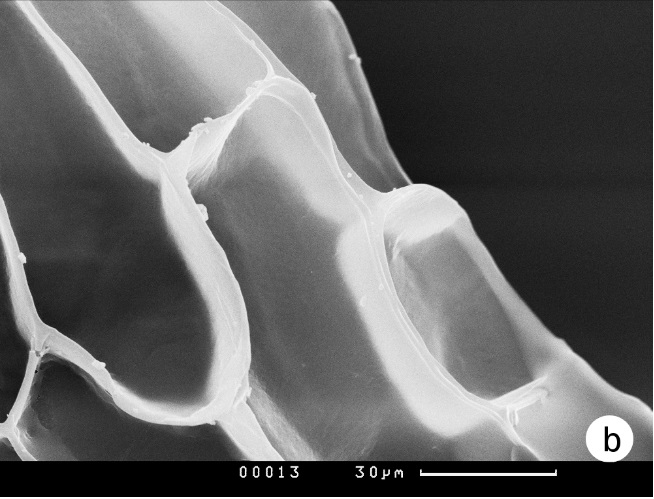 |
Рис. 4. Структура поверхности периклинальных стенок клеток семенной оболочки
а – Ophrys caucasica, косые штрихи скульптуры поверхности, b – Orchis purpurea subsp. caucasica, отсутствие скульптуры поверхности.
 |
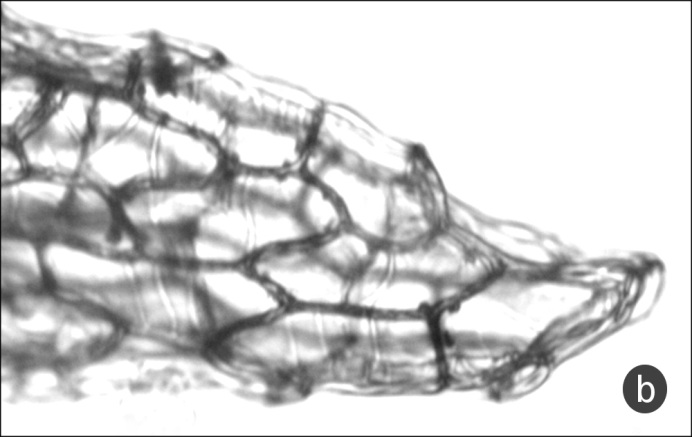 |
Рис. 5. Редкие штрихи скульптуры поверхности периклинальных стенок клеток оболочки семени
a – Spiranthes spiralis, b – Dactylorhiza urvilleana.
выраженных скульптурных утолщений (рис. 4b), здесь лишь изредка можно наблюдать неясные разводы (как у O. militaris subsp. stevenii), означающие, возможно, неравномерность толщины клеточной стенки. На таксономическом уровне ниже рода скульптурные утолщения стремительно теряют специфичность, отличить по ним близкие виды не всегда возможно.
Ключ для определения 25 видов орхидей низкогорной зоны Сочинского Причерноморья по семенам представлен ниже. Для использования ключа необходимо иметь образцы семян в количестве не менее нескольких десятков (а лучше сотен), взятых после начала диссеминации, то есть вполне сформированных. Семена заливают 96 % этиловым спиртом либо смесью спирта с глицерином в пропорции 1:1, но возможно вести определение и в воздухе, просто расположив семена на предметном стекле, накрыв покровным или не накрывая. При микроскопировании достаточно светового микроскопа с 100–300-кратным увеличением. Использование портативного микроскопа позволяет вести определение даже в полевых условиях. Однако необходимо иметь возможность измерить семена в поле зрения микроскопа, для этого микроскоп должен быть откалиброван. Относительный размер зародыша (ОРЗ, отношение длины семени к длине зародыша) может быть определён глазомерно либо вычислен по результатам измерений. Обычно для упрощения процедуры определения выбирают наиболее расправленные семена, содержащие максимально развитый зародыш; семена, сильно смятые и искажённые по форме, что определяется их положением внутри плода, как правило, для определения малопригодны. В связи с этим все количественные показатели, используемые в ключе, касаются именно таких, хорошо расправленных, семян. Качественные признаки, разумеется, тоже наиболее отчётливо видны на хорошо оформленных семенах.
В полевых исследованиях иногда есть возможность, в зависимости от степени сохранности найденного образца, предварительно оценить принадлежность его к тому или иному роду. Это касается исследований, которые проводят в период после окончания цветения и до полного отмирания надземной части растений. В таких случаях наиболее ценными наблюдениями будут форма плодов, их взаимное расположение и ориентация на стебле, форма и относительные (к плодам) размеры прицветных листьев, и некоторые другие признаки. В нашем ключе лишь однажды возникла необходимость привлечь ориентацию плодов на стебле, так же, как и цвет семян.
Ключ может оказаться полезным также в редких случаях при затруднениях в определении какого-либо гербарного образца (если сохранились семена).
Ключ для определения орхидей Сочинского Причерноморья по семенам
1 (21) Скульптура поверхности периклинальных стенок клеток семенной оболочки представлена чёткими штрихами, поперечными, продольными или косыми (рис. 1b).
2 (5) Скульптура редкая, от 2–3 до 8 штрихов в одной клетке.
3 (4) Штрихов скульптуры 5–8 в одной клетке (рис. 3a), скульптура есть в каждой клетке; длина семени в среднем 300–500 мкм Spiranthes spiralis
4 (3) Штрихи скульптуры крайне редкие (рис. 3b), по 1–3 в одной клетке; скульптура есть не в каждой клетке; длина семени в среднем 1200 мкм Dactylorhiza urvilleana
5 (2) Скульптура частая, до нескольких десятков штрихов в одной клетке.
6 (7) Форма семени веретеновидная, число клеток оболочки вдоль семени 9–11 Platanthera bifolia
7 (6) Форма семени булавовидная или грушевидная.
8 (13) Антиклинальные стенки халазальной части семени извитые (рис. 2a, 5b).
9 (10) Длина семени в среднем 600 мкм A. morio subsp. caucasica
10 (9) Длина семени в среднем 460 мкм.
11 (12) Относительный размер зародыша (ОРЗ) больше 3. Штрихи скульптуры частые и ровные, расстояния между ними одинаковы и близки к толщине штриха Serapias orientalis subsp. feldwegiana
12 (11) ОРЗ меньше 3, чаще 2. Штрихи скульптуры почти всегда расположены реже, на расстоянии 2–3–5-кратной толщины штрихов друг от друга, штрихи часто изогнуты Anacamptis pyramidalis
13 (8) Антиклинальные стенки халазальной части семени прямые (рис. 3a, 5a).
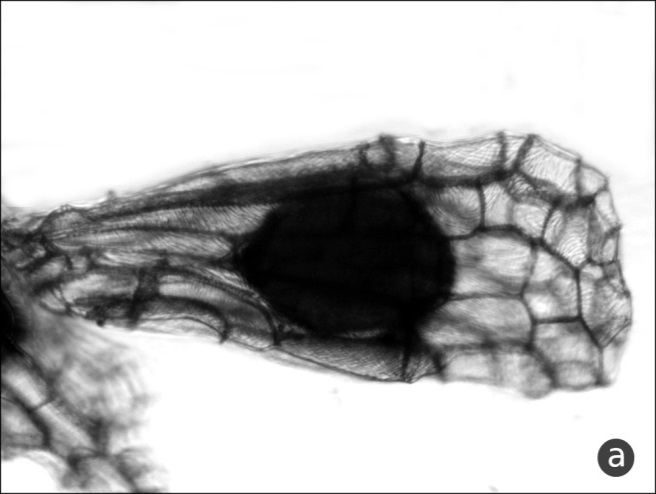
14 (15) ОРЗ равен 2–3. Штрихи скульптуры халазальной части семени большей частью дуговидные, часто разветвляются, образуя вилки (рис. 6a) Neotinea tridentata
15 (14) ОРЗ = 5–8. Штрихи скульптуры халазальной части семени более ровные.
16 (17) ОРЗ = 6–8. Скульптура по бокам медиальной части семени образует просветы-лакуны в числе 6–8 на одной клетке (рис. 6b) Steveniella satyrioides
17 (16) ОРЗ = 5. Просветы-лакуны не выявляются.
18 (19) Халазальная часть семени длиннее микропилярной в большинстве клеток. Число изодиаметрических клеток халазальной части семени – около 6 Ophrys apifera
19 (18) Халазальная часть семени по длине равна микропилярной в большинстве клеток. Число изодиаметрических клеток халазальной части семени – около 10–16.
20 (21) Форма семени чаще грушевидная, длина семени в среднем 450 мкм, число изодиаметрических клеток халазальной части семени – около 16 O. caucasica
21 (20) Форма семени чаще булавовидная, длина семени в среднем 670 мкм, число изодиаметрических клеток халазальной части семени – около 10 O. oestrifera
22 (1) Скульптура поверхности периклинальных стенок клеток семенной оболочки не выражена.
23 (32) Число клеток вдоль семени 5–8. Клетки семенной оболочки контрастные: удлинённые в микропилярной и медиальной областях клеточной оболочки и почти изодиаметрические на халазальном полюсе клетки (рис. 3 a, b).
24 (29) Форма семени чаще булавовидная. Халазальная часть семени равна по ширине микропилярной части.
25 (28) Зародыш окружён желтоватым слоем кутикулы под семенной оболочкой. Граница кутикулы отчётливо видна в халазальной части семени. Антиклинальные стенки клеток халазальной части семени извитые, волнистые.
26 (27) ОРЗ = 2–2,5. Длина семени в среднем 330 мкм O. punctulata
27 (26) ОРЗ = 3–5. Длина семени в среднем 450 мкм O. militaris subsp. stevenii
28 (25) Граница кутикулы вокруг зародыша в халазальной части семени не видна. Волнистость антиклинальных стенок клеток халазальной части семени не выражена Orchis purpurea subsp. caucasica
29 (24) Форма семени чаще грушевидная. Халазальная часть шире микропилярной в 1,5–2 раза.
30 (31) Халазальная часть семенной оболочки заметно длиннее микропилярной. Длина семени в среднем 370 мкм O. mascula
31 (30) Халазальная часть семенной оболочки короче микропилярной. Длина семени в среднем 340 мкм O. provincialis
 |
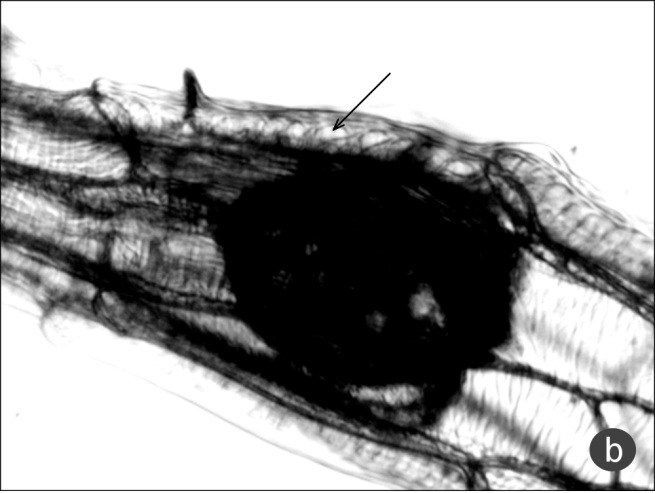 |
Рис. 6. Детали скульптуры периклинальных стенок клеток оболочки
a – дуги и развилки (Neotinea tridentata), b – просветы-лакуны, одна из них показана стрелкой (Steveniella satyrioides).
32 (23) Число клеток вдоль семени 10–30. Клетки семенной оболочки практически все почти изодиаметрические или коротко-прямоугольные (рис. 5 a, b, 6a).
33 (44) Форма семени линейная либо удлинённо-веретеновидная.
34 (39) Форма семени чаще линейная, встречается и веретеновидная. Цвет семян сероватый. Плоды на стебле ориентированы вертикально вверх.
35 (36) ОРЗ больше 6. Число клеток вдоль семени более 30 Cephalanthera longifolia
36 (35) ОРЗ меньше 5. Число клеток вдоль семени 25 и менее.
37 (38) Число клеток вдоль семени 20–25 C. damasonium
38 (37) Число клеток вдоль семени 15–17 C. rubra
39 (34) Форма семени веретеновидная, линейной не бывает. Цвет семян ярко-коричневый. Плоды на стебле поникшие.
40 (41) Длина семени в среднем 1400 мкм. Число клеток вдоль семени 33–40 Epipactis helleborine
41 (40) Длина семени менее 1200 мкм. Число клеток вдоль семени менее 30.
42 (43) ОРЗ = 6. Длина семени в среднем не более 1200. Число клеток вдоль семенной оболочки 20–26 E. leptochila subsp. neglecta
43 (42) ОРЗ = 5. Длина семени в среднем 900 мкм. Число клеток вдоль семенной оболочки обычно 17–30 E. pontica
44 (33) Форма семени баллонообразная либо коротко-булавовидная.
45 (46) ОРЗ = 8. Длина семени более 1000 мкм. Число клеток в длину 30–34 Limodorum abortivum
46 (45) ОРЗ = 4–6. Длина семени менее 800 мкм. Число клеток вдоль семени 8–19.
47 (48) ОРЗ = 4. Число клеток вдоль семени 8–12. Клетки прямоугольные Neottia nidus—avis
48 (47) ОРЗ = 5–6. Число клеток вдоль семени 12–19. Клетки преимущественно неправильной изодиаметрической формы N. ovata
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования микроморфологии семян получен инструмент для изучения распространения орхидей после периода цветения (в случае успешного плодоношения). Вместе с тем, выявлены наиболее ценные для диагностики характеристики строения семян. Прежде всего, это форма семени, его размер, число клеток, составляющих семенную оболочку, их форма в разных областях оболочки, характер смежных антиклинальных стенок клеток и скульптурных утолщений периклинальных стенок. Форма семени бывает удлинённо-веретеновидной, линейной или баллоновидной у семян Limodorum-типа и грушевидной или булавовидной у семян Orchis-типа. Форма клеток одинакова на всей семенной оболочке либо контрастна – удлиненная в микропилярной и медиальной частях и изодиаметрическая на халазальном полюсе. Этот признак также отличает тип семян. Антиклинальные стенки клеток бывают извитыми или ровными, что наблюдается у разных родов. Периклинальные стенки клеток снабжены скульптурными утолщениями разного рисунка либо рисунок может отсутствовать, этот признак устойчиво характеризует разные роды и даже виды. Частые или редкие штрихи скульптуры, преимущественно прямые или изогнутые, образующие лакуны на границах клеток либо нет – эти признаки видоспецифичны.
Определённую ценность имеют относительные размеры семян, в частности, отношение длины семени к длине зародыша (ОРЗ), а также относительные размеры областей семени – микропилярной части, медиальной, где расположен зародыш, и халазальной.
Направленность штрихов скульптуры (вдоль клетки оболочки, поперёк или косо) слишком варьирует даже для семян одной популяции, не считая отличий в разных частях ареала, и потому для диагностики использована быть не может.
Остатки суспензора, как правило, присутствуют в семенах почти всех видов, а вот выступ на верхушке зародыша отмечен только у видов Limodorum-типа, да и то не у всех.
Цвет семян лишь иногда помогает определению. Вид зародыша на просвет, который может быть мелкозернистой структуры или составленным из крупных округлых образований, бывает разным у одного и того же вида.
Ключ полезен в полевых исследованиях при изучении распространения орхидей в период после цветения и до полного рассеивания семян.
Учитывая значимость и полезность характерных признаков строения семенной оболочки и зародыша семени орхидей для выяснения филогенетических связей и для практического применения в диагностике в полевых условиях, мы должны признать необходимость расширения этих аспектов знания об орхидеях.
Благодарности. Автор выражает искреннюю благодарность Максиму Игоревичу Антипину, изготовившему SEM-фотографии семян орхидей, а также Елене Леонидовне Макаровой за помощь в сборе материала.
REFERENCES
Аверьянова Е. А. Морфология семян некоторых видов орхидных (Orchidaceae) Сочинского Причерноморья // Экосистемы. – 2015. – Вып. 4. – С. 52–57.
Аверьянова Е. А. Морфология семян некоторых видов орхидей (Оrchidaceae) Западного Закавказья // Экосистемы. – 2018. – Вып. 16 (46). – С. 87–93.
Аверьянова Е. А. Морфология семян представителей рода Neottia Guett. (Orchidaceae) в Сочинском Причерноморье // Заповедники – 2019: биологическое и ландшафтное разнообразие, охрана и управление. Мат. IX Всеросс. науч.-практич. конф. (Симферополь, 9–11 октября 2019 г.). – Симферополь: ИТ АРИАЛ, 2019. – С. 221–225.
Кириллова И. А. Морфометрический анализ и качество семян орхидных на северной границе распространения // Охрана и культивирование орхидей: матер. Х Междунар. науч.-практич. конф. (Минск, Беларусь, 1–5 июня 2015 г.). – Минск: А. Н. Вараксин, 2015. – С. 84–88.
Красная книга Краснодарского края. Растения и Грибы. III издание / [Отв. ред. С. А. Литвинская]. – Краснодар: адм. Краснодарского края, 2017. – 850 с.
Красная книга Российской Федерации (растения и грибы). – М.: Товарищество научных изданий КМК, 2008. – 855 с.
Куропаткин В. В., Ефимов П. Г. Конспект родов Anacamptis, Neotinea и Orchis s. str. (Orchidaceae) флоры России и сопредельных стран с обзором проблемы подразделения Orchis s. l. на отдельные роды // Ботанический журнал, 2014. – Т. 99, № 5. – С. 555–593.
Свиридов А. В. Типы биодиагностических ключей и их применение. – М.: Зоологический музей МГУ, 1994. – 110 с.
Черепанов С. К. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). – СПб.: Мир и семья–95, 1995. – 992 с.
Шибанова Н. Л., Долгих Я. В. Морфометрическая характеристика семян и реальная семенная продуктивность редких видов орхидных Предуралья // Вестник Пермского университета. Серия Биология. – 2010. – Вып. 2. – С. 4–6.
Широков А. И., Крюков Л. А., Коломейцева Г. Л. Морфометрический анализ семян некоторых видов орхидных Нижегородской области // Вестник ТвГУ. Серия Биология и экология. – 2007. – Вып. 4, № 8 (36). – С. 205–208.
Arditti J., Michaud J. D., Healey P. L. Morphometry of orchid seeds. 2. Native California and related species of Calypso, Cephalanthera, Corallorhiza and Epipactis // American Journal of Botany. – 1980. – Vol. 67. – P. 347–365.
Barthlott W., Große-Veldmann B., Korotkova N. Orchid seed diversity: A scanning electron microscopy survey. – Berlin: Botanic Garden and Botanical Museum Berlin-Dahlem. – Englera 32, 2014. – 245 p.
Bern Convention / Convention de Berne (Appendix/Annexe I), 19.IX.1979.
Chase M. W., Cameron K. M., Freudenstein J.V., Pridgeon A. M., Salazar G., Berg C., Schuiteman A. An updated classification of Orchidaceae // Botanical Journal of the Linnean Society. – 2015. – 177. – P. 151–174.
Clifford H. T., Smith W. K. Seed morphology and classification of Orchidaceae // Phytomorphology. – 1969. – 19. – P. 133–139.
Convention on International Trade in Endagered Species of Wild Fauna and Flora (CITES, Appendix II). – 2006.
Delforge P. Orchids of Europe, North Africa and the Middle East (3rd ed.). – London: A and C Black Publishers Ltd., 2006. – 640 p.
Dressler R. L. Phylogeny and classification of the orchid family. – Portland, Oregon: Dioscorides Press, 1993. – 278 p.
Efimov P. G. Orchids of Russia. Annotated checklist and geografic distribution // Nature Conservation Research. Заповедная наука – 2020. – 5(Suppl.1).
Galán C. P, Seligrat I., Ortúñez E., Gamarra R., Vivar A., Scrugli A. A study of seed micromorphology in the genus Ophrys (Orchidaceae) // Anales del Jardín Botánico de Madrid. – 2014. – 71 (2). – P. 215– 224.
Gamarra R., Ortúñez E., Galán P., Guadaño V. Anacamptis versus Orchis (Orchidaceae): seed micromorphology and its taxonomic significance // Plant Systematics and Evolution. – 2012. – 298 (3) – P. 597–607.
Güler N. Seed micromorphology of Orchis Tourn. ex L. (Orchidaceae) and allied genera growing in Edirne province, Turkey // PhytoKeys. – 2016 – 68. – P. 9–25.
Şeker, Ş., Şenel, G. Comparative seed micromorphology and morphometry of some orchid species (Orchidaceae) belong to the related Anacamptis, Orchis and Neotinea genera // Biologia. – 2017. – Vol. 72, N 1. – P. 14–23.
Swamy K. K, Kumar H. N. K., Ramakrishna T. M., Ramaswamy S. N. Studies on seed morphometry of epiphytic orchids from Western Ghats of Karnataka // Taiwania. – 2004. – 49. – P. 124–40.
Verma J., Sharma K., Thakur K., Sembi J. K., Vij S. P. Study on seed morphometry of some threatened Western Himalayan orchids // Turkish Journal of Botany – 2014. – 38. – P. 234–251.

