THE RESULTS OF THE FUNCTIONAL STATE OF THE MEIOBENTHIC FAUNA RESEARCH IN HIGH-SULFIDE BIOTOPES OF COASTAL LAKES-LAGOONS OF THE KANDALAKSHA BAY (WHITE SEA)
JOURNAL: «EKOSISTEMY», Issue 26, 2021
Publication text (PDF):Download
UDK: 574.5: 574.587:546.221.1(268.46)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Ivanova E. A.1, Krasnova E. D.2, Voronov D. A.3,4, Timofeev V. A.1, Gulin M. B.1
1 A. O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
2 Lomonosov Moscow State University, Moscow, Russia
3Institute for Information Transmission Problems of the Russian Academy of Sciences (Kharkevich Institute), Moscow, Russia
4 A. N. Belozersky Research Institute of Physico-Chemical Biology Lomonosov Moscow State University, Moscow, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-26-43-50
PAGES: from 43 to 50
STATUS: Published
LANGUAGE: Russian
KEYWORDS: meiobenthos, hypoxia, hydrogen sulfide contamination, proportion of living and dead organisms, meromictic lagoons, White Sea.
ABSTRACT (ENGLISH):
The article presents the results of the studies of physiological state of meiofauna taken from the bottom sediments of two meromictic lakes which had different stages of geological isolation from the White Sea. It was concluded that active living benthic organisms of these high-sulfide biotopes could penetrate no deeper than the upper boundary of the hemocline. Organisms living at the depth of the upper redox-chemocline boundary (nematodes, chironomids and oligochaetes) in the lakes-lagoons of the Kandalaksha Bay (White sea) have high locomotor activity characteristics. Nematodes and rotifers were found on the lower edge of the chemocline, but they were motionless and did not show signs of active life. Therefore, they, with a high degree of probability, could be attributed to the dead component of the community. No meiobenthos was found in the anoxic zone at the bottom of the sulfide lake at a depth of 7.5 m. Finding abundant motionless benthic ciliates, belonging to the family Tintinnidae at the upper edge of the chemocline of Lake Trekhtsvetnoe does not allow researchers to make unambiguous conclusion about their physiological state. The main factor limiting the penetration of zoobenthic oxybionts into the redox zone of the studied meromictic White Sea lagoons is obviously the combined effect of deficiency of dissolved oxygen with simultaneous contamination of the aquatic environment and benthal with hydrogen sulfide. On the contrary, the positive properties of this habitat can be attributed to the high content of potential food resources (biomass of photo-and chemolithotrophic microorganisms), and, probably, the previously observed layer of the chemocline with an increased temperature. It is noteworthy that the latter phenomenon, which is observed in most of the stratified lakes-lagoons of the polar region, is most developed in the winter period.
ВВЕДЕНИЕ
Исследования возможности выживания бентосных гидробионтов в донной среде с критическими условиями существования – острой гипоксией и сероводородным заражением – активно обсуждаются в научных публикациях в последние годы (Заика, Сергеева, 2009; Гулин, 2012; Иванова, 2017; Стунжас, 2019). Примерами таких экстремальных местообитаний могут служить и сульфидные биотопы донных осадков беломорских меромиктических озёр-лагун, «отшнуровывающихся» от данного водоёма в связи с поднятием его берегов в Голоцене (Краснова и др., 2016).
Ключевым параметром исследуемых прибрежных местообитаний является значительное сероводородное заражение донной среды, происходящие в процессе бактериальной сульфатредукции в совокупности с выраженной плотностной стратификацией водной толщи. Следствием наличия высокой концентрации сероводорода в осадках является острая гипоксия среды в редокс-зоне, переходящая с глубиной в аноксию.
На побережье Белого моря из-за постгляциального поднятия берега возникло множество прибрежных озер-лагун, в разной степени изолированных от моря. На данный момент их известно уже более двадцати. В зависимости от стадии изоляции водообмен морской воды происходит с разной периодичностью и с интенсивностью. Данная работа касается двух водоемов, которые в типологическом ряду отделяющихся от Белого моря водоемов находятся на его разных полюсах.
Проблема исследования биоразнообразия донной фауны экстремальных местообитаний заключается в корректности оценки численности реально обитающих в них, функционально активных организмов. Причиной подобных расхождений служат, прежде всего, методические ограничения. Так, при работе с фиксированными пробами практически невозможно определить долю живой и мёртвой компоненты в сообществе. И зачастую отмершие тела учитываются как живые, тем самым завышая реальную численность мейобентоса.
Достаточно простым способом определения физиологического состояния фауны признаётся визуальное наблюдение нефиксированных проб методом прямого микроскопирования (Giere, 2009; Мокиевский, 2009). Такой избирательный учёт активного зообентоса в пробах позволяет избежать завышенных оценок численности из-за добавления в общий счёт и мёртвых тел, и давать точную оценку плотности поселений животных.
Целью данной работы является определение доли активной живой компоненты сообществ мелких (длиной до 1 мм) донных животных из осадков сульфидных биотопов отшнуровывающихся озёр-лагун Белого моря с помощью серии визуальных наблюдений физиологического состояния мейобентоса методом прямого микроскопирования.
МАТЕРИАЛ И МЕТОДЫ
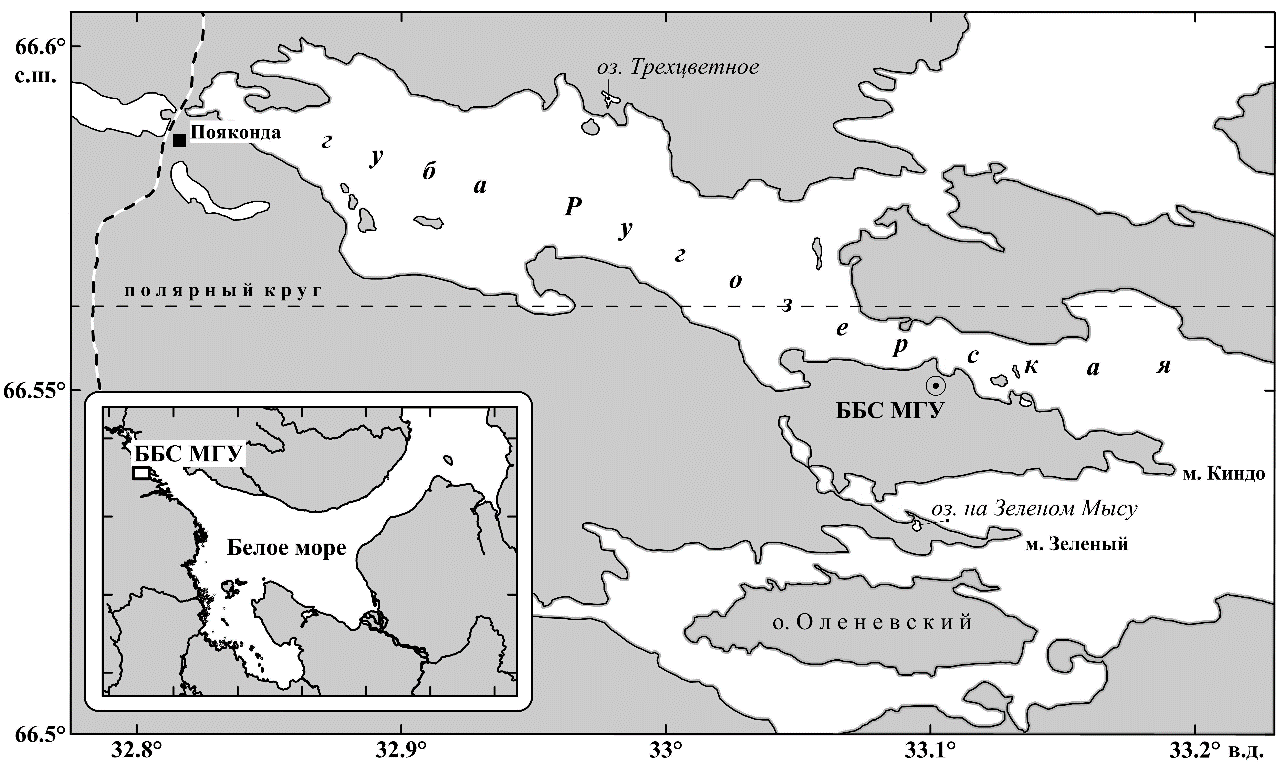
Сборы нефиксированных «живых» проб донных грунтов проводились в озёрах-лагунах – озере Трёхцветное и озере на мысе Зелёный в Кандалакшском заливе Белого моря, Карельский берег (рис. 1) в сентябре 2018 и марте 2019 годов.
Рис. 1. Район исследований в Кандалакшском заливе Белого моря
Озеро на мысе Зеленый (66°31′49″N, 33°05′42″E) представляет раннюю стадию изоляции (Краснова и др., 2015): уровень воды в ней находится между уровнями полной и малой воды в море. Из-за этого в лагуну в каждом приливном цикле поступает некоторое количество морской воды, но приливной цикл асимметричный – с коротким приливом и долгим отливом. В поверхностном слое, который свободно обменивается водой с морем, соленость воды такая же, как на прилегающей морской акватории. В придонном слое, из-за рассола, который образуется при каждом ледоставе, затем опускается на дно и сохраняется в ковше лагуны, соленость на несколько единиц выше. Различия в солености поверхностного и придонных слоев достаточны для возникновения плотностной стратификации, которая сохраняется в течение всего года.
Озеро Трёхцветное (66°35′31″N, 32°58′40″E), напротив, представляет продвинутую стадию изоляции: его уровень поднят над уровнем моря настолько, что водоем больше не подвержен приливным явлениям. Поверхностный 1,5 м слой воды пресный, но в ковше озера хранится реликтовая морская вода, сохранившаяся со времен, когда озеро было морским заливом. Из-за различий в плотности этих слоев в озере Трёхцветном сформировалась устойчивая меромиксия (Краснова, 2017; Savvichev et al., 2018). В обоих водоемах есть хемоклин, разделяющий аэробную и анаэробную зоны. В озере Трехцветном он практически совпадает с галоклином. В озере на мысе Зеленый хемоклин располагается на 2–3 м ниже галоклина, и промежуток между хемоклином и галоклином заполнен соленой водой с аэробными условиями, изолированной от атмосферы, благодаря чему в летнее время там может накапливаться кислород, выработанный фитопланктоном в ходе фотосинтеза и достигать 200 % насыщения. В этом соленом высокоаэрированном слое иногда наблюдается погруженный максимум температуры, который благоприятствует развитию аэробной биоты (Краснова, Воронов, 2019а; Краснова, Воронов, 2019б).
Работы проводились с использованием малогабаритных плавсредств – вёсельной лодки и одноместного плотика. Позиционирование выполняли с привязкой к глубине дна по эхолоту Garmin Fishfinder 140. Отбор проб грунта произведен с помощью дночерпателя Экмана-Берджи с квадратным сечением корпуса (площадь захвата 15×15 см), из которого поршневой пластиковой трубкой диаметром 40 мм брали образец грунта с неповреждённой стратификацией. Толщина взятого слоя грунта составляла в 2018 году 0–1 см, в 2019 – 0–0,5 см. Навеска просматривалась целиком под микроскопом в камере Богорова. Подробно методика наблюдений описана в работе (Иванова, 2017).
Измерения концентрации растворённого кислорода и температуры в водной толще и непосредственно на границе «вода – донные осадки» осуществляли in situ с применением оксиметра HQ40d (Hach, США), снабжённого погружным блоком сенсоров на кабель-тросе – оптодом оксиметра и термистором, и оптическим оксиметром YSI ProODO (США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Концентрация кислорода и другие параметры среды (окислительно-восстановительный потенциал (ОВП), солёность). Результаты измерения физико-химических параметров среды представлены в таблице 1. Помимо значений, полученных нами, приведены среднемноголетние, а также минимальные и максимальные данные для этих горизонтов по результатам многолетнего мониторинга, (Krasnova et al., 2015; Lunina et al., 2019), что позволяет охарактеризовать степень постоянства или динамичности условий обитания организмов. Анализ архивных данных необходим для полной картины пространственного распределения бентоса по глубине, поскольку экстремобионтная фауна зачастую способна пережидать кратковременную аноксию.
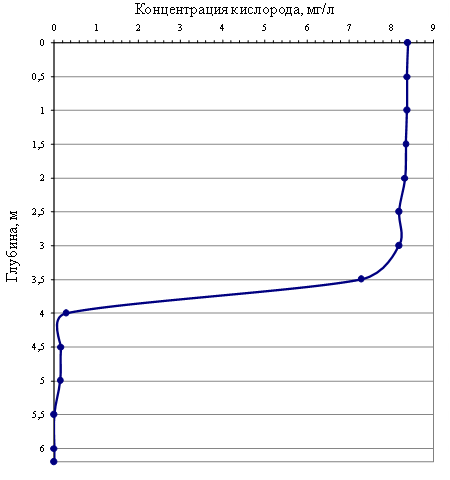
На графике (рис. 2) представлены результаты наших измерений концентрации кислорода на озере Зелёный мыс. По данным многолетнего мониторинга (2012–2019 гг.) расположение редокс-хемоклина в озере Трёхцветное, в течение годового цикла на протяжении всего периода исследований, фиксировалась на глубине 2,0 м, тогда как в аналогичном стратифицированном озере на мысе Зелёный редокс-хемоклин находился существенно глубже (в интервале 3,5–5,5 м) и его местоположение изменялось в разные
Таблица 1
Физико-химические параметры придонного слоя воды (концентрация кислорода, окислительно-восстановительный потенциал (ОВП) и солёность)
| Параметр | Озеро Трёхцветное | Озеро на мысе Зелёный | |||
| Глубина и время взятия проб | |||||
| 1,5 м
март 2019 |
2 м
сентябрь 2018 |
7,5 м
сентябрь 2018 |
4,5 м
март 2019 |
||
| Кислород, мг/л | При отборе проб
Min. / Ср./ Max. |
0,34
0 / 6,4 / 28 |
0,29
0 / 0,19 / 3.6 |
0,00
0 / 0 / 0 |
0,00
0 / 4 / 14 |
| ОВП, мВ | При отборе проб
Min. /Ср./ Max. |
+250
-352/+124/+284 |
-177
-351/-263/+13 |
-377
-422/-388/-314 |
-289
-283/32/+234 |
| Солёность, ‰ | При отборе проб
Min. /Ср./ Max. |
0,4
0/3/14 |
4,2
2/10/17 |
21,9
19,7/22,0/22,7 |
27,5
26,4/28/29,0 |
Примечание к таблице. Над чертой (выделены жирным) представлены собственные данные; под чертой – среднемноголетние и экстремальные значение за период с лета 2012 по март 2019 года по (Krasnova et al., 2015; Lunina et al., 2019).
сезоны (Krasnova et al., 2015; Lunina et al., 2019), что согласуется с полученными нами результатами (табл. 1).
Соленость воды в озере Трехцветное (по данным 2012–2019 гг.) в слое воды до глубины 1,5 м постепенно уменьшалась (от 14 единиц до нуля). Вода на этом горизонте обычно аэрирована, заморные условия были зарегистрированы только в самом начале наблюдений в 2012 году. После экстремального заброса воды из моря, вызванного необычно высококим подъемом после ветрового нагона, в этот период произошло частичное перемешивание озера, из-за чего сероводород из нижних слоев попал в поверхностную воду, а хемоклин на некоторое время поднялся до уровня 1 м. Такое нарушение стратификации, привело к тому, что на следующий год на этой глубине возник солоноватый слой с массовым развитием фитопланктона, который насытил воду кислородом до 261 % насыщения, что соответствовало 28 мг/л. В последующий период исследований с горизонта 1,5 м условия стали аэробными, а с 2 м начиналась анаэробная зона. Глубина 7,5 м (максимальная в этом водоеме) характеризовалась, как зона с постоянными анаэробными условиями, самой высокой соленостью (близкой к солености в море) и резко отрицательным ОВП (Krasnova et al., 2015; Lunina et al., 2019).
В озере на мысе Зеленый положение хемоклина нестабильно, и на глубину 4,5 м может приходиться как аэробная, так и анаэробная его часть, а ОВП варьирует в пределах 0,5 V от –283 до +234 mV, но чаще он отрицательный. Соленость здесь всегда высокая и превышает таковую на соседних морских акваториях из-за концентрирования рассола, который образуется при формировании льда (Krasnova et al., 2015; Lunina et al., 2019). Полученные нами результаты по концентрации кислорода, солености воды и значениям окислительно-восстановительного потенциала укладываются в диапазон описанных архивных данных (табл. 1).
Мейобентос. Результаты полевых экспериментов по изучению физиологического состояния бентосной мейофауны в исследованных меромиктических лагунах Белого моря представлены в таблице 2.
В наиболее глубоком месте озера Трёхцветное (7,5 м), где концентрация сероводорода достигает максимальных значений (Losyuk, Kokryatskaya, Krasnova, 2015), в пробах грунта ни живых, ни неподвижных или разложившихся организмов обнаружено не было. На нижней границе хемоклина озера Трёхцветное, на изобате 2 м живой мейобентос также отсутствовал, однако здесь были найдены неподвижные нематоды и коловратки. Напротив, у верхней кромки хемоклина озёр Трёхцветное и Зелёный мыс численность активного живого мейобентоса достигала 20 – 25 % от общего числа обнаруженных организмов. Все активные формы были представлены Metazoa: Nematoda, Chironomida, Oligochaeta.
Рис. 2. Вертикальный профиль концентрации кислорода в озере на мысе Зелёный (сентябрь 2018 г.)
На глубине 1,5 м озера Трёхцветное большинство неподвижных форм составляли одноклеточные организмы – преимущественно Ciliophora. Однако определить физиологическое состояние бентосных инфузорий, большинство из которых здесь представлено семейством Tintinnidae, оказалось затруднительно. Известно, что инфузории этого семейства находятся в известковой раковине и увидеть признаки их активного движения сложно. Несмотря на это, хорошая сохранность раковин, так же как и их обилие, может косвенно указывать на массовое присутствие бентосных цилиат в пределах хемоклина (на глубине 1,5–2 м) озера Трёхцветное.
Другие неподвижные Metazoa, довольно разнообразно представленные в пробах, не проявляли двигательной активности, не реагировали на прикосновение препаровальной иглы или на свет и, с большой долей вероятности, могут быть отнесены к мёртвым организмам.
В озере на мысе Зеленый на глубине 4,5 м, где в марте 2019 года начиналась анаэробная зона, мейобентос был очень беден. В поверхностном слое осадка обнаружено всего несколько особей брюхоногих моллюсков, ракушковых рачков и инфузорий, все они были неподвижны. Живыми были только нематоды, которых в пробе тоже было очень мало.
Таблица 2
Визуальные наблюдения мейофауны в пробах сульфидных осадков меромиктических озёр-лагун Белого моря (численность, экз./100 см2)
| Название озера, глубина и время взятия проб | |||||||||
| Озеро Трехцветное | Озеронамысе Зеленый | ||||||||
| 1,5 ммарт 2019 | 2 мсентябрь 2018 | 7,5 мсентябрь 2018 | 4,5 ммарт 2019 | ||||||
| Слой | Таксон | Ж | Н | Ж | Н | Ж | Н | Ж | Н |
| 0,0–0,5 см | |||||||||
| Bivalvia(juvenile) | 0 | 112 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Ciliata | 0 | 1448 | 0 | 0 | 0 | 0 | 0 | 8 | |
| Chironomida | 8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Gastropoda | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 8 | |
| Nematoda | 304 | 0 | 0 | 0 | 0 | 0 | 8 | 0 | |
| Oligochaeta | 72 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Ostracoda | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 8 | |
| 0–1,0 см | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Bivalvia juv. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Ciliata | 0 | 0 | 0 | 8 | 0 | 0 | 0 | 0 | |
| Срironomida | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Nematoda | 0 | 0 | 0 | 24 | 0 | 0 | 0 | 0 | |
| Oligochaeta | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Rotatoria | 0 | 0 | 0 | 8 | 0 | 0 | 0 | 0 | |
| Всего, экз./0,01м2 | 384 | 1560 | 0 | 40 | 0 | 0 | 8 | 24 | |
| Всего, % | 20 | 80 | 0 | 100 | 0 | 0 | 25 | 75 | |
Примечание к таблице: Ж – живые, активно движущиеся организмы; Н – неподвижные организмы/
ЗАКЛЮЧЕНИЕ
Таким образом, в сульфидных осадках двух меромиктических водоемов, частично изолированных от Белого моря, у верхней границы хемоклина (озеро Трёхцветное – 1,5 м, озеро на мысе Зелёный – 4,5 м) все обнаруженные в пробах нематоды, хирономиды и олигохеты находились в активно-подвижном состоянии. Вместе с тем, у нижней кромки хемоклина (озеро Трёхцветное – 2 м) все обнаруженные нематоды и коловратки были неподвижны и не проявляли признаков активной жизнедеятельности, что с большой вероятностью, позволяет их отнести к мёртвой компоненте сообщества. На дне озера Трёхцветное на глубине 7,5 м в условиях аноксии мейобентос не обнаружен.
Массовое обнаружение неподвижных бентосных инфузорий у верхней кромки хемоклина озера Трёхцветное не позволяет однозначно заключить об их физиологическом состоянии.
Поскольку озёра-лагуны являются экотопом с высокоградиентными пространственно-временными условиями, агрессивными для обитающих там гидробионтов, активные живые бентосные организмы способны проникать не глубже верхней границы хемоклина.
Основным лимитирующим фактором, ограничивающими проникновение оксибионтного зообентоса в редокс-зону изученных меромиктических беломорских лагун, является, очевидно, наблюдаемое здесь сочетанное действие острого дефицита растворённого кислорода с одновременным сероводородным заражением водной среды и бентали. С другой стороны, наоборот, к позитивным свойствам данного местообитания можно отнести высокое содержание потенциальных пищевых ресурсов (биомасса фото- и хемолитотрофных микроорганизмов), а также, возможно, наблюдаемый ранее в хемоклине слой с повышенной температурой среды. Примечательно, что последний феномен, отмечаемый в большинстве стратифицированных озёр-лагун Заполярья, наиболее развит именно в зимний период.
Благодарности. Авторы глубоко признательны В. П. Чекалову (ИнБЮМ, Севастополь) за помощь при проведении полевых работ, а также администрации и штату Беломорской биологической станции МГУ им. М. В. Ломоносова за возможность проведения полевых работ на ее базе.
Исследование проведено по теме государственного задания ФИЦ ИнБЮМ «Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом», номер государственной регистрации НИОКТР АААА-А18-118021490093-4, а также поддержаны РФФИ (грант 19-05-00377).
REFERENCES
Гулин М. Б. К изучению роли гипоксии и аноксии в жизни морских эукариот // Морской экологический журнал. – 2012. – Т. 11, Вып. 1. – С. 1–11.
Гулин М. Б. Батиметрическое распределение живых активных форм зообентоса в хемоклине Чёрного моря // Морской экологический журнал. – 2013. – Т. 12, Вып. 1. – С. 5–17.
Заика, В. Е., Сергеева, Н. Г. Вертикальное распределение глубоководных инфузорий в Чёрном море // Морской экологический журнал. – 2009. – Т. 8, Вып. 1. – С. 32–36.
Иванова Е. А. Экология мейобентоса метановых сипов Чёрного моря: фаунистические характеристики и результаты наблюдений физиологического состояния методом прямого микроскопирования // Экосистемы. – 2017. – Вып. 10. – С. 28–34.
Краснова Е. Д., Воронов Д. А., Демиденко Н. А., Кокрятская Н. М., Пантюлин А. Н., Рогатых Т. А., Самсонов Т. Е., Фролова Н. Л. К инвентаризации реликтовых водоемов, отделяющихся от Белого моря // Комплексные исследования Бабьего моря, полузолированной беломорской лагуны: геология, гидрология, биота – изменения на фоне трансгрессии берегов // Труды Беломорской биостанции МГУ. – 2016. – Т. 12. – С. 211–241.
Краснова Е. Д., Воронов Д. А. Заглубленный максимум температуры в озерах с устойчивой стратификацией на побережье Белого моря // Трешниковские чтения – 2019: Современная географическая картина мира и технологии географического образования: Материалы Всероссийкой научно-практической конференции с международным участием. – Ульяновск: УлГПУ им. И. Н. Ульянова, 2019а. – С. 145–148.
Краснова Е. Д., Воронов Д. А. Как формируется заглубленный максимум температуры в беломорских меромиктических водоёмах? // Геология морей и океанов: Материалы XXIII Международной научной конференции (Школы) по морской геологии. Т. 3. – Москва: ИОРАН, 2019б. – С. 160–164.
Краснова Е. Д. Водоемы, отделяющиеся от моря: разнообразие и типовая структура // Изучение, рациональное использование и охрана природных ресурсов Белого моря. – Санкт-Петербург: Зоологический институт РАН, 2017. – С. 115–118.
Краснова Е. Д., Воронов Д. А., Мардашова М. В., Пантюлин А. Н., Фролова Н. Л. Многолетняя изменчивость физико-химических параметров в частично изолированной лагуне на Зеленом мысу (Карельский берег Белого моря) // Сборник тезисов IV Международной научно-практической конференции Морские исследования и образование: MARESEDU-2015. – Москва, 2015. – С. 451–454.
Мокиевский В. О. Экология морского мейобентоса. – М.: Т-во научных изданий КМК, 2009. – 286 с.
Стунжас П. А., Гулин М. Б., Зацепин А. Г., Иванова Е. А. О возможности присутствия кислорода в верхнем слое осадков сероводородной зоны Черного моря // Океанология. – 2019. – Т. 59, № 1. – С. 166–169. DOI: 10.31857/S0030-1574591166-169
Giere O. Meiobenthology – the Microscopic Motile Fauna of Aquatic Sediments, 2nd ed. – Berlin, Heidelberg: Springer – Verlag, 2009. – 527 p.
Krasnova E. D., Kharcheva A. V., Milyutina I. A., Voronov D. A., Patsaeva S. V. Study of microbial communities in redox zone of meromictic lakes isolated from the White Sea using spectral and molecular methods // Journal of the Marine Biological Association of the United Kingdom. – 2015. – Vol. 95, N 8. – P. 1579–1590. DOI:10.1017/S0025315415000582
Losyuk G., Kokryatskaya N., Krasnova E. Formation of hydrogen sulfide in isolated basins at the Karelian of the White Sea coast // EARSeL eProceedings. – 2015. – Vol. 14. – P. 49–54. DOI: 10.12760/02-2015-1-07
Lunina O. N., Savvichev A. S., Babenko V. V., Boldyreva D. I., Kuznetsov B. B., Kolganova T. V., Krasnova E. D., Kokryatskaya N. M., Veslopolova E. F., Voronov D. A., Demidenko N. A., Letarova M. A., Letarov A. V., Gorlenko V. M. Seasonal variations in the structure of an anoxygenic phototrophic bacterial community from the meromictic lake Trekhtsvetnoe (Kandalaksha Bay, White Sea) // Microbiology. – 2019. – Vol. 88, N 1. – P. 100–114. DOI: 10.1134/S002626171901004
Savvichev A. S., Babenko V. V., Lunina O. N., Letarova M. A., Boldyreva D. I., Veslopolova E. F., Demidenko N. A., Kokryatskaya N. M., Krasnova E. D., Gaisin V. A., Kostryukova E. S., Gorlenko V. M., Letarov A. V. Sharp water column stratification with an extremely dense microbial population in a small meromictic lake, Trekhtzvetnoe // Environmental Microbiology. – 2018. – Vol. 20, Iss. 10. – P. 3784–3797. DOI: 10.1111/1462-2920.1438
Savvichev A. S., Babenko V. V., Lunina O. N., Letarova M. A., Boldyreva D. I., Veslopolova E. F., Demidenko N. A., Kokryatskaya N. M., Krasnova E. D., Gaisin V. A., Kostryukova E. S., Gorlenko V. M., and Letarov A. V. Sharp water column stratification with an extremely dense microbial population in a small meromictic lake, Trekhtzvetnoe // Environmental Microbiology. – 2018. – Vol. 20, Iss. 10. – P. – 3784–3797. DOI: 10.1111/1462-2920.14384