MORPHOSTRUCTURE OF THE FIELD MOUSE THYROID GLAND IN NORMAL STATE IN THE CONDITIONS OF FOREST-STEPPE NEAR KRASNOYARSK
JOURNAL: «EKOSISTEMY», Issue 26, 2021
Publication text (PDF):Download
UDK: 591.444:599.32(292.511.6)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Lyuto A. A., Shishikin A. S.
V.N. Sukachev Institute of Forest SB RAS, Krasnoyarsk, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-26-106-115
PAGES: from 106 to 115
STATUS: Published
LANGUAGE: Russian
KEYWORDS: field mouse, thyroid gland, morphology, thyroid gland structure, bioindication criteria.
ABSTRACT (ENGLISH):
The regional research of the zonal undisturbed (normal) morphology of the thyroid gland of young field mice was carried out in the conditions of forest-steppe near Krasnoyarsk. The most important indicators of the thyroid gland are identified: macroscopically, the width of each lobe is 2-2. 7 mm, the length is 1.5-2 mm, the height is 1-2 mm. The width of the isthmus is 1.5-2 mm. The color of the gland ranges from red to dark red and it clearly contrasts with the background of the larynx and thyroid cartilage. The thyroid and parathyroid glands are a single organocomplex. The specific features of the structure of the thyroid gland of field mice are the small size of the organ, a thin capsule, the presence of internal accessory parathyroid glands, a compactly organized parenchyma, and a moderately developed vascular network. The stroma of the gland is relatively poorly developed, it contains a thin network of reticular cells, a small number of macrophages. The epithelium of large follicles has a prismatic shape, although middle size follicles have cubic shaped epithelium. The height of thyrocytes is 6.83 microns, the mean area of follicles is 467.9 microns; Brown index is 9.7; follicular-colloid index is 3.72; the sclerosis index is 0.81. The field mouse, due to its ecological and morphological features, is a valuable object of bioindication for assessment of the state of background and anthropogenic landscape in the conditions of the Krasnoyarsk forest-steppe. The size of the gland (taking into account age of a mouse), the Brown index, as well as the height and shape of thyrocytes (follicular epithelium) are significant bioindication criteria to assess the changes in the case of technogenic exposure influenced by pollutants.
ВВЕДЕНИЕ
В литературе крайне мало внимания уделено морфологическим особенностям внутренних органов мыши полевой и их показателям патологического анализа для биоиндикации. Отсутствуют многие важные данные о морфологической структуре щитовидной железы, которая может использоваться для экологической оценки биотопов в различных экосистемах.
Мышь полевая (Apodemus agrarius, Pallas, 1771), как вид, широко распространена (Карасева и др., 2008), и проявляет факультативную синантропию, а если точнее, то, географически ограниченную синантропию (Кучерюк, 2016).
По данным В. С. Громова, мышь полевая обладает высокой подвижностью и довольно большим индивидуальным участком (0,16–0,18 га) (Громов 1995, 2008), при этом тяготеет к агро- и антропоценозам: крупнотравным участкам среди полей, пустырям, полям (Карасева, Телицына, Жигальский, 2008).
Техногенный биотоп КрАЗа и его СЗЗ (55 лет работы) являются уникальными по своей структуре и населению ММ для лесостепной территории Центральной Сибири. Уникальность их состоит в постоянном выбросе поллютантов металлургического производства алюминия. В СЗЗ (за забором) при грубом выравнивании горной породы проходят ранние стадий сукцессии лугового биотопа. За период наблюдений с 2017 по 2019 год на техногенной площадке непосредственно вблизи завода отловлен только один синантропный вид мелких млекопитающих, мышь полевая.
Наличие единственного вида около КрАЗа определило его статус маркерного, и вызвало необходимость определить критерии нормальной морфологии внутренних органов эталона отловленных зверьков на фоновом биотопе (агроценозе).
Любой биологический объект экосистемы способный активно реагировать на её изменение и обитающих в достаточном количестве можно использовать как маркерный биоиндикатор. Щитовидная железа как один из важнейших органов внутренней секреции особенно подвержена влиянию поступления химических поллютантов и особенностям техногенных и географических биогеохимических провинций (Рустембекова, 2011). Большинство организмов, заселяющих агрессивные биогеохимические провинции адаптируют к ним свой метаболизм с учетом специфической пропорции химических элементов (Сазонов, 2012). Диспропорция этих элементов в прочих равных условиях может вызвать патологию или гибель животных. Адаптационные показатели и возможности вида в условиях экстремального обитания представляют большой научный интерес.
Воздействие химических поллютантов в газопылевых выбросах КрАЗа на эндокринную систему определило главным объектом научных исследований щитовидную железу. Она отвечает за выработку йодсодержащих гормонов, регулирующих катаболизм (процессы расщепления сложных соединений) и многие физиологические параметры (артериальное давление, пульс, дыхание, температуру). Паращитовидная железа выделяет паратгормон, регулирующий, в свою очередь, работу щитовидной железы, поскольку обе железы представляют собой единый органо-комплекс, то мы дали краткую характеристику на обе этих железы.
Целью проведенных исследований было определение параметров ненарушенной (нормальной) структуры щитовидной железы мыши полевой, и формирование биоиндикационных критериев для оценки изменений в условиях техногенного воздействия.
МАТЕРИАЛЫ И МЕТОДЫ
Эврибионтность мыши полевой позволяет выбрать исследовательскую площадку практически в любом объекте мониторинга, но наилучшим биотопом для этой цели будет пустырь либо агроценноз. Оптимальным периодом отлова следует считать август-сентябрь как момент наибольшей годовой численности сеголеток. Предпочтительны для анализа именно сеголетки, так как они обладают примерно одинаковым возрастом, связанным с сезонностью размножения, выработкой адаптивной реакции на специфику обитания, осенний отлов не оказывает существенного влияния на последующую структуру популяции и ее воспроизводственные возможности. В то время как перезимовавшие взрослые особи могут обладать органопатологиями вызванными, помимо воздействия поллютантов, иными причинами (возраст, паразиты, инфекции, внешние неблагоприятные условия по кормам и зимовке), ранний отлов перезимовавших особей может спровоцировать депрессию численности.
Комплексный (почва, растительность, животные) мониторинг Красноярского алюминиевого завода (КрАЗ работает с 1964) организован в 2016 году по трансекте загрязнения юг – север. По рельефу и господствующему ветру преобладает восточное направление переноса поллютантов. Наиболее загрязненный участок расположен непосредственно около забора завода с максимальной пылевой нагрузкой. Эта территория подверглась грубой планировке горной породы и в настоящее время заросла бурьянистой растительностью с преобладанием полыни (Artemisia vulgaris Linnaeus, 1753), которая находится на стадии формирования куртин злаков. Для сравнения, на горных отвалах Бородинского угольного разреза смена бурьянистой стадия на злаковую занимает 3–5 лет. Единично произрастает вяз перисто-ветвистый (Ulmus pinnato-ramosa Dieck, 1890), что указывает на возможность формирования зеленых насаждений импактной зоны. Мелкие млекопитающие в условиях сильной запыленности испытывают недостаток воды. В поставленные 5-ти литровые бутылки (3 шт.) для сбора жидких осадков и выпадающих летом поллютантов, несмотря на значительную высоту относительно поверхности почвы (10 см), залезло 5 взрослых полевых мышей.
Второй участок расположен на удалении 1 км от завода на территории снесенного (в 2003) поселка «Индустриальный». Для него характерна аллейная посадка тополей и селитебный почвогрунтовый покров без нанесения плодородного слоя почвы.
Третий (фоновый) участок удален на 3 км и не испытывает воздействия поллютантов КрАЗа. Он расположен в овраге и окружен сельхозугодьями различного назначения. В связи со смывом почвы в понижения, формируются смешанное высокотравье и березовые колки с шиповником (Rosa sp.), характерные для Красноярской лесостепи.
Все три мониторинговых участка объединяются по доминированию травянистой растительности и снижению градиента загрязнения КрАЗом.
Отловы проводили стандартным методом, который используется на других объектах мониторинга (давилками, установленными по схеме 10×10 м в четыре ряда с приманкой из кедрового ореха, выдержанного в не рафинированном подсолнечном масле). В каждом сезоне было установлено 40 ловушек на 3 дня, ежегодно отрабатывалось 120 и средний улов на 100 ловушко-суток, за 2019 год на исследуемом фоновом биотопе составил 12,5 особей, 2018 – 15,0, 2017 – 3,3 и 2016 – 16,6. Наблюдается определенная динамика численности с депрессией в 2017 году, что характерно для большинства мониторинговых объектов от вырубок средней тайги до отвалов Бородинского угольного разреза Канской лесостепи и определяется общими погодными условиями.
В качестве основной гипотезы использовалось морфологическое изменение щитовидной железы в результате воздействия выбросов КрАЗа. За счет активности мыши полевой в вечернее время, проверку ловушек можно проводить раз в сутки (утро), структура органа при этом не изменяется и позволяет исследовать орган без наличия посмертных артефактов. Особенности анатомии исследуемой железы исключают повреждение дужкой давилки, поэтому все отловленные особи подвергались морфологическому анализу. Для анатомо-морфологических исследований, проведено вскрытие, осмотр внутренних органов и взяты пробы для гистологических исследований. Изначально, при поисковых исследованиях для анализа физиологической активности зверьков брали печень и селезенку, а также другие органы (сердце, легкие, почки), но эти данные, ввиду специфики темы и большого объема, не вошли в представленную работу.
Гистологические исследования проводили согласно общепринятых методик (Коржевский, Гиляров 2010). Микроскопию срезов проводили на тринокулярном микроскопе МикМед-6 с насадкой для микрофотографий. Микрофотосъемку и анализ микрофотографий выполняли на фотоаппарате Canon EOS 1100D в программе Altami Studio 3.4. Для математической и статистической обработки использовали программу Statistika 6.0 и пакет программ MS Office. Калибровку оптической части микроскопа и аналитической части программы проводили после фотосъемки объекта микрометра проходящего света ОМП Гост 7513-75. Всего подготовлено 28 проб от зверьков, отловленных в 2018–2019 годах, и изготовлено более 120 микропрепаратов щитовидной железы полевой мыши.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Особенностью исследуемого биотопа (N56°07´31,22 E93°01´20,42) является то, что сам этот биотоп не является естественным с точки зрения геологии, структуры почв, водного баланса растительности и многих других факторов. Это агроценноз представляющий из себя обширное поле с островками леса в 3 километрах к северо–востоку от Красноярского Алюминиевого завода таким образом исключающий газо–пылевое загрязнение городским смогом и инверсию ветровых выбросов труб КраМЗ. За счет отсутствия выраженного техногенного загрязнения, для дальнейших исследований он будет принят как фоновый. Островки леса в западинах и оврагах, а также вблизи линий ЛЭП, представляющие собой стации переживания для многочисленных видов мелких млекопитающих. Биоразнообразие таких стаций в сравнении с другими, рядом расположенными площадками высокое, индексы видового богатства Маргалеха составляют от 0,69(2018) до 1,67(2016), Менхиника от 0,71 (2018) до 1,34 (2016), индексы Уиттекера за период с 2017 по 2019 год менялись от 1,07 до 3,05. Для таких видов стаций характерен смешанный состав, включающий как лесные, луговые так и городские синантропные виды животных и птиц. За счет того, что на небольшой площади пересекаются поле, высокотравный луг и крупнотравный березняк, складываются уникальные условия для укрытия и кормовой базы мышевидных грызунов, и многих других животных и птиц.
В уловах исследованной площадки в составе мелких млекопитающих встречали хомяка обыкновенного (Cricetus cricetus, Linnaeus, 1758), крысу серую (Rattus norvegicus, Berkenhout, 1769), бурундука сибирского (Tamias sibiricus, Laxmann, 1769), полевок серых: обыкновенную (Microtus arvalis Pallas, 1778), узкочерепную (Microtus gregalis, Pallas 1779), экономку (Microtus oeconomus, Pallas 1779); лесных полевок: красную (Myodes rutilus, Pallas, 1779) и красно-серую (Myodes rufocanus, Sundevall, 1846); насекомоядных: бурозубок обыкновенную (Sorex araneus Linnaeus, 1758) и среднюю (Sorex caecutiens Laxmann, 1788). (Громов, Ербаева, 1995). Мышь полевая (Apodemus agrarius Pallas, 1771) в данном биотопе составляет доминирующий вид.
Численность мыши полевой подвержена сильным (2–8 кратным) сезонным колебаниям. Пик численности является сезонным эффектом, а размножение полевых мышей и не лимитируется плотностью популяции, а зависит от кормовых условий (Громов 2008).
Для получения выборки пригодной для статистического анализа необходимо вести долговременный мониторинг.
Таблица 1
Численный состав уловов мелких млекопитающих за 2016–2019 годы на фоновом биотопе
| Виды | 2016 | 2017 | 2018 | 2019 | Итого |
| Мышь полевая | 7 | 2 | 16 | 12 | 37 |
| Крыса серая | — | — | — | 2 | 2 |
| Хомяк обыкновенный | — | — | 1 | — | 1 |
| Полевка экономка | — | — | 1 | 1 | 2 |
| Узкочерепная полевка | 1 | — | — | — | 1 |
| Красная полевка | 4 | 1 | — | — | 5 |
| Обыкновенная полевка | 1 | — | — | — | 1 |
| Обыкновенная бурозубка | 4 | 1 | — | — | 5 |
| Средняя бурозубка | 1 | — | — | — | 1 |
| Всего | 18 | 4 | 18 | 15 | 55 |
В результате мониторинговых исследований исследован долговременный период колебаний численности популяции в момент её наибольшего пика и отловлено в 2018–2019 г. 28 особей мышей полевых, пригодных для проведения морфологического анализа и составления критериев нормального функционирования желез внутренней секреции.
Возрастной состав абсолютного большинства особей, отловленных в 2019 году представлен 12 сеголетками (12), в 2018 году сеголетки были преобладающими, 10 (из которых 8 особей – самцы) к 7 зимовавшим (самки). Средняя масса отловленных сеголеток за 2018–2019 год у самцов составила 18,08 г, в то время как средняя масса самок оказалась ниже и составила 14,74 г. Средняя масса взрослых самцов за 2018–2019 год составила 18,2 г, самок – 32,4.
Три четверти особей попадает в ловушки в первые сутки после установки ловушек остальные попадают на вторые сутки. Третьи сутки по отлову безрезультатны.
Микроструктура щитовидной железы мыши полевой имеет свои особенности, связанные с организацией коллоида, величиной эпителия и собственно размером и формой самой железы.
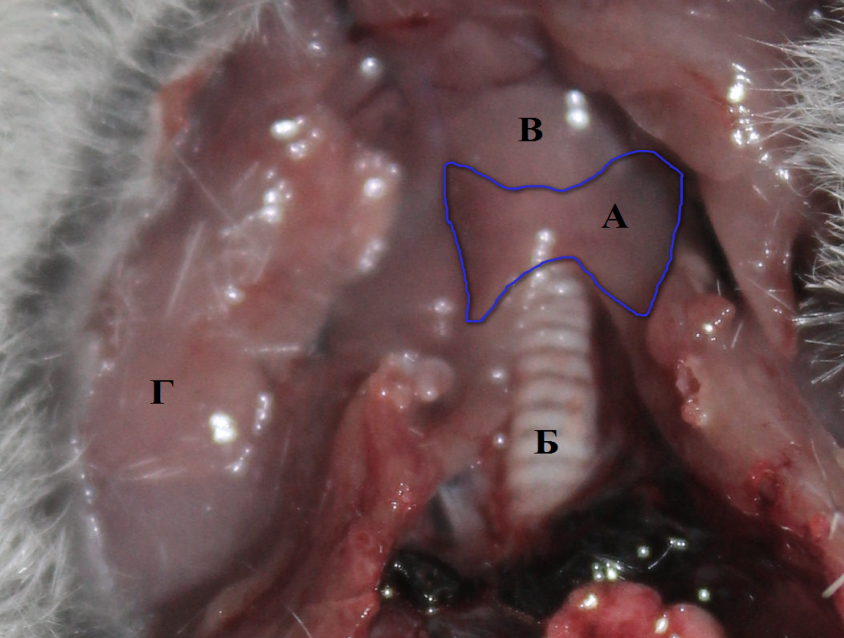
Анатомически железа мыши полевой представляет собой компактный непарный паренхиматозный орган внутренней секреции, имеет две выраженных доли и тонкий узкий перешеек, хвостатая (центральная) доля в центре не выражена (рис. 1).
Рис. 1. Топология и макроанатомия щитовидной железы мыши полевой
А – щитовидная железа, расположение и границы (обведены синим); Б –трахея; В-щитовидный хрящ; Г– пакет нижнечелюстных желез.
От перешейка доли расширяются и округляются, образуя латерально широкие лопасти как основания вытянутых овалов, иногда напоминая при этом крылья бабочки. Ширина каждой доли 2–2,7 мм, длина 1,5–2 мм, высота 1–2 мм. Ширина перешейка 1,5–2 мм. Цвет железы варьирует от красного до темно-красного, четко выделяясь на фоне гортани и щитовидного хряща.
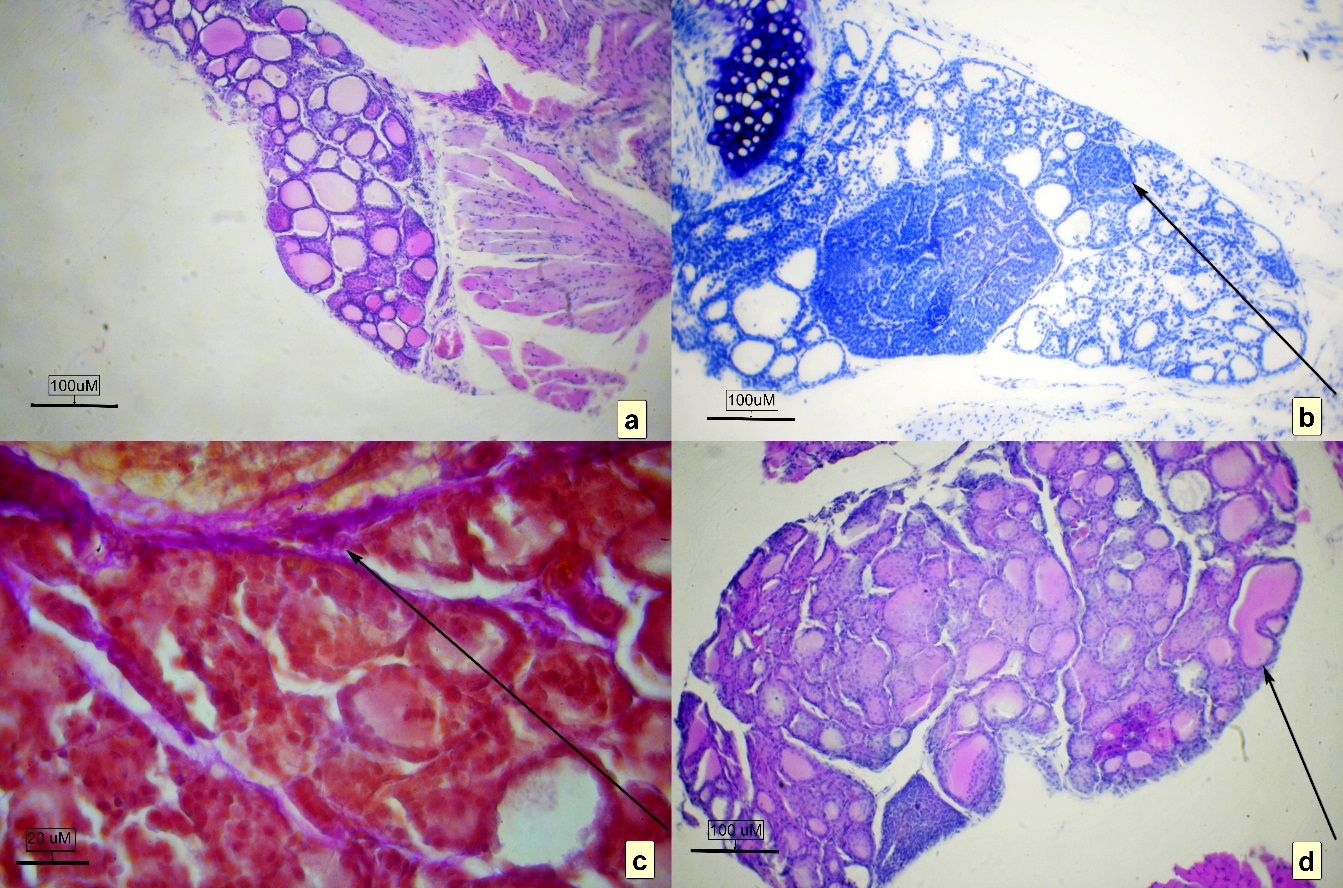
Железа снаружи имеет тонкую капсулу, представленную плоским неороговевающим эпителием, к которому присоединяется рыхлая соединительная ткань. По латеральной части органа в паренхиме ближе к выпуклой части органа в небольших пространствах величиной 9–15 мкм от ткани щитовидной железы в виде округлых или овальных образований можно встретить паращитовидные железы в виде одиночного островка в каждой доле (рис. 2А, общий вид).
Строма железы развита относительно слабо, в её составе имеется тонкая сеть ретикулярных клеток, небольшого количества тканевых макрофагов (1–2 в поле зрения при увеличении объектива х10, окуляра х16). Фолликулы часто (примерно треть в поле зрения железы) образуют небольшие дольки, которые одеты сеточкой ретикулярных клеток и опутаны некрупными кровеносными сосудами в виде 1–3 артериол – 2–6 венул и примерно по 1–3 капилляра на один фолликул, которых в поле зрения объектива увеличением ×40 приходится от 10 до 30 штук.
Соединительно-тканный каркас органа-строма очень хорошо визуализируется при окраске пикрофуксином по методу Ван-Гизон и представлена ретикулярными клетками и коллагеновыми волокнами, окрашенными фуксином в красный цвет (рис. 2Г). Такие окрашенные участки, в виде длинных тонких переплетенных пучков, шириной 1–3 мкм, четко отграничивают дольки железы. Капсула по полюсам плавно утолщаясь переходит в связки и фасции, вдоль которых часто можно наблюдать крупные сосуды, снабжающие щитовидную железу и рядом лежащие ткани. Коллоид при окраске пикрофуксином приобретает оранжевый цвет с небольшими оттенками в зависимости от его плотности (чем плотнее, тем темнее).
Щитовидные и паращитовидные железы представляют единый органокомплекс. Парные паращитовидные железы имеют небольшой размер (от 0,2 до 1 мм в диаметре), их форма тяготеет к эллипсоидной (бобовидной), но может иметь и иную форму (10–15 % случаев в виде треугольника со скругленными гранями или призмы, что не является признаком патологических изменений, так как функциональная структура при этом сохранена и аналогична железам других форм).
Фолликулы щитовидной железы могут соединятся между собой, образуя в некоторых случаях некрупную сеть из 2–4 сообщающихся цистерн сложной формы (рис 2В). Подобные агрегации отмечали у полевой мыши в четырех пробах (из 28). Считать ли это физиологической нормой в условиях дефицита йода – открытый вопрос, требующий дополнительных исследований.
Основная форма фолликулов на срезе – пятиугольная уплощенная призма (ближе к центру), либо вытянутый овал (периферия органа). Коллоид внутри фолликулов может сильно отличаться по консистенции в пределах одной железы, светооптически в большинстве фолликулов он имеет умеренную плотность, и образует структуру без посторонних пузырьков и включений от светло-розового до интенсивно розового цвета. Разница в структуре коллоида указывает на различную активность участков железы, в данном случае это является нормальным процессом расходования и выработки гормонов. В четверти исследованных фолликулов (коэффициент вариации при этом колеблется в пределах 30–40 %) коллоид незначительно отслоен от эпителия и по периферии более светлый, что при это не считается патологией.
В срезах с участков вблизи наружной части щитовидной железы встречаются тангенциальные срезы фолликулов, в которых можно при толщине среза более 8 мкм (10–12) увидеть боковую стенку фолликулов чуть глубже коллоида, через который просвечивает эпителий, который дает картинку фолликула без просвета и полностью заполненного эпителиальными клетками. Такие фолликулы при мофрометрических подсчетах не включали в генеральную выборку (однако не следует забывать то, что для индекса склерозирования подсчет площади таких фолликулов проводится и он очень важен), ввиду невозможности точно оценить просвет фолликула, высоту и количество слоев эпителия, соотношение и состояние коллоида. В целом при соблюдении единообразия исследований отсутствие таких фолликулов в выборке не влияет на относительные характеристики железы.
Эпителий фолликулов крупных фолликулов мыши полевой имеет призматическую формы, в зависимости от активности фолликула он может быть уплощен при низкой активности железы или же может быть высоким в случае активной продукции коллоида в мелких фолликулах. Для средних фолликулов тиреоциты (согласно международной гистологической номенклатуре (Семченко и др. 1999), наиболее правильное название фолликулярного эпителия щитовидной железы фолликулярный эндокриноцит – endocrinocitis follicularis, однако наиболее часто в клинической практике и литературе применяют равнозначные привычные термины тироцит=тиреоцит, поэтому для избегания путаницы, для соблюдения единообразия терминологии и сокращения объема и повторения громоздких терминов мы в дальнейшем будем использовать в нашей работе термин тиреоцит) имеют кубическую форму.
При окраске железы красителем толуоидиновым синим на предмет исключения воспалительных реакций не наблюдали каких-либо признаков присутствия тучных клеток (рис. 2Б). В капсуле железы находили единичные (1 клетка на 2–3 поля зрения при увеличении объектива ×10) макрофаги, имевшие метахроматическое окрашивание в виде малиновой зернистости, что в данном случае можно считать нормой.
Согласно данных В. Н. Манского (2018) коэффициент вариации по массе щитовидной железы даже у лабораторных мышей в возрасте от 3 до 6 месяцев достигает 56–61 %.
Рис. 2. Щитовидная железа мыши полевой, микрокартина
а – общий план, окраска гематоксилином и эозином; b – общий план, окраска толуоидиновым синим водным (стрелкой указана дополнительная паращитовидная железа) ув. об. ×10; c – морфоструктура соединительнотканных прослоек коллагена в железе (малинового цвета, указана стрелкой) окраска пикрокармином по Ван-Гизон, ув. об. ×40; d – общий план, стрелкой указана сложная цистерна из нескольких объединенных фолликулов, окраска гематоксилином и эозином, ув. об. ×10.
Структура и функции щитовидной железы подразумевают под собой динамичный гуморальный ответ на любой раздражитель, с перестройкой ткани и быстрой адаптацией к сложившимся условиям. Это накладывает отпечаток на морфологию тканей органа- выражающуюся в большой вариабельности массы, структуры коллоида, высоты эпителия, объема, количества и формы фолликулов, входящих в строение железы.
Следует отметить условность абсолютных цифровых данных в исследовании морфометрии макро- и микроструктур, связанных в первую очередь с неизбежными методическими погрешностями в подходе проведения морфологических исследований. Опираясь на коэффициент вариации в средних и минимальных показателях, а также близкие показатели средней площади исследованных желез, пропорции эпителия к площади фолликулов, его высоты и количества самих фолликулов в паренхиме, не смотря на возможную погрешность в абсолютных величинах, постоянны в своих пропорциях, и могут служить достаточным критерием для отделения нормы от патологии в исследованиях, проводимых в других лабораториях с иными производителями реактивов и приборов.
Индексы Брауна, склерозирования и фолликулярно коллоидный, в щитовидной железе в норме не имеют существенных особенностей от прочих мелких млекопитающих (Манских, 2017), при этом максимальные и минимальные значения индексов довольно сильно варьируют, так индекс Брауна в максимальном значение превышает 49 условных единиц (бит), что объясняется максимальными показателями общей выборки (особенности методов учета).
Линейные размеры фолликулов, эпителия и другие показатели приведены в таблице 2.
Таблица 2
Линейные показатели щитовидной железы полевой мыши
| Критерий | Площадь, мкм2 | Площадь фолликулов, мкм2 | Количество фолликулов | Площадь паращитовидной железы, мкм2 | Индекс склерозирования | Индекс Брауна | ФКИ |
| Средняя | 488306 | 467 | 82 | 48528 | 0,81 | 9,07 | 3,72 |
| Максимальное значение | 629711 | 1457 | 101 | 15239 | 2,62 | 49,87 | 5,79 |
| Минимальное значение | 213591 | 158 | 62 | 95115 | 0,16 | 3,95 | 2,05 |
| m | 152422 | 235 | 18 | 28957 | 0,11 | 1,00 | 1,30 |
| Cv, % | 31 | 38 | 22 | 60 | 0,13 | 0,11 | 0,35 |
Примечание к таблице. m – стандартное отклонение, Cv – коэффициент вариации.
Морфологически щитовидную железу сеголеток можно описать как орган с высокой продукцией гормонов, при этом для железы можно выделить участки активной продукции секрета фолликулов (обычно каудальная часть железы), так и с относительно спокойными участками, в которых накапливается коллоид разной степени плотности.
Видовые особенности строения щитовидной железы у мышей полевых в отличии от полевок, крыс и лабораторных мышей (Chery, 2014) состоят в малом размере органа, тонкой капсуле, встречающимся наличии внутренних добавочных паращитовидных желез, компактно организованной паренхиме, умеренно развитой сосудистой сети.
Таблица 3
Показатели фолликулов щитовидной железы
| Градация фолликулов | Малые | Средние | Крупные | ||||||
| Показатель | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 |
| Средние значения | 350,93 | 6,29 | 0,68 | 923,03 | 6,87 | 0,44 | 2429,29 | 7,30 | 0,25 |
| M | 91,17 | 1,75 | 0,06 | 251,89 | 1,38 | 0,03 | 1342,58 | 2,16 | 0,06 |
| Cv, % | 26 | 28 | 8 | 27 | 20 | 8 | 55 | 30 | 25 |
Примечание к таблице. 1 – площадь эпителия фолликулов, 2 – высота эпителия; 3 – отношение площади эпителия к площади фолликула. M – стандартное отклонение, Cv – коэффициент вариации.
Среди основных принципиальных показателей морфоструктуры необходимо выделить наиболее важные, на наш взгляд: индекс Брауна – показатель функциональной активности; высота и форма тироцитов (фолликулярного эпителия). Именно эти показатели в первую очередь изменятся при незначительных или непродолжительных поступлениях в физиологический процесс поллютантов и именно на них стоит обратить внимание в случае проведения биоиндикационных исследований и экомониторинга. Индекс склерозирования изменится лишь на поздней стадии развития заболевания, когда произойдут частично обратимые или же вовсе необратимые изменения, в то время как фолликулярно-коллоидный индекс слишком лабилен и может изменятся под воздействием экстремальных температур для организма, изменении рациона (сезонный или случайный), изменением физиологического статуса (беременность активирует щитовидную железу, старение снижает активность и повышает процент соединительной ткани в железе (Кобозева, Гуркин, 1986; Рустембековаи др., 2011).
В таблице 4 объединены критерии оценки техногенного воздействия, а также возможные изменения и причины возникновения патологии тканей щитовидной железы. В основном изменения носят метрические показатели, которые хорошо определяются при микроморфометрическом анализе. Приобретенная техногенная патология определяется по совокупности обозначенных критериев.
Таблица 4
Диагностические критерии нарушений щитовидной железы мыши полевой при техногенных воздействиях
| Критерий оценки | Норма | Изменения | Причины изменений |
| Форма тиреоцитов | Призматический\кубический | Плоский | Сниженная продукция гормонов (гипотиреоз), химический или возрастной |
| Высокий\ столбчатый | Повышенная продукция гормонов (гипертиреоз) химический генез | ||
| Высота тиреоцитов | 6,83+1,40 мкм | 5 и менее мкм ср | Сниженная продукция гормонов, техногенные или возрастные изменения |
| 7 и более среднее, значения разброса более 2 | Повышенная продукция гормонов | ||
| Индекс Брауна | 9,7+1,0 | 11 и выше | Сниженная продукция гормонов |
| 8 и ниже | Повышенная продукция гормонов | ||
| Фолликулярно-коллоидный индекс | 3,72+1,30 | 5 | Сниженная продукция гормонов |
| 2,5 и ниже / | Повышенная продукция гормонов | ||
| Индекс склерозирования | 0,81+0,11 | Более 1 | Анаплазия, либо деструкция эпителия, с его заменой соединительной тканью |
| Менее 0,6 | Гиперплазия эпителия | ||
| Интенсивность окраски коллоида | Малиновый цвет, ровная структура без включений и зернистости | Бледно окрашенный коллоид | Сниженная продукция гормонов |
| Яркий густой коллоид | Повышенная продукция гормонов |
ЗАКЛЮЧЕНИЕ
Проведены региональные исследования зональной ненарушенной (нормальной) морфологии щитовидной железы сеголеток мышей полевых в условиях Красноярской лесостепи и выявлены наиболее важные показатели органа: высота тироцитов 6,83 мкм, средняя площадь фолликулов 467,9 мкм2, индекс Брауна 9,7, фолликулярно-коллоидный индекс 3,72, индекс склерозирования 0,81, которые закладываются в основу базы данных нормального (зонального, ландшафтного) биоиндикации органов.
Видовые особенности строения щитовидной железы у мышей полевых в отличии от полевок, крыс и лабораторных мышей состоят в малом размере органа, тонкой капсуле, встречающимся наличии внутренних добавочных паращитовидных желез, компактно организованной паренхиме, умеренно развитой сосудистой сети.
Наиболее важные биоиндикационные критерии для оценки изменений в случае техногенного воздействия под влиянием поллютантов: размеры железы (с учетом возраста), индекс Брауна, а также высота и форма тироцитов (фолликулярного эпителия).
Мышь полевая, за счет экологических и морфологических особенностей, представлена ценным объектом биоиндикации в условиях Красноярской лесостепи для оценки состояния фоновых и техногенных территорий.
На основе полученных сведений о нормальном состоянии щитовидной железы планируется провести исследование влияния выбросов фторидов КрАЗа и других металлургических производств алюминия.
REFERENCES
Громов В. С. Пространственно-этологическая структура популяций грызунов – М.:Товарищество научных изданий КМК. – 2008. – 581 с.
Громов И. М., Ербаева М. А. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны. – СПб, 1995. – 522 с.
Карасева Е. В. Телицына А. Ю. Жигальский О. А. Методы изучения грызунов в полевых условиях. – М.: ЛКИ, 2008 – 412 с.
Коржевский Д. Э. Гиляров А. В. Основы гистологической техники. – СПб: СпецЛит, 2010. – 95 с.
Кобозева Н. В., Гуркин Ю. А. Перинатальная эндокринология. – Руководство для врачей. – Ленинград, 1986. – 312 с.
Кучерюк В. В. Синантропные грызуны и их значение в передаче инфекций // Вопросы прикладной экологии. – 2016. – № 1 – С. 36–39.
Манских В. Н. Патоморфология лабораторной мыши. Т. 1. – М.: Вако, 2017. – 208 с.
Сазонов Н. Н. Охотничьи животные – биоиндикаторы биогеохимических провинций Якутии // Вестник СВФУ. – 2012. – Т. 9, №1. – С. 41–45.
Семченко В. В. Международная гистологическая номенклатура / [Под ред. В. В. Семченко, Р. П. Самусева, М. В. Моисеева, В. Л. Колосовой]. – Омск: Омская медицинская академия, 1999. – 156 с.
Рустембекова С. А. Тлиашинова А. М Бурая Т. И. Возрастные особенности структуры и функции щитовидной железы // Новые исследования. – 2011 – С. 65–74.
Рустембекова С. А. Оценка факторов экологического риска при патологии щитовидной железы (на примере московской агломерации) // Вестник РУДН. Медицина. – 2011. – № 4. – С. 123–128.
Cheryl L. A Practical Guide to the Histology of the Mouse Scudamore. – Mary Lyon Centre, MRC Harwell, UK Wiley Blackwell, 2014. – P. – 232.