Экосистемы, 35: 28–40 (2023) https://ekosystems.cfuv.ru
![]()
УДК 595.34
Пионтковский С. А.1, Загородняя Ю. А.2, Попова Е. В.2, Ал-Хашми Х. А.3
- Севастопольский государственный университет Севастополь, Россия
- Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
- Университет Султана Кабуса Маскат, Оман
spiontkovski@mail.ru, artam-ant@yandex.ru, el-popova@yandex.ru, halidmat99@gmail.com
Общее сходство структуры и динамики Черного и Аравийского морей по ряду биологических и физических характеристик делает теоретически интересным сравнение их многолетних трендов. В плане выбора объекта для исследований в сравнительном аспекте, примечателен один из видов динофитовых планктонных водорослей – Noctiluca scintillans (Macartney) Kofoid & Sweezy, 1921, который занимает особое положение в пелагической экосистеме. Популяции этого вида образуют мощные скопления в прибрежных водах; обладают высоким биолюминесцентным потенциалом, поскольку амплитуды одиночных вспышек её крупных клеток в десятки раз превышают таковые мелкого фитопланктона; клетки ноктилюки флюоресцируют, что позволяет следить за пространственно-временной динамикой численности и биомассы по измерениям с помощью флюориметров. Клетки ноктилюки просчитывали под микроскопом в камере Богорова. Для перехода от численности к биомассе использовали известные эмпирические соотношения между размером и массой. Анализ данных дистанционных (со спутников MODIS-Aqua/Terra) и контактных измерений (с научно-исследовательских судов) показал, что биомасса и численность ноктилюки не имеет выраженного тренда многолетней изменчивости в первых двух декадах 21 века в прибрежных водах Аравийского моря, в то время как в Черном море выявлено уменьшение биомассы и численности с 60-х годов прошлого века. Причиной таких различий может быть, как миксотрофное питание ноктилюки в Аравийском море (обеспечивающее бòльшую стабильность динамики численности популяции), так и более интенсивная конкуренция ноктилюки из-за пищи (с планктонными ракообразными, желетелыми организмами и мелкими пелагическими рыбами), которая привела к уменьшению биомассы ноктилюки в прибрежных водах Черного моря.
Ключевые слова: Черное море, Аравийское море, хлорофилл-а, зоопланктон, фитопланктон, Noctiluca scintillans.
ВВЕДЕНИЕ
- рамках концепции Больших морских экосистем Мирового океана, Черное и Аравийское моря относят к самостоятельным экосистемам с вытекающей из этого стратегией использования ресурсов и рационального управления ими (Sherman, 2014; Transboundary Water Assessment Program, 2015). Выделение обоих морей в самостоятельные Большие морские экосистемы связано как с их географическим положением (рис. 1), так и с особенностью биологической и гидрохимической структуры: обе экосистемы обладают мощными зонами гипоксии и аноксии вертикальные градиенты которых формируют особенности пространственной структуры и функционирования и, в конечном итоге, влияют на промысловый запас организмов средних и высоких трофических уровней.
Сравнение структурно-функциональных характеристик пелагических экосистем обоих водоемов представляет многоплановый теоретический интерес в связи с тем, что:
- оба моря находятся под воздействием сходного (муссонного по механизму возникновения и сезонности) характера ветров (Ефимов, Юровский, 2017; Schott, McCreary, 2001), с преобладанием циклонической завихрённости;
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Межгодовая изменчивость в динамике популяций
массовых видов планктона прибрежных вод Черного и Аравийского морей
![]()
- различаются размерами акваторий и уровнем первичной продукции (большей в Аравийском море), при ее резко выраженной сезонности;
- индекс здоровья обеих экосистем одинаково низок (70 у Черного и 66 у Аравийского моря) и находится ниже среднего по сравнению с другими Большими морскими экосистемами Мирового океана (Transboundary Water Assessment Program, 2015);
- оба моря имеют границу кислородного минимума, расположенную сравнительно близко к поверхности;
- населены некоторыми идентичными массовыми видами, что позволяет сравнивать границы толерантности одного вида к различающимся диапазонам сезонной и многолетней изменчивости факторов среды.
В плане выбора объекта для исследований в сравнительном аспекте, интересен один из видов динофитовых планктонных водорослей – Noctiluca scintillans (Macartney) Kofoid & Sweezy, 1921, который занимает особое положение в пелагической экосистеме. Популяции данного вида:
- образуют мощные скопления в прибрежных водах;
- обладают высоким биолюминесцентным потенциалом, поскольку амплитуды одиночных вспышек её крупных клеток в десятки раз превышают таковые мелкого фитопланктона (Токарев и др., 2016);
- клетки ноктилюки флюоресцируют, что позволяет следить за пространственно-временной динамикой численности и биомассы по измерениям с помощью флюориметров
(Piontkovski et al., 2016).
Примечательно, что гидробиологи при сборе и обработке проб, ноктилюку относят к фракции мезозоопланктона, поскольку она является крупным (0,5–1,0 мм) организмом, хорошо улавливаемым зоопланктонными сетями и потребляющим, наравне с фито, зоопланктон. Сезонная изменчивость численности и биомассы ноктилюки в южных, восточных, и западных прибрежных водах Черного моря заметно различается, что связано с разнообразной комбинацией определяющих ее факторов (Загородняя и др., 2007; Michneva, Stefanova, 2011; Mikaelyan et al., 2014; Űstűn et al., 2018). Многолетняя изменчивость динамики популяции изучена заметно меньше. В связи с этим, цель наших исследований состояла в выявлении и сравнении межгодовой изменчивости численности и биомассы ноктилюки в прибрежных водах Черного и Аравийского морей. В Аравийском море этот вид занимает экологическую нишу миксотрофных организмов (Goes et al., 2018), тогда как в Черном море он относится к гетеротрофам (Никишина и др., 2011; Дриц и др., 2013; Dagenais-Bellefeuille, Morse, 2013).
В исходной рабочей гипотезе мы предположили, что разная стратегия питания ноктилюки (в Черном и Аравийском морях) может приводить к заметным различиям многолетней динамики численности и биомассы под воздействием природных факторов разной модальности. Для динамики биомассы фитопланктона умеренных и субтропических широт характерны бимодальные и одномодальные сезонные циклы (Cebrián, Valiela, 1999).
Цель работы – провести анализ временных серий биофизических и гидрофизических характеристик биомассы и численности планктонной водоросли ноктилюки (Noctiluca scintillans), включающих как сезонные, так и формирующиеся на их фоне многолетние монотонные тренды.
МАТЕРИАЛЫ И МЕТОДЫ
Для формирования временных серий биофизических и гидрофизических характеристик были использованы дистанционные измерения (со спутников MODIS-Aqua/Terra) и контактные измерения (с борта научно-исследовательских и рыбопоисковых судов: «Профессор Водяницкий», «Трепанг», «Наутилус» в Черном море и «Al Jamyah» в Аравийском море). Дистанционные измерения биомассы хлорофилла-а, температуры поверхностного слоя (с пространственным разрешением 4 км) и скорости ветра у поверхности (модель MERRA-2 /M2TMNXOCN v.5.12.4) были загружены в виде пространственно и
29
Пионтковский С. А., Загородняя Ю. А., Попова Е. В., Ал-Хашми Х. А.
![]()
помесячно осредненных временных серий с портала GIOVANNI (https://giovanni.gsfc.nasa.gov/giovanni).
Анализ пространственно-временной изменчивости численности и биомассы ноктилюки основан на 708 пробах зоопланктона, собранных в 1960–1969 годах (Грезе и др., 1971; Грезе, Федорина, 1979) и 317 пробах, собранных в 1980, 1995 и 2010–2018 годах в Черном море. В 1960–1969, 1980, 1995 и 2002 годах материалы собирали в прибрежной зоне шельфа, кроме того, в 1995 году – в открытом море у берегов Крыма и в 2010–2018 годах – вдоль разрезов от берегов Крыма в мористую часть (над глубинами 50–200 м). Разрезы образовывали сетку океанографических станций c координатами: 43–45° с. ш., 32–38° в. д. При оценке сезонного цикла ноктилюки на каждый месяц в среднем приходилось около 25 проб, собранных сетью Джеди (площадь входного отверстия 0,1 м2, размером ячеи 140–145 мкм) в слое над кислородным минимумом (~0–150 м) и меньшей протяженности над малыми глубинами. Пробы фиксировали 4 % раствором формальдегида для последующей обработки в стационарной лаборатории. Клетки ноктилюки просчитывали в 1 мл (взятом из 50 мл пробы) под микроскопом МБС в камере Богорова в трех повторностях. Для перехода от размерных характеристик клеток к биомассе использовали известные соотношения между размером и массой (Петипа, 1957).
Помимо многолетней изменчивости биомассы ноктилюки, мы приводим данные по биомассе кормового зоопланктона. Термин появился в литературе в 50-х годах (Кусморская, 1954) и характеризует фракцию зоопланктона, составляющую рацион в основном мелких пелагических рыб, без желетелых организмов. В Аравийском море было собрано 150 проб зоопланктона в мелководных районах и 48 проб в интегральном слое над глубинами около 100 м в Оманском заливе (в районе с координатами 23° с. ш. 58–43° в. д.). Пробы были собраны сетями с размером ячеи 200 мкм и обработаны в Институте биологии южных морей РАН по той же методике, что и черноморские.
Для статистического анализа использованы программные продукты «Statistica v.9» и «PAST v.13». Проверка статистической значимости монотонных трендов во временных сериях параметров проведена по непараметрическому критерию Мэна-Кендалла широко применяемому при анализе временных серий в гидрофизике (Wang et al., 2020). В этом тесте параметр «Z» следует нормальному распределению с E(Z)=0, V(Z)=1. Нулевая гипотеза Ho (о статистически незначимом тренде) отвергается при абсолютном значении Z>Z1-a/2, где a – принятый уровень значимости (в нашем случае а=0,05). Значение теста (р) ниже уровня значимости, показывает, что во временной серии измерений присутствует монотонный тренд.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Собранные в обоих районах пробы зоопланктона различаются количеством и охваченными временными интервалами, поэтому мы посчитали целесообразным начать изложение результатов с более изученного Черного моря, в котором данные по численности и биомассе ноктилюки начинаются с шестидесятых годов прошлого века.
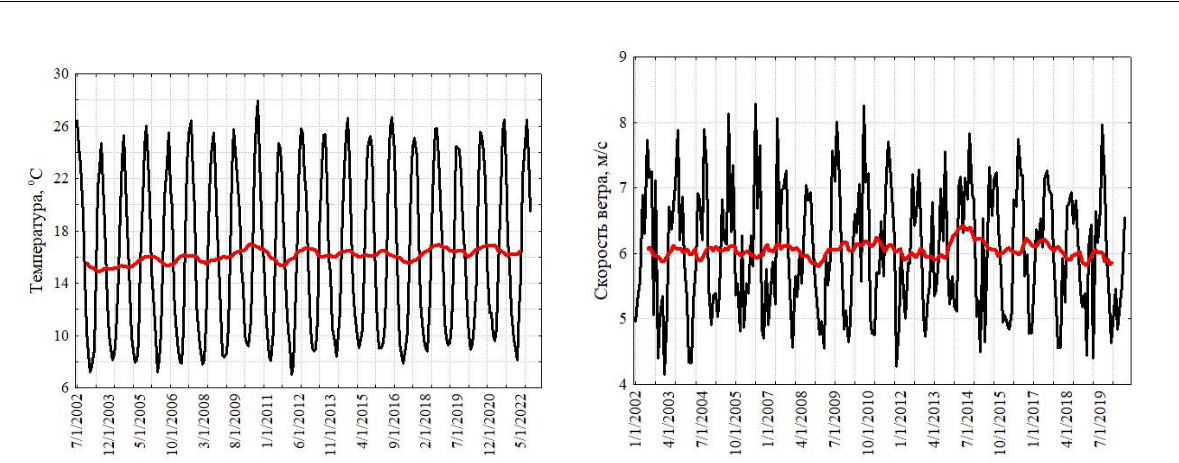
Черное море. Прибрежные воды северной части Черного моря у берегов Крыма подвержены значительной сезонной изменчивости ветров, термогалинной структуры вод и течений. Некоторые приведенные на рисунке 1 характеристики дают представление о диапазоне изменчивости сезонных циклов поверхностной температуры и скорости ветра у поверхности моря за 20-летний период измерений в 21 веке.
Мы не приводим спутниковые данные по межгодовой изменчивости биомассы хлорофилл-а в прибрежной зоне Черного моря, поскольку ошибки восстановления хлорофилла-а в ней высоки (Suslin, Churilova, 2017). В связи с этим, временные серии больше отображают динамику окрашенной компоненты растворенной органики (желтого растворенного вещества) и других составляющих суммарной концентрации взвеси. Она многокомпонентная и в прибрежных водах Крыма включает в себя как органическую, так и неорганическую фракции (Алескерова и др., 2017, 2019).
30
Межгодовая изменчивость в динамике популяций
массовых видов планктона прибрежных вод Черного и Аравийского морей
а б

в г
Рис. 1. Сезонная и многолетняя изменчивость поверхностной температуры (а), скорости ветра (б) и численности ноктилюки в прибрежной зоне Черного моря (в)
Для сезонного цикла ноктилюки использовано осреднение численности за 1999, 2001, 2006, 2010, 2011, 2013 и 2016-2019 годы (Zagorodnyaya, Piontkovski, 2022). Красная кривая на верхних рисунках (а, б) характеризует многолетний тренд, полученный скользящей средней с окном в 12 месяцев. Формат шкалы времени по абсциссе: месяц-число-год. Красные квадраты нижнего левого рисунка (в) характеризуют среднюю, а синие прямоугольники – верхнюю и нижнюю границы 95 % доверительных интервалов. Нижний правый рисунок (г) показывает географическое положение мест отбора планктонных проб в Черном и Аравийском морях.
Сравнивая материалы по мезопланктону, полученные в 1960 годах (Грезе и др. 1979) с таковыми 1980 годов, можно отметить, что его среднегодовая биомасса снизилась с 224 до 215 мг м-3, тогда как биомасса ноктилюки, возросла с 159 до 178 мг м-3. Оба показателя резко уменьшились в середине 1990-х годов (табл. 1). Так, в 1995 году среднегодовая биомасса мезопланктона составила 58 мг м-3, и основной вклад в суммарную биомассу вносила ноктилюка – 45 мг м-3. Минимальная биомасса ноктилюки зарегистрирована в начале 2000-х годов. Сборы проб зоопланктона в 2002 году проводили только в верхнем 10 метровом слое. Известно, что с повышением температуры воды летом, ноктилюка, как представитель батипланктонного комплекса, опускается ниже, в слой термоклина. Следовательно, в 2002 году слой обитания ноктилюки облавливали не полностью, и её биомасса, вероятно, была занижена. В 1999 году в акватории Карадагского природного заповедника (южный берег Крыма) среднегодовая биомасса ноктилюки тоже была низкой – 10,4 мг м-3 (данные авторов).
Снижение среднегодовых величин биомассы мезопланктона и ноктилюки в эти годы зарегистрировано и в открытом море у берегов Крыма (табл. 2). В отличие от взморья, биомасса ноктилюки на шельфе была выше. Материалы 2010–2018 годов показали, что суммарная биомасса мезопланктона на шельфе Крымского полуострова оставалась низкой по
31
Пионтковский С. А., Загородняя Ю. А., Попова Е. В., Ал-Хашми Х. А.
![]()
| Таблица 1 | |||||||||||||||||||||
| Многолетняя изменчивость биомассы мезопланктона* и ноктилюки (мг м-3) в | |||||||||||||||||||||
| прибрежных водах Крыма (район г. Севастополя) | |||||||||||||||||||||
| Группа | Сезоны | Среднегодовая | |||||||||||||||||||
| биомасса, | Источник | ||||||||||||||||||||
| организмов | Зима | Весна | Лето | Осень | |||||||||||||||||
| мг м-3 | |||||||||||||||||||||
| Суммарный | |||||||||||||||||||||
| мезопланктон, | 126 | 340 | 320 | 111 | 224 | ||||||||||||||||
| 0–40 м | Грезе и др., 1979; | ||||||||||||||||||||
| (1960-е годы) | Грезе, Федорина, | ||||||||||||||||||||
| В том числе | 1979 | ||||||||||||||||||||
| ноктилюка | 85 | 299 | 208 | 45 | 159 | ||||||||||||||||
| (1960-е годы) | |||||||||||||||||||||
| Суммарный | |||||||||||||||||||||
| мезопланктон, | 123 | 563 | 127 | 45 | 215 | ||||||||||||||||
| 0–40 м | |||||||||||||||||||||
| Загородняя и др., | |||||||||||||||||||||
| (1980 г.) | |||||||||||||||||||||
| 2003 | |||||||||||||||||||||
| В том числе | |||||||||||||||||||||
| ноктилюка | 107 | 517 | 72 | 16 | 178 | ||||||||||||||||
| (1980 г.) | |||||||||||||||||||||
| Суммарный | |||||||||||||||||||||
| мезопланктон, | 64 | 121 | 25 | 23 | 58 | ||||||||||||||||
| 0–40 м | Загородняя и др., | ||||||||||||||||||||
| (1995 г.) | 2003 | ||||||||||||||||||||
| В том числе | |||||||||||||||||||||
| ноктилюка | 62 | 104 | 14 | 1 | 45 | ||||||||||||||||
| (1995 г.) | |||||||||||||||||||||
| Суммарный | |||||||||||||||||||||
| мезопланктон, | 15 | 15 | 19 | 58 | 27 | ||||||||||||||||
| 15–40 м | |||||||||||||||||||||
| Zagorodnyaya et al., | |||||||||||||||||||||
| (2002 г.) | |||||||||||||||||||||
| 2007 | |||||||||||||||||||||
| В том числе | |||||||||||||||||||||
| ноктилюка | 2 | 5 | 1 | 1 | 2 | ||||||||||||||||
| (2002 г.) | |||||||||||||||||||||
Примечание к таблице. * – без учета относящихся к макропланктону гребневиков и медуз. Биомасса округлена до целых величин.
сравнению с 1960–1970 годами. Биомасса ноктилюки снизилась почти в 4 раза, тем не менее, на её долю приходилось почти 50% биомассы мезопланктона.
-
- целом же, для многолетней изменчивости биомассы мезопланктона прибрежных и шельфовых вод характерен отрицательный тренд (тест Мэна-Кендалла, S=−6, p=0,042). При этом, доля ноктилюки заметно уменьшилась (табл. 1, 2). Что же касается межгодовой изменчивости по сезонам, то наибольшая вариабельность биомассы ноктилюки характерна для летнего периода, как в прибрежных водах, так и в открытым море.
Известные нам данные по многолетней изменчивости биомассы мезопланктона и ноктилюки в других районах Черного моря фрагментарны и трудно сравнимы так как часто приводятся в разных размерных единицах. Так, в восточной его части в открытом море биомасса суммарного мезопланктона в 1970-х годах увеличилась относительно 1960-х годов
- 272 до 317 мг м-3, (в слое 0–100 м), а биомасса ноктилюки за эти годы возросла с 191 до 243,5 мг м-3 (Маштакова, 1985). Для первых двух декад 21 века данные по ноктилюке представлены
32
Межгодовая изменчивость в динамике популяций
массовых видов планктона прибрежных вод Черного и Аравийского морей
![]()
| Таблица 2 | ||||||||||||||||||||||
| Многолетние изменения биомассы мезопланктона* и ноктилюки (мг м-3) | ||||||||||||||||||||||
| в открытом море на шельфе Крыма | ||||||||||||||||||||||
| Группа | Сезоны | Среднегодовая | ||||||||||||||||||||
| биомасса, | Источник | |||||||||||||||||||||
| организмов | Зима | Весна | Лето | Осень | ||||||||||||||||||
| мг м-3 | ||||||||||||||||||||||
| Суммарный | ||||||||||||||||||||||
| мезопланктон | — | 226 | 339 | — | 291** | |||||||||||||||||
| (1959–1974 гг.), | Федорина, | |||||||||||||||||||||
| 0–100 м | 1978 | |||||||||||||||||||||
| В том числе | — | 156 | 238 | — | 205** | |||||||||||||||||
| ноктилюка | ||||||||||||||||||||||
| Суммарный | ||||||||||||||||||||||
| мезопланктон | 25 | 226 | 144 | 96 | 123 | |||||||||||||||||
| (1995 г.), | Загородняя и | |||||||||||||||||||||
| 0–100 м | др., 2001 | |||||||||||||||||||||
| В том числе | 11 | 164 | 100 | 86 | 91 | |||||||||||||||||
| ноктилюка | ||||||||||||||||||||||
| Суммарный | ||||||||||||||||||||||
| мезопланктон | 45 | 160 | 143 | 60 | 102 | |||||||||||||||||
| (2010–2019 гг.), | Собственные | |||||||||||||||||||||
| 0–150 м | данные | |||||||||||||||||||||
| В том числе | 7 | 97 | 87 | 6 | 49 | |||||||||||||||||
| ноктилюка | ||||||||||||||||||||||
| Примечание к таблице. | * – | без учета | относящихся к | макропланктону гребневиков и медуз; | ||||||||||||||||||
- – средняя биомасса за вегетационный период (март – август). Биомасса в таблице округлена до целых величин.
- численностью, которая возросла от первой декады ко второй, судя (визуально) по представленному графическому материалу (Mikaelyan et al., 2014). В прибрежных водах Геленджика биомасса мезопланктона в слое 0-50 м двукратно уменьшилась в 2013–2014 годами по сравнению с 2005–2012 годами (Arashkevich et al., 2015).
Существенные изменения произошли в западной части моря, где биомасса суммарного зоопланктона с 1951–1960 по 1975–1980 годы возросла с 310 до 2665 мг м-3, за счёт десятикратного увеличения биомассы ноктилюки, с 163 до 2536 мг м-3 (Полищук и др., 1984). Однако, в 2013 году биомасса ноктилюки в прибрежных водах Одессы уже составляла ~80 мг м3 (Олефир, 2017).
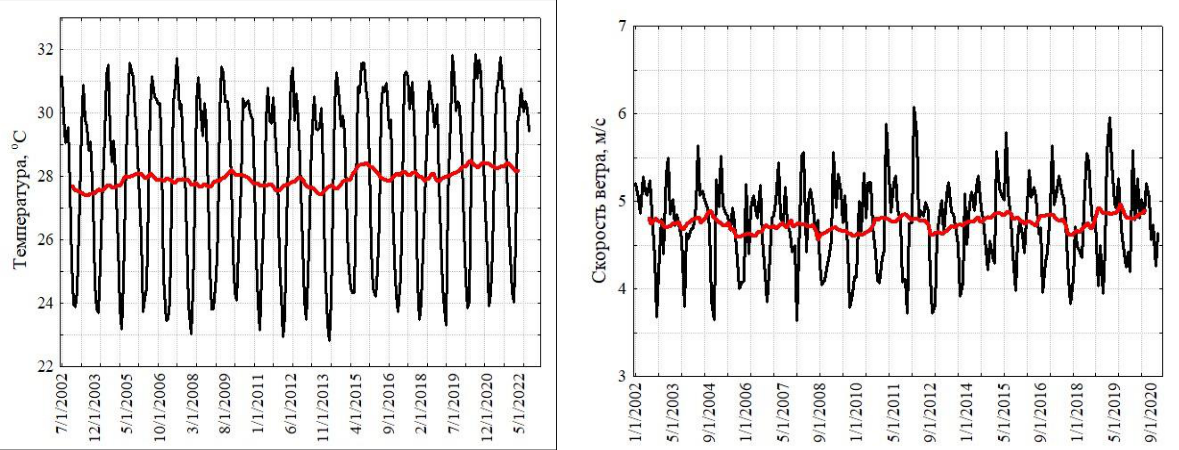
Аравийское море. Прибрежные воды северо-западной части Аравийского моря (включая Оманский залив) также подвержены значительной сезонной изменчивости ветров и термогалинной структуры, в связи со сменой зимнего (северо-восточного) и летнего (юго-западного) муссонов (Schott, McCreary, 2001). В весенний и осенний межмуссонные периоды происходит распад муссонной системы ветров, что сопровождается соответствующей перестройкой системы прибрежных течений. Зимний муссон обычно длится с ноября по февраль, летний – с июня до середины сентября, хотя, межгодовая изменчивость муссонов в эти периоды может несколько смещаться. Временные серии скорости ветра и поверхностной температуры моря достаточно наглядно представляют эту сезонность (рис. 2). Коэффициент вариации температуры составил 10 %.
По данным помесячно осредненных величин многолетний монотонный тренд скорости ветра у поверхности, отсутствовал (тест Мэна-Кендалла, S=155; Z=0,13; p=0,89), показывая стабильность скорости за 20-летний период (2002–2022 гг.). В Оманском заливе и во всей северо-западной части Аравийского моря, зимний муссон – это время сезонного максимума
33
Пионтковский С. А., Загородняя Ю. А., Попова Е. В., Ал-Хашми Х. А.
![]()
биомассы ноктилюки. Интенсивное конвективное перемешивание верхних слоев обеспечивает поступление биогенов в эвфотический слой, включая силикаты, как наиболее важных для роста диатомовых водорослей. Диатомовые являются главным компонентом пищевого рациона ноктилюки (Smetacek, 1998; Dagenais-Bellefeuille, Morse, 2013).
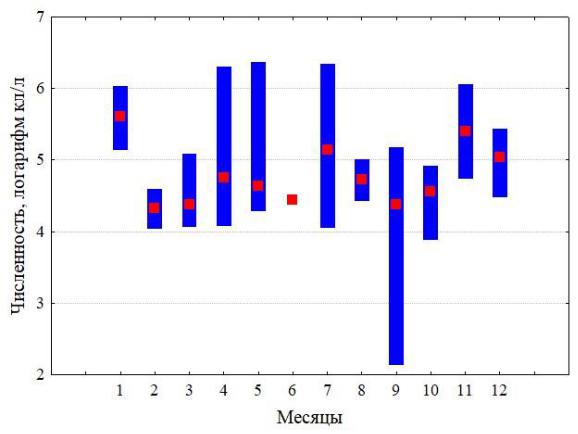
Сезонную динамику численности ноктилюки можно проследить по пробам, собранным на шельфе над глубинами около 100 м в 2010–2018 годы (рис. 2), где хорошо выражен зимний максимум численности и менее развито летне-осеннее цветение. В Аравийском море во время зимнего цветения численность ноктилюки может в 1000 раз превосходить таковую в Черном море. Следует отметить, что зимнее цветение в Оманском заливе (по данным наших планктонных сборов) является отголоском более мощного цветения на акватории всей северо-западной части Аравийского моря. Масштаб этого явления беспрецедентен (рис. 3) и в других районах Мирового океана не наблюдается.
а б
в
Рис. 2. Многолетняя изменчивость поверхностной температуры (а), скорости ветра (б) и сезонный цикл численности ноктилюки в Оманском заливе (2010–2018 гг.) (в)
Красная кривая на верхних рисунках характеризует многолетний тренд, полученный скользящей средней с окном в 12 месяцев.
Помимо масштабности явления, спутниковые снимки показывают и пространственную неоднородность в распределении биомассы хлорофилла-а в феврале-марте (рис. 3, верхняя панель), которая представлена, преимущественно, ноктилюкой, в это время; как вклад других видов фитопланктона в суммарную биомассу, обычно, очень мал. Приведенные фотографии также показывают, что в Оманском заливе и северо-западной части Аравийского моря преобладает зеленая форма ноктилюки, обусловленная цветом пигментов эндосимбионта –
34
Межгодовая изменчивость в динамике популяций
массовых видов планктона прибрежных вод Черного и Аравийского морей
![]()

a б

в
г  д
д

Рис. 3. Цветение ноктилюки: многомасштабная картина
Зимнее цветение ноктилюки в северо-западной части Аравийского моря (а), в феврале 2015 года, по данным дистанционных измерений (NASA, MODIS-Aqua; https://phys.org/news/2017-03-algae-bloom-arabian-sea-tied.html). Зимнее цветение ноктилюки в Оманском заливе (б) по данным дистанционных измерений (NASA, MODIS-Aqua). Цветение ноктилюки в Оманском заливе, в мае 2019 года (в) по данным дистанционных измерений (https://commons.wikimedia.org/wiki/File: Arabiansea_vir_2019 123.jpg). Фотография цветения зеленой формы ноктилюки (г) в прибрежных водах Оманского залива (фото С. А. Пионтковского). Фотография цветения красной формы ноктилюки (д) у берегов Калифорнии (фото S. Haddock, https://biolum.eemb.ucsb.edu/organism/redtide.html).
35
Пионтковский С. А., Загородняя Ю. А., Попова Е. В., Ал-Хашми Х. А.
![]()
Protoeuglena noctilulucae (который до недавней ревизии таксономической принадлежности имел название Pedinomonas noctilucae (Subrahman) Sweeney). В Черном море, в прибрежных водах умеренных широт восточной Атлантики и восточной части Тихого океана преобладает красная форма ноктилюки.
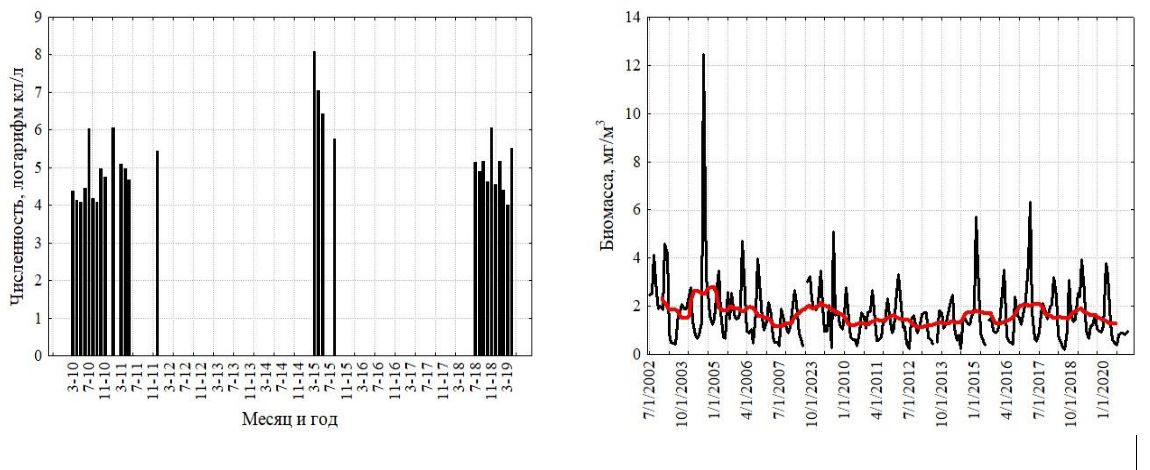
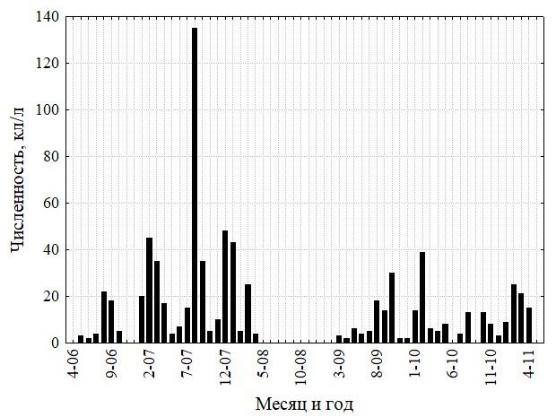
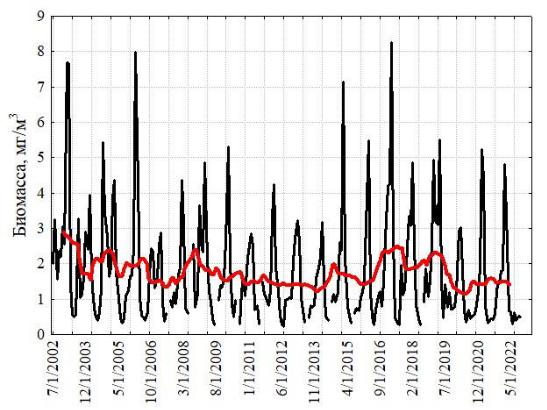
Межгодовая изменчивость численности ноктилюки в Оманском заливе (хотя и фрагментарно измеренная по собранным пробам) не обнаружила заметных трендов, что свидетельствует об достаточно стабильной модальности сезонных циклов в исследованном временном интервале (рис. 2). В сезонной динамике численности ноктилюки в прибрежных водах над глубинами около 20 м (рис. 4) также не обнаружено выраженных монотонных межгодовых трендов (тест Мэна-Кендалла, S=63; Z=1,23; p=0,22).
а
 в
в
б
г
Рис. 4. Многолетняя изменчивость численности ноктилюки в Оманском заливе (2010–
2018 гг.) (а), во всей северо-западной части Аравийского моря (19–27° с. ш., 56-65° в. д.) (б), в
мелководной бухте Оманского залива (в), и биомассы хлорофилла-а в Оманском заливе
(мг м-3, MODIS-Aqua, (г)
Красная кривая на правых рисунках характеризует многолетний тренд, полученный скользящей средней с окном в 12 месяцев.
Поскольку сборы планктонных проб были фрагментарны, мы дополнили данные по многолетней динамике дистанционными измерениями биомассы хлорофилла-а в Оманском заливе (рис. 4), тем более что зимний максимум этой биомассы в основном формируется ноктилюкой. Она вносит основной вклад и в летний максимум. 20-летняя серия измерений, построенная только по зимним данным, показала отсутствие многолетнего тренда биомассы во временных сериях (тест Мэна-Кендалла, S=8; Z=0,23; p=0,82).
Причины различия многолетних трендов популяций ноктилюки в Черном и Аравийском морях, вероятно, связаны как с различием их экологических ниш, так и с конкуренцией за
36
Межгодовая изменчивость в динамике популяций
массовых видов планктона прибрежных вод Черного и Аравийского морей
![]()
пищу с желетелыми организмами и другим зоопланктоном, так как ноктилюка в Черном море является гетеротрофом. В её пищевом рационе присутствуют объекты размером от нескольких до 800 мкм, что включает клетки фитопланктона, фекальные пеллеты зоопланктона, личинок двустворчатых моллюсков, науплиальные стадии и яйца копепод (Никишина и др., 2011). В Аравийском море ноктилюка – типичный миксотроф, с фотосинтезирующими эндосимбионтами в теле, обеспечивающими ноктилюке выживание в условиях недостатка пищи за счет первичной продукции симбионтов (Furuya et al., 2006).
Отсюда, экологическая ниша миксотрофа представляется более надежной, стабилизирующей многолетнюю динамику численности популяции ноктилюки. Интересно, что приблизительно вдвое большее (по сравнению с Аравийским морем) видовое разнообразие фитопланктона Черного моря (Георгиева, Сеничкина, 1996; Motwani et al., 2014; Al-Hashmi et al., 2019b; Piontkovski et al., 2019), который является потенциальной пищей для ноктилюки, не является значимым фактором в плане такой стабилизации. Следует также отметить, что эндосимбионты ноктилюки адаптированы к условиям гипоксии (D’Souza, 2022), что также повышает конкурентоспособность популяций зеленой формы ноктилюки.
Что же касается конкуренции из-за пищевых ресурсов, то в многолетней динамике популяций ноктилюки эта конкуренция представляется более напряженной в пелагиали прибрежных вод Черного моря, где ноктилюка конкурирует из-за пищи почти со всеми организмами мезозоопланктона и прежде всего с копеподами, как наиболее многочисленными и желетелым зоопланктоном, включая Aurelia aurita (Linnaeus, 1758), Mnemiopsis leidyi A.Agassiz, 1865 и Pleurobrahia pileus (O.F.Müller, 1776). По данным экспедиционных исследований 2010–2013 годов, сырая биомасса желетелых организмов превосходила биомассу ноктилюки в прибрежных и открытых водах у берегов Крыма в десятки раз (Zagorodnyaya et al., 2023). При этом, в 2005–2017 годах отмечено увеличение общей биомассы желетелых в открытых водах у берегов Крыма (Anninsky et al., 2022).
Данных о многолетней динамике биомассы желетелого зоопланктона – основного конкурента ноктилюки в прибрежных водах Омана и северо-западной части Аравийского моря, где она формирует мощные сезонные цветения, мы не нашли. Известные нам исследования посвящены сезонной изменчивости численности мезозоопланктона (Piontkovski et al., 2014; Al-Hashmi et al., 2019a) без количественной оценки желетелых организмов.
ЗАКЛЮЧЕНИЕ
Теоретическое углубление и региональная детализация широко принятой в морской экологии концепции Больших морских экосистем предполагает их многоплановое сравнение
- целью оптимизации управления и рационального использования их промысловых ресурсов. Экологические проблемы, вызванные изменением климата, указывают на приоритетность развития исследований на масштабах климатической изменчивости. В этом плане сравнение многолетних трендов в динамики численности и биомассы массовых видов-индикаторов состояния экосистем представляет особую ценность. Такое сравнение предпринято нами на примере пелагических экосистем Черного и Аравийского морей, в которых есть общие виды. В основу сравнительного анализа были положены данные многолетних дистанционных (со спутников) и контактных (с научно-исследовательских судов) измерений параметров, характеризующих обе пелагические экосистемы.
Оказалось, что биомасса и численность массового вида планктонных водорослей – Noctiluca scintillans в прибрежных водах Аравийского моря не имеет выраженного тренда межгодовой изменчивости в первых двух декадах 21 века, в то время как в Черном море выявлено уменьшение ее биомассы и численности, берущее начало с 1960-х годов. Выявленные различия могут быть связаны как с наличием миксотрофного питания ноктилюки в Аравийском море, которое обеспечивает бòльшую стабильность её численности, так и с более интенсивной конкуренцией за пищу с планктонными ракообразными (прежде всего, копеподами) и желетелыми организмами (медузами и гребневиками) в прибрежных
37
Пионтковский С. А., Загородняя Ю. А., Попова Е. В., Ал-Хашми Х. А.
![]()
водах Черного моря, что могло привести к многократному уменьшению биомассы ноктилюки.
Не менее актуальным представляется анализ многолетних трендов биомассы и численности ноктилюки в глубоководных районах Черного моря (за пределами шельфа). Результаты такого анализа мы планируем представить в следующей публикации.
Благодарности. Авторы признательны коллегам Отдела планктона ИнБЮМ: К. А. Галаговец, О. А. Гарбазей, А. С. Кудяковой и университета Султана Кабуса: Х. Ал-Хабси, С. Ал-Хусаиби за помощь в сборе и обработке планктонных проб.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 23-24-00007) и в рамках государственных заданий ФГБУН ИнБЮМ № 121030100028-0 «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана» и №
121040600178-6 «Структурно-функциональная организация, продуктивность и устойчивость морских пелагических систем». Часть полевых исследований была выполнена
- Центре коллективного пользования НИС «Профессор Водяницкий» Федерального государственного бюджетного учреждения науки Федерального исследовательского центра «Институт биологии южных морей имени А. О. Ковалевского» РАН.
Список литературы
Алескерова А. А., Кубряков А. А., Горячкин Ю. Н., Станичный С. В. Распространение вод из Керченского пролива в Черное море // Морской гидрофизический журнал. – 2017. – Т. 6, № 1. – С. 53–64.
Алескерова А. А., Кубряков А. А., Горячкин Ю. Н., Станичный С. В., Гармашов А. В. Распределение взвешенного вещества у западного побережья Крыма при воздействии сильных ветров различных направлений // Исследования Земли из космоса. – 2019. – № 2. – С. 74–88.
Георгиева Л. В., Сеничкина Л. Г. Фитопланктон черного моря: современное состояние и перспективы исследований // Экология моря. – 1996. – № 45. – С. 613.
Грезе В. Н., Балдина Э. П., Билева О. К. Динамика численности и продукция основных компонентов зоопланктона в неритической зоне Черного моря // Биология моря. – 1971. – № 24. – С. 12–49.
Грезе В. Н., Федорина А. И. Численность и биомасса зоопланктона // Основы биологической продуктивности Черного моря / [Ред. В. Н. Грезе]. – Киев: Наук. думка, 1979. – С. 157–164.
Дриц А. В., Никишина А. Б., Сергеева В. М., Соловьев К. А. Питание, дыхание и экскреция черноморской Noctiluca scintillans MacCartney в летний период // Океанология. – 2013. – Т. 53, № 4. – С. 1–10.
Ефимов В. В., Юровский А. В. Формирование завихренности и поля скорости ветра в атмосфере над Черным морем // Морской гидрофизический журнал. – 2017. – № 6. – С. 3–12.
Загородняя Ю. А., Ковалев А. В., Островская Н. А. Сезонные изменения биомассы кормового зоопланктона в открытых районах Черного моря у Крыма, в 1995 г. // Экология моря. – 2001. – Вып. 55. – С. 17–22.
Загородняя Ю. А., Павловская Т. В., Морякова В. К. Современное состояние зоопланктона у берегов Крыма // Современное состояние биоразнообразия прибрежных вод Крыма (черноморский сектор). – Севастополь: ЭКОСИ-Гидрофизика, 2003. – С. 49–83.
Загородняя Ю. А., Темных А. В., Морякова В. К. Сезонные изменения голопланктона в прибрежной зоне Черного моря в 2002 г. // Морской экологический журнал. – 2007. – № 1. – С. 31–42.
Кусморская А. П. Зоопланктон Черного моря и выедание его промысловыми рыбами // Труды ВНИРО. – 1954. – Т. 28. – С. 203–216.
Маштакова П. Г. Многолетняя динамика планктонного сообщества восточной части Черного моря. – Океанологические и рыбохозяйственные исследования Черного моря. – М.: Наука, 1985. – 271 с.
Никишина А. Б., Дриц А. В., Васильева Ю. В., Тимонин А. Г., Соловьев К. А., Ратькова Т. Н., Сергеева В. М. Роль популяции Noctiluca scintillans в трофодинамике планктона Черного моря в весенний период // Океанология. – 2011. – Т. 51, № 6. – С. 1090–1101.
Олефир И. В. Современное состояние кормового зоопланктона северо-западной части Черного моря // Современные проблемы и перспективы развития рыбохозяйственного комплекса. – М.: ВНИРО, 2017. – С. 211– 2014.
Петипа Т. С. О среднем весе основных форм зоопланктона Черного моря // Труды Севастопольской биологической станции. – 1957. – Т. 9. – С. 39–57.
Полищук Л. Н., Настенко Е. В., Гаркавая Г. П. Некоторые особенности современного состояния пелагического и нейстонного зооценов Черного моря // Экология моря. – 1984. – Вып. 18. – С. 25–34.
38
Межгодовая изменчивость в динамике популяций
массовых видов планктона прибрежных вод Черного и Аравийского морей
![]()
Токарев В. Н., Евстигнеев П. В., Машукова О. В. Планктонные биолюминесценты Мирового океана: видовое разнообразие, характеристики светоизлучения в норме и при антропогенном воздействии. – Симферополь: Н. Орианда, 2016. – 340 с.
Федорина А. И. Динамика развития зоопланктона Черного моря и причины, ее обусловливающие // ВНИРО.
1978. – Деп. ЦНИИ ТЭЧРХ 22. 05. 78, № 149. – С. 1–49.
Al-Hashmi K. A., Sarma V. V. B., Piontkovski S. A., Al-Habsi H., Harrison P. J. Response of phytoplankton to changes in hydrographic properties in a subtropical embayment in the Sea of Oman // International Journal of Ecology and Environmental Sciences. – 2019a. – Vol. 45. – N 5. – P. 71–84.
Al-Hashmi K. A., Piontkovski S. A., Bruss G., Hamza W., Al-Junaibi M., Bryantseva Y. Popova E. Seasonal variations of plankton communities in coastal waters of Oman // International Journal of Oceans and Oceanography. – 2019b. –Vol. 13, N 2. – P. 395–426.
Anninsky B. E., Finenko G. A., Datsyk N. A., Hubareva E. S. Expansion of gelatinous macrozooplankton in the open
Black Sea off Crimea under the weather events of recent years // Mediterranean Marine Science. – 2022. – Vol. 23, N 3. –
P. 460–472.
Arashkevich E.G., Louppova N. E., Nikishina A. B., Pautova L. A., Chasovnikov V. K., Drits A. V., Podymov O. I., Romanova R. R., Stanichnaya R. R., Zatsepin A. G., Kuklev S. B., Flint M. V. Marine environmental monitoring in the shelf zone of the Black Sea: assessment of the current state of the pelagic ecosystem // Oceanology. – 2015. – Vol. 55, N 6. – P. 871–876.
Cebrián J., Valiela I. Seasonal pattern in phytoplankton biomass in coastal ecosystems // Journal of Plankton Research. – 1999. – Vol. 21, N 3. – P. 429–444.
Dagenais-Bellefeuille S., Morse D. Putting the N in dinoflagellates // Frontiers in Microbiology. – 2013. – N 4. – DOI:10.3389/fmicb.2013.00369.
D’Souza A. The climate-driven adaptation of mixotrophic green Noctiluca scintillans in the Arabian Sea // Terra Science and Education. – 2022. – DOI:10.36838/v4i6.5.
Furuya K., Saito H., Sriwoon R., Omura T., Furio E. E., Borja V. M, Lirdwitayaprasit T. Vegetative growth of Noctiluca scintillans containing the endosymbiont Pedinomonas noctilucae // African Journal of Marine Science. – 2006. – Vol. 28, N 2. – P. 305–308.
Goes J. I., Gomes H. R., Al-Hashmi K., and Buranapratheprat A. Ecological drivers of green Noctiluca blooms in two monsoonal-driven ecosystems / [Eds. P. M. Glibert et al.]. – Global Ecology and Oceanography of Harmful Algal Blooms, Ecological Studies. – 2018. – Vol. 232. – P. 232–244.
Michneva V, Stefanova K. Species diversity, abundance and biomass dynamic of mesozooplankton along the Bulgarian Black Sea (2008-2010) // Proceeding of Union of Scientists –Varna: Series “Marine Sciences”. – 2011. – P. 97– 104.
Mikaelyan A. S., Malej A., Shiganova T. A., Turk V., Sivkovitch A. E., Musaeva E. I., Kogovšek T., Lukasheva T. Populations of the red tide forming dinoflagellate Noctiluca scintillans (Macartney): A comparison between the Black Sea and the northern Adriatic Sea // Harmful Algae. – 2014. – N 33. – P. 29–40.
Motwani G., Raman M., Matondkar P., Parab S., Pednekar S., Solanki H. Comparison between phytoplankton bio-diversity and various indices for winter monsoon and inter monsoon periods in north-eastern Arabian Sea // Indian Journal of Geo-Marine Sciences. – 2014. – Vol. 43, N 8. – P. 1513–1518.
Piontkovski S. A., Al-Maawali A., Al-Mantheri W., Al-Hashmi K., Popova E. Zooplankton of Oman coastal waters // Agricultural and Marine Sciences. – 2014. – Vol. 19. – P. 37–50.
Piontkovski S.A., Queste B., Al-Shaaibi A., Al-Hashmi K., Bryantseva J., Popova E. Subsurface algal blooms of the north-western Arabian Sea // Marine Ecology Progress Series. – 2016. – N 566. – P. 67–78.
Piontkovski S. A., Hamza W., Al-Abri N., Al-Busaidi S., Al-Hashmi K. A. The Gulf and the Sea of Oman: an overview of seasonal variations of physical, chemical and biological characteristics // Aquatic Ecosystem Health and Management. – 2019. – N 22. – P. 108–130.
Schott F. A., McCreary J. P. The monsoon circulation of the Indian Ocean // Progress in Oceanography. – 2001. – N 51. – P. 1–123.
Sherman K. Toward Ecosystem-Based Management (EBM) of the World’s Large Marine Ecosystems During Climate Change // Environmental Development. – 2014. – N 11. – P .43–66.
Smetacek V. Diatoms and the silicate factor // Nature. – 1998. – N 391. – P. 224–225.
Suslin V. V., Churilova T. Ya. Regional algorithm for separating light absorption by chlorophyll-a and colored detrital matter in the Black Sea, using 480–560 nm bands from ocean color scanners // International Journal of Remote Sensing. – 2017. – Vol. 37, N 18. – P. 4380–4400.
Transboundary Water Assessment Programme. UNESCO [Electronic resource]. – http://onesharedocean.org/public_store/lmes_factsheets/factsheet_32_Arabian_Sea.pdf. 2015
Űstűn F, Bat L, Mutlu E. Seasonal variation and taxonomic composition of mesozooplankton in the southern Black Sea (off Sinop) between 2005 and 2009, 2018 // Turkish Journal of Zoology. – 2018. – N 42. – P. 541–556.
Zagorodnyaya Yu. A., Piontkovski S. A. Seasonal and interannual variations of the abundance of the dinoflagellate Noctiluca scintillans in the northern Black Sea // Marine Biology Research. – 2022. –Vol. 18, N 1–2. – P. 104–116.
Zagorodnyaya Yu. A., Piontkovski S. A., Gubanov V. V. The pelagic ecosystem of the Black Sea goes gelatinous // Marine Biology Research. – 2023. In press.
39
Пионтковский С. А., Загородняя Ю. А., Попова Е. В., Ал-Хашми Х. А.
![]()
Wang F., Shao W., Yu H., Kan G., He X., Zhang D., Ren M. Wang G. Re-evaluation of the power of the Mann-Kendall Test for detecting monotonic trends in hydrometeorological time series // Frontiers in Earth Science. – 2020. – Vol. 8, N 14. DOI:10.3389/feart.2020.00014.
Piontkovski S. A., Zagorodnyaya Yu. A., Popova E. V., Al-Hashmi K. A. Interannual variability of some abundant plankton species populations of the Black Sea and Arabian Sea coastal waters // Ekosistemy. 2023. Iss. 35. P. 28–40.
A general similarity of the Black Sea and Arabian Sea structure and dynamics in a number of biological and physical characteristics makes the comparison of long-term trends of these seas theoretically interesting. One of the planktonic dinoflagellate algae, namely Noctiluca scintillans (Macartney) Kofoid and Sweezy, 1921, which hold a specific state in a pelagic ecosystem, seemed to be interesting for a comparative analysis. Populations of this species form huge aggregations in coastal waters and possess a high bioluminescent potential due to a high magnitude of single flashes. Large size cells are one order of magnitude that of small sized phytoplankton. Moreover, Noctiluca cells exhibit fluorescence that enables one to monitor the spatio-temporal abundance and biomass dynamics by means of fluorimeters. Noctiluca cells were counted by means of a microscope in the Bogorov chamber in our study. Empirical size-weight ratios were applied to convert the abundance to the biomass. Data analysis of remotely sensed and directly measured Noctiluca abundance and biomass showed no pronounced trend in coastal Arabian Sea waters during the first two decades of the 21st century. Meanwhile, the decline was observed in coastal waters of the northern Black Sea, since the 1960s. A distinct feeding strategy could be a clue to different trends. Noctiluca exhibits heterotrophic feeding in the Black Sea while a mixotrophy was observed in the Arabian Sea. A mixotrophic strategy should enhance the stability of interannual population dynamics. The other factor contributing to observed trend difference should be the competition for food (with planktonic crustaceans, gelatinous organisms and small pelagic fishes) which seems to be comparatively high in the Black Sea.
Key words: Black Sea, Arabian Sea, chlorophyll-a, zooplankton, phytoplankton, Noctiluca scintillans.
Поступила в редакцию 10.03.23
Принята к печати 23.04.23
40

