УТОЧНЕНИЕ МОРФОЛОГИИ И ЭКОЛОГИИ ДВУХ ВИДОВ РОДА PECTENOGAMMARUS REID, 1940 (GAMMARIDAE, AMPHIPODA) ИЗ ЧЕРНОГО И АЗОВСКОГО МОРЕЙ (КРЫМ)
CLARIFICATION OF MORPHOLOGY AND ECOLOGY OF TWO SPECIES OF THE GENUS PECTENOGAMMARUS REID, 1940 (GAMMARIDAE, AMPHIPODA) FROM THE BLACK AND AZOV SEAS (CRIMEA)
JOURNAL: «EKOSISTEMY», Issue 38, 2024
Publication text (PDF): Download
UDK: 595.371.13-14/-15(262.5+262.54)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Grintsov V.A.
A. O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2024-38-124-139
PAGES: from 124 to 139
STATUS: Published
LANGUAGE: Russian
KEYWORDS: Amphipoda, Pectenogammarus, ecology, functional morphology, Black Sea, the Sea of Azov.
ABSTRACT (ENGLISH):
The researchers studied the morphology and ecology of two species from the genus Pectenogammarus – Pectenogammarus olivii (H.Milne Edwards, 1830) and Pectenogammarus foxi (Schellenberg, 1928) from the Black and Azov Seas coasts of Crimea. It is found that the species P. foxi prefers pebble-sandy beaches, and the species P. olivii prefers rocky and rocky-boulder beaches. Morphological analysis of P. foxi and P. olivii shows that the differences in spines or setae between these species relate primarily to the epimeral and abdominal parts of the body. The nature of the location, the number of spines, the type (simple, plumose), and the number of setae on the epimeral plates of the second and third epimeron segments, the dorsal and subdorsal sections of the urosome, the outer edge of the outer ramus of the uropod 3, the inner edge of the inner ramus of the uropod 3, the outer edge of the lobes of the telson are analyzed. The features of the location, number, and type of setae and spines of the P. foxi species, which prefers a splash zone of beaches with regularly moving pebbles and sand, are the following: 1) the third epimeral plate is armed only with setae; 2) on the subdistal section of the inner edge of the inner ramus of the uropod 3, with an increase in the size of the individual, not only the number of spines and setae increases, but also the variety of their types. It indicates an increase in the polyfunctionality of this section as an individual grows; 3) on the subdorsal and dorsal sections of the first segment of the urosome, mainly setae are observed, and only occasionally spines (no more than 26 % of individuals). The features of the location and type of setae, and spines of the species of P. olivii, which prefers clusters of stones, boulders and other massive solid substrates in a splash zone are as follows: 1) the third epimeral plate is equipped not only with setae, but also with strong spines; 2) on the subdistal section of the inner edge of the inner ramus of uropods 3, only plumose setae are present, regardless of the study area; 3) on the subdorsal and dorsal sections of the first urosomal segment, only spikes are observed. It is revealed that the P. olivii species, inhabiting a complex environment comprising both massive artificial (concrete structures) and natural (boulders, stones) substrates in a surf-exposed coastal area, exhibits a reduction in the number of feathery setae on the outer edge of the outer ramus of the uropod 3, as well as on the inner edge of the inner ramus of the uropod 3. It is assumed that all the identified differences are related to the mobility of the substrates and hydrodynamic conditions in these complex habitats.
ВВЕДЕНИЕ
Амфиподы – один из отрядов класса ракообразных Malacostraca, наиболее успешно освоивший все сообщества и глубины Мирового океана, в том числе благодаря пластичной морфологии и уникальному сочетанию конечностей разного типа. В значительной степени это связано с функциональной составляющей морфологии, понимание которой – один из ключей познания механизмов выживания амфипод в самых различных условиях Мирового океана. Вместе с тем публикации в данной области исследования весьма малочисленны и касаются прежде всего ротовых органов (Цветкова, 1975; Watling, 1993; Mayer at al., 2009; Pavesi, Olesen, 2017). Меньше работ известно в области исследования морфологии гнатопод (Holmquist, 1982), коксальных пластинок (Moore, 2009) и переопод (Гурьянова, 1951). Особенности специфических выростов конечностей представителей семейства Hyalidae Bulyčeva, 1957, связанные с гидродинамикой, упоминаются в работе (Bousfield, Hendrycks, 2002). Анализ морфологических изменений в процессе эволюции наиболее полно сделан Е. Ф. Гурьяновой (1951), С. В. Василенко (1974) а также Барнаром и Караманом (Barnard, Karaman, 1991).
Анализ функционального значения морфологии амфипод, обитающих в экстремальных зонах, таких как зона заплеска, в связи с предпочитаемым биотопом или сообществом, практически не проводился. Вместе с тем, именно такие условия требуют от видов наиболее эффективных приспособлений.
Цель настоящей работы – изучить особенности экологии и функциональной морфологии двух видов из рода Pectenogammarus: Pectenogammarus olivii (H.Milne Edwards, 1830) и Pectenogammarus foxi (Schellenberg, 1928).
МАТЕРИАЛ И МЕТОДЫ
Особей P. olivii (Gammaridae, Amphipoda) собирали в зоне заплеска в четырех районах Крыма: м. Тарханкут (дата отбора пробы – 13.06.2008); Севастополь, внешний рейд Севастопольской бухты (дата отбора пробы – 23.06.2010); м. Казантип (дата отбора пробы – 31.05.2023), Севастопольская бухта (дата отбора пробы – 27.08.2023). Все особи собраны из скоплений оторванных водорослей (0–3 м от берега) или под камнями. Особей P. foxi отбирали в трех районах Крыма: Севастополь, пляж вблизи базы Мокроусова (дата отбора пробы – 26.07.2011); м. Казантип (дата отбора пробы – 31.05.2023); Карадаг, б. Пуццолановая (дата отбора пробы – 08.04.2011). Типы грунтов в районах отбора проб представлены в таблице 1.
Таблица 1
Районы отбора проб и типы грунтов
| Районы отбора проб | Типы грунтов |
| м. Казантип, Азовское море | Каменистый, галечно-песчанный |
| м. Тарханкут | Каменистый, галечно-песчанный |
| Севастополь, внешний рейд Севастопольской бухты | Скалы, бетонные конструкции, валуны |
| Севастопольская бухта, вблизи р. Черной | Валуны, галька, бетонные конструкции |
| Севастополь, пляж вблизи базы Мокроусова | Галечно-песчанный |
| Карадаг, б. Пуццолановая | Галечно-песчанный |
Пробы с особями фиксировали 96 % этанолом. В лаборатории особей отбирали с использованием микроскопа Микмед 5 и светового биологического микроскопа МБС 9. Исследовали только взрослых самцов, чтобы исключить половые и возрастные различия. Различия, связанные с размером особей, были по возможности нивелированы, хотя и эти данные были получены и будут представлены в данной статье. Исследованные элементы морфологии, и количество проанализированного материала соответственно районам отбора проб представлено в таблице 2.
Измерения проводили с помощью окуляр-микрометра светового биологического микроскопа МБС 9. Фотографии габитусов и частей тела взрослых самцов сделаны с использованием микроскопа Hitachi SU 3500. Препараты для SEM фотографирования подготавливали следующим образом: особей помещали в 96 % этанол. После выдерживания сутки, особей очищали от посторонних частиц с использованием иголки и пипетки, а затем переносили для сушки. Сушку проводили методом критической точки в приборе Leica EM CPD300 в 96 % этаноле. После сушки препараты помещали на столик с двусторонним скотчем и переносили в прибор Leica EM ACE200 для напыления смесью золото-палладий. После напыления препараты помещали в микроскоп Hitachi SU 3500 и фотографировали. Для анализа были выбраны элементы вооружения частей тела и придатков взрослых самцов.
Таблица 2
Исследованные элементы морфологии двух видов Pectenogammarus (взрослые самцы), районы отбора проб и количество проанализированного материала
| Исследованные элементы морфологии | Виды (районы отбора проб, количество проанализированного материала) |
| Уросом | P. olivii – м. Казантип – 50 экз.; Севастополь, внешний рейд Севастопольской бухты – 50 экз.; Севастопольская бухта вблизи р. Черной – 50 экз.; м. Тарханкут – 50 экз.P. foxi – м. Казантип – 50 экз; Севастополь, пляж базы Мокроусова – 50 экз.; Карадаг, б. Пуццолановая – 50 экз. |
| Эпимеральные пластинки 2-й пары | P. olivii – м. Казантип – 100 пластинок; Севастополь, внешний рейд Севастопольской бухты – 80 пластинок; Севастопольская бухта вблизи р. Черной – 100 пластинок; м. Тарханкут – 96 пластинок.P. foxi – м. Казантип – 63 пластинки; Севастополь, пляж базы Мокроусова – 100 пластинок; Карадаг, б. Пуццолановая – 100 пластинок |
| Эпимеральные пластинки 3-й пары | P. olivii – м. Казантип – 100 пластинок; Севастополь, внешний рейд Севастопольской бухты – 80 пластинок; Севастопольская бухта вблизи р. Черной – 100 пластинок; м. Тарханкут – 96 пластинок.P. foxi – м. Казантип – 63 пластинки; Севастополь, пляж базы Мокроусова – 99 пластинок; Карадаг, б. Пуццолановая – 100 пластинок |
| Уропод 3-й пары наружная ветвь | P. olivii – м. Казантип – 25 ветвей; Севастополь, внешний рейд Севастопольской бухты – 25 ветвей; Севастопольская бухта вблизи р Черной – 25 ветвей; м. Тарханкут – 25 ветвей.P. foxi – м. Казантип – 23 ветви; Севастополь, пляж базы Мокроусова – 25 ветвей; Карадаг, б. Пуццолановая – 25 ветвей |
| Уропод 3-й пары внутренняя ветвь | P. olivii – м. Казантип – 25 ветвей; Севастополь, внешний рейд Севастопольской бухты – 25 ветвей; Севастопольская бухта вблизи р. Черной – 25 ветвей; м. Тарханкут – 25 ветвей.P. foxi – м. Казантип – 23 ветви; Севастополь, пляж базы Мокроусова – 25 ветвей; Карадаг, б. Пуццолановая – 25 ветвей |
| Лопасти тельсона | P. olivii – м. Казантип – 120 лопастей; Севастополь, внешний рейд Севастопольской бухты – 80 лопастей; Севастопольская бухта вблизи р. Черной – 99 лопастей; м. Тарханкут – 98 лопастей.P. foxi – м. Казантип – 64 лопасти; Севастополь, пляж базы Мокроусова – 100 лопастей; Карадаг, б. Пуццолановая – 98 лопастей |
За шипы были приняты выросты кутикулы игловидной формы, не сгибающиеся при воздействии; за щетинки – выросты кутикулы волосовидной формы, поддающиеся сгибанию при воздействии (по Barnard, Karaman, 1991).
Идентификацию особей проводили с использованием определителей (Мордухай-Болтовской и др., 1969; Bellan-Santini, 1998; Grintsov, Sezgin, 2011; Гринцов, 2022).
Для статистического анализа использовали программы MS Exel и PAST. Рассчитывались среднее значение и стандартное отклонение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экология и функциональная морфология
Два вида – P. foxi и P. olivii (рис. 1) – обитают в одной и той же зоне моря – заплеске галечно-песчанных и каменистых пляжей, иногда во время штормов укрываясь на большей глубине или забиваясь в щели под крупными валунами. Однако наблюдения и многочисленные сборы в Черном и Азовском морях показали, что один из них P. foxi преимущественно заселяет галечно-песчанные пляжи, в то время как P. olivii преимущественно поселяется в пространстве под камнями и валунами. При этом P. olivii можно обнаружить в значительных количествах в зоне заплеска в скоплениях оторванных макрофитов, приносимых волнами. P. foxi также встречаются в этих скоплениях, но в меньшем количестве. Таким образом, данные два вида в основном разделили зону обитания и вместе встречаются реже, часто образуя моновидовые поселения.

Рис. 1. Внешний вид самцов Pectenogammarus olivii (A) и P. foxi (Б) (вид сбоку, масштабная линейка – 1 мм)
Морфологические приспособления выростов кутикулы в условиях постоянно перемещающейся штормами гальки и песка, и относительно стабильных камней (особенно валунов) могут различаться предположительно по причине различия типов грунтов и генерируемой морем различной гидродинамики соответственно типу грунта. Рассмотрим щетинки и шипы, и их возможную функциональную роль, поскольку как указывал А. Н. Северцов (1949), каждый орган полифункционален, но в зависимости от обстоятельств какая-то из функций доминирует. Щетинки амфипод полифункциональны, поскольку ряд функций уже выявлен и доказан. Щетинки используются как органы, помогающие очищать определенные части тела (Цветкова, 1975) помогать продвижению пищи к ротовому отверстию (Исрапов, 1992), играть роль элементов ловчего аппарата на гнатоподах и антеннах для сбора частиц детрита и взвеси (Bellan-Santini, 1998), функционировать как чувствительные органы (Цветкова, 1975). Дополнительно можно предположить, что щетинки играют роль элементов, смягчающих удар животного об твердые предметы во время шторма. Шипы амфипод прежде всего органы защиты от хищников, но они могут быть и сенсорными органами, поскольку часто на концах они снабжены тонкими волосками. На дистальных концах гнатопод и переопод группы шипов являются дополнительным органом захвата субстрата, действуя вместе с когтем как зажим. Они получили название «запирательных» шипов (Цветкова, 1975). Шипы могут быть и дополнительным элементом «расклинивания» амфипод в щелях под камнями во время шторма. Шипы, как и щетинки, могут участвовать в очищении особи от налета на теле и конечностях (Цветкова, 1975).
Морфологический анализ показал, что различия выростов кутикулы (шипов или щетинок) между P. foxi и P. olivii охватывают прежде всего эпимеральную и абдоминальную части тела – вооружения наружной поверхности эпимеральных пластинок вблизи их вентрального края, особенно антеровентральной части, дорсальной и субдорсальной частей уросомальных сегментов, вооружения уропода 3, как наружной, так и внутренней ветвей, а также лопастей тельсона.
Рассмотрим эти различия между P. foxi и P. olivii с привлечением знаний об функциональных назначениях щетинок и шипов. Анализ выборок взрослых самцов показал стабильное различие в кутикулярных образованиях не только в зависимости от вида, но и районов отбора, что отражает кроме прочего и степень вариабельности этих элементов.
Сегменты уросомы, дорсальные и субдорсальные участки. Сегменты уросомы, дорсальные и субдорсальные участки представлены на рисунке 2.
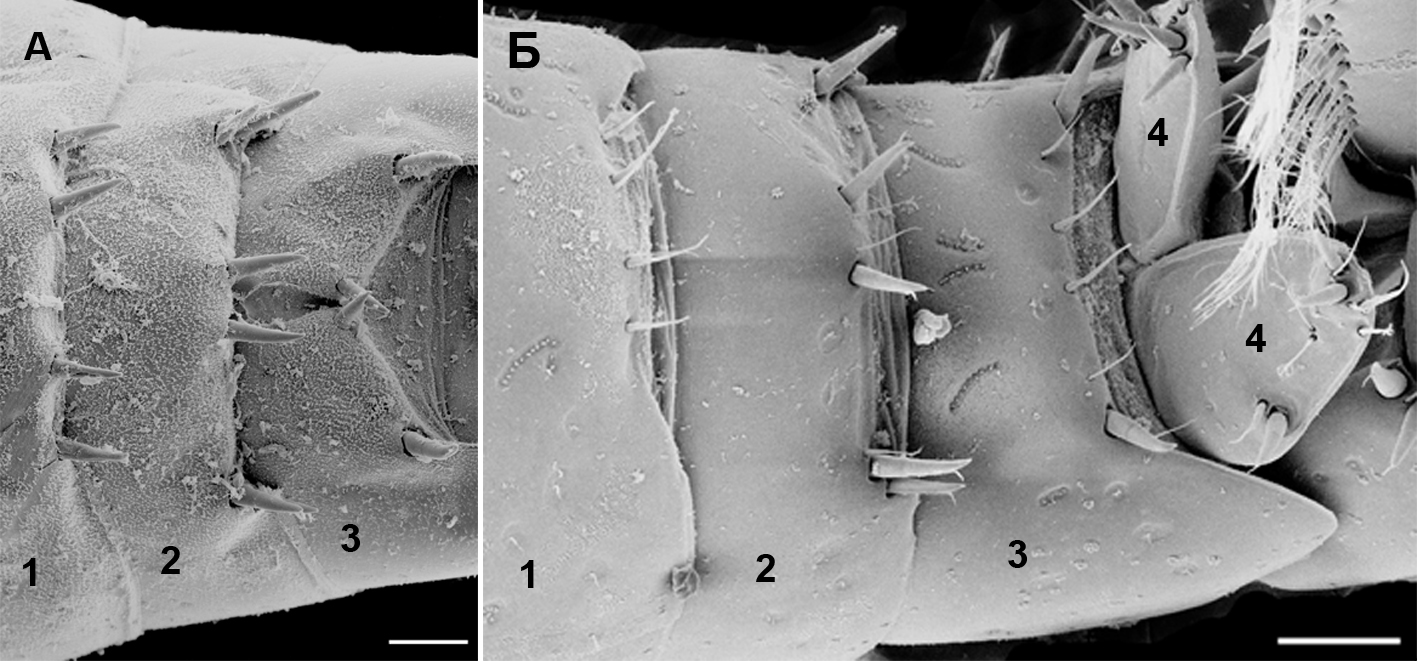
Рис. 2. Внешний вид уросомальных сегментов Pectenogammarus olivii (A) и P. foxi (Б) (вид сверху)
1 – первый сегмент уросома; 2 – второй сегмент уросома; 3 – третий сегмент уросома; 4 – лопасти тельсона. Масштабная линейка – 0,1 мм.
Кутикулярные выросты дорсальной и субдорсальной частей сегментов уросомы для Gammaridae используются систематиками как важная часть морфологического описания видов или таксонов более высокого ранга (Цветкова, 1975; Грезе, 1977, 1985). Тем не менее, например, формулы числа щетинок и шипов дорсальной и субдорсальной частей уросомальных сегментов уросомы, которые приводились в этих описаниях, касались отдельных экземпляров, по которым они описывались. Однако, анализ этих элементов на данных участках сегментов и даже их тип (щетинки, щипы) у различных особей могут варьировать, что не совпадает с описанием. Представляется крайне важным при описании делать по возможности анализ вариабельности некоторых признаков, которые считаются важными для определения. К сожалению, это не выполняется во многих описаниях, что затрудняет процесс идентификации вида и приводит к появлению множества «видов», которые приходится потом сводить в синонимы.
Анализ двухсот экземпляров P. olivii из районов с разными условиями, в двух морях (Азовское море – м. Казантип: Черное море – м. Тарханкут; внешний рейд Севастопольской бухты), показал, что шипы и щетинки в дорсальной и субдорсальной части уросомальных сегментов подвержены вариабельности. Различается как их количество, так и состояние (под последним понимается насколько массивными могут быть шипы и щетинки). Так, около 10 % особей во всех исследованных регионах имели в разной степени утонченные шипы в дорсальном ряду третьего сегмента уросомы, вплоть до замены их щетинками, хотя в описании Грезе (Грезе, 1985) у черноморских особей отмечены только шипы. Исследование кутикулярных образований P. foxi (150 экз.) в области дорсальной и субдорсальных участков сегментов уросомы также показало, что наряду с обычно отмечаемыми шетинками для дорсального и субдорсальных участков первого сегмента уросомы, у некоторых особей встречаются крепкие, развитые шипы. Доля взрослых самцов с шипами на вышеуказанных участках составляет для района Севастополя (пляж вблизи базы Мокроусова) 17 % от всех исследованных особей; района м. Казантип (Азовское море) – 6 %; района бухты Пуццолановой (Карадаг, Черное море) – 26 %. При этом наблюдается тенденция увеличения доли особей с шипами на вышеуказанных участках с возрастанием средней длины особей. Так, наименьшая доля (6 %) приходится на м. Казантип, при средней длине особи 6,13±0,72 мм (средняя длина ± стандартное отклонение), среднее значение (17 %) приходится на район базы Мокроусова вблизи Севастополя (средняя длина особи – 8,14±1,02 мм), а наибольшее значение (26 %) – на бухту Пуццолановую, Карадаг (средняя длина особи – 11,64±1,21 мм). Нет сомнения, что эти признаки контролируются генетически, но проявление шипа или щетинки в данном участке предположительно может иметь и регуляцию со стороны внешней среды – так, можно предположить, что более крупным особям в некоторых случаях нужны и шипы как защитные элементы во время штормов, когда галька движется и может травмировать особь. Не исключено что возможный механизм образования шипов у некоторых особей включается при определенном сочетании влияющих факторов, например, размерного состава фрагментов гальки и песка, в интерстециали которой живут особи P. foxi, а также размеры самих особей. Возможно, чем больше размер особи по сравнению с размерами гальки, тем вероятнее опасность гибели от травмирования и тем важнее шипы, снижающие опасность столкновения особей с двигающейся галькой. Представляется, что по мере роста особи вероятность таких столкновений с двигающимся субстратом возрастает и включается генетический механизм появления шипов как дополнительных элементов защиты.
Эпимеральные пластинки второго сегмента плеосомы. Эпимеральные пластинки второго сегмента плеосомы представлены на рисунке 3 ЕР2.
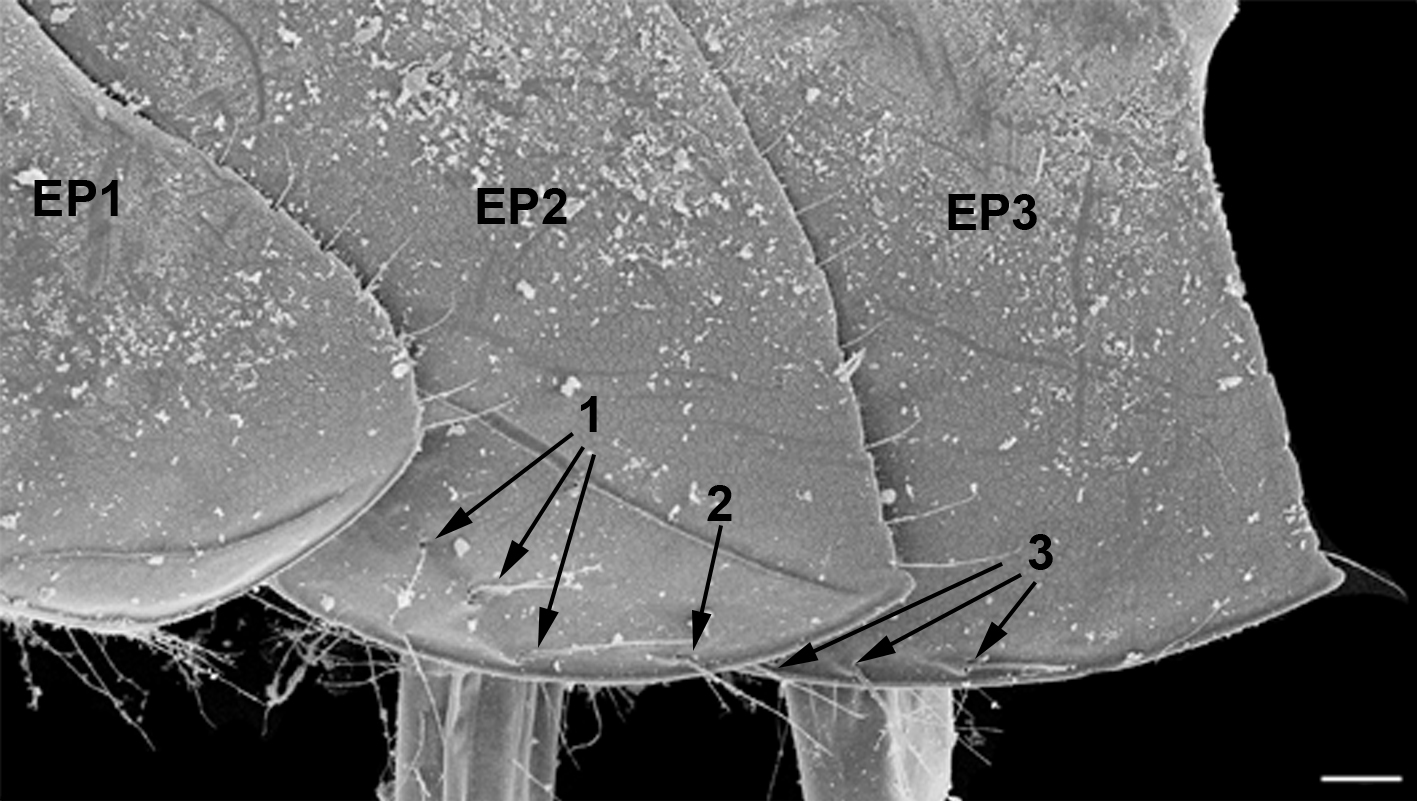
Рис. 3. Эпимеральные пластинки Pectenogammarus foxi (вид сбоку)
EP1, EP2, EP3 – эпимеральные пластинки 1, 2 и 3 сегментов эпимерона; 1 – кутикулярные выросты косого ряда второй эпимеральной пластинки; 2 – дополнительные кутикулярные выросты второй эпимеральной пластинки; 3 – кутикулярные выросты третьей эпимеральной пластинки. Масштабная линейка – 0,1 мм.
Pectenogammarus olivii. Эпимеральные пластинки 2-го сегмента плеосомы имеют шипы и щетинки, расположенные в определенных участках наружной поверхности пластинки. Это участок вблизи антеро-вентрального края пластинки и немного в сторону от него (рис. 3). Обычно шипы и/или щетинки в разном сочетании располагается по косой к вентральному краю. Иногда отмечаются дополнительные шипы или щетинки, расположенные или в стороне от косого ряда, или/и вдоль средней части вентрального края или чуть дальше к его заднему краю (рис. 3). Еще один важный момент – и щетинки и шипы ориентированы по направлению к задней части тела, что может снижать вероятность травмирования базиподита седьмого переопода шипом на эпимеральной пластинке при движении переопода. Расположение косого ряда неслучайно, Ряд расположен вдоль заднего края базиподита седьмого переопода, когда особь подгибает плеон и уросом или седьмой переопод двигается назад. Количественный анализ числа шипов и щетинок на эпимеральной пластинке 2 показал следующее: у особей из м. Казантип при средней длине особи 7,14±0,81 мм (средняя длина ± стандартное отклонение), число шипов косого ряда колебалось между их отсутствием и тремя шипами. Такие же пределы были и у щетинок. При этом, с ростом особи число щетинок и шипов увеличивалось. Так при длине особи от 5,10 до 6,25 мм отмечено только 0, 1 или 2 шипа; а в диапазоне длины 6,26–8,8 мм появлялся третий дополнительный шип и/или щетинка. Дополнительно к косому ряду были отмечены дополнительные шипы и щетинки также от одного до трех, а их количество тоже увеличивалось с возрастанием длины особей аналогично шипам и щетинкам косого ряда. Однако количество данных элементов варьировало, на что указывает их отсутствие у 30 % самых крупных особей.
В районе внешнего рейда Севастопольской бухты при средней длине особи 7,96±0,92 мм, как и на м. Казантип, отмечали от 1 до 3 шипов, а число щетинок оказалось меньше – от 0 до 2 практически при той же самой длине особей. Дополнительных шипов и щетинок также оказалось меньше чем на м. Казантип – от 0 до 2. Особи из района Севастополя оказались более шиповатыми относительно м. Казантип в косом ряду и менее вооруженными дополнительными элементами кутикулы.
В районе м. Тарханкут при средней длине особей 6,64±0,84 мм диапазоны числа шетинок и шипов практически совпали с таковыми для м. Казантип и так же отличались от диапазонов этих элементов для района внешнего рейда Севастопольской бухты. Наконец, в Севастопольской бухте вблизи р. Черной (район защищен от шторма) при средней длине особей 7,47±1,28 мм появляются особи, у которых нет либо шипов, либо щетинок в косом ряду, подобно особям из удаленных районов м. Тарханкут и м. Казантип, что сближает их больше между собой, чем с соседним, близко расположенным районом внешнего рейда Севастопольской бухты. Однако дополнительных элементов (шипов, щетинок) у них меньше, чем у других трех районах исследования, большинство особей их не имеют совсем.
Сам по себе факт подобного варьирования свидетельствует о возможном влиянии внешней среды, что весьма важно как для выживания, так и для эволюции, поскольку допускает выживание особей с тем или иным количеством шипов и щетинок при самых разных воздействиях окружающей среды.
Участок на внешнем рейде Севастопольской бухты расположен в прибойной зоне. Дополнительно к этому данный участок – сложное сочетание камней, валунов и искусственных бетонных конструкций, что, возможно, способствовало (за счет гидродинамики) увеличению числа шипов на поверхности эпимеральных пластинок вторых плеосомальных сегментов. На других участках прибрежья нет такого сочетания твердых субстратов, как на внешнем рейде Севастопольской бухты: на м. Казантип и м. Тарханкут – это обломки валунов и камни, а внутри Севастопольской бухты субстрат как на двух предыдущих мысах плюс закрытое от штормов место.
Pectenogammarus foxi. Количественный анализ числа шипов и щетинок на эпимеральной пластинке 2 показал следующее: у особей из м. Казантип при средней длине особи 6,11±0,71 мм (средняя длина ± стандартное отклонение), число шипов косого ряда колебалось между их отсутствием и двумя шипами. Число щетинок колебалось в большем диапазоне от 1 до 5. Доля особей с шипами была невелика и составляла 6,25 %. Щетинки косого ряда были отмечены у всех особей. Дополнительно к косому ряду были отмечены только щетинки, количество которых колебалось между их отсутствием и двумя щетинками. Щетинки присутствовали у 61 % просмотренных элементов.
В районе Севастополя (база Мокроусова) при средней длине особей 8,14±1,02 мм шипы были отмечены только на косом ряду в 3 % от числа проанализированных элементов. И их максимальное количество было 2. Число щетинок колебалось в большем диапазоне, чем в районе м. Казантип – от 0 до 8. И присутствовали они у 98 % просмотренных элементов. Дополнительно к косому ряду были отмечены только щетинки, количество которых колебалось между их отсутствием и пятью щетинками. Щетинки присутствовали у 94 % просмотренных элементов.
В районе б. Пуццолановой (Карадаг) при средней длине особи 11,64±1,21 мм шипы были отмечены только на косом ряду в 4 % от числа проанализированных элементов, и в случае их присутствия был только 1 шип. Число щетинок колебалось в большем диапазоне, чем в районе м. Казантип, но сопоставимо с районом Севастополя – от 2 до 9. И присутствовали они у всех просмотренных элементов. Дополнительно к косому ряду были отмечены только щетинки, количество которых колебалось между их отсутствием и пятью щетинками. Щетинки присутствовали у 85 % просмотренных элементов.
В результате анализа не выявлено значительных различий в показателях щетинок и шипов. Все они объяснимы различием в размерах особей. По щетинкам более мелкие в среднем особи м. Казантип соответственно имеют меньшее их число. По шипам различия вообще не просматриваются, эти элементы редки у данного вида, а их число на эпимеральных пластинках второго сегмента плеосомы мало.
Эпимеральные пластинки третьего сегмента плеосомы. Эпимеральные пластинки третьего сегмента плеосомы представлены на рисунке 3 EP3. В отличие от эпимеральной пластинки второго сегмента плеосомы, эти эпимеральные пластинки имеют ряды шипов и щетинок только вблизи вентрального края и не отклоняются от него в сторону (рис. 3 EP3). Рассмотрим их в соответствие с районами, где собран материал.
Pectenogammarus olivi. Казантип. Отмечено, что на данном участке эпимеральной пластинки либо шипы, либо щетинки могут отсутствовать вовсе. Количество шипов на одну эпимеральную пластинку колеблется от 1 до 3, щетинок – от 1 до 4. Общее количество выростов кутикулы может доходить до четырех в разном сочетании шипов и щетинок.
Севастополь, внешний рейд Севастопольской бухты, открытое море. Почти все особи на эпимеральных пластинках 3 пары имеют шипы. Из 100 исследованных эпимеральных пластинок только на 2 не было шипов, тогда как в районе м. Казантип таких пластинок было 42 из 100 исследованных. Количество щетинок в районе внешнего рейда Севастопольской бухты было напротив меньше, чем в районе м. Казантип. Если в последнем отмечали 9 эпимеральных пластинок с 4 щетинками из 100 исследованных, то в районе внешнего рейда их не было совсем.
Севастополь, Севастопольская бухта вблизи р. Черная, район, закрытый от шторма. Данные по этому району очень близки к таковым удаленного от него м. Казантип, и весьма далеки от расположенного вблизи внешнего рейда Севастопольской бухты. Так в бухте Севастополя у значительного числа эпимеральных пластинок 3 пары отсутствовали шипы (24 пластинки из 80 исследованных), максимальное количество шипов на одну эпимеральную пластинку не превышало 3, а количество щетинок даже больше, чем у особей из акватории у м. Казантип и доходит до 5 на одну пластинку. Общее количество элементов на одну пластинку доходит до 5 в разном сочетании шипов и щетинок.
Тарханкут. Как и в двух других районах – м. Казантип и Севастопольская бухта, вблизи р. Черной, в районе м. Тарханкут значительная часть эпимеральных пластинок 3-й пары не имеют шипов вовсе (64 из 96 исследованных), а наибольшее количество шипов не превышает 3. Число щетинок на одну эпимеральную пластинку доходит до 4. Все эти особенности существенно отличают м. Тарханкут от района внешнего рейда Севастопольской бухты на открытом прибрежье. Таким образом из всех районов явно выделяется внешний рейд Севастопольской бухты – открытый штормам участок. Он отличается большим количеством шипов и меньшим – щетинок. Единственное его отличие, возможно влияющее на элементы морфологии, например, от м. Тарханкут, в сложном сочетании массивных искусственных и естественных субстратов, создающих сложную комбинацию пустот между этими конструкциями. Такая комбинация в сочетании со штормами, вероятно, генерирует множество турбулентных завихрений воды, к которым особям P. olivii приходится приспосабливаться. Возможно, шипы помогают как-то расклиниваться особям в щелях и не вымываться потоками воды, что и способствует большей генерации шипов особями.
Pectenogammarus foxi. На наружной поверхности этой пары эпимеральных пластинок вблизи вентрального края есть только щетинки, шипы совершенно отсутствуют.
В районе м. Казантип при средней длине особи 6,11±0,71 мм число щетинок колебалось от 2 до 7, составляя в среднем 4 щетинки. В районе Севастополя (база Мокроусова) при средней длине особей 8,14±1,02 мм число щетинок колебалось от 3 до 8, составляя в среднем 6 щетинок.
В районе б. Пуццолановой (Карадаг) при средней длине особи 11,64±1,21 мм число щетинок колебалось от 3 до 9, составляя в среднем 5 щетинок. Таким образом, тенденция увеличения числа щетинок хотя и просматривается, но весьма нечетко учитывая тот момент, что средняя длина особей в исследованных выборках различается почти вдвое (6,11 мм и 11,64 мм), а среднее количество щетинок колеблется в очень узких пределах (4-6 щетинок). Это указывает на необходимость в достаточно большом числе щетинок даже у относительно небольших особей. Возможно, щетинки на данных участках эпимеральных пластинок играют роль помимо других еще и амортизатора, поскольку особи этого вида обитают в регулярно двигающемся субстрате – песке и гальке, перекатываемыми волнами. В подобной среде важную роль может играть быстрота реакции на изменяющиеся условия и эффективная защита при ударе об движущиеся камни. Важно, что все щетинки направлены больше в сторону уросома и слегка наискось вентрально, что может помочь особям успешнее двигаться вперед, поскольку направленные таким образом щетинки частично препятствуют движению особи назад. Отсутствие шипов может указывать на большую важность для быстрого передвижения особи, чем расклинивание её в щелях, как это имеет место у особей P. olivii. Щетинки для расклинивания особи совершенно неэффективны вследствие своей эластичности.
Третья пара уропод, наружная ветвь. Третья пара уропод, наружная ветвь представлена на рисунке 4 NV. Данная пара уропод у обоих видов весьма развита и играет роль рулей при движении особей вследствие специфичности своей формы, выростов кутикулы и подвижности сустава.

Рис. 4. Внешний вид третьей уроподы Pectenogammarus foxi (вид сверху)
NV – наружная ветвь; VV – внутренняя ветвь; 1 – внешний край наружной ветви; 2 – субдистальный участок внутреннего края внутренней ветви; 3 – средний участок внутреннего края внутренней ветви; 4 – проксимальный участок внутреннего края внутренней ветви. Масштабная линейка – 0,1 мм.
Характерным для обоих видов является большее развитие наружной ветви, имеющей форму вытянутой ланцетовидной лопасти, вооруженной по краям как шипами, так и щетинками различного типа – перистыми и простыми. На конце ее имеется маленький второй членик. Наибольшее количество щетинок относится к типу перистых. Возможно, перистые щетинки, как и перья у птиц, играют роль элементов, поддерживающих особь в данном случае в толще воды при ее движении за счет увеличения поверхности сопротивления воде. Чем больше щетинок данного типа, тем больше площадь этой поверхности. Можно предположить, что в пресной воде вооружение такими щетинками должно быть больше, чем в морской, поскольку плотность пресной воды ниже таковой морской. Однако анализ материала показал некоторые особенности, не совпадающие с данной гипотезой. Рассмотрим колебания числа перистых щетинок обоих исследованных видов, взяв за образец наружный край первого членика наружной ветви, поскольку вооружение наружного и внутреннего краев этой ветви весьма близки.
Pectenogammarus olivii. Отметим, что средняя длина особей с учетом стандартного отклонения не отличается значимо между всеми районами исследования. Для м. Казантип она составила 8,10±1,42 мм (средняя длина ± стандартное отклонение); для внешнего рейда Севастопольской бухты – 7,64±0,73 мм, для м. Тарханкут – 6,47±0,71 мм, для Севастопольской бухты вблизи р. Черной – 7,48±1,37 мм.
Казантип. Число перистых щетинок на наружном крае наружной ветви колебалось от 17 до 33, составляя в среднем 27±4. Севастополь, внешний рейд Севастопольской бухты открытое море, сложная комбинация субстратов (навалы бетонных конструкций и естественных твердых субстратов). Количество перистых щетинок колебалось от 2 до 16, составляя в среднем 5±3. Севастопольская бухта вблизи реки Черной. Число перистых щетинок на данном крае наружной ветви колебалось от 6 до 31, составляя в среднем 18±6.
Тарханкут. Число перистых щетинок на данном крае наружной ветви колебалось от 5 до 28, составляя в среднем 19±4.
Из полученных результатов следует, что не расстояние между районами играют роль, а особенности конкретных условий в данных районах. Именно особенности условий возможно запускают генетически детерминированные механизмы появления того или иного числа щетинок в наружном крае наружной ветви третьего уропода. Так, число перистых щетинок в двух близко расположенных районах Севастополя (бухта и открытый берег) различается больше, чем между Севастопольской бухтой и участком м. Казантип, расположенным в Азовском море. А участок м. Тарханкут, расположенный на открытом морю западном берегу Крыма, имеет параметры числа щетинок такие же, как и внутри Севастопольской бухты на участке, защищенном от прибоя. Наиболее всего отличается участок внешнего рейда Севастопольской бухты. Кроме того, что он находится в зоне открытого моря и подвержен прибою, его особенность в сложной комбинации крупных бетонных элементов и естественного твердого субстрата, прежде всего валунов и камней. Возможно, именно размерный состав и специфика комбинации твердых субстратов влияет на набор микроусловий (щелей, углублений) и гидродинамику в них, а через эти параметры на необходимость появления того или иного числа перистых щетинок на данном участке наружной ветви третьей уроподы.
Pectenogammarus foxi. Все особи, собранные с трех районов прибрежья Крыма, обитали в сходных условиях, скопления гальки и песка в зоне заплеска пляжей. Все районы расположены на открытом море. Типы кутикулярных выростов (щетинки разного типа, шипы) наружного края наружной ветви третьей уроподы такие же, как и у P. olivii. М. Казантип. При средней длине особи 6,11±0,71 мм число перистых щетинок колебалось от 7 до 16, составляя в среднем 11±3.
В районе Севастополя (пляж базы Мокроусова) при средней длине особей 8,14±1,02 мм число перистых щетинок колебалось от 9 до 20, составляя в среднем 13±3.
В районе б. Пуццолановой (Карадаг) при средней длине особи 11,64±1,21 мм число перистых щетинок колебалось от 14 до 43, составляя в среднем 27±8.
Таким образом очевидно увеличение числа щетинок с ростом особей, что можно объяснить с функциональной точки зрения (больший размер особи требует большего числа щетинок для ее поддержания в воде). Вероятно вследствие сходства самой среды обитания во всех районах, где отбирали особи (галька и песок в зоне заплеска на открытых прибою участках), влияние среды на данный элемент морфологии явно не проявляется.
Третья пара уропод, внутренняя ветвь (рис. 4 VV). В отличие от наружной ветви у данных видов внутренняя ветвь намного меньше, чешуевидной формы и вооружена значительно слабее. Однако, эта ветвь может играть роль небольших рулей при поворотах особей. Наблюдается значительное разнообразие выростов кутикулы подобно таковому наружной ветви (шипы, щетинки простые и перистые). Выросты расположены в определенных участках внутреннего края этой ветви, что позволяет разделить край на участки. Концевые дистальные участки не рассматривались, поскольку они достаточно стабильны. Анализу были подвергнуты субдистальные участки внутреннего края (рис. 4 1), средняя часть края (рис. 4 2), а также проксимальные участки (рис. 4 3). Следует сразу отметить, что у некоторых особей на любом из этих участков отсутствовали выросты кутикулы, что может указывать на большое разнообразие условий, по всей вероятности, так или иначе запускающих генетически детерминированный механизм появления (или не появления) тех или иных кутикулярных выростов. Рассмотрим их.
Pectenogammarus olivii
Поскольку средняя длина особей, собранных со всех районов исследований, значимо не отличается, при анализе длина не будет учитываться.
Субдистальный участок внутреннего края внутренней ветви уропода 3. Во всех районах отмечены только перистые щетинки.
Казантип. Щетинки отмечены у 66 % от всех исследованных внутренних ветвей. Количество щетинок на 1 ветвь в случае их наличия колебалась от 1 до 3.
Севастополь, внешний рейд Севастопольской бухты открытое море. Отмечены щетинки только у 8 % особей, подавляющее число ветвей в данном участке не имело щетинок. Количество щетинок в случае их наличия не превышало одной.
Севастопольская бухта вблизи реки Черной. Подавляющее большинство проанализированных ветвей (88 %) имели щетинки в этой части. В случае их наличия их количество колебалось от 1 до 4.
Тарханкут. Большинство проанализированных ветвей имели в данной части щетинки (62 %). В случае наличия щетинок их количество колебалось от 1 до 3. Формирование только перистых щетинок свидетельствует о вполне конкретной функциональной нагрузке данного участка ветви. Скорее всего, это поддержание особи в воде.
Обращает внимание один момент, как и на наружной ветви, на данном участке внутренней ветви резко снижается количество перистых щетинок в районе внешнего рейда Севастопольской бухты – открытого района со сложной комбинацией массивных искусственных и естественных твердых субстратов. Возможная причина рассматривалась выше.
Средний участок внутреннего края, внутренней ветви третьего уропода.
Казантип. Отмечено два типа кутикулярных выростов – перистые щетинки и шипы. Более половины проанализированных ветвей имели шипы (56 % ветвей, по 1 шипу на ветвь). Ветвей с перистыми щетинками было намного меньше (4 % ветвей, по 1-й щетинке на ветвь).
Севастополь, внешний рейд Севастопольской бухты открытое море. Отмечены только шипы, но зарегистрированы они у подавляющего большинства исследованных ветвей (82 % ветвей, по 1 шипу на ветвь).
Севастопольская бухта вблизи реки Черной. Отмечены три типа выростов кутикулы – перистые щетинки, простые щетинки и шипы. Подавляющее большинство исследованных ветвей имели шипы в этой части ветки (82 % ветвей, по 1 шипу на ветвь). Перистые щетинки отмечались реже, они зарегистрированы у 62 % ветвей (по 1-й или 2-м щетинкам на ветвь). Наконец, простые щетинки отмечались намного реже, только у 8 % просмотренных ветвей (1 щетинка на ветвь). М. Тарханкут. Зарегистрировано два типа кутикулярных выростов – перистые щетинки и шипы. Шипы отмечены у большинства проанализированных ветвей (74 % ветвей, по 1 шипу на ветвь). Перистые щетинки отмечались намного реже (8 % ветвей, по 1 щетинке на ветвь).
Обращает внимание два момента. Первый – снижение разнообразия кутикулярных выростов до одного типа – шипов в районе внешнего рейда Севастопольской бухты. Возможные причины рассмотрены выше. Второй – увеличение разнообразия типов кутикулярных выростов в районе Севастопольской бухты, защищенной от прибоя, что возможно объяснить, в том числе, и необходимостью большего поддержания тела этих амфипод при ослаблении турбулентности как правило вызываемой штормами.
Проксимальный участок внутреннего края, внутренней ветви третьего уропода.
Казантип. На данном участке ветви отмечены только простые щетинки у подавляющего большинства проанализированных ветвей (82 % ветвей, по 1 щетинке на ветвь).
Севастополь, внешний рейд Севастопольской бухты открытое море. Отмечены только простые щетинки у большинства исследованных ветвей (62 % ветвей, по 1 щетинке на ветвь).
Севастопольская бухта вблизи реки Черной. Отмечены два типа выростов кутикулы – перистые и простые щетинки. Простые щетинки зарегистрированы у подавляющего большинства исследованных ветвей (98 % ветвей, по 1 щетинке на ветвь). Перистые щетинки регистрировались намного реже (14 % ветвей, по 1 или 2 щетинкам на ветвь).
Тарханкут. Зарегистрированы только простые щетинки у большинства проанализированных ветвей (78 % ветвей, по 1 щетинке на ветвь).
Как и с случае со средней частью внутреннего края внутренней ветви на данном участке отмечается те же два момента проанализированные выше.
Pectenogammarus foxi. Субдистальный участок внутреннего края, внутренней ветви третьего уропода.
Казантип при средней длине особей 6,13±0,72 мм отмечали единичные случаи (4 % исследованных ветвей) появления только перистых щетинок.
Севастополь (пляж базы Мокроусова) при средней длине особей 8,14±1,02 мм отмечали перистые щетинки (4 % ветвей. По 1 щетинке на ветвь), и шипы (2 % ветвей, по 1 шипу на ветвь).
Карадаг, б. Пуццолановая при средней длине особей 11,64±1,21 мм чаще отмечали перистые щетинки (40 % ветвей, по 1 щетинке на ветвь), шипы (16 % ветвей, по 1 шипу на ветвь) и простые щетинки (12 % ветвей, по 1 щетинке на ветвь). Таким образом, с ростом особей увеличивается не только количество кутикулярных выростов, но разнообразие их типов. Объяснить подобную тенденцию только потребностями эффективно маневрировать в воде было бы неверно. Вероятно назначение этих кутикулярных элементов более полифункционально.
Средний участок внутреннего края, внутренней ветви третьего уропода.
Казантип при средней длине особей 6,13±0,72 мм чаще отмечали шипы (66 % ветвей, по 1 или 2 шипам на ветвь), чем перистые щетинки (2 % ветвей, по 1 щетинке на ветвь).
Севастополь (пляж базы Мокроусова) при средней длине особей 8,14±1,02 мм у большинства ветвей были шипы (84 % ветвей, по 1 или 2 шипам на ветвь), существенно реже перистые щетинки (5 % ветвей, по 1 щетинке на ветвь).
Карадаг, б. Пуццолановая при средней длине особей 11,64±1,21 мм почти все ветви были с шипами (92 % ветвей, по 1 или 2 шипам на ветвь), и изредка с перистыми щетинками (4 % ветвей, по 1 или 2 щетинкам на ветвь). Обращает внимание разный характер изменения числа шипов и щетинок при увеличении длины особей. Если число случаев с шипами с ростом особи последовательно увеличивается, то число случаев появления щетинок почти не изменяется. Это может указывать на разное функциональное назначение шипов и щетинок на данном участке ветви уропода.
Проксимальный участок внутреннего края, внутренней ветви третьего уропода.
Казантип при средней длине особей 6,13±0,72 мм отмечали перистые щетинки (66 % ветвей, по 1 щетинке на ветвь). Севастополь (пляж базы Мокроусова) при средней длине особей 8,14±1,02 мм отмечали перистые щетинки (54 % ветвей, по 1 или 2 щетинкам на ветвь).
Карадаг, б. Пуццолановая при средней длине особей 11,64±1,21 мм отмечали как перистые щетинки (42 % ветвей, по 1 щетинке на ветвь), так и изредка шипы (6 % ветвей, по 1 шипу на ветвь). Таким образом, на данном участке подобно сублистальному участку с ростом особей возрастает как частота появления кутикулярных выростов, так и их разнообразие, что может указывать на разную функциональную нагрузку тех или иных типов выростов кутикулы.
Тельсон. Как и в случае анализа внутреннего края внутренней ветви, возможно проанализировать разные участки наружного края вследствие постоянного расположения кутикулярных выростов вдоль края (рис. 5).

Рис. 5. Лопасть тельсона
LT – лопасть тельсона; 1 – субдистальный участок наружного края лопасти; 2 – средний участок наружного края лопасти; 3 – проксимальный участок наружного края лопасти. Масштабная линейка – 0,1 мм.
Pectenogammarus olivii. Поскольку средняя длина особей, собранных со всех районов исследований, значимо не отличается, анализ данного параметра будет проводится без учета этой длины.
Субдистальный участок. Во всех районах исследования отмечен только один тип щетинок – простые.
Казантип. Почти все исследованные лопасти тельсона имели щетинки (98 % лопастей) на этом участке.
Севастополь, внешний рейд Севастопольской бухты открытое море. Почти все исследованные лопасти тельсона имели щетинки (96 % лопастей, 1 или 2 щетинки на лопасть).
Севастопольская бухта вблизи реки Черной. Почти все исследованные лопасти тельсона были с щетинками (99 % лопастей, 1, 2 или 3 щетинки на лопасть).
Тарханкут. Почти все лопасти были с щетинками (96 % лопастей, 1 или 2 щетинки на лопасть).
Таким образом, данный участок тельсона характеризуется стабильным типом кутикулярных выростов, которые присутствуют почти у всех исследованных лопастей из всех районов исследования. Вероятно, подобный элемент на данном участке тельсона весьма важен, и выполняет какую-то определенную функцию для выживания особи.
Средний участок наружного края лопастей тельсона. Во всех районах исследования на этом участке отмечены два типа кутикулярных выростов – простые щетинки и шипы.
Казантип. Почти все исследованные лопасти тельсона имели шипы (93 % лопастей, 1 или 2 щетинки на лопасть). Простые щетинки отмечены реже, (26 % лопастей, 1 или 2 щетинки на лопасть).
Севастополь, внешний рейд Севастопольской бухты открытое море. Большинство лопастей имели шипы (85 % лопастей, 1 шип на лопасть). Шетинки отмечали реже (16 % лопастей, 1 щетинка на лопасть).
Севастопольская бухта вблизи реки Черной. Все исследованные лопасти имели шипы, (1 или 2 шипа на лопасть). Щетинки отмечены у 37 % лопастей (1 щетинка на лопасть).
Тарханкут. Зарегистрировано наличие шипов почти у всех исследованных лопастей (92 %, 1 или 2 шипа на лопасть). Щетинки отмечены у 19 % лопастей, (1 щетинка на лопасть).
Таким образом, подобно субдистальному участку, на среднем участке также наблюдается стабильный набор типов кутикулярных выростов, один из которых (простые щетинки) во всех районах исследования регистрировался намного реже. Это может свидетельствовать о вполне определенной функции кутикулярных выростов, независимо от района исследования.
Проксимальный участок наружного края лопастей тельсона в отличие от других участков имеет только простые щетинки и только в районе Севастополя, на внешнем рейде Севастопольской бухты. Число лопастей тельсона, с данной щетинкой на этом участке мало (9 % лопастей). Функциональное назначение данного элемента кутикулы неясно, возможно оно как-то связано с особенностями гидродинамики в случае наличия сложной комбинации массивных твердых субстратов искусственного и естественного происхождения.
Pectenogammarus foxi. Субдистальный участок наружного края лопастей тельсона вооружен только простыми щетинками во всех районах исследования.
Казантип, при средней длине особей 6,13±0,72 мм щетинки отмечали у большинства лопастей (69 % лопастей, от 1 до 3 щетинок на лопасть).
Севастополь (пляж базы Мокроусова) при средней длине особей 8,14±1,02 мм щетинки отмечали на всех лопастях (1–4 щетинки на лопасть).
Карадаг, б. Пуццолановая при средней длине особей 11,64±1,21 мм щетинки отмечали часто (96 % лопастей, 1–4 щетинки на лопасть).
Таким образом, данный тип кутикулярных выростов стабилен во всех районах исследования, присутствует у подавляющего большинства особей и незначительно количественно возрастает с увеличением длины особей. Это свидетельствует, возможно, о вполне определенной функциональной роли данных щетинок в жизнедеятельности особей данного вида.
Средний участок наружного края тельсона вооружен простыми щетинками и шипами во всех районах исследования. Единичный случай наличия перистой щетинки отмечен в районе Карадага, б. Пуццолановой.
Казантип. При средней длине особей 6,13±0,72 мм простые щетинки отмечали в большинстве лопастей (80 % лопастей, 1–3 щетинки на лопасть). Шипы отмечены в большинстве лопастей (86 % лопастей, 1 шип на лопасть).
Севастополь (пляж базы Мокроусова). При средней длине особей 8,14±1,02 мм простые щетинки отмечали в большинстве лопастей (94 % лопастей, 1–3 щетинки на лопасть). Шипы отмечали практически во всех лопастях (99 % лопастей, 1 или реже 2 шипа на лопасть).
Карадаг, б. Пуццолановая. При средней длине особей 11,64±1,21 мм, щетинки отмечали в большинстве лопастей (92 % лопастей, 1–3 щетинки на лопасть). Шипы отмечали в большинстве лопастей (97 % лопастей, 1 или 2 шипа на лопасть).
Таким образом, варианты типов кутикулярных выростов вне зависимости от района исследования оставался стабильным и сохранялся также диапазон числа элементов, что может указывать на вполне определенную функциональную роль этого участка для выживания.
Проксимальный участок наружного края тельсона вооружен простыми щетинками во всех районах исследования, а шипы не были отмечены только в б. Пуццолановой.
Казантип. При средней длине особей 6,13±0,72 мм простые щетинки отмечали у меньшего числа лопастей (16 % лопастей, 1 или 2 щетинки на лопасть). Шипы также отмечены реже (16 % лопастей, 1 шип на лопасть).
Севастополь (пляж базы Мокроусова). При средней длине особей 8,14±1,02 мм простые щетинки отмечали редко (6 % лопастей, 1 или 2 щетинки на лопасть). Шипы отмечались редко (4 % лопастей, 1 шип на лопасть).
Карадаг, б. Пуццолановая. При средней длине особей 11,64±1,21 мм щетинку отметили в единственном случае. Шипы отсутствовали.
Таким образом, как и на других участках, типы кутикулярных выростов были те же за исключением особей из б. Пуцоллановой у которых отсутствовали шипы. Однако все выросты кутикулы в этой части лопастей тельсона были отмечены у небольшого числа особей, что может указывать на рудиментарный характер данных образований, возможно развитый у предковых форм.
ВЫВОДЫ
- Особи P. olivii, населяющие заплеск открытого прибрежья с сочетанием массивных искусственных и естественных субстратов (бетонных конструкций, валунов, камней) имеют менее вооруженные перистыми щетинками ветви третьей уроподы, а эпимеральные пластинки больше вооружены шипами, чем у особей из других районов с другим сочетанием элементов субстрата.
- Эпимеральные пластинки третьей пары у вида, предпочитающего галечно-песчанный пляж (P. foxi) вооружены только щетинками, тогда как у вида предпочитающего каменисто-валунный пляж (P. olivii) на данном элементе тела наблюдаются также и шипы.
- Субдорсальные и дорсальные участки первого уросомального сегмента у вида, предпочитающего галечно-песчанный пляж (P. foxi) преимущественно вооружены щетинками, и лишь изредка шипами, тогда как у вида, предпочитающего каменисто-валунный пляж (P. olivii), на данном элементе тела наблюдаются шипы.
- Дорсальные участки третьего уросомального сегмента у вида, предпочитающего каменисто-валунный пляж (P. olivii) преимущественно вооружены массивными шипами, изредка щетинками или тонкими шипами, тогда как у вида P. foxi на данном участке тела отмечаются щетинки.
- У вида P. olivii на субдистальном участке внутреннего края внутренней ветви уропода 3 отмечены только перистые щетинки независимо от района исследования,
- У вида P. foxi на субдистальном участке внутреннего края внутренней ветви третьего уропода с увеличением размера особи увеличивается не только количество кутикулярных выростов, но разнообразие их типов.
Исследование выполнено в рамках темы госзадания. «Комплексное исследование механизмов функционирования морских биотехнологических комплексов с целью получения биологически активных веществ из гидробионтов» (№ гос. регистрации 124022400152-1).
Василенко С. В. Капреллиды (морские козочки) морей СССР и сопредельных вод. – Л.: Наука, 1974. – 287 с.
Грезе И. И. Амфиподы Чёрного моря и их биология. – Киев.: Наук. думка,1977. – 154 с.
Грезе И. И. Фауна Украины. Высшие ракообразные. Амфиподы. – Киев.: Наук. думка, 1985. – Т. 26, вып. 5. – 172 с.
Гринцов В. А. Амфиподы Черного моря: иллюстрированный атлас-определитель. – Севастополь: ФИЦ ИНБЮМ, 2022. – 476 c.
Гурьянова Е. Ф. Амфиподы морей СССР. – Л.: Изд-во АН СССР, 1951. – 1029 с.
Исрапов И. Экологическая структура таксоцена амфипод Каспийского моря: автореф. дис. … докт. биол. наук: спец. 03.00.18 Гидробиология. – М.: ИО РАН, 1992. – 50 с.
Мордухай-Болтовской Ф. Д., Грезе И. И., Василенко С. В. Отряд амфиподы или разноногие. Amphipoda // Определитель фауны Чёрного и Азовского морей. Т. 2. – Киев: Наук. думка, 1969. – С. 440–494.
Северцов А. Н. Морфологические закономерности эволюции. – М-Л.: Изд-во. АН СССР, 1949. – Т. 5. – 536 с.
Цветкова Н. Л. Прибрежные гаммариды северных и дальневосточных морей СССР и сопредельных вод. – Л.: Наука, 1975. – 256 с.
Barnard J. L., Karaman G. S. The families and genera of marine Gammaridean Amphipoda (except marine Gammaroids) // Records of the Australian Museum. – 1991. – Suppl. 13 (Parts 1-2). – P. 866.
Bellan-Santini D. Ecology // The Amphipoda of the Mediterranean / [Ed. S. Ruffo]. – Monaco.: Musée océanographique, 1998. – Pt. 4. – P. 869–895. (Memoires de l’Institut oceanographique; vol. 13).
Bousfield E., Hendrycks E. The talitroidean amphipod family Hyalidae revised, with emphasis on the North Pacific fauna: systematics and distributional ecology // Amphipacifica. – 2002. – Vol. 3 (3). – P. 17–134.
Grintsov V., Sezgin M. Manual for identification of Amphipoda from The Black Sea // Sevastopol. Digit Print. – 2011. – 151 p.
Holmquist J. The Functional Morphology of Gnathopods: Importance in Grooming, and Variation with Regard to Habitat, in Talitroidean Amphipods // Journal of Crustacean Biology. – 1982. – Vol. 2, N 2. – P. 159–179.
Mayer G., Maier G., Mass A., Waloszek D. Mouthpart Morphology of Gammarus roeselii Compared to a Successful Invader, Dikerogammarus villosus (Amphipoda) // Journal of Crustacean Biology. – 2009. – Vol. 29 (2). – P. 161–174.
Moore P. A functional interpretation of coxal morphology in Epimeria cornigera (Crustacea: Amphipoda: Paramphithoidae) // Journal of the Marine Biological Assotiation of the United Kingdom. – 2009. – Vol. 61, iss. 3. DOI: https://doi.org/10.1017/S0025315400048189
Pavesi L., Olesen J. Functional morphology and environmental adaptations of mouthparts in the driftwood amphipod Macarorchestia remyi (Schellenberg, 1950), and a comparison with the sandhopper Talitrus saltator (Montagu, 1808) (Amphipoda: Talitridae) // Journal of Crustacean Biology. – 2017. – Vol. 37 (1). – P. 37–44. DOI: 10.1093/jcbiol/ruw006
Watling L. Functional morphology of the amphipod mandible // Journal of Natural History. – 1993. – Vol. 27, iss. 4. – P. 837–849.

