Экосистемы, 36: 39–55 (2023) https://ekosystems.cfuv.ru
УДК [591.524.11:551.468.3](262.5.04) DOI 10.5281/zenodo.10370870
Сравнительный анализ макрозообентоса псевдолиторали бухты Казачья (Крым, Чёрное море) в периоды 2007–2010 и 2021–2022 годов
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
verakopiy@gmail.com; bondarenko.luda@gmail.com
Изучено современное состояние макрозообентоса зоны псевдолиторали бухты Казачья и проведён сравнительный анализ его качественного состава и количественных показателей в разные периоды и сезоны исследования. За 2007–2010 и 2021–2022 годы обнаружено 86 видов макрозообентоса, относящихся к разным таксономическим категориям: Polychaeta (36 видов), Crustacea (33), Mollusca (13), Platyhelminthes, Oligochaeta, Chironomidae и Nemertea. Их количество к 2022 году увеличилось в 1,6 раза. Дополнительно в список включены 38 видов гидробионтов, 14 видов макрозообентоса найдены только в 2007–2010 годах. Средние значения численности и биомассы макрозообентоса в 2007–2010 годах варьируют в пределах от 774±176 до 4051±306 экз./м2
- от 0,585±0,216 до 12,57±0,033 г/м2 соответственно. В 2021–2022 годах они изменяются от 24±17 до 7352±3514 экз./м2 и от 0,021±0,016 до 18,945±11,557 г/м2 соответственно. В оба периода максимальная численность макрозообентоса отмечена летом, сформирована она полихетами. Наибольшая биомасса в 2007–2010 годах зарегистрирована летом, в 2021–2022 годах – осенью. Значительный вклад в данный показатель в оба периода внесли моллюски. Трофическая структура макрозообентоса представлена поли-, детрито-, фитофагами и плотоядными животными. В 2007–2010 годах зимой в 43 % проб отмечены олигохеты, с апреля по сентябрь массовым видом была Hydrobia acuta (Draparnaud, 1805), которая относится к растительным детритофагам. Тогда как в 2021–2022 годах наибольшее количество массовых видов отмечено в осенне-зимний период, среди них доминировал Saccocirrus papillocercus Bobretzky, 1872. Весной и летом по встречаемости доминировали полихеты
Capitella capitata (Fabricius, 1780), Salvatoria clavata (Claparède, 1863), Microphthalmus fragilis Bobretzky, 1870 и
амфипода Pectenogammarus foxi (Schellenberg, 1928) – представители поли- и фитофагов. Изменение количества и таксономического разнообразия массовых видов с различным типом питания в разные сезоны можно связать с периодом размножения гидробионтов и изменением кормовой базы.
Ключевые слова: псевдолитораль, макрозообентос, численность, биомасса, бухта Казачья, Чёрное море.
ВВЕДЕНИЕ
Бухта Казачья является западной частью Двойной бухты, она располагается на юго-западе Крыма. С востока ограничена небольшим полуостровом с мысом Манганари, а с запада
– мысом Херсонес (рис. 1). Южная часть бухты разделена мысом Святого Климента на два «рукава»: западный и восточный, с севера имеет открытый выход в море. Расстояние от вершины восточного «рукава» до мыса Манганари составляет около 2,8 км, расстояние от вершины западного «рукава» до мыса Западный – 2,4 км (Копий и др., 2017; Беляева, 2018; Латушкин и др., 2019). Максимальная ширина бухты 1,13 км. Подводный склон отмелый, бенч в виде непрерывной полосы, сужается к вершине бухты, в его границах встречаются крупные известковые глыбы, ракушечник и песчаные отложения (Особо охраняемые…, 2020). Берега высокие, пологие и окаймлены отмелями. От вершины к устью бухта ориентирована по оси юг-север и поэтому при северных ветрах её акватория подвержена сильному волновому воздействию. Побережье представляет собой неширокие и прерывистые отвесные абразионные обрывы с обособленными группами глыб известкового и вулканического происхождения, а также галечные пляжи (Рябушко и др., 2019). Этот район наиболее удалён от устьев рек и поэтому менее подвержен их влиянию (Александров, 2018).
-
- последние десятилетия на берегах бухты возводятся коттеджи и многоэтажные дома. Береговыми источниками загрязняющих веществ являются нефтехранилище, дельфинарий и хозяйственно-бытовые стоки, поступающие из посёлка бухты Казачья. Кроме этого, к факторам, влияющим на экологическое состояние бухты, относятся загрязняющие вещества, поступающие с внешнего рейда. Активная застройка берегов бухты и развитие новой селитебной зоны с соответствующей инфраструктурой, площадь и население которой с каждым годом растут, привели к значительному увеличению антропогенной нагрузки на экосистему бухты Казачья (Рябцев, 2001; Миронов и др., 2002; Копий и др., 2017; Котельянец
- др., 2017; Александров, 2018; Беляева, 2018; Латушкин и др., 2019; Соловьёва и др., 2019; Орехова, 2021).
Постоянно действующие источники органического загрязнения привели к значительному его накоплению. Высокие концентрации органического углерода (4,32– 7,86 %) обуславливают то, что кислород не является основным компонентом при его окислении, а в донных отложениях преобладают анаэробные условия. В придонном слое вод концентрация кислорода соответствует 97 % насыщения. На поверхности осадка концентрация кислорода снижается до 200 мкМ (80 % насыщения). Концентрация сероводорода в донных отложениях значительно выше, чем в других бухтах Севастопольского региона (Orekhova, Konovalov, 2018; Орехова и др., 2019).
На состояние биоты участка псевдолиторали существенное влияние оказывает рекреационная нагрузка. В связи с тем, что бухта Казачья является полузамкнутой акваторией эстуарного типа, её способность к биологической очистке ограничена, поэтому при использовании ресурсов бухты должны соблюдаться условия по её охране (Михайлова, Беляева, 2005).
Изучению видового состава и количественных характеристик макрозообентоса прибрежной зоны бухты Казачья посвящено небольшое количество работ (Маккавеева, 1992; Михайлова, Беляева, 2005). Данные о сообществах зоны псевдолиторали вдоль черноморского побережья Крыма носят фрагментарный характер (Мокиевский, 1949; Копий, 2014; Копий и др., 2017) и не могут в полной мере отразить объективную картину состояния исследуемых сообществ. Интерес к исследованию краевых, или контактных, зон моря связан, прежде всего, с их наименьшей изученностью по сравнению с другими зонами бентали. Изучение процессов формирования и функционирования морских сообществ контактных зон позволяют получить информацию о направлениях и темпах развития экосистем и их деградации в естественных условиях и при антропогенных нагрузках.
Учитывая вышесказанное, данная работа направлена на изучение современного состояния макрозообентоса псевдолиторали бухты Казачья с целью проведения сравнительного анализа его качественного состава и количественных показателей в разные периоды и сезоны 2007–2010 и 2021–2022 годов.
МАТЕРИАЛ И МЕТОДЫ
-
- основу работы положены материалы бентосных съёмок рыхлых грунтов псевдолиторали акватории бухты Казачья. Отбор проб осуществляли в июне, сентябре 2021 года и январе, апреле, июне 2022 года на трёх разрезах: 1 – в кутовой части, 2 – в западном рукаве бухты, 3 –
- восточном её рукаве (рис. 1).
На каждом разрезе, расположенном перпендикулярно берегу, пробы отбирали в трёх точках: в зоне уреза воды, ниже уреза воды на 0,5 и 1 м. Урезом воды считали среднюю линию между верхним и нижним краями заплеска. Расстояние между смежными точками составляло 50 см. Сбор материала проводили ручным дночерпателем (S=0,04 м2) в двух повторностях. Всего отобрано 68 проб.
- лаборатории грунт промывали через сито с диаметром ячеи 0,5 мм и просматривали под бинокуляром, затем макрозообентос распределяли по группам. Полихет, ракообразных и моллюсков идентифицировали до вида (Определитель…, 1972; Чухчин, 1984; Киселева, 2004; Grintsov, Sezgin, 2011; Гринцов, 2022). Таксономическая принадлежность приведена в соответствие с базой данных World Register of Marine Species (2023).
При описании количественного развития фауны использованы показатели численности (N, экз./ м2) и биомассы (В, г/м2).
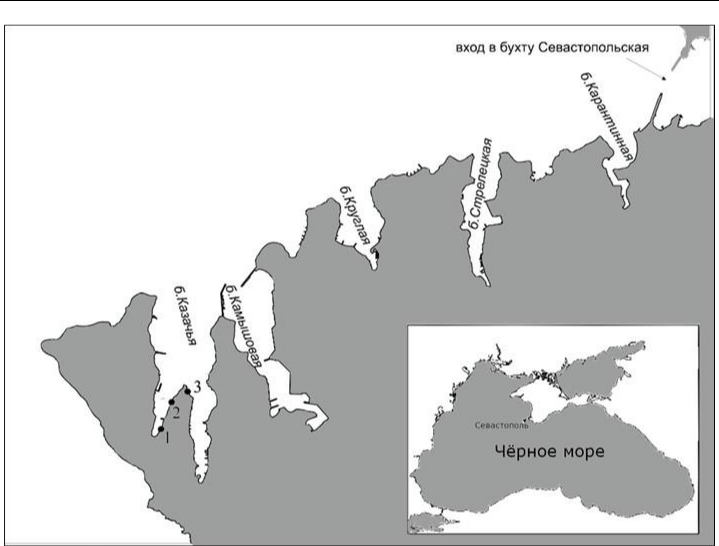
Рис. 1. Карта-схема районов исследования
Для определения фаунистического сходства использовался индекс Чекановского-Сёренсена (Сёмкин, Горшков, 2010):
=2/( + ),
где: a и b – число видов в сравниваемых списках, с – число общих видов.
Трофическую принадлежность макрозообентоса определяли, используя данные литературных источников (Грезе, 1977; Чухчин, 1984; Киселева, 2004).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Видовой состав и количественные показатели макрозообентоса рыхлых грунтов псевдолиторали бухты Казачья в периоды исследований 2007–2010 и 2021–2022 годов представлены в таблице 1. Сезонное время и точки отбора проб в разные периоды исследований полностью совпадали. За период наблюдения 2021–2022 годов идентифицировано 70 видов макрозообентоса, относящихся к разным таксономическим категориям: Polychaeta (32 вида), Crustacea (26), Mollusca (8). Представители классов Clitellata (Oligochaeta), Hexapoda (Chironomidae), а также типов Platyhelminthes и Nemertea до вида не идентифицированы. Каждый из этих таксонов рассматривали как один вид.
Видовой состав и количественные показатели макрозообентоса в различные сезоны года неодинаковы. Летом наступает период наиболее активных процессов в гидроценозах – самый информативный период для оценки количественных и качественных характеристик бентоса.
- связи с этим наибольшее количество видов (61) обнаружено в летний период, весной обнаружен 31 вид, осенью – 27, зимой – 5.
Таблица 1
Видовой состав и количественные показатели макрозообентоса рыхлых грунтов
псевдолиторали бухты Казачья в различные периоды исследования
|
Июнь |
Сентябрь |
Январь |
Апрель |
||||||||||||||||||||||||||||||||||
|
2007– |
2021– |
2007– |
2021– |
2007– |
2021– |
2007– |
2021– |
||||||||||||||||||||||||||||||
|
Виды |
2010 |
2022 |
2010 |
2022 |
2010 |
2022 |
2010 |
2022 |
|||||||||||||||||||||||||||||
|
N |
N |
N |
N |
N |
N |
N |
N |
||||||||||||||||||||||||||||||
|
B |
B |
B |
B |
B |
B |
||||||||||||||||||||||||||||||||
|
B |
B |
||||||||||||||||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|||||||||||||||||||||||||||||
|
Polychaeta |
|||||||||||||||||||||||||||||||||||||
|
Alitta succinea |
– |
30 |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Leuckart, 1847) |
0,06 |
||||||||||||||||||||||||||||||||||||
|
Capitella capitata |
82 |
679 |
679 |
1588 |
41 |
– |
43 |
264 |
|||||||||||||||||||||||||||||
|
(Fabricius, 1780) |
0,099 |
0,114 |
0,114 |
0,442 |
0,013 |
0,041 |
0,256 |
||||||||||||||||||||||||||||||
|
Caulleriella bioculata |
– |
1 |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Keferstein, 1862) |
0,028 |
||||||||||||||||||||||||||||||||||||
|
Eumida sanguinea |
– |
1 |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Örsted, 1843) |
0,0002 |
||||||||||||||||||||||||||||||||||||
|
Eunereis longissima |
2 |
1 |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Johnston, 1840) |
0,0008 |
0,002 |
|||||||||||||||||||||||||||||||||||
|
Exogone naidina (=Exogone |
4 |
||||||||||||||||||||||||||||||||||||
|
gemmifera) Örsted, 1845 |
– |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
0,004 |
|||||||||||||||||||||||||||||||||||||
|
Fabricia stellaris |
– |
1 |
– |
– |
6 |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Müller, 1774) |
0,0002 |
0,003 |
|||||||||||||||||||||||||||||||||||
|
Genetyllis tuberculata |
– |
– |
– |
2 |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Bobretzky, 1868) |
0,002 |
||||||||||||||||||||||||||||||||||||
|
Hediste diversicolor |
1 |
1 |
9 |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(O.F. Müller, 1776) |
0,015 |
0,001 |
0,179 |
||||||||||||||||||||||||||||||||||
|
Heteromastus filiformis |
– |
– |
– |
73 |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Claparède, 1864) |
0,016 |
||||||||||||||||||||||||||||||||||||
|
Leiochone leiopygos |
– |
1 |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Grube, 1860) |
0,0004 |
||||||||||||||||||||||||||||||||||||
|
Lindrilus flavocapitatus |
– |
1785 |
– |
1505 |
– |
– |
– |
136 |
|||||||||||||||||||||||||||||
|
(Uljanina, 1877) |
0,066 |
0,047 |
0,003 |
||||||||||||||||||||||||||||||||||
|
Malacoceros tetracerus |
2 |
2 |
|||||||||||||||||||||||||||||||||||
|
(=Scolelepis ciliatus) |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||||
|
0,001 |
0,001 |
||||||||||||||||||||||||||||||||||||
|
(Schmarda, 1861) |
|||||||||||||||||||||||||||||||||||||
|
Micronephthys longicornis |
– |
1 |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Perejaslavtseva, 1891) |
0,0004 |
||||||||||||||||||||||||||||||||||||
|
Microphthalmus fragilis |
315 |
87 |
121 |
150 |
– |
– |
154 |
5 |
|||||||||||||||||||||||||||||
|
Bobretzky, 1870 |
0,078 |
0,025 |
0,008 |
0,02 |
0,025 |
0,001 |
|||||||||||||||||||||||||||||||
|
Microspio mecznikowiana |
3 |
– |
– |
– |
– |
– |
– |
— |
|||||||||||||||||||||||||||||
|
(Claparède, 1869) |
0,003 |
||||||||||||||||||||||||||||||||||||
|
Mysta picta |
– |
1 |
– |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Quatrefages, 1866) |
0,004 |
||||||||||||||||||||||||||||||||||||
|
Namanereis pontica |
20 |
1 |
– |
– |
4 |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Bobretzky, 1872) |
0,003 |
0,002 |
0,004 |
||||||||||||||||||||||||||||||||||
|
Nereididae |
– |
34 |
2 |
3 |
– |
– |
9 |
4 |
|||||||||||||||||||||||||||||
|
Blainville, 1818 |
0,026 |
0,005 |
0,003 |
0,004 |
0,006 |
||||||||||||||||||||||||||||||||
|
Nereis zonata |
– |
46 |
– |
– |
2 |
– |
– |
– |
|||||||||||||||||||||||||||||
|
Malmgren, 1867 |
0,03 |
0,005 |
|||||||||||||||||||||||||||||||||||
|
Notomastus latericeus |
– |
2 |
– |
6 |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
Sars, 1851 |
0,0004 |
0,005 |
|||||||||||||||||||||||||||||||||||
|
Perinereis cultrifera |
– |
– |
3 |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||
|
(Grube, 1840) |
0,039 |
||||||||||||||||||||||||||||||||||||
|
Phyllodoce maculata |
– |
– |
– |
– |
– |
– |
– |
2 |
|||||||||||||||||||||||||||||
|
(Linnaeus, 1767) |
0,005 |
||||||||||||||||||||||||||||||||||||
42
Таблица 1 (продолжение)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||||||||||||||||||||||||||||||
|
Pisione remota |
8 |
23 |
– |
16 |
– |
– |
– |
4 |
||||||||||||||||||||||||||||||
|
(Southern, 1914) |
0,008 |
0,026 |
0,005 |
0,002 |
||||||||||||||||||||||||||||||||||
|
Platynereis dumerilii |
1 |
19 |
2 |
|||||||||||||||||||||||||||||||||||
|
(Audouin & Milne Edwards, |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||||||
|
0,011 |
0,205 |
0,043 |
||||||||||||||||||||||||||||||||||||
|
1833) |
||||||||||||||||||||||||||||||||||||||
|
Polycirrus jubatus |
– |
9 |
– |
– |
– |
– |
8 |
– |
||||||||||||||||||||||||||||||
|
Bobretzky, 1868 |
0,124 |
0,004 |
||||||||||||||||||||||||||||||||||||
|
Polydora cornuta |
1 |
– |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
Bosc, 1802 |
0,002 |
|||||||||||||||||||||||||||||||||||||
|
Polyophthalmus pictus |
1 |
3 |
– |
– |
– |
– |
– |
2 |
||||||||||||||||||||||||||||||
|
(Dujardin, 1839) |
0,0008 |
0,009 |
0,003 |
|||||||||||||||||||||||||||||||||||
|
Protodorvillea kefersteini |
294 |
38 |
11 |
– |
3 |
– |
– |
2 |
||||||||||||||||||||||||||||||
|
(McIntosh, 1869) |
0,063 |
0,032 |
0,004 |
0,001 |
0,004 |
|||||||||||||||||||||||||||||||||
|
Saccocirrus papillocercus |
1889 |
1073 |
378 |
1828 |
187 |
4 |
613 |
266 |
||||||||||||||||||||||||||||||
|
Bobretzky, 1872 |
0,96 |
0,748 |
0,284 |
0,855 |
0,231 |
0,004 |
0,59 |
0,08 |
||||||||||||||||||||||||||||||
|
Salvatoria clavata |
13 |
205 |
15 |
19 |
3 |
– |
8 |
9 |
||||||||||||||||||||||||||||||
|
(Claparède, 1863) |
0,003 |
0,028 |
0,005 |
0,003 |
0,001 |
0,008 |
0,002 |
|||||||||||||||||||||||||||||||
|
Spio decorata |
1 |
25 |
– |
36 |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
Bobretzky, 1870 |
0,003 |
0,017 |
0,035 |
|||||||||||||||||||||||||||||||||||
|
Syllides longocirratus |
– |
1 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
(Örsted, 1845) |
0,0002 |
|||||||||||||||||||||||||||||||||||||
|
Syllis gracilis |
– |
1 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
Grube, 1840 |
0,0004 |
|||||||||||||||||||||||||||||||||||||
|
Syllis hyalina |
– |
– |
– |
– |
– |
– |
– |
4 |
||||||||||||||||||||||||||||||
|
Grube, 1863 |
0,001 |
|||||||||||||||||||||||||||||||||||||
|
Syllis prolifera |
– |
1 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
Krohn, 1852 |
0,0004 |
|||||||||||||||||||||||||||||||||||||
|
Всего |
2632 |
4054 |
623 |
5245 |
246 |
4 |
852 |
700 |
||||||||||||||||||||||||||||||
|
1,2396 |
1,358 |
0,572 |
1,665 |
0,258 |
0,004 |
0,886 |
0,406 |
|||||||||||||||||||||||||||||||
|
Crustacea |
||||||||||||||||||||||||||||||||||||||
|
Ampelisca diadema |
– |
2 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
(Costa, 1853) |
0,003 |
|||||||||||||||||||||||||||||||||||||
|
Ampelisca sevastopoliensis |
– |
1 |
– |
– |
– |
– |
– |
2 |
||||||||||||||||||||||||||||||
|
Grintsov, 2011 |
0,0002 |
0,053 |
||||||||||||||||||||||||||||||||||||
|
Ampithoe ramondi |
3 |
2 |
||||||||||||||||||||||||||||||||||||
|
– |
– |
– |
– |
– |
– |
0,000 |
||||||||||||||||||||||||||||||||
|
Audouin, 1826 |
0,001 |
|||||||||||||||||||||||||||||||||||||
|
7 |
||||||||||||||||||||||||||||||||||||||
|
Apohyale perieri |
– |
9 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
(Lucas, 1846) |
0,001 |
|||||||||||||||||||||||||||||||||||||
|
Apohyale prevostii |
– |
4 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
(H. Milne Edwards, 1830) |
0,002 |
|||||||||||||||||||||||||||||||||||||
|
Caprella acanthifera |
– |
1 |
– |
– |
– |
4 |
— |
— |
||||||||||||||||||||||||||||||
|
Leach, 1814 |
0,0002 |
0,0004 |
||||||||||||||||||||||||||||||||||||
|
Chondrochelia savignyi |
8 |
2 |
4 |
|||||||||||||||||||||||||||||||||||
|
– |
— |
0,0000 |
— |
— |
— |
|||||||||||||||||||||||||||||||||
|
(Kroyer, 1842) |
0,0012 |
0,0004 |
||||||||||||||||||||||||||||||||||||
|
8 |
||||||||||||||||||||||||||||||||||||||
|
Monocorophium insidiosum |
13 |
– |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
(Crawford, 1937), |
0,0025 |
|||||||||||||||||||||||||||||||||||||
|
Cumella (Cumella) limicola |
– |
1 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
Sars, 1879 |
0,00004 |
|||||||||||||||||||||||||||||||||||||
|
Dexamine spinosa |
1 |
2 |
||||||||||||||||||||||||||||||||||||
|
– |
– |
– |
– |
– |
– |
0,000 |
||||||||||||||||||||||||||||||||
|
(Montagu, 1813) |
0,0002 |
|||||||||||||||||||||||||||||||||||||
|
4 |
||||||||||||||||||||||||||||||||||||||
|
Echinogammarus sp. |
2 |
— |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||
|
0,0008 |
||||||||||||||||||||||||||||||||||||||
|
Eurydice dollfusi |
2 |
6 |
4 |
|||||||||||||||||||||||||||||||||||
|
0,000 |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||||||||
|
Monod, 1930 |
0,004 |
0,008 |
||||||||||||||||||||||||||||||||||||
|
6 |
||||||||||||||||||||||||||||||||||||||
|
Gammarellus carinatus |
– |
– |
– |
– |
– |
– |
– |
4 |
||||||||||||||||||||||||||||||
|
(Rathke, 1837) |
0,001 |
|||||||||||||||||||||||||||||||||||||
Таблица 1 (продолжение)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||||||||||||||||||||||||
|
Gammarus insensibilis |
– |
41 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
Stock, 1966 |
0,02 |
|||||||||||||||||||||||||||||||
|
Idotea balthica |
– |
3 |
– |
– |
– |
– |
– |
4 |
||||||||||||||||||||||||
|
(Pallas, 1772) |
0,003 |
0,006 |
||||||||||||||||||||||||||||||
|
Iphinoe elisae |
2 |
2 |
||||||||||||||||||||||||||||||
|
– |
– |
0,0000 |
– |
– |
– |
– |
||||||||||||||||||||||||||
|
Băcescu, 1950 |
0,0005 |
|||||||||||||||||||||||||||||||
|
8 |
||||||||||||||||||||||||||||||||
|
Iphinoe tenella |
7 |
– |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
Sars, 1878 |
0,002 |
|||||||||||||||||||||||||||||||
|
Lekanesphaera hookeri (Leach, |
8 |
1 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
1814) |
0,002 |
0,02 |
||||||||||||||||||||||||||||||
|
Melita palmata |
9 |
1 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
(Montagu, 1804) |
0,003 |
0,0004 |
||||||||||||||||||||||||||||||
|
Microdeutopus gryllotalpa |
– |
80 |
– |
– |
– |
– |
– |
25 |
||||||||||||||||||||||||
|
Costa, 1853 |
0,035 |
0,005 |
||||||||||||||||||||||||||||||
|
Microdeutopus sp. |
– |
2 |
– |
– |
– |
– |
– |
27 |
||||||||||||||||||||||||
|
0,0005 |
0,004 |
|||||||||||||||||||||||||||||||
|
Microdeutopus versiculatus |
– |
93 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
(Spence Bate, 1857) |
0,049 |
|||||||||||||||||||||||||||||||
|
2 |
||||||||||||||||||||||||||||||||
|
Microprotopus sp. |
– |
– |
– |
– |
– |
– |
– |
0,000 |
||||||||||||||||||||||||
|
2 |
||||||||||||||||||||||||||||||||
|
Monocorophium acherusicum |
– |
1509 |
– |
73 |
– |
– |
– |
66 |
||||||||||||||||||||||||
|
(Costa, 1853) |
0,514 |
0,014 |
0,018 |
|||||||||||||||||||||||||||||
|
Orchestia gammarellus |
328 |
2 |
15 |
– |
– |
– |
– |
2 |
||||||||||||||||||||||||
|
(Pallas, 1766) |
0,228 |
0,001 |
0,011 |
0,038 |
||||||||||||||||||||||||||||
|
Palaemon elegans |
– |
1 |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
Rathke, 1836 |
0,453 |
|||||||||||||||||||||||||||||||
|
Pectenogammarus foxi |
790 |
389 |
716 |
|||||||||||||||||||||||||||||
|
(=Echinogammarus foxi ) |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||||
|
0,095 |
0,083 |
0,184 |
||||||||||||||||||||||||||||||
|
(Schellenberg, 1928) |
||||||||||||||||||||||||||||||||
|
Plumulojassa ocia(=Jassa ocia |
2 |
|||||||||||||||||||||||||||||||
|
– |
– |
0,000 |
– |
– |
– |
– |
– |
|||||||||||||||||||||||||
|
(Spence Bate, 1862) |
||||||||||||||||||||||||||||||||
|
1 |
||||||||||||||||||||||||||||||||
|
Sphaeroma serratum |
5 |
2 |
– |
– |
– |
– |
3 |
– |
||||||||||||||||||||||||
|
(J. C. Fabricius, 1787) |
0,002 |
0,0005 |
0,001 |
|||||||||||||||||||||||||||||
|
Stenosoma capito (=Synisoma |
– |
– |
– |
– |
– |
– |
1 |
– |
||||||||||||||||||||||||
|
capito) (Rathke, 1836) |
0,001 |
|||||||||||||||||||||||||||||||
|
Tanais dulongii |
– |
9 |
– |
2 |
– |
– |
– |
– |
||||||||||||||||||||||||
|
(Audouin, 1826) |
0,006 |
0,0003 |
||||||||||||||||||||||||||||||
|
Всего |
365 |
2572 |
21 |
546 |
0 |
8 |
3 |
852 |
||||||||||||||||||||||||
|
0,242 |
1,213 |
0,012 |
0,1805 |
0,0008 |
0,052 |
0,31 |
||||||||||||||||||||||||||
|
Mollusca |
||||||||||||||||||||||||||||||||
|
Abra segmentum |
46 |
3 |
66 |
306 |
2 |
– |
12 |
14 |
||||||||||||||||||||||||
|
(Récluz, 1843) |
0,077 |
0,139 |
0,474 |
5,797 |
0,233 |
0,163 |
0,229 |
|||||||||||||||||||||||||
|
Cardiidae |
2 |
– |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
(Lamarck, 1809) |
0,119 |
|||||||||||||||||||||||||||||||
|
Cerastoderma glaucum |
30 |
14 |
– |
13 |
– |
– |
1 |
4 |
||||||||||||||||||||||||
|
(Bruguière, 1789) |
8,217 |
0,93 |
10,781 |
0,046 |
7,5 |
|||||||||||||||||||||||||||
|
Chamelea gallina |
– |
– |
– |
– |
– |
– |
1 |
– |
||||||||||||||||||||||||
|
(Linnaeus, 1758) |
0,259 |
|||||||||||||||||||||||||||||||
|
Hydrobia acuta |
229 |
1 |
700 |
– |
11 |
– |
63 |
– |
||||||||||||||||||||||||
|
(Draparnaud, 1805) |
0,738 |
0,002 |
1,166 |
0,026 |
0,137 |
|||||||||||||||||||||||||||
|
Irus irus |
– |
– |
– |
2 |
– |
– |
– |
– |
||||||||||||||||||||||||
|
(Linnaeus, 1758) |
0,025 |
|||||||||||||||||||||||||||||||
|
Loripes orbiculatus |
– |
– |
– |
– |
– |
– |
2 |
2 |
||||||||||||||||||||||||
|
Poli, 1795 |
0,047 |
0,036 |
||||||||||||||||||||||||||||||
|
Mytilaster lineatus |
– |
4 |
2 |
– |
– |
– |
1 |
– |
||||||||||||||||||||||||
|
(Gmelin, 1791) |
0,049 |
0,034 |
0,068 |
|||||||||||||||||||||||||||||
|
Mytilus galloprovincialis |
6 |
– |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||
|
(Lamarck, 1819) |
1,483 |
|||||||||||||||||||||||||||||||
Таблица 1 (продолжение)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||||||||||||||||||||||||||||||||||||||||||||||
|
Parvicardium exiguum |
– |
1 |
– |
16 |
– |
– |
– |
– |
||||||||||||||||||||||||||||||||||||||||||||||
|
(Gmelin, 1791) |
0,012 |
0,313 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Setia valvatoides |
1 |
– |
– |
– |
– |
– |
– |
– |
||||||||||||||||||||||||||||||||||||||||||||||
|
Milaschewitsch, 1909 |
0,001 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tritia neritea (=Cyclope neritea) |
5 |
– |
2 |
– |
– |
– |
– |
5 |
||||||||||||||||||||||||||||||||||||||||||||||
|
(Linnaeus, 1758) |
0,189 |
0,192 |
1,941 |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Truncatella subcylindrica |
– |
– |
– |
– |
1 |
– |
– |
– |
||||||||||||||||||||||||||||||||||||||||||||||
|
(Linnaeus, 1767) |
0,004 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Всего |
319 |
23 |
770 |
337 |
14 |
0 |
80 |
25 |
||||||||||||||||||||||||||||||||||||||||||||||
|
10,824 |
1,132 |
1,866 |
16,916 |
0,263 |
0,72 |
9,706 |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Platyhelminthes |
88 |
184 |
271 |
56 |
440 |
– |
268 |
9 |
||||||||||||||||||||||||||||||||||||||||||||||
|
0,016 |
0,014 |
0,043 |
0,019 |
0,026 |
0,132 |
0,548 |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Oligochaeta |
554 |
413 |
30 |
14 |
68 |
4 |
197 |
32 |
||||||||||||||||||||||||||||||||||||||||||||||
|
0,138 |
0,066 |
0,01 |
0,002 |
0,029 |
0,003 |
0,086 |
0,012 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Nemertea |
70 |
68 |
14 |
53 |
4 |
8 |
71 |
258 |
||||||||||||||||||||||||||||||||||||||||||||||
|
0,07 |
0,147 |
0,042 |
0,139 |
0,007 |
0,013 |
0,127 |
0,44 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Chironomidae |
23 |
38 |
7 |
39 |
2 |
– |
2 |
4 |
||||||||||||||||||||||||||||||||||||||||||||||
|
0,042 |
0,012 |
0,019 |
0,025 |
0,002 |
0,004 |
0,001 |
||||||||||||||||||||||||||||||||||||||||||||||||
|
4051± |
7352± |
1736± |
6290± |
774± |
1473± |
1880± |
||||||||||||||||||||||||||||||||||||||||||||||||
|
24±17 |
520 |
890 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
306 |
3514 |
215 |
3898 |
176 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
ИТОГО |
0,021± |
1,989 |
11,42 |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
12,572± |
3,941± |
2,56± |
18,95± |
0,585± |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
0,016 |
±0,61 |
3±5,3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
0,033 |
1,365 |
0,03 |
11,56 |
0,216 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
6 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
Примечание к таблице. В графе «Виды» указаны современные названия видов, рядом в скобках названия, которые приводились в литературных источниках ранее. В числителе – численность (N, экз./м2), в знаменателе – биомасса (B, г/м2).
В течение всего года зарегистрированы полихета S. papillocercus, амфиподы C. acanthifera, Ch. savignyi, а также Oligochaeta и Nemertea. Только в один из сезонов обнаружены: 30 видов макрозообентоса летом, 3 – осенью, 6 – весной (табл. 1).
Средние значения численности и биомассы макрозообентоса варьируют в пределах от 24±17 до 7352±3514 экз./м2 и от 0,021±0,016 до 18,945 ±11,557 г/м2 соответственно (табл. 1). Максимальная численность макрозообентоса отмечена летом, сформирована она полихетами (рис. 2).
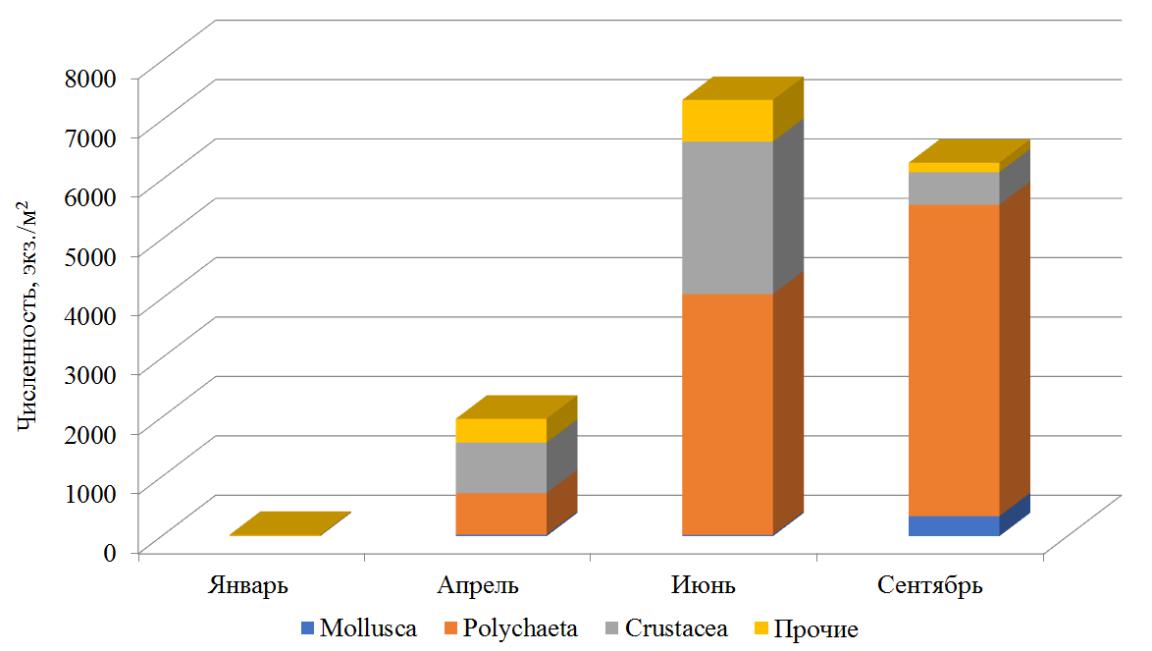
Рис. 2. Численность макрозообентоса в разные сезоны года
Наибольшая биомасса зарегистрирована в осенний период, сформирована она моллюсками (рис. 3).
Зимой в бухте обнаружено наименьшее количество видов и низкие количественные показатели макрозообентоса. На первом и втором разрезе пробы взять не удалось из-за погодных условий. На третьем разрезе зарегистрированы единичные экземпляры полихеты
- papillocercus, ракообразные Ch. savignyi и C. acanthifera, которым не свойственно обитание в илистом грунте. Так же отмечены олигохеты и немертины. На момент съёмки температура воды составила 7 °С, солёность – 20,4 ‰.
Весной видовой состав макрозообентоса стал значительно богаче и представлен полихетами (12 видов), ракообразными (11), моллюсками (4), также отмечены турбеллярии, олигохеты, немертины и личинки комара. В это время года по численности доминируют ракообразные (83 %), по биомассе – моллюски (89 %).
Среди полихет наибольший вклад (по 38 %) в общую численность внесли C. capitata и S. papillocercus, в биомассу – C. capitata (63 %). Обычно данная полихета обитает на мягких илистых, песчано-илистых грунтах от уреза воды до глубины 200 м, иногда встречается на водорослях. Эвригалинный вид, переносит значительные колебания солёности от почти пресной воды до 41,5 ‰. Черви выживают при гипоксии и в высоко сульфидных зонах
(Tenore, Chesney, 1985; Киселева, 2004; Сёмин, 2011; Trayanova et al., 2011; Варигин, Рыбалко, 2014; Çinar et al., 2014; Копий, Бондаренко, 2020).
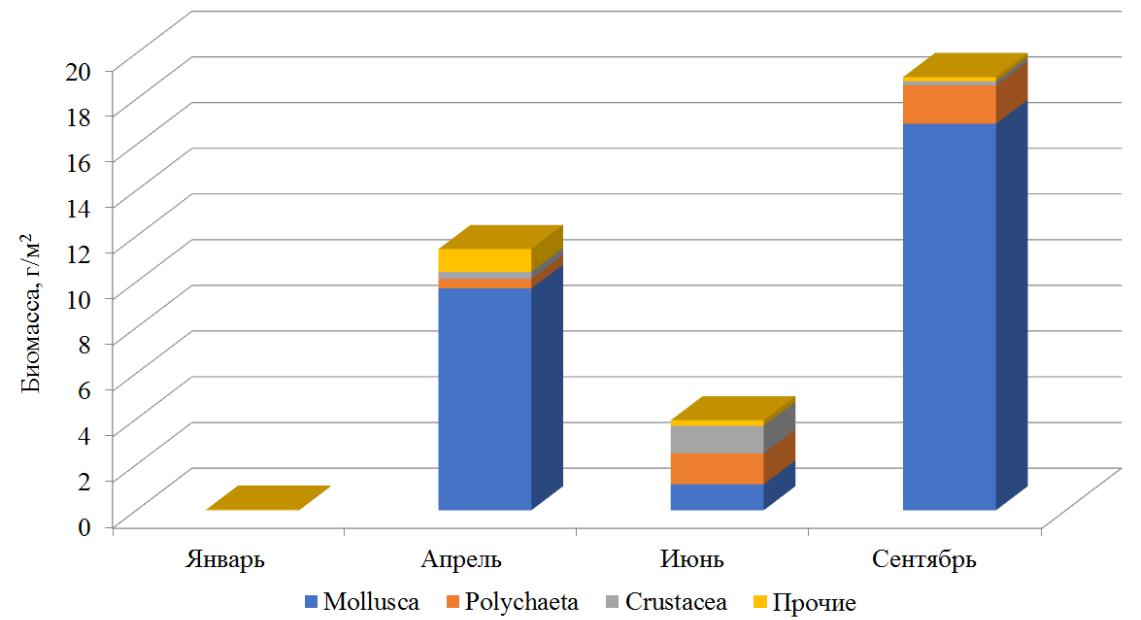
Рис. 3. Биомасса макрозообентоса в разные сезоны года
- наших пробах C. capitata встречена на песчаном, песчано-ракушечном и илистом грунте, ниже уреза воды, с численностью от 25 до 2375 экз./м2. Температура воды составила
12,9–13,5 °С, солёность – 20,3 ‰.
Среди ракообразных по численности и биомассе доминировал P. foxi, его доля в общей численности ракообразных составила 84 %, в биомассе – 59 %.
Моллюски встречены только в кутовой части бухты в единичных экземплярах. Основной вклад (56 %) в общую численность моллюсков внесла A. segmentum, в биомассу – C. glaucum (77 %).
Плотность поселения и биомасса представителей Platyhelminthes, Oligochaeta, Chironomidae и Nemertea составили соответственно 16 % и 8,76 % от общих показателей макрозообентоса.
Летом макрозообентос бухты представлен полихетами (28 видов), ракообразными (24), моллюсками (5), также отмечены турбеллярии, олигохеты, немертины и личинки комара. По численности и биомассе макрозообентоса доминировали полихеты. На их долю приходилось 55 % общей численности и 34 % биомассы. Доминировали L. flavocapitatus (44 % численности полихет) и S. papillocercus (55 % биомассы). Известно, что для этих видов характерно обитание в прибрежной зоне. На момент сбора проб температура на разрезах колебалась от 19 до 24 °С, солёность – от 18 до 18,9 ‰.
Из Crustacea доминировал M. acherusicum, на его долю приходилось 59 % общей численности ракообразных и 42 % биомассы. Обычно данный вид обитает в прибрежной инфралиторальной зоне на глубине от 0 до 20 м. Предпочитает илистый грунт, но встречается
- на песчаном грунте. Ведёт малоподвижный образ жизни, относится к группе амфипод, строящих трубки (Bellan-Santini et al., 1982; Грезе, 1985). В наших пробах на песчаном грунте встречены единичные экземпляры, а в илу его численность варьировала от 525 до 22925 экз./м2. Основной вклад в формирование количественных показателей макрозообентоса на песчаных грунтах внёс P. foxi, его численность изменялась от 25 до 15900 экз./м2.
Моллюски отмечены в единичных экземплярах, поэтому их вклад в общую численность макрозообентоса составил 0,3 %, в биомассу – 29 %.
Плотность поселения и биомасса представителей Platyhelminthes, Oligochaeta, Chironomidae и Nemertea составили соответственно 9,6 % и 2,7 % от общих показателей макрозообентоса.
Осенью макрозообентос представлен полихетами (12 видов), ракообразными (7), моллюсками (4), также отмечены турбеллярии, олигохеты, немертины и личинки комара. Значительный вклад в общую численность макрозообентоса внесли полихеты (83 %), в биомассу – моллюски (89 %).
Cреди полихет по численности и биомассе доминировал S. papillocercus. Известно (Копий, Лисицкая, 2012), что саккоциррус обитает в поверхностном грунте, между частицами крупнозернистого песка на глубинах от 0 до 50 м. Его численность может значительно колебаться в зависимости от изменения состава грунта или гидрологического режима. Обычно встречается на мелководье, как в эпифауне, так и в инфауне. В Чёрном море вдоль крымского побережья половозрелые особи встречаются с мая по октябрь (Зернов, 1913; Копий, Заика, 2009; Копий, 2014). Согласно нашим исследованиям по сравнению с летним периодом, средняя численность саккоцирруса возросла в 1,7 раза. По-видимому, это связано с процессом размножения в летне-осенний период, так как осенью доминировала молодь.
Среди ракообразных значительный вклад в численность и биомассу внёс P. foxi, на его долю приходилось 71 % и 46 % соответственно.
Моллюски встречались только в кутовой части бухты в основном в единичных экземплярах, за исключением A. segmentum, максимальная численность которой достигала 4725 экз./м2. Вклад абры в общую численность моллюсков составил 91 %. Обычно моллюск ведёт подвижный образ жизни, встречается почти на всех грунтах, но предпочтение отдаёт мягким илистым и песчано-илистым грунтам, которые преобладают в кутовой части бухты. Данный вид обитает при температуре воды до +28–30 ºС, выдерживает колебания солёности от 3 до 30 ‰. В общую биомассу моллюсков, несмотря на низкую численность (6 экз.) значительный вклад внесла C. glaucum (64 %). Данный вид переносит солёность в диапазоне от 5 до 45,3 ‰. Оба вида эврибионты, могут выживать в анаэробных условиях, обладают высокой выносливостью к содержанию сероводорода и аммиака, встречаются в условиях относительно высокого содержания хлороформэкстрагируемых веществ и нефтяных углеводородов в грунте (Воробьев, 1949; Тихонова, Алёмов, 2012; Копий, Бондаренко, 2020). В наших пробах температура воды составила +22 ºС, солёность – 18,5 ‰.
Плотность поселения и биомасса представителей Platyhelminthes, Oligochaeta, Chironomidae и Nemertea составили соответственно 0,026 % и 0,01 % от общих показателей макрозообентоса.
Несмотря на то, что для зоны псевдолиторали характерно невысокое видовое разнообразие, что может быть связано с неблагоприятными условиями обитания, в бухте
Казачья зарегистрировано наибольшее количество видов макрозообентоса, что в 2–5 раз выше, чем в других бухтах Севастопольского региона. Наиболее высокий индекс фаунистического сходства (0,61) отмечен в кутовых частях бухт Круглая и Казачья, что можно связать с одинаковыми условиями обитания в них. Высокий индекс Чекановского-Сёренсена (0,55) отмечен также для псевдолиторали бухты Казачья и юго-восточного побережья Крыма. Для псевдолиторали бухты Казачья и Западного Крыма данный индекс составил 0,35 (Копий, 2014).
-
- результате обобщения наших данных, полученных при обработке бентосных проб, за периоды наблюдения 2007–2010 (Копий и др., 2017) и 2021–2022 годов в биотопе рыхлых грунтов псевдолиторали бухты Казачья обнаружено 86 видов макрозообентоса, относящихся
- разным таксономическим категориям: Polychaeta (36 видов), Crustacea (33), Mollusca (13), Platyhelminthes, Oligochaeta, Chironomidae и Nemertea (табл. 1).
- результате сравнительного анализа выявлено, что количество видов к 2022 году увеличилось в 1,6 раза. Дополнительно в список включены 38 видов гидробионтов. Необходимо отметить, что 14 видов (4 – полихеты, 5 – раки, 5 – моллюски) макрозообентоса, найденные только в 2007–2010 годах, не являются редкими и обитают в других бухтах Севастополя (Макаров и др., 2019; Алёмов, 2021; Болтачева и др., 2022; Макаров, 2022; Копий, 2023). Коэффициент сходства видов за периоды наблюдения 2007–2010 и 2021–2022 годов составил 0,4.
Наибольшее количество видов в выше названные периоды исследования зарегистрировано летом (рис. 4).
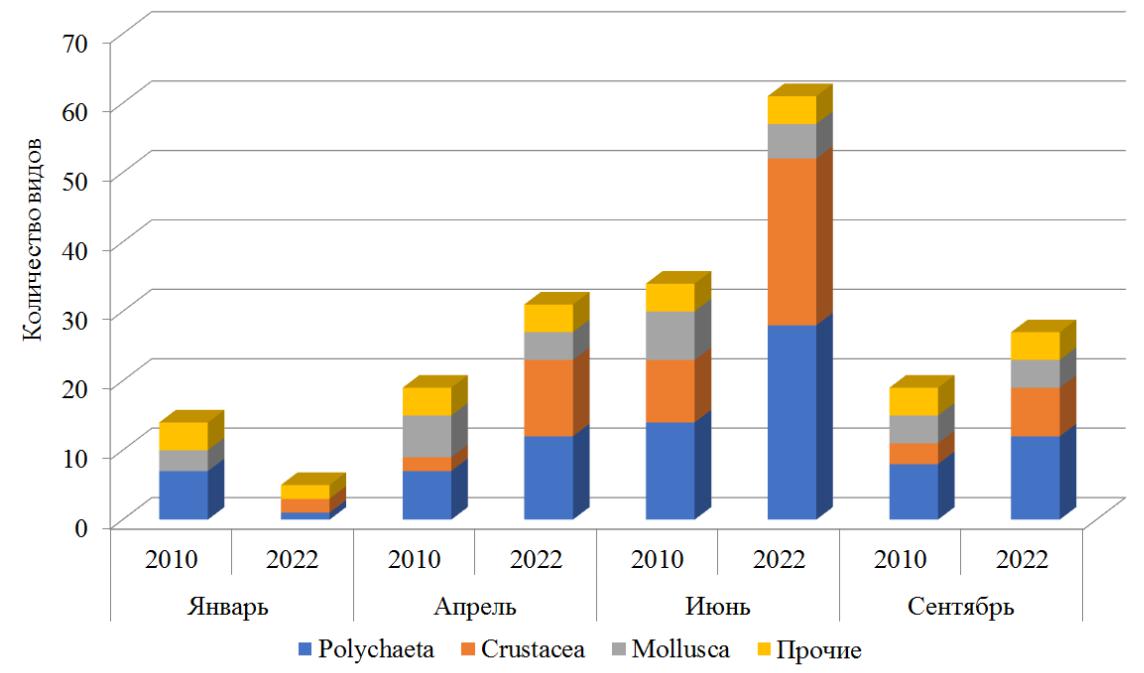
Рис. 4. Видовой состав макрозообентоса в разные временные периоды
Наиболее богатым во все сезоны оказался видовой состав полихет. Показано, что количество их видов изменялось от 1 до 28. Небольшое количество видов в разные сезоны (от 3 до 7) зарегистрировано у моллюсков. Видовой состав раков варьировал от 2 до 24.
Изменились и количественные показатели макрозообентоса. Средние значения численности к 2021–2022 годам выросли в 2 раза, существенный вклад в оба периода внесли полихеты (54 и 65 % общей численности макрозообентоса соответственно). Максимальная плотность поселения макрозообентоса отмечена летом (рис. 5).
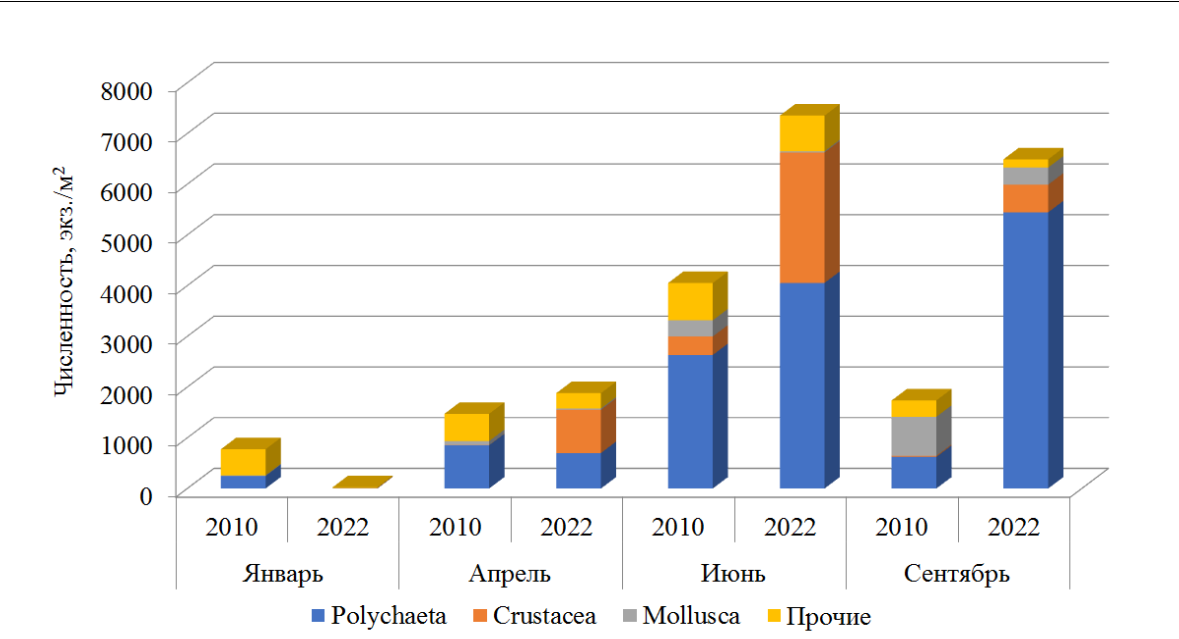
Рис. 5. Численность макрозообентоса в разные временные периоды
Средние значения биомассы макрозообентоса к 2021–2022 годам также увеличились в 2 раза, существенный вклад в оба периода внесли моллюски (по 77 % общей численности макрозообентоса). Максимальная биомасса макрозообентоса в 2007–2010 годах отмечена летом, в 2021–2022 – осенью (рис. 6).
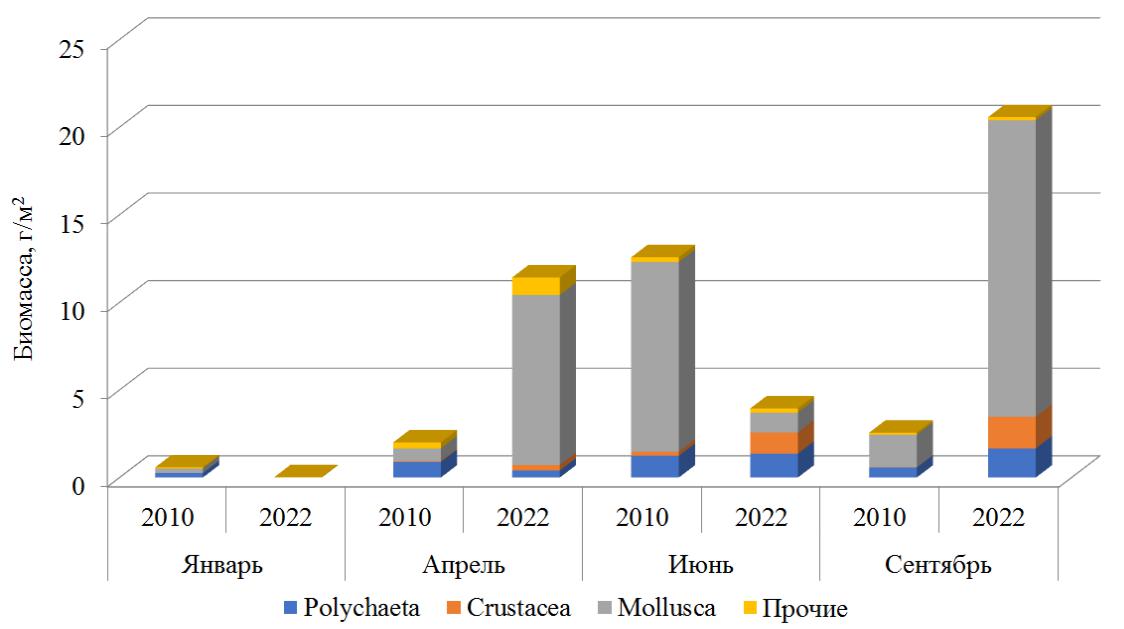
Рис. 6. Биомасса макрозообентоса в разные временные периоды
-
- оба периода весомый вклад в данный показатель внёс двустворчатый моллюск C. glaucum, который обитает на всех типах грунтов, предпочитая плотные (Копий, Бондаренко, 2020). В наших пробах данный вид зарегистрирован только в кутовой части бухты, где преобладают плотные илистые грунты.
Трофическая структура макрозообентоса представлена поли-, детрито-, фитофагами и плотоядными животными (рис. 7).
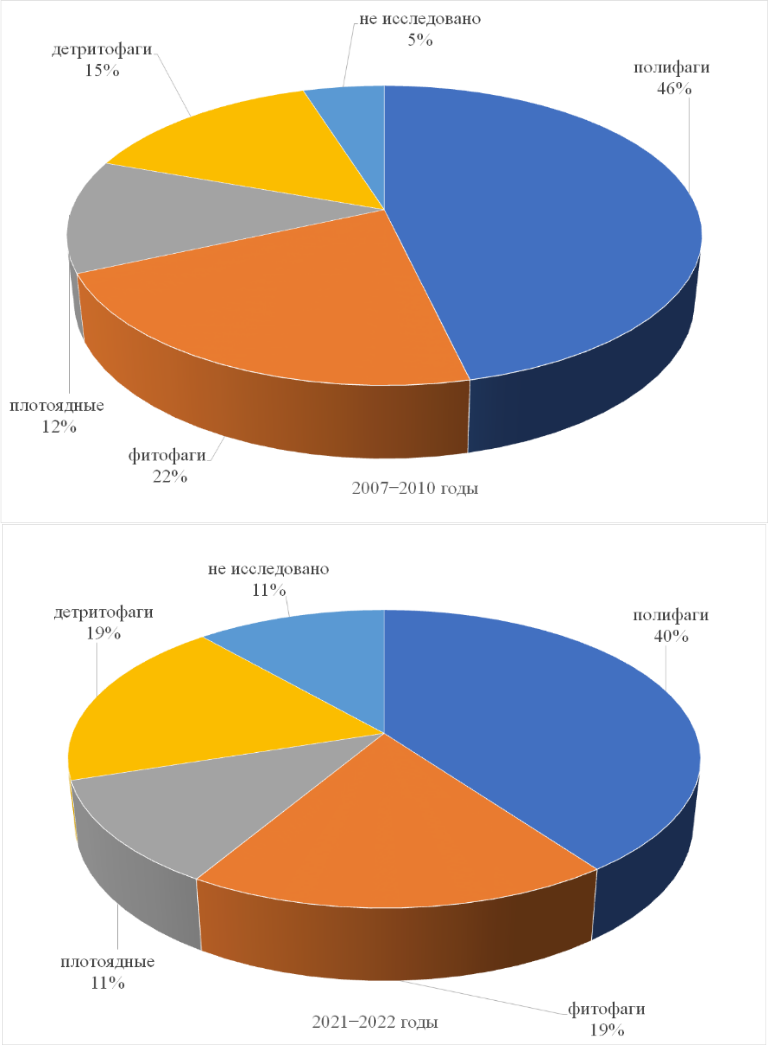
Рис. 7. Трофическая структура макрозообентоса в разные временные периоды
Сравнительный анализ показал, что в исследуемые временные периоды доминировали полифаги. Количество видов представителей всех трофических групп увеличилось за последнее десятилетие на 62–70 %. Коэффициент Чекановского-Сёренсена для фитофагов, плотоядных и полифагов составил 0,45, 0,46 и 0,6 соответственно. Наименьшее сходство видового состава отмечено для детритофагов (0,2).
Увеличение в 2021–2022 годах количества видов детритоядных представителей макрозообентоса, по-видимому, связано с изменением экологической ситуации в бухте. Анализ химического загрязнения и гидробиологического состояния Казачьей бухты в 2011 году указывает на то, что она являлась относительно чистой и менее других бухт Севастополя подвержена антропогенному влиянию. Низкий уровень загрязнения морской воды и донных осадков нефтяными углеводородами, полихлорбифенилами, тяжёлыми металлами связан с отсутствием поблизости существенных источников загрязнения. Отмечен также весьма низкий уровень загрязняющих веществ в тканях различных гидробионтов. Особенности протекающих гидрофизических, гидрохимических и гидрибиологических процессов позволяют акватории поддерживать высокую самоочистительную способность (Беляева, 2018). Альгофлора бухты в 2010 году сохраняла особенности, характерные для чистых акваторий (Евстигнеева и др., 2015).
Однако к 2017 году биомасса фитоценозов морских трав снизилась в 2–3 раза, при этом исчезли фитоценозы Zostera marina. Одной из главных причин элиминации данного вида является интенсификация хозяйственной деятельности в прибрежной зоне бухты. Анализ спутниковых снимков, доступных в Google Earth Pro (v. 7.3.0), показал, что с 2010 по 2017 годы на берегах бухты Казачья возведены причалы общей протяжённостью 600 м, в прибрежной зоне построено более 120 коттеджей, гостиниц и многоэтажных домов. Строительство в акватории, дноуглубление, наличие берегового стока с повышенным содержанием соединений азота приводят к снижению прозрачности воды, что оказывает губительное влияние на заросли зостеры (Александров, 2018). Исследователи также отмечают поступление хозяйственно-бытовых стоков в акваторию и возрастание уровня загрязнения донных осадков (Котельянец и др., 2017).
-
- трофической структуре макрозообентоса изменились и количественные показатели (рис. 8). К 2021–2022 годам численность полифагов возросла в 5 раз в связи с тем, что увеличилась плотность поселения полихеты C. capitata в 13,5 раз, двустворчатого моллюска A. segmentum в 2,5 раза и обнаруженной только в этот период полихеты L. flavocapitatus с численностью от 136 до 1785 экз./м2. Плотность поселения детритофагов возросла в 2 раза. Существенный вклад (81 %) в данный показатель внесла амфипода M. acherusicum.
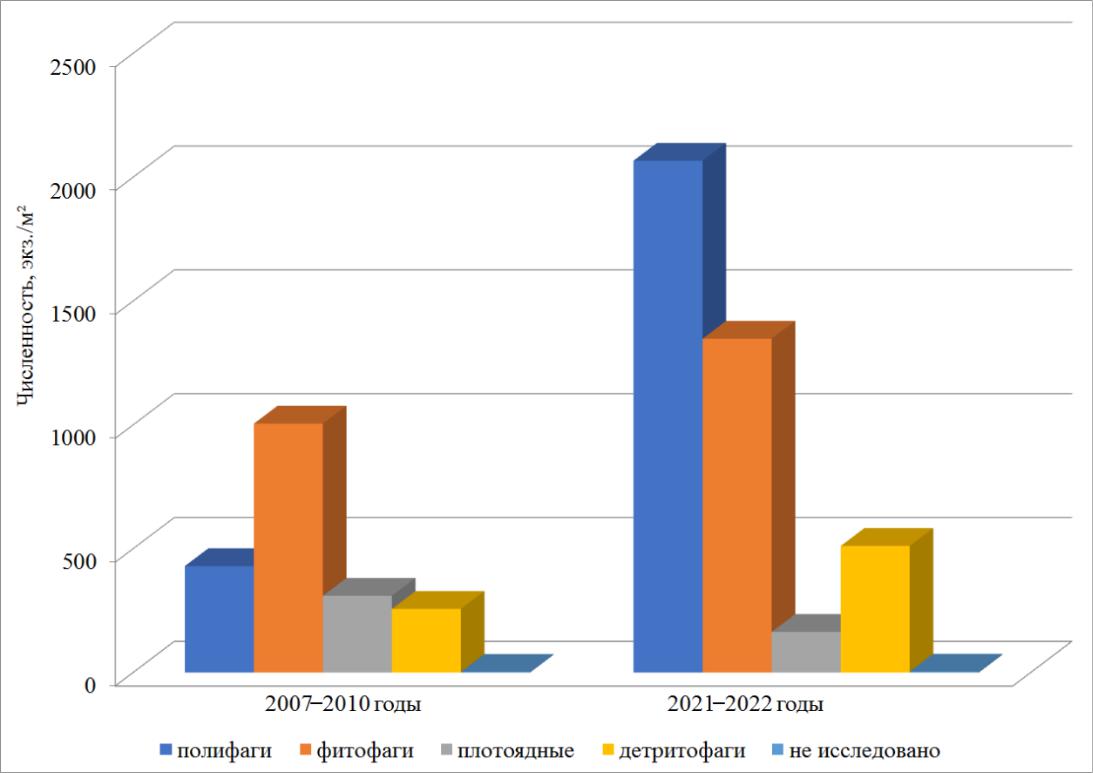
Рис. 8. Численность представителей трофических групп в разные временные периоды
Биомасса полифагов к 2021–2022 годам возросла в 2,3 раза (рис. 9). Существенный вклад
- данный показатель внесли двустворчатые моллюски C. glaucum (69 %) и A. segmentum (22 %).
- 2007–2010 годах зимой в 43 % проб отмечены олигохеты, с апреля по сентябрь массовым видом была H. acuta, которая относится к растительным детритофагам (Чухчин, 1984). Тогда как в 2021–2022 годах наибольшее количество массовых видов отмечено в
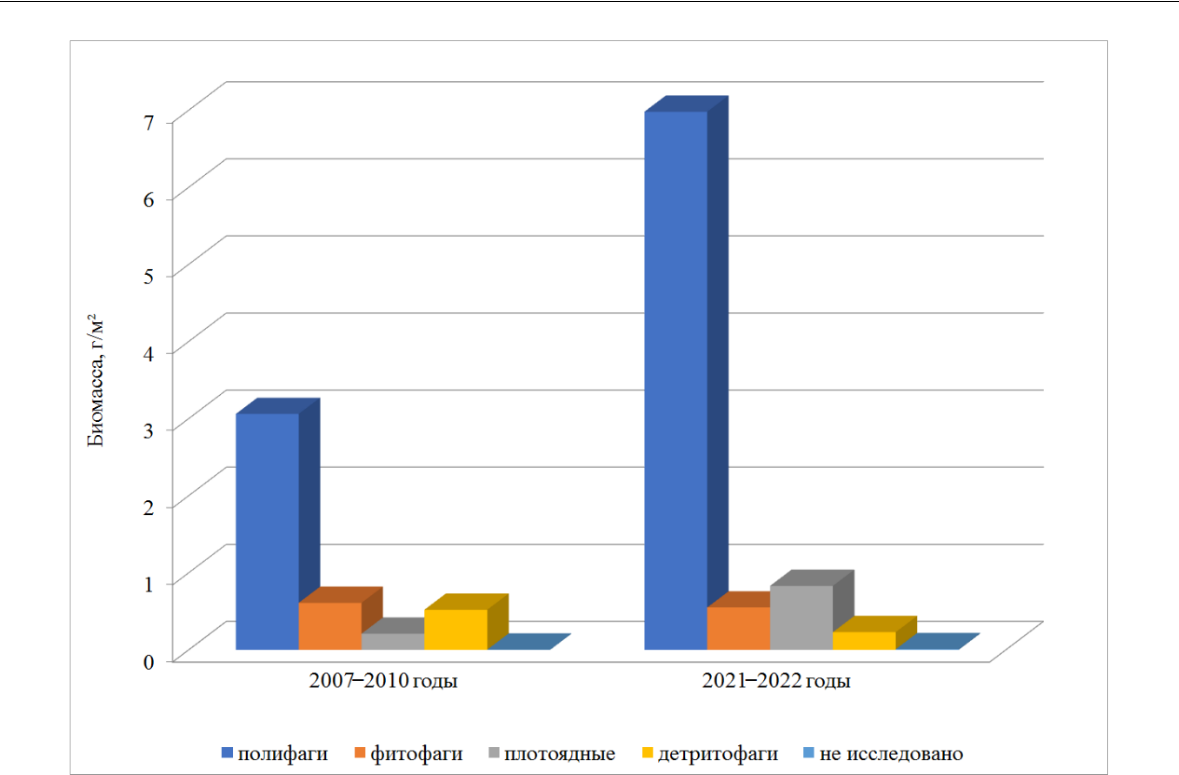
Рис. 9. Биомасса представителей трофических групп в разные временные периоды
осенне-зимний период, среди них доминировал S. papillocercus. Весной и летом по встречаемости преобладали полихеты C. capitata, S. clavata, M. fragilis и амфипода P. foxi. – представители поли- и фитофагов, что, по-видимому, можно связать с периодом размножения
- изменением кормовой базы.
ЗАКЛЮЧЕНИЕ
За периоды наблюдения 2007–2010 и 2021–2022 годов в зоне псевдолиторали биотопа рыхлых грунтов бухты Казачья обнаружено 86 видов макрозообентоса, относящихся к разным таксономическим категориям: Polychaeta (36 видов), Crustacea (33), Mollusca (13), Platyhelminthes, Oligochaeta, Chironomidae и Nemertea. К 2021–2022 годам их количество увеличилось в 1,6 раза. Дополнительно в список включены 38 видов гидробионтов, 14 видов макрозообентоса найдены только в 2007–2010 годах.
Средние значения численности и биомассы макрозообентоса в 2007–2010 годах варьируют в пределах от 774±176 до 4051±306 экз./м2 и от 0,585±0,216 до 12,57 ±0,033 г/м2 соответственно. В 2021–2022 годах они изменяются соответственно от 24±17 до 7352±3514 экз./м2 и от 0,021±0,016 до 18,945 ±11,557 г/м2.
-
- 2007–2010 годах зимой в 43 % проб отмечены олигохеты, с апреля по сентябрь массовым видом был моллюск H. acuta, который относится к растительным детритофагам. Тогда как в 2021–2022 годах наибольшее количество массовых видов отмечено в осенне-зимний период, среди них преобладал S. papillocercus. Весной и летом по встречаемости доминировали полихеты C. capitata, S. clavata, M. fragilis и амфипода P. foxi. – представители поли- и фитофагов.
- оба периода наибольшее количество видов и максимальная численность макрозообентоса отмечена летом. Наибольшая биомасса в 2007–2010 годах зарегистрирована
- летний период, в 2021–2022 годах – осенью. Изменение количества и таксономического разнообразия массовых видов с различным типом питания в разные сезоны можно связать с периодом размножения гидробионтов и изменением кормовой базы.
Статья подготовлена в рамках Государственного задания ФГБУН ФИЦ «Институт биологии южных морей имени А. О. Ковалевского РАН» «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана», № 121030100028-0
Список литературы
Александров В. В. Макрофитобентос бухты Казачья (Чёрное море) в осенний период 2017 г. // Морской биологический журнал. – 2018. – Т. 3, № 4. – С. 3–13.
Алёмов С. В. Межгодовая и сезонная динамика сообществ макрозообентоса Севастопольской бухты (Чёрное море) в начале XXI века на участках с различным уровнем загрязнения // Труды Карадагской научной станции им. Т. И. Вяземского – природного заповедника РАН. – 2021. – Вып. 1 (17). – С. 3–16.
Беляева О. И. Физико-географическая характеристика бухты Казачьей и оценка экологического состояния (Чёрное море) // Научные записки природного заповедника «Мыс Мартьян». – 2018. – 9. – С. 47–48.
Болтачева Н. А., Ревков Н. К., Бондаренко Л. В., Макаров М. В., Надольный А. А. Донная фауна бухты Круглой (Чёрное море, Крым). Сообщение II. Таксономический состав и количественное развитие макрозообентоса рыхлых грунтов. // Труды Карадагской научной станции им. Т. И. Вяземского – природного заповедника РАН. – 2022. – Т. 7, № 2 (22). – С. 3–22.
Варигин А. Ю., Рыбалко А. А. Межгодовая изменчивость макрозообентоса северной части Сухого лимана // Вісник ОНУ Сер.: Біологія. – 2014. – Т. 19, вип. 2(35). – С. 53–60.
Воробьев В. П. Бентос Азовского моря // Труды Азово-Черноморского научно-исследовательского института морского рыбного хозяйства и океанографии. – 1949. – Вып. 13. – 195 с.
Грезе И. И. Амфиподы Чёрного моря и их биология. – Киев: Наукова думка, 1977. – 156 с.
Грезе И. И. Высшие ракообразные. Бокоплавы. Фауна Украины. – Киев: Наукова думка, 1985. – Т. 26, вып. 5. – 163 с.
Гринцов В. А. Амфиподы Чёрного моря. – Севастополь: ФИЦ ИнБЮМ, 2022. – 475 с.
Евстигнеева И. К., Гринцов В. А., Лисицкая Е. В., Макаров М. В., Танковская И. Н. Биоразнообразие сообществ макрофитов бухты Казачья (Севастополь, Черное море) // Бюллетень Московского общества испытателей природы. Отдел биологический. – 2015. – Т. 120, вып. 6. – С. 51–64.
Зернов С. А. К вопросу об изучении жизни Чёрного моря // Записки императорской академии наук. Сер. 8. – 1913. – Т. 32, № 1. – 300 с.
Киселева М. И. Многощетинковые черви (Polychaeta) Чёрного и Азовского морей. – Апатиты: Изд-во Кольского научного центра РАН, 2004. – 409 с.
Копий В. Г. Характеристика таксономического состава полихет в акватории бухты Ласпи (Крым, Чёрное море) // Вестник МГТУ. – 2023. – Т. 26, № 1. – С. 69–77.
Копий В. Г. Сообщества макрозообентоса песчаной псевдолиторали у черноморских берегов Крыма: дис. …
канд. биол. наук: спец. 03.02.10 Гидробиология. – Севастополь, 2014. – 224 с.
Копий В. Г., Бондаренко Л. В., Аннинская И. Н. Макрозообентос биотопов зоны псевдолиторали бухты Казачья (Чёрное море, Крым) // Бюллетень Московского общества испытателей природы. Отд. биол. – 2017. – Т. 122., вып. 2. – С. 34–41.
Копий В. Г., Бондаренко Л. В. Атлас обитателей псевдолиторали Азово-Черноморского побережья Крыма. – Севастополь: ФИЦ ИнБЮМ, 2020. – 120 с. DOI: 10.21072/978-5-6044865-1-1
Копий В. Г., Заика В. Е. Годичная динамика популяции полихеты Saccocirrus papillocercus в интерстициали зоны заплеска (Чёрное море, Севастопольская бухта) // Морской экологический журнал. – 2009. – Т. 8, № 2. – С. 49– 52.
Копий В. Г., Лисицкая Е. В. Некоторые особенности биологии и современное состояние популяции Saccocirrus papillocercus Bobretzky, 1872 (Polychaeta: Saccocirridae) прибрежной зоны Крыма (Чёрное море) // Морской экологический журнал. – 2012. – Т. XI, № 4. – С. 39–44.
Котельянец Е. А., Гуров К. И., Тихонова Е. А., Соловьева О. В. Некоторые геохимические показатели донных отложений прибрежной акватории под влиянием антропогенного фактора (на примере бухты Казачья,
- Севастополь) // Вестник Удмуртского университета. Серия Биология. Науки о земле. – 2017. – Т. 27, № 1. – С. 5– 13.
Латушкин А. А., Чепыженко А. А, Празукин А. В., Фирсов Ю. К. Распределение полей температуры,
солёности, общего взвешенного вещества и растворённого органического вещества в бухте Казачья (г. Севастополь) // Экологическая безопасность прибрежной и шельфовой зон моря. – 2019. – Вып.1. – С. 54–61.
Макаров М. В., Бондаренко Л. В., Витер Т. В., Подзорова Д. В. Обрастания твёрдых искусственных субстратов в сезонном аспекте у побережья Севастополя (Юго-западный Крым, Чёрное море) // Учёные записки Крымского федерального университета имени В. И. Вернадского. Биология. Химия. – 2019. – Том 5 (71), № 2. – С. 116–131.
Макаров М. В. Таксоцен Gastropoda мелководья на рыхлых грунтах в некоторых районах у побережья Крыма (Чёрное море) // Водные биоресурсы и среда обитания. – 2022. – Т. 5, № 2. – С. 54–67.
Маккавеева Е. Б. Многолетние изменения эпифитона в Севастопольских бухтах // Многолетние изменения зообентоса Чёрного моря. – Киев: Наукова думка, 1992. – С. 217–226.
Миронов О. Г., Кирюхина Л. Н., Алёмов С. В. Экологическая характеристика бухты Казачьей (Чёрное море) // Экология моря. – 2002. – 61. – С. 85–89.
Михайлова Т. В., Беляева О. И. Изучение распределения макрозообентоса в бухте Казачьей (Чёрное море) // Морские биотехнические системы. – 2005. – Вып. 3. – С. 91–96.
Мокиевский О. Б. Фауна рыхлых грунтов литорали западных берегов Крыма // Труды ИОАН. – 1949. – Т. 4. –
- 124-159.
Определитель фауны Чёрного и Азовского морей / [Под ред. Ф. Д. Мордухай-Болтовского]. – Киев: Наукова думка, 1972. – Т. 1. – 437 с.; Т. 2. – 536 с.; Т. 3. – 340 с.
Орехова Н. А. Окислительно-восстановительные условия донных отложений и характеристика макрозообентоса бухт Круглой и Казачьей (г. Севастополь) // Морской биологический журнал. – 2021. – Т. 6, № 4. – С. 68–86.
Орехова Н. А., Овсяный Е. И., Тихонова Е. А. Органическое вещество и окислительно-восстановительные условия в донных отложениях Балаклавской бухты // Учёные записки Крымского федерального университета имени В. И. Вернадского. Биология. Химия. – 2019. – Т. 5 (71), № 3. – С. 49–64.
Особо охраняемые природные территории Севастополя / [Ред. Е. И. Голубева, Е. А. Позаченюк]. – Симферополь: ИТ АРИАЛ, 2020. – 140 с.
Рябушко Л. И., Бондаренко А. В., Балычева Д. С. Особо охраняемые природные территории черноморского побережья Крыма (очерк) // Заповедные территории. – 2019. – № 2 – С. 117–132. DOI: 10.25808/26186764.2019.49.13.008
Рябцев Ю. Н. Моделирования переноса нефтяного пятна поверхностными течениями в районе бухт Камышовая и Казачья // Годовой отчет отдела гидрофизики шельфа МГИ НАН Украины. – Севастополь: МГИ НАНУ, 2001. – 287 с.
Сёмин В. Л. Экология полихет Азовского моря и лиманов российской части его побережья: автореф. дис. … канд. биол. наук. – Мурманск, 2011. – 25 с.
Сёмкин Б. И., Горшков М. В. Об оценке сходства и различия в серии флористических и фитоценотических описаний // Комаровские чтения. – 2010. – Вып. 57. – С. 203–220.
Соловьёва О. В., Тихонова Е. А., Клименко Т. Л., Скрыпник Г. В., Вотинова Т. В. Органические вещества донных отложений в условиях урбанизации побережья // Океанология. – 2019. – Т. 59, № 2. – С. 234–242.
Тихонова Е. А., Алёмов С. В. Характеристика донных осадков и макрозообентоса б. Казачья в первой декаде XXI века // Екологічна безпека прибережної та шельфової зон та комплексне використання ресурсів шельфу. – 2012. – Вип. 26 (1). – С. 88–94.
Чухчин В. Д. Экология брюхоногих моллюсков Чёрного моря. – Киев: Наук. думка, 1984. – 176 с. Bellan-Santini D., Karaman G., Krapp-Schickel G., Ledoyer M., Myers A., Ruffo S., Schiecke U. The Amphipoda
of the Mediterranean. Part 1: Gammaridae (Corophiidae) // Memories de l’Institut Oceanographique. – N 13. – 1982. – P. 185–208.
Çinar M. E., Dagli E., Sahin G. K. Checklist of Annelida from the coasts of Turkey // Turkish Journal of Zoology. – 2014. – Vol. 38. – P. 734–764.
Grintsov V., Sezgin M. Manual for identification of Amphipoda from the Black Sea. – Sevastopol: Digit print, 2011. – 151 p.
Orekhova N. A., Konovalov S. K. Oxygen and sulfides in bottom sediments of the coastal Sevastopol region of Crimea. // Oceanology. – 2018. – Vol. 58, N 5. – P. 679–688. https://DOI.org/10.1134/S0001437018050107
Tenore K. B., Chesney E. J. The effects of interaction of rate of food supply and population density on the bioenergetics of the opportunistic polychaete, Capitella capitata (type I) // Limnology and Oceanography – 1985. – Vol. 30, iss. 6. – P. 1188–1195.
Trayanova A. T., Todorova V. R., Konsulova T. H., Shtereva G. P., Hristova O. D., Dzhurova B. S. Ecological State of Varna Bay in Summer 2009 according to Benthic Invertebrate Fauna // Acta zoologica bulgarica – 2011. – 63 (3). – P. 277–288.
WoRMS Editorial Board (2023): World Register of Marine Species. Available from https://www.marinespecies.org at VLIZ. Accessed 2023-06-01.
Kopiy V. G., Bondarenko L. V. Macrozoobenthos in the pseudolittoral zone of Kazachya Bay (Crimea, Black Sea) in different periods of the study // Ekosistemy. 2023. Iss. 36. P. 39–55.
The current state of the macrozoobenthos in the pseudolittoral zone of the Kazachya Bay was studied and a comparative analysis of its qualitative composition and quantitative indicators was carried out in different periods and seasons of the research. In 2007–2010 and 2021–2022, 86 macrozoobenthos species from different taxa: Polychaeta (36 species), Crustacea (33), Mollusca (13), Platyhelminthes, Oligochaeta, Chironomidae and Nemertea were found. By 2022, their number increased by 1.6 times. Moreover, 38 species of hydrobionts were added to the list. Fourteen species of macrozoobenthos were identified only in 2007–2010. Average values of abundance and biomass of macrozoobenthos in 2007–2010 varied from 774±176 to 4051±306 ind./m2 and from 0.585±0.216 to 12.57±0.033 g/m2, respectively. In 2021-2022, they varied from 24±17 to 7352±3514 individuals/m2 and from 0.021±0.016 to 18.945±11.557 g/m2, respectively. In both periods, maximum abundance of macrozoobenthos formed by Polychaeta was registered in summer. In 2007–2010, the maximum biomass of macrozoobenthos was registered in summer, and in 2021–2022 it was observed in autumn. Mollusks made a significant contribution to this indicator in both periods. The trophic structure of macrozoobenthos is represented by polyphages, phytophages, detritophages and carnivores. In 2007–2010, oligochaetes were registered in 43 % of the samples in winter; H. acuta (Draparnaud, 1805), which belongs to plant detritivores, was the dominanhe species from April to September. In 2021–2022, the largest number of mass species was registered in the autumn-winter period, and S. papillocercus Bobretzky, 1872 dominated there. In spring and summer, polychaetes Capitella capitata (Fabricius, 1780), Salvatoria clavate (Claparède, 1863), Microphthalmus fragilis Bobretzky, 1870 and amphipod Pectenogammarus foxi (Schellenberg, 1928) — representatives of polyphagous and phytophagous species — dominated in terms of occurrence. Changes in the number and taxonomic diversity of mass species with different feeding types in different seasons can be associated with the breeding season of hydrobionts and changes in the food supply.
Key words: pseudolittoral, macrozoobenthos, abundance, biomass, Kazachya Bay, Black Sea.
Поступила в редакцию 15.06.23
Принята к печати 26.07.23

