Экосистемы, 36: 75–86 (2023) https://ekosystems.cfuv.ru
УДК 582.271/275:502.7(262.5) DOI 10.5281/zenodo.10374113
Евстигнеева И. К., Танковская И. Н.
Состав и биомасса макрофитобентоса памятника природы «Прибрежный аквальный комплекс у мыса Фиолент» (Черное море)
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
ikevstigneeva@gmail.com, itankovskay@gmail.com
Проведена оценка продукционного потенциала бентосных фитоценозов памятника природы в акватории мыса Фиолент и выявлены особенности распределения видов в группах сапробности, галобности, по степени встречаемости в Черном море и в зависимости от сроков вегетации макроводорослей. Материалом для исследования послужили пробы фитобентоса, собранные в июле 2021 года на восточном и западном участках охраняемой территории с глубин от 0,5 до 15 м. Всего собрано 44 количественные пробы. Показано, что в фитоценозе памятника природы ключевым продуцентом среди отделов является Ochrоphyta, вторую и третью позицию занимают Rhodophyta и Chlorophyta. К видам высоких категорий доминирования относятся Vertebrata subulifera, Ericaria crinita, Gongolaria barbata и Phyllophora crispa. Высоким разнообразием отличаются малозначимые виды, относительная фитомасса которых менее 1 %. Установлено, что минимум и максимум средней фитомассы отделов не совпадают в пространстве. Общей особенностью фитоценоза на двух участках охраняемой акватории является один и тот же тип пространственной вариабельности абсолютной фитомассы отделов и одинаковая тенденция ее батиметрических изменений у Ochrophyta и макрофитобентоса. Величина индекса Пиелу (0,72) близка к 1, что указывает на равномерное сложение ценоза по фитомассе. С учетом отношения к факторам солености и сапробности среды, в зависимости от степени встречаемости в Черном море и продолжительности вегетации водоросли, обитающие в акватории памятника природы, распределяются между 12 группами. Среди них наибольшим числом видов представлены морская, ведущая, однолетняя и олигосапробная группы. Спектры групп в отделах и степень видового разнообразия каждой из них на обследованных участках памятника природы отличаются незначительно. На примере групп – индикаторов режима галобности и сапробности морской среды показано наличие связи между глубиной обитания и числом видов в группах. Данные
- вкладе полисапробионтов и групп-индикаторов распреснения морской воды указывают на ухудшение экологической ситуации в акватории пляжа «Царский».
Ключевые слова: макрофитобентос, фитомасса, фитогалобный и фитосапробный состав, встречаемость, сроки вегетации, изменчивость, Крым, Черное море.
ВВЕДЕНИЕ
Увеличение антропогенного пресса на прибрежную зону Черного моря приводит к необходимости составления прогнозов возможных последствий ее активного освоения (Горячкин, 2015). Эти прогнозы должны базироваться на результатах регулярных и масштабных наблюдений за состоянием вовлеченных в хозяйственную деятельность прибрежных участков Черного моря. К сожалению, не все участки охвачены такими исследованиями, а имеющиеся немногочисленные данные по отдельным регионам нуждаются в актуализации. Безусловно, преодоление таких препятствий позволило бы сформировать объективное представление о современном состоянии бентосной флоры у Крымского полуострова, что, в свою очередь повысило бы прикладную значимость составляемых прогнозов, как для всей его прибрежной зоны, так и для особо охраняемых природных территорий. Охраняемые территории, помимо прямого назначения, являются полигонами для мониторинга состояния локального биоразнообразия, результаты которого и должны стать базой для усовершенствования природоохранных мероприятий (Fernández et al., 2016; Coad et al., 2019). В прибрежной зоне Крыма расположены шесть особо охраняемых природных территорий, включающих морские акватории (Позаченюк, 2020). К ним относится
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Евстигнеева И. К., Танковская И. Н.
![]()
памятник природы гидрологического профиля «Прибрежный аквальный комплекс (ПАК) у мыса Фиолент». Помимо знаний флористического состава и таксономической структуры макрофитобентоса (МФБ) охраняемого объекта большое значение имеют сведения о биомассе, формируемой растениями и о дифференциации видов по участию в продукционном процессе. Результаты исследования видового разнообразия макроводорослей данного района авторами опубликованы ранее (Евстигнеева, Такновская, 2023). Важно также учитывать, что фитоценозы представляют собой системы экологически и биологически различных видов растений. Среди подходов к классификации черноморских макроводорослей есть тот, который базируется на учете их отношения к факторам солености и сапробности среды, степени встречаемости в Черном море и генетически закрепленной продолжительности вегетационного периода (Калугина-Гутник, 1975). Данные о флористическом составе фитосапробных и фитогалобных групп, а также групп, выделенных по срокам вегетации и встречаемости в море, позволяют не только оценить один из аспектов биоразнообразия морских экосистем, но и расширить возможности фитоиндикации среды.
Цель работы – оценить продукционный потенциал макрофитобентоса и выявить особенности распределения видов по группам в зависимости от их отношения к солености и сапробности среды обитания, а также по срокам вегетации и степени встречаемости на разных участках «Прибрежного аквального комплекса у мыса Фиолент» по глубинам.
МАТЕРИАЛ И МЕТОДЫ
Памятник природы «ПАК у мыса Фиолент» находится на юго-западе Крыма (Севастопольский регион) и представляет собой единую бенчево-клифовую зону, выработанную в отложениях структурных денудационно-останцовых равнин Гераклейского полуострова и в магматических породах (Игнатов и др., 2016). Его береговая зона отличается особым геолого-геоморфологическим строением и активными динамическими процессами. Клиф у мыса Фиолент представлен крутыми склонами, для него характерна система микроамфитеатральных структур, формирование которых связано с выходами водных источников (Панкеева, 2022). Акватория считается относительно чистой, что обеспечивается сезонными и суточными перемещениями водных масс и сгонно-нагонными явлениями. К факторам, обеспечивающим особенности циркуляции и динамики вод в районе от мыса Херсонес до мыса Фиолент, относятся интенсивный поток Основного Черноморского течения, направленный на запад и северо-запад вдоль южного побережья Крыма, севастопольский антициклон, северная периферия которого нередко является вдольбереговым потоком, направленным на юго-восток (Дьяков и др., 2020; Маньковский, Маньковская, 2019). Западнее ПАК располагаются КОС (канализационные очистные сооружения) «Южные», восточнее – КОС «Балаклавские». В неблагоприятных условиях (слабые течения и отсутствие стратификации) плюм сточных вод может быть большим (до 2,0–3,5 км2) и способным к поднятию на поверхность. Периодически у мыса Фиолент значения БПК5 превышают ПДК (Грузинов и др., 2019). В 2021 году такое явление было зафиксировано у выпуска КОС «Балаклавские». Максимальная концентрация нитратного азота в районе этого выпуска достигала 340 мкг/л. Плюм сточных вод сопровождался выносом на поверхность плавающих предметов и прослеживался до мыса Херсонес. Отдельные случаи увеличения концентраций форм азота наблюдались в Голубой бухте, в районе сброса сточных вод, прошедших только механическую очистку КОС «Южные» (Дьяков и др., 2020).
Альгологические работы проводили в июле 2021 года методом вертикальных гидроботанических разрезов. Один из разрезов был выполнен на восточном участке памятника (акватория пляжа «Яшмовый»), второй – на западном (пляж «Царский») (рис. 1).
Отбор проб производили с помощью водолаза на глубинах 0,5; 1; 3; 5; 10 и 15 метров до границы распространения водорослей, в четырехкратной повторности с применением учетных площадок размером 25×25 см (Калугина, 1969). Всего было собрано 44 количественные пробы. Их первичная обработка проходила в лаборатории, где определяли
76
Состав и биомасса макрофитобентоса памятника природы
«Прибрежный аквальный комплекс у мыса Фиолент» (Черное море)

Рис. 1. Прибрежный аквальный комплекс у мыса Фиолент (Севастопольский регион)
a – схема расположения разрезов; b, c – пляж «Яшмовый» (I) (N 44º30.244′; E 33º30.225′); d – пляж «Царский» (II) (N 44º30.461′; E 33º28.921′); заросли макроводорослей на глубинах 1 (e) и 10 (f) метров.
видовой состав водорослей с применением микроскопа «Армед XS-90» и сырую массу на электронных весах «ВК-600».
Для идентификации видов руководствовались отечественным определителем (Зинова, 1967) и учитывали результаты последних номенклатурных ревизий (Guiry, Guiry, 2023). Виды распределяли по группам встречаемости, разных сроков вегетации, фитосапробности и фитогалобности в соответствии со шкалой (Калугина-Гутник, 1975). Для описания фитоценозов рассчитывали коэффициент встречаемости (R, %) ключевых видов-продуцентов,выравненность видов по биомассе оценивали по индексам Шеннона (Н) и Пиелу (Е) (Дажо, 1975; Розенберг, 2010). По индивидуальной фитомассе и с применением шкалы доминирования Е. Л. Любарского, базирующейся на сведениях об относительной фитомассе видов, определяли группы малозначимых и второстепенных видов, содоминантов и доминантов разных категорий (Баканов, 2005).
Для описания пространственной изменчивости МФБ определяли лимиты, размах вариации и среднее значение его характеристик с доверительным интервалом (уровень
77
Евстигнеева И. К., Танковская И. Н.
![]()
достоверности р=0,05) (Жукова, Миинец, 2019). По величине коэффициента вариации (Cv, %) оценивали тип изменчивости признаков по семибалльной шкале (небольшое варьирование, верхне- и нижненормальный, значительный, большой, очень большой, аномально высокий) (Зайцев, 1990). Особенности батиметрических изменений видового состава исследовали на примере групп – индикаторов сапробности (олиго-, мезо- и полисапробная) и галобности (морская, солоноватоводно-морская и солоноватоводная) морской среды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фитомасса бентосных водорослей в акватории пляжа «Яшмовый» (восточная граница ПАК). Большую часть прибрежья памятника природы занимает эрикариево-гонголариевый фитоценоз (Панкеева и др., 2022). Исследования показали, что на восточном участке ПАК абсолютная биомасса этого фитоценоза варьирует от 1345 до 7952 г‧м-2, достигая в среднем для станций разреза 5122±2807 г‧м-2. Размах крайних значений показателя (6607 г‧м-2), величина доверительного интервала и коэффициента вариации (63 %) свидетельствуют о высокой изменчивости продукционной характеристики фитоценоза, которая по шкале Г. Н. Зайцева соответствует типу «значительная». Отметим, что подавляющее большинство видов (73 %) имеют фитомассу менее 1,0 г‧м-2. Основу общей абсолютной фитомассы составляют бурые водоросли. Их средняя фитомасса достигает 64 % от этого показателя у фитоценоза на восточной границе ПАК. Анализируемая характеристика Ochrophyta (Och) варьирует так широко, что ее крайние значения различаются в 5 раз. Судя по величине коэффициента вариации (58 %), тип изменчивости фитомассы Och, как базового продуцента, совпадает с таковым у сообщества водорослей в целом. На всех глубинах, кроме 1 м, доминирует представитель бурых водорослей Ericaria crinita (Duby) Molinari et Guiry. На 1 м роль ключевого продуцента выполняет Gongolaria barbata (Stackh.) Kuntze. Отсюда частота доминирования Ericaria crinita, в соответствии с представлениями Де Фриза, равна 80 % (Баканов, 2005). На второй позиции находятся представители Rhodophyta (Rh). О значимости их участия в продукционном процессе свидетельствует тот факт, что на одной из станций разреза они разделяют с бурыми водорослями место лидера. Средняя фитомасса видов Rh (1713±1306 г‧м-2) вдвое меньше, чем у Och и достигает 33,5 % от этого показателя
- альгоценоза. На Vertebrata subulifera (C. Agardh) Kuntze) приходится 71 % общей фитомассы красных водорослей, а у более половины видов отдела (69 %) фитомасса менее 1,0 г‧м-2. Представители Chlorophyta (Ch) произрастают в диапазоне глубин, более узком (от 0,5 до 5 м), чем у других отделов. На долю их фитомассы на этих горизонтах приходится от тысячных долей до 10 % фитомассы МФБ. Среди видов отдела весомый вклад в продукционный процесс вносят Cladophora albida (Nees) Kütz. и Ulva intestinalis L.
Бурые водоросли лидируют не только по абсолютной, но и по относительной фитомассе, средняя величина которой (68±11 %) вдвое выше, чем у Rh и в 21 раз, чем у Ch. Пространственные вариации данного показателя у отделов увеличиваются в порядке: Och>Rh>Ch, что соответствует характеру изменений абсолютной фитомассы. То есть, наибольшей устойчивостью в пространстве отличается отдел, лидирующий по вкладу в процесс формирования фитомассы МФБ, а наименьшей – отдел с более узкой зоной распространения в акватории пляжа «Яшмовый» и низкой фитомассой.
Синхронность пространственных вариаций фитомассы МФБ и Och иллюстрирует ценотическую значимость отдела в качестве ключевого продуцента (рис. 2). Максимум абсолютной фитомассы Ch зафиксирован на 1 м, Och – на 1 и 3 м, Rh – на 5 м, фитоценоза – на всех указанных глубинах. Наименьшее значение показателя у Ch отмечено на 3 м, у Och, Rh и фитоценоза – на 0,5 м.
Данные по относительной фитомассе позволяют распределить виды по группам в соответствии со шкалой, предложенной Е. Л. Любарским для определения степени продукционного доминирования видов (таблица). Основная часть видов попадает в группу элементов, малозначимых по вкладу в продукционный процесс. За ними следуют
78
Состав и биомасса макрофитобентоса памятника природы
«Прибрежный аквальный комплекс у мыса Фиолент» (Черное море)
![]()
второстепенные виды. Среди них отмечены один вид Ch, два вида Och и четыре – Rh. Группы высоких категорий доминирования представлены доминантами и субдоминантами. Роли доминантов выполняют Ericaria crinita и Vertebrata subulifera, субдоминанта – Gongolaria barbata.
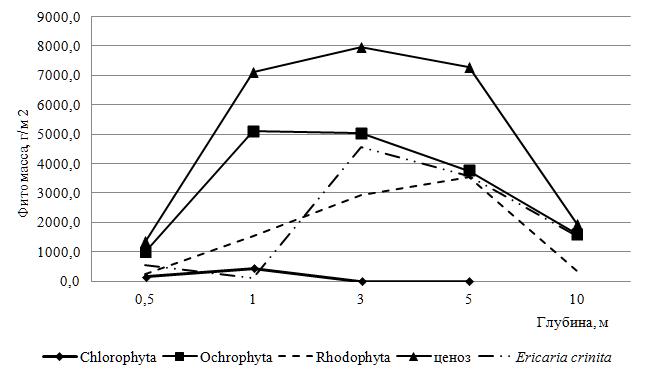
Рис. 2. Батиметрические изменения фитомассы отделов и фитоценоза охраняемой акватории пляжа «Яшмовый»
Таблица
Группы продукционного доминирования макроводорослей по шкале Е. Л. Любарского
| Степень доминирования видов | I | II | ||||
| n* | %** | n | % | |||
| Малозначимый | 38 | 79 | 37 | 84 | ||
| Второстепенный | 7 | 15 | 4 | 9 | ||
| Cубдоминантный | 1 | 2 | 2 | 5 | ||
| Доминантный | 2 | 4 | 0 | |||
| Абсолютный доминантный | – | – | 1 | 2 | ||
| Общее число видов | 48 | 44 | ||||
Примечание к таблице. * – абсолютное число видов, ** – относительное число видов.
Индекс Шеннона изменяется от 0,90 на 10 м до 2,68 – на 0,5 м. Территориальная локация максимума индекса связана с тем, что условия обитания гидробионтов на мелководье отличаются разнообразием и динамичностью, что предопределяет высокое разнообразие видов, выполняющих функцию содоминантов. Для всего фитоценоза индекс составляет 2,59. Величина индекса Пиелу (0,72) близка к 1, что указывает на равномерное сложение сообщества по фитомассе на восточной границе ПАК.
Фитомасса бентосных водорослей в акватории пляжа «Царский» (западная граница ПАК). На данном участке ПАК абсолютная биомасса фитоценоза изменяется от 1698 до 8540 г‧м-2 и в среднем для станций достигает 4654±2340 г‧м-2. Размах крайних значений показателя (6842 г‧м-2), величина доверительного интервала и коэффициента вариации (63 %) свидетельствуют о высокой вариабельности продукционной характеристики фитоценоза («значительная»). У половины видов, обитающих в акватории пляжа, фитомасса не достигает 1,0 г‧м-2. Наибольшая часть абсолютной фитомассы МФБ сформирована за счет бурых водорослей (рис. 3). Их вклад в среднюю фитомассу сообщества на западном участке составляет 78 %. Минимум и максимум анализируемой характеристики Och различаются в 5
79
Евстигнеева И. К., Танковская И. Н.
![]()
раз. Тип изменчивости фитомассы Och и МФБ совпадает. На всех глубинах господствует Ericaria crinita, что обеспечивает ей максимально высокую частоту доминирования (100 %). На втором месте по продукционной значимости находятся представители Rh, средняя абсолютная фитомасса (1152±910 г‧м-2) которых втрое меньше, чем у Och и составляет 23 % от этого показателя у сообщества. Величина доверительного интервала и коэффициента вариации (92 %) позволяют определить интенсивность пространственных вариаций фитомассы Rh как «очень большую». 67 % фитомассы красных водорослей приходится на Vertebrata subulifera, у более половины видов отдела (52 %) этот показатель меньше 1,0 г‧м-2. Абсолютная фитомасса Ch колеблется от 0,1 до 41,0 г‧м-2. Ее крайние значения, размах вариации и средняя величина во много раз ниже, чем у других отделов. 60 % фитомассы Ch приходится на Ulva intestinalis, тогда как у других представителей отдела относительная фитомасса менее 0,2 %. Средняя относительная фитомасса Och (78,3±8,8 %) втрое выше, чем у Rh и на порядки, чем у Ch.
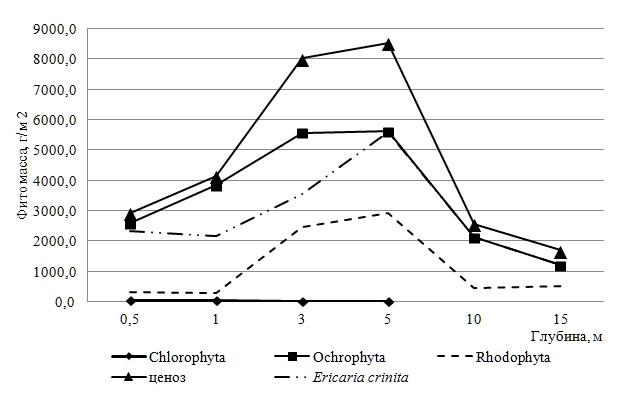
Рис. 3. Батиметрические изменения фитомассы отделов и фитоценоза охраняемой акватории пляжа «Царский»
Интенсивность пространственных вариаций абсолютной и относительной фитомассы у отделов возрастает в направлении: Och>Rh>Ch. Кривые, описывающие изменения абсолютной фитомассы по глубинам, большей частью идентичны у Och, Rh, МФБ, а также у ключевого продуцента Ericaria crinita, но только начиная с 1 м (рис. 3). Отмечено совпадение локации максимума фитомассы Ch и минимума у Rh (0,5 и 1 м), минимумов показателя у Och
- МФБ (15 м). Кроме того, для сообщества на глубине 3 м характерен пик количественного развития Och, Rh и МФБ, а для Rh и МФБ еще и на 5 м, то есть на горизонте, где фитомасса зеленых водорослей ничтожно мала. Вертикальное распределение фитомассы отделов хорошо согласуется с ослаблением интенсивности и обеднением спектрального состава света с глубиной (Звалинский, 1986; Дуленин, 2015).
Подавляющее большинство видов (84 %), обитающих в акватории западной части охраняемого объекта, имеют невысокую относительную фитомассу и в соответствии со шкалой Е. Л. Любарского относятся к малозначимым элементам (таблица). В фитоценозе отмечены абсолютный доминант Ericaria crinita и содоминанты – Vertebrata subulifera и Gongolaria barbata. Виды категории «доминант» отсутствуют. Четыре вида, среди которых больше представителей Rh, являются второстепенными элементами. В эту группу, в частности, входит Phyllophora crispa (Huds.) P. S. Dixon, обнаруженная на глубинах 10 и 15 м, где расположено урочище подводного склона, одной из характеристик которого является
80
Состав и биомасса макрофитобентоса памятника природы
«Прибрежный аквальный комплекс у мыса Фиолент» (Черное море)
![]()
мозаичное чередование галечно-гравийных донных осадков с битой ракушей (Панкеева и др., 2022). Phyllophora crispa известна как ключевой ценозообразущий черноморский вид, однако в районе исследований ее вклад в общую фитомассу невелик и составляет 4 и 13 %.
Индекс Шеннона изменяется от 0,85 на 10 м до 1,90 на 1 м. Для всего фитоценоза индекс составляет 1,90, а средний для глубин – 1,36. Величина индекса Пиелу (0,71) близка к 1.
Сравнительная характеристика продукционного потенциала макрофитобентоса на восточной и западной границах ПАК. Учитывая степень равномерности сложения фитоценоза по биомассе, следует ожидать, что в случае обнаружения различий МФБ на двух участках, они будут не столь заметными и касающимися только его отдельных параметров. Одно из установленных отличий относится к уровню общей фитомассы МФБ и входящих в него отделов на некоторых горизонтах. Так, абсолютная фитомасса Ch на 0,5 м, Rh и фитоценоза на 1 м выше в акватории пляжа «Яшмовый», в районе же пляжа «Царский» и только на 5 м более высоким уровнем этого показателя отличаются Och и фитоценоз (рис. 2, 3). Среднее для исследованной части фитали значение индекса Н, степень разнообразия второстепенных видов, средняя абсолютная фитомасса Rh и фитоценоза, вклад Ch и Rh в среднюю фитомассу МФБ больше в акватории пляжа «Яшмовый». Здесь же на порядок выше средняя фитомасса Ch, отсутствуют «абсолютные» доминанты, но есть такие виды-доминанты, как Ericaria crinita и Vertebrata subulifera. В районе пляжа «Царский» Ericaria crinita выполняет функцию «абсолютного» доминанта.
МФБ двух участков ПАК характеризуется равной или близкой к ней фитомассой Сh, Rh
- фитоценоза на глубине 3 м, а также средней фитомассой Och. Повсеместно проявляется господство малозначимых видов, а среди отделов – Och. Вторую и третью позицию неизменно занимают Rh и Ch. Примерно одинаковым выглядит список видов, вносящих существенный вклад в процесс формирования фитомассы отделов и альгоценоза. К ним относятся Ulva intestinalis, Gongolaria barbata, Ericaria crinita, Laurencia obtusa (Huds.) J.V. Lamour. и виды
Cladophora Kütz. Альгоценозу на двух участках ПАК характерен один и тот же тип пространственной вариабельности абсолютной фитомассы отделов и одинаковая тенденция ее батиметрических изменений у Och, Rh и МФБ. Индекс Шеннона на обоих участках изменяется широко с максимумом на малых глубинах и минимумом на больших. Величина индекса Пиелу, близкая к 1, свидетельствует об относительно равномерном сложении фитоценоза по анализируемому показателю.
Флористический состав и видовое разнообразие групп сапробности, галобности, встречаемости и разных сроков вегетации водорослей ПАК. В состав МФБ охраняемого объекта входят макроводоросли 12 групп, среди которых наибольшим числом видов отличаются ведущая (58 % от общего числа идентифицированных видов), олигосапробная (58 %) и морская (69 %). Среди групп с разной продолжительностью жизни равное и преимущественное развитие получают одно- и многолетники. Спектры групп у отделов не совпадают между собой. Отличительными особенностями Ch являются примерно равная видовая представленность всех групп видов с разной встречаемостью в бентосе Черного моря, отсутствие сезонных видов, господство однолетних (90 % от числа видов в отделе), мезосапробных (50 %) и солоноватоводно-морских (70 %) видов (рис. 4, 5). Групповой спектр Och редуцирован за счет однолетников, мезо- и полисапробионтов, солоноватоводно-морской группы. Об однородности качественного состава бурых водорослей свидетельствует высокая доля доминирующих групп (61–100 %). Такие водоросли известны своей требовательностью к качеству среды обитания и при наличии соответствующих условий формируется адекватный им комплекс видов (Великанов и др., 1981). В районе исследований Och на 100 % состоят из морских и олигосапробных водорослей. Красные водоросли, доминирующие по таксономическому разнообразию, представлены всеми 12 группами, среди которых очень много ведущих, одно- и многолетних, олигосапробных и морских (41–76 % от общего числа видов отдела) видов. Групповые спектры Rh и альгоценоза полночленные, с единым комплексом доминирующих групп.
Сравнение состава МФБ на двух участках показало, что различие по числу видов в большинстве имеющихся групп незначительное и составляет один или два таксона (рис. 6).
81
Евстигнеева И. К., Танковская И. Н.
![]()
Отмечено равное видовое представительство солоноватоводной и сезонной групп. Совпадает или близка к совпадению доля (в %) видов всех групп встречаемости, солоноватоводно-морских, солоноватоводных, одно- и многолетних, сезонных, мезо- и олигосапробных водорослей. Более весомое отличие характерно однолетникам и олигосапробионтам, абсолютное число видов которых на три–четыре таксона выше в сообществе акватории пляжа «Яшмовый». Заметным является и различие по вкладу в общий состав видов морской группы. Абсолютное число видов в ней в районе пляжа «Яшмовый» выше только на 2 таксона, но доля их уже больше вдвое (69 % от общего числа видов в альгоценозе пляжа). Для фитоценоза в целом на западном участке характерно более высокое видовое разнообразие полисапробионтов и почти вдвое больший вклад их в общий состав. Такое разнообразие полисапробионтов, высокий вклад солоноватоводно-морских и солоноватоводных видов
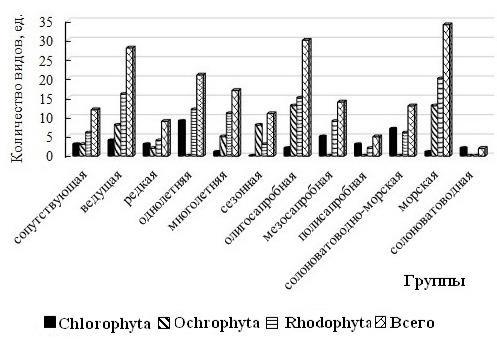
Рис. 4. Флористический состав и видовая насыщенность разных групп водорослей на охраняемой акватории пляжа «Яшмовый»
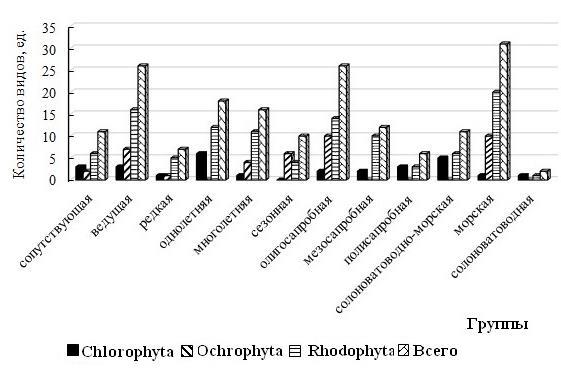
Рис. 5. Флористический состав и видовая насыщенность групп водорослей на разных участках охраняемой акватории пляжа «Царский»
82
Состав и биомасса макрофитобентоса памятника природы
«Прибрежный аквальный комплекс у мыса Фиолент» (Черное море)
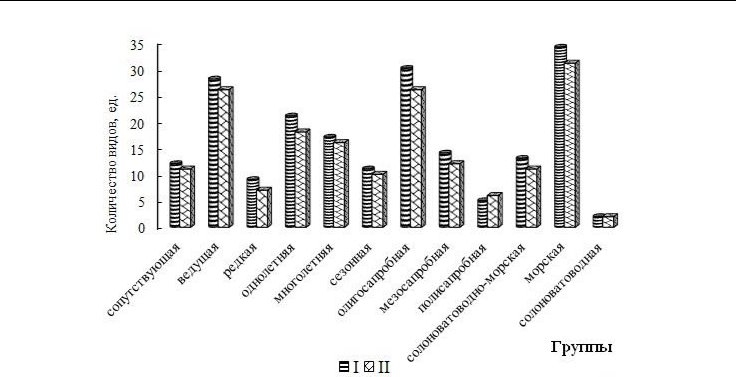
Рис. 6. Распределение видов между группами сапробности, галобности, с разной встречаемостью и в зависимости от сроков вегетации
- – пляж «Яшмовый», II – пляж «Царский».
указывают на формирование в акватории пляжа «Царский» экологической ситуации, близкой
- критичной. Спектры групп в фитоценозе в целом на двух участках являются полночленными с одинаковым комплексом лидирующих групп (ведущая, морская, одно- и многолетняя, олигосапробная).
Сходство и различие характерно и для группового спектра каждого из отделов. Для Ch на любом из обследованных участков характерно отсутствие сезонных видов, равное абсолютное число видов в сопутствующей, многолетней, олигосапробной, полисапробной и морской группах. Одинаковым является и относительное число многолетних и солоноватоводно-морских видов. Тем не менее, Ch на восточном участке ПАК отличается более высоким видовым разнообразием редких, однолетних и мезосапробных водорослей. Перечень базовых по числу видов групп совпадает, за исключением того, что на западном участке более высокое развитие получают полисапробионты, на восточном – мезосапробионты. Общей характеристикой Och на западном и восточном участках ПАК являются отсутствие однолетних, мезосапробных, солоноватоводно-морских видов и одинаковый комплекс ключевых групп. Сапробную и галобную части спектра бурых водорослей отличает высокая однородность за счет абсолютного господства олигосапробионтов и типично морских видов. Спектр видов Rh представлен всеми 12 группами, на двух участках ПАК он проявляет высокое качественное и количественное сходство.
Таким образом, выявленные различия групповых спектров трех отделов и фитоценоза не могут считаться существенными. Особого внимания заслуживает только факт весомого вклада полисапробионтов и совместная доля групп-индикаторов распреснения морской среды в акватории пляжа «Царский».
Сходство состава макроводорослей на восточном и западном участке памятника природы позволяет ограничить описание батиметрической изменчивости числа видов в разных группах на примере таких важных индикаторов качества среды, как группы сапробности (олиго-, мезо и полисапробная) и галобности (солоноватоводная, солоноватоводно-морская и морская) в фитоценозе пляжа «Яшмовый». Установлено, что встречаемость представителей большинства перечисленных групп составляет 100 % и только у полисапробионтов (R=80 %) и солоноватоводных видов (R=60 %) она ниже. На каждой глубине количественно доминируют морская и олигосапробная группы. Вторую позицию неизменно занимают
83
Евстигнеева И. К., Танковская И. Н.
![]()
мезосапробные и солоноватоводно-морские водоросли. Максимум абсолютного числа видов приурочен к 0,5 и 1 м, минимум – к нижней границе распространения макроводорослей в акватории пляжа. Отсутствие донной растительности на глубине более 10 м, где распространено урочище слабонаклонной равнины из песчаных отложений, было отмечено ранее (Панкеева и др., 2022). Связь между глубиной обитания и абсолютным числом видов в группах проявляется по-разному. У мезосапробионтов она обратно пропорциональная, а у полисапробионтов и солоноватоводно-морских растений такой же характер взаимосвязи зафиксирован в части фитали, ограниченной глубинами 0,5 и 3 м. В динамике числа видов у олигосапробионтов и в морской группе можно только выделить четкую локацию максимума (1 м) и минимума (10 м). Данные о доле участия (в %) каждой группы в формировании сапробной и галобной частей экоспектра МФБ свидетельствуют о том, что он наиболее однороден на глубине 10 м, где на отдельные группы приходится по 90 % от общего числа видов в сообществе. В таких группах абсолютное и относительное число видов проявляет устойчивость в пространстве и их батиметрические колебания осуществляются в пределах биологической «нормы». У остальных групп количественная трансформация видового состава происходит интенсивнее. На 0,5 м степень доминирования отдельных сапробных и галобных групп не столь велика как на других горизонтах. Очевидно, более динамичные условия обитания на мелководье способствуют развитию видов с самыми разными экологическими предпочтениями и генетически закрепленными сроками вегетации. Среднее абсолютное число видов, как и относительное, в доминирующих группах во много раз выше, чем у групп, занимающих соподчиненное положение.
ВЫВОДЫ
-
- В ходе исследований получены данные о величине биомассы МФБ на разных участках памятника природы у мыса Фиолент и в зависимости от глубины обитания водорослей. Установлено, что в охраняемой акватории ключевыми продуцентами среди отделов является
Ochrоphyta, среди видов – Vertebrata subulifera, Ericaria crinita, Gongolaria barbata, Phyllophora crispa. Отмечено доминирование малозначимых видов с фитомассой менее 1 % от таковой у альгоценоза.
-
- Показано, что в части фитали, ограниченной 0,5 и 3 м для Och и МФБ, 0,5 и 5 м для Rh, проявляется прямая связь между глубиной и величиной фитомассы, в остальной части она обратная.
- Среднее значение индекса Шеннона и величина индекса Пиелу свидетельствуют об относительно равномерном распределении видов по абсолютной фитомассе на разных участках и по глубинам.
- Фитобентос охраняемой акватории состоит из представителей групп сапробности, галобности, разных сроков вегетации и встречаемости в Черном море, среди которых доминируют морские, ведущие, однолетние и олигосапробные виды. Наибольшим качественным своеобразием отличается Chlorophyta за счет высокого развития редких видов
- индикаторов средней степени распреснения и органического загрязнения морской среды.
- Видовой состав выделенных групп подвержен батиметрической изменчивости с разной степенью интенсивности. Различия же в числе видов у большинства групп на двух участках незначительные, однако, весомость вклада полисапробионтов и совместная доля групп-индикаторов распреснения морской среды указывают на ухудшение экологической обстановки в акватории пляжа «Царский».
В целом, проведенные гидроботанические исследования позволяют сформировать объективное представление о современном состоянии бентосной флоры особо охраняемых природных территорий и повысить прикладную значимость составляемых прогнозов для прибрежных участков Крымского полуострова, вовлекаемых в хозяйственную деятельность человека.
84
Состав и биомасса макрофитобентоса памятника природы
«Прибрежный аквальный комплекс у мыса Фиолент» (Черное море)
![]()
Работа выполнена в рамках государственного задания Института биологии южных морей им. А. О. Ковалевского РАН (проект № 121030300149-0).
Список литературы
Баканов А. И. Количественная оценка доминирования в экологических сообществах // Количественные методы экологии и гидробиологии: сборник научных трудов / [Ред. чл.-корр. РАН Г. С. Розенберг]. – Тольятти: СамНЦ РАН, 2005. – С. 37–68.
Великанов Л. Л., Гарибова Л. В, Горбунова Н. П. Курс низших растений. – Высшая школа, 1981. – 504 с. Горячкин Ю. Н. Современное состояние береговой зоны Крыма. – Севастополь: ЭКОСИ-Гидрофизика,
2015. – 252 с.
Грузинов В. М., Дьяков Н. Н., Мезенцева И. В., Мальченко Ю. А., Жохова Н. В., Коршенко А. Н. Источники загрязнения прибрежных вод Севастопольского района // Океанология. – 2019. – Т. 59, № 4. – С. 579–590. https://doi.org/10.31857/S0030-1574594579-590
Дажо Р. Основы экологии. М.: Прогресс, 1975. – 245 с.
Дьяков Н. Н., Мальченко Ю. А., Липченко А. Е., Боброва С. А., Тимошенко Т. Ю. Гидролого-гидрохимические характеристики прибрежных вод Крыма и необходимые мероприятия по снижению уровня загрязнения рекреационных зон // Труды государственного океанографического института. – 2020. – № 221. –
- 163–194.
Дуленин А. А. Распространение сублиторальной растительности материкового побережья Охотского моря (в пределах Хабаровского края) // Известия Тихоокеанского научно-исследовательского рыбохозяйственного центра. – 2015. – 180 (1). – 107–27.
Евстигнеева И. К., Танковская И. Н. Таксономический анализ макрофитобентоса акватории памятника природы «Прибрежный аквальный комплекс у мыса Фиолент» (Черное море) // Вестник Пермского университета. Сер. Биология. – 2023, Вып. 2. – С. 179‒194. http://dx.doi.org/10.17072/1994-9952-2023-2-179-194
Жукова А. А., Минец М. Л. Биометрия. Описательная статистика: Учебное пособие. – Минск: БГУ. Ч. 1.,
2019. – 100 с.
Зайцев Г. Н. Математика в экспериментальной ботанике. – М.: Наука, 1990. – 96 с.
Звалинский В. И. Закономерности влияния интенсивности и спектрального состава света на фотосинтез морских водорослей: автореф. дис. … д-ра биол. наук. – 03.01.02 – Минск: Институт фотобиологии АН БССР, 1986. – 45 с.
Зинова А. Д. Определитель зеленых, бурых и красных водорослей южных морей СССР. – М.– Л.: Наука, 1967. – 397 с.
Игнатов E. И, Орлова М. С., Санин А. Ю. Береговые морфосистемы Крыма. – Севастополь: ЭКОСИ-Гидрофизика, 2014. – 267 с.
Калугина А. А. Исследование донной растительности Черного моря с применением легководолазной техники // Морские подводные исследования. – 1969. – С. 105–113.
Калугина-Гутник А. А. Фитобентос Черного моря. – Киев: Наукова думка, 1975. – 248 с.
Маньковский В. И., Маньковская Е. И. Оптические аномалии в Севастопольском антициклоническом вихре // Экологическая безопасность прибрежной и шельфовой зон моря. – Севастополь: МГИ. – 2019. – № 1. – С. 48–53.
Панкеева Т. В., Миронова Н. В., Пархоменко А. В. Ландшафтные исследования памятника природы «Прибрежный аквальный комплекс у мыса Фиолент» // Труды Карадагской научной станции им. Т. И. Вяземского – природного заповедника РАН. – 2022. – Т. 7, № 3 (23). – С. 45–60.
Позаченюк Е. А., Панкеева Т. В., Панкеева А. Ю., Пизова Е. В. Состояние особо охраняемых природных территорий города федерального значения Севастополя // Геополитика и экогеодинамика регионов. – 2020. – Т. 6 (16), вып. 2. – С. 161–171.
Розенберг Г. С. Информационный индекс и разнообразие: Больцман, Котельников, Шеннон, Уивер … //
Самарская Лука: проблемы региональной и глобальной экологии. – 2010. – Т. 19 (2). – С. 4–25.
Coad L., Watson J. E., Geldmann J., Burgess N. D., Leverington F., Hockings M., Knights K., Marco M. Widespread shortfalls in protected area resourcing undermine efforts to conserve biodiversity // Frontiers in Ecology and the Environment. – 2019. – Vol. 17 (5). – Р. 259–264.
Fernández C. G., Paulo D., Serrão E. A, Engelen A. H. Limited differences in fish and benthic communities and possible cascading effects inside and outside a protected marine area in Sagres (SW Portugal) // Journal Marine Environmental Research. – 2016. – Vol. 114. – P. 12–23.
Guiry M. D., Guiry G. M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway.
URL: http: // www.algaebase.org (Searched on june 2023).
85
Евстигнеева И. К., Танковская И. Н.
![]()
Evstigneeva I. K., Tankovskaya I. N. Composition and biomass of macrophytobenthos of the natural monument «Coastal aquatic complex at Cape Fiolent» (Black Sea) // Ekosistemy. 2023. Iss. 36. P. 75–86.
The productive potential of benthic phytocenoses within the waters of Cape Fiolent Natural Monument was assessed and the peculiarities of species distribution in terms of saprobity, halobity, the degree of occurrence in the Black Sea and dependence on the vegetation period of macroalgae was revealed. The researchers studied Phytobenthos samples collected in July 2021 in the eastern and western sections of the protected area from depths ranging from 0.5 to 15 m. A total of 44 quantitative samples were collected. Results indicate that Ochrоphyta is the dominant producer among the divisions in the phytocenosis of the natural monument, followed by Rhodophyta and Chlorophyta. Species of high dominance categories include Vertebrata subulifera, Ericaria crinita, Gongolaria barbata and Phyllophora crispa. Less significant species demonstrate high diversity, with their relative phytomass being less than 1%. It was found that the minimum and maximum of the average phytomass of the divisions do not coincide in space. The study revealed that the phytocenosis in the two sections of the protected waters displays the same type of spatial variability in absolute phytomass among Ochrophyta and macrophytobenthos, with comparable bathymetric changes. The value of Pielou index (0.72) approaches 1, indicating a uniform composition of the cenosis in terms of phytomass. Taking into account the factors of salinity and saprobity of environment, depending on the degree of occurrence in the Black Sea and duration of vegetation, the algae inhabiting the waters of the natural monument are distributed among 12 groups. The marine, leading, annual and oligosaprobic groups are represented by the largest number of species. The group spectra within divisions and the degree of species diversity within each group in the surveyed areas of the natural monument differ insignificantly. The significant correlation between habitat depth and species richness within the indicator groups for halobity and saprobity regime is demonstrated. Furthermore, the data on the contribution of polysaprobionts and indicators of desalination sea water indicate the deterioration of the ecological situation in the watersof the Tsarsky beach aquatory.
Key words: macrophytobenthos, phytomass phytohalobic and phytosaprobic composition; occurrence, vegetation period, variability, Crimea, Black Sea.
Поступила в редакцию 31.07.23
Принята к печати 18.09.23
86

