Publication text (PDF): Download
УДК 599:614.449(292.471)
Результаты эколого-топологического мониторинга мелких млекопитающих Крыма с учётом их природно-очаговой зоонозности
Владычак В. В.1, Кобечинская В. Г.2, Коваленко И. С.1, Абибулаев Д. Э.1, Якунин С.Н.1, Тихонов С. Н.1
1 Противочумная станция Республики Крым Симферополь, Республика Крым, Россия vladychak.victor@mail.ru
2 Институт биохимических технологий, экологии и фармации Крымского федерального университета имени В. И. Вернадского,
Симферополь, Республика Крым, Россия valekohome@mail.ru
Изложены результаты анализа многолетней динамики распространения мелких млекопитающих на территории Крыма. Определены доминирующие виды в различных ландшафтных зонах полуострова. Обозначена роль отдельных видов мелких млекопитающих в функционировании природных очагов различных видов инфекций, возбудители которых циркулируют на территории Крыма. Из всех природно-очаговых зоонозных инфекций лептоспироз регистрируется наиболее часто во всех природных зонах с наибольшим количеством выявлений у видов, обитающих в горной зоне (69,6 %). Положительные находки на туляремию выявляются во всех природных зонах практически с одинаковой частотой (22,9–26,1 %). Главными носителями, содержащими возбудитель туляремии по данным исследованиям, являются малая белозубка (Crocidura suaveolens ), общественная полевка (Microtus socialis ), степная мышь (Sylvaemus witherbyi ) и домовая мышь (Mus musculus). Возбудитель хантавирусной инфекции зарегистрирован с наибольшей частотой в степной зоне (66,7 %). Положительные находки возбудителей иксодовых клещевых боррелиозов (ИКБ) зарегистрированы на территории степной зоны (19,6 %). В горной и предгорной зонах полуострова возбудители этой инфекции в мелких млекопитающих не отмечены.
Ключевые слова: мелкие млекопитающие, зоонозность, природно-очаговые инфекции, мониторинг, фоновый вид, Крым.
ВВЕДЕНИЕ
Вопросу изучения экологии, биологии и территориальной приуроченности мелких млекопитающих, имеющих большое экономическое и эпидемиологическое значение, посвящено много работ как в Российской Федерации (Бондаренко и др., 1977; Алексеев и др., 1989; Кучерук, Карасева, 1992; Дулицкий, 2001; Бондаренко, Утенкова, 2009; Леман, 2020 и др.), так и за рубежом (Schmaljohn, Hjelle, 1997; Adler et al, 2002; Ellis et al ., 2002; Красавцев и др., 2013; Foley, Piovia-Scott, 2014; Алымкулова и др., 2019; Combs, 2022 и др.). Это обусловлено тем, что они занимают ведущее положение в циркуляции возбудителей многих зоонозных инфекций и часто являются главными прокормителями разнообразных кровососущих членистоногих, которые, в свою очередь, обеспечивают циркуляцию опасных трансмиссивных заболеваний (Товпинец и др., 1988; Маркешин, 1994; Костин, Дулицкий, 1999; Кучерук, 2006; Кравцов и др., 2013; Тарасов, 2016).
Несмотря на островную обедненность фауны мелких млекопитающих Крымского полуострова – всего 21 вид, относящийся к двум отрядам: насекомоядные (Insectivora) и грызуны (Rodentia) – они играют существенную роль в поддержании активности природных очагов ряда зоонозов (Алексеев и др., 1989).
Активное преобразование территорий обитания мелких млекопитающих (вырубка леса после пожаров, распашка степей, осушение и освоение русел малых рек, развитие сферы активного туризма) привело к резкому увеличению антропогенной нагрузки на природные
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
экосистемы полуострова и уменьшению их зон естественного обитания. Становится важным фактором и изменение климатических показателей на территории Крыма в рамках глобального потепления. По данным исследований климата Крыма В. П. Нестеренко (2016) отмечено, что за последние 20 лет среднегодовая температура воздуха увеличилась на 1,24±0,06°С, осадки в зимний период в среднем увеличились на 62±15 мм. Мягкие зимние температурные показатели благоприятно влияют на увеличение численности мелких млекопитающих, и как следствие, это ведет к увеличению частоты возможного контакта их с человеком. Также изменение климата в сторону более теплых показателей создает предпосылки для расселения и укоренения завезенных новых возбудителей, а также видов резервуаров и переносчиков, которые могут стать недостающим звеном в развитии той или иной новой нозологии (Кучерук, Карасева, 1992).
Таким образом, влияние экологических факторов на территорию Крыма как природного, так и антропогенного происхождения существенно повышает риски осложнения эпидемической ситуации и возникновения вспышек зоонозных инфекций. Поэтому основной задачей при изучении мелких млекопитающих Крыма является необходимость проведения мониторинга территории полуострова по уточнению современных реально существующих границ природных очагов инфекций с выявлением доминирующих видов в различных ландшафтных зонах, для последующего учета этих данных при планировании преобразования территории и разработке новых туристических маршрутов.
Цель наших исследований – анализ многолетней динамики распространения мелких млекопитающих на территории Крыма, с учётом их природно-очаговой зоонозности.
МАТЕРИАЛ И МЕТОДЫ
Исследования проводились на базе Федерального государственного казенного учреждения здравоохранения «Противочумная станция Республики Крым» Роспотребнадзора, согласно методическим рекомендациям «Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекционных болезней. МР 3.1. 0211-20 (2020) и с соблюдением требований СанПин 3.3686-21 «Санитарно- эпидемиологические требования по профилактике инфекционных болезней» (2021) Все работы выполнялись в соответствии с законами и иными нормативными правовыми актами Российской Федерации, действующими в сфере эпидемиологии и экологии, основ трудового законодательства. Все латинские наименования животных приводятся по А. А. Лисовскому (2019).
Для отлова мелких млекопитающих (грызунов, насекомоядных) применяли плашки (давилки Геро) с трапом или без него. Минимальной учетной единицей для каждой стации обитания видов считали 100 ловушко-ночей (ловушко-суток). Основной показатель численности – число зверьков (общее и по видам), попавших в такое количество ловушек. Орудия лова расставлялись в 2 или 4 линии (не ближе 50 метров одна от другой) соответственно, по 50 и 25 ловушек согласно принятым методикам учета (Карасева и др., 2008; Шефтель, 2018). Для каждого вида вычислялся индекс доминирования (далее ИД), отображающий отношение числа особей какого-либо вида к общему числу видов в биоценозе, согласно МУ 3.1.3012-12 (2012):
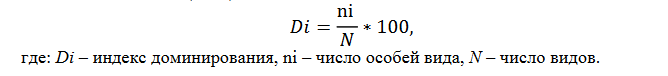
Собранный материал снабжался этикеткой, в которой указывались: вид материала, адрес сбора, биотоп (стацию), дату отлова, общее количество отловленных животных, в том числе по видам, после чего материал помещали в контейнер для транспортировки в лабораторию, где специалисты проводили детальный анализ по выявлению на инфицированность позвоночных животных с установлением их спектра. Все полученные результаты обрабатывались стандартными методами математической статистики (Шмойлова, 2002).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
За весь период нашего обследования территории полуострова (2015–2020 годов) было отработано 19671 ловушко/суток, отловлено 2231 экземпляров мелких млекопитающих в различных стациях в трех ландшафтно-климатических зонах Крыма – горной, предгорной и степной. Наиболее часто встречающиеся в отловах виды представлены в таблице 1.
Таблица 1
Виды мелких млекопитающих, встречавшихся наиболее часто в отловах (2015–2020 годов) по территории полуострова
| Отряд | Вид | Русское название |
| Rodentia | Sylvaemus witherbyi, Thomas, 1902 | Степная мышь |
| Sylvaemus flavicollis (tauricus), Melchior, 1834 | Желтогорлая мышь | |
| Sylvaemus uralensis, Pallas, 1811 | Малая лесная мышь | |
| Mus musculus, Linnaeus, 1758 | Домовая мышь | |
| Mus spicilegus, Petenyi, 1882 | Курганчиковая мышь | |
| Microtus socialis, Pallas, 1773 | Общественная полевка | |
| Microtus arvalis (obscurus), Pallas, 1778 | Алтайская полевка | |
| Cricetus cricetus, Linnaeus, 1758 | Хомяк обыкновенный | |
| Cricetulus migratorius, Pallas, 1773 | Серый хомячок | |
| Rattus norvegicus, Berkenhout, 1769 | Серая крыса | |
| Sicista lorigera, Nathusius, 1840 | Южная мышовка | |
| Insectivora | Crocidura suaveolens, Pallas, 1811 | Малая белозубка |
| Crocidura leucodon, Hermann, 1780 | Белобрюхая белозубка |
Горная зона занимает приблизительно 10 % территории полуострова. Здесь было выставлено 2005 ловушек и отловлено 175 экземпляров мелких млекопитающих (средняя численность 8,7 экз. на 100 ловушко/суток) (табл. 2). Доминирующими видами мелких млекопитающих в этой природной зоне является степная мышь (S. witherbyi ) – ИД 41,8 %, обыкновенная полевка (M. arvalis (obscurus)) – ИД 30,8 %, желтогорлая мышь (S. flavicollis (tauricus)) – ИД 21,7 %. Фаунистический спектр наиболее узкий по сравнению с остальными ландшафтно-климатическими зонами. Встречаемость в отловах M. musculus и S. uralensis минимальна.
Таблица 2
Результаты отлова мелких млекопитающих в горной зоне Крыма с 2015 по 2020 год
| Вид | Количество экземпляров | Индекс доминирования,
% |
Количество на 100 ловушек/
суток |
| Microtus arvalis (obscurus) | 54 | 30,8 | 3,0 |
| Sylvaemus flavicollis (tauricus) | 38 | 21,7 | 2,1 |
| Sylvaemus witherbyi | 73 | 41,8 | 4,1 |
| Mus musculus | 9 | 5,1 | 0,5 |
| Sylvaemus uralensis | 1 | 0,6 | 0,05 |
В предгорной зоне, занимающей приблизительно 20 % территории полуострова, накоплено 4799 ловушко/суток и отловлено 533 экземпляра мелких млекопитающих (средняя численность 11,1 экз. на 100 ловушко/суток). Результаты отлова мелких млекопитающих в предгорной зоне Крыма за период с 2015 по 2020 годы представлены в таблице 3.
Таблица 3
Результаты отлова мелких млекопитающих в предгорной зоне Крыма с 2015 по 2020 год
| Вид | Количество экземпляров | Индекс доминирования, % | Количество на 100 ловушек/
суток |
| Microtus socialis | 193 | 36,2 | 4,1 |
| Mus spicilegus | 11 | 2,0 | 0,2 |
| Sylvaemus flavicollis
(tauricus) |
13 | 2,4 | 0,3 |
| Sylvaemus witherbyi | 190 | 35,6 | 4,0 |
| Cricetulus migratorius | 4 | 0,75 | 0,1 |
| Crocidura suaveolens | 22 | 4,1 | 0,5 |
| Microtus arvalis (obscurus) | 40 | 7,5 | 0,9 |
| Mus musculus | 42 | 7,8 | 0,9 |
| Sylvaemus uralensis | 14 | 2,6 | 0,3 |
| Rattus norvegicus | 4 | 0,7 | 0,1 |
Доминирующими видами мелких млекопитающих предгорной зоны является общественная полевка (M. socialis) – ИД 36,2 % и степная мышь (S. witherbyi ) ИД 35,6 % (190– 193 экз.). Ко второй группе по численности особей, которые встречались в ловушках, можно отнести: обыкновенную полевку (M. arvalis (obscurus), домовую мышь (M. musculus), малую белозубку (C. suaveolens) – 22–42 экз. Самая низкая встречаемость в отловах серого хомячка (C. migratorius ) и cерой крысы (R. norvegicus).
Наиболее широкий спектр видов выявлен за годы исследований в степной части полуострова, который занимает 70% территории Крыма (таблица 4). За весь период исследования накоплено 12867 ловушко/суток и отловлено 1523 экземпляров мелких млекопитающих (здесь самая высокая средняя численность – 11,8 экземпляра на 100 ловушко/суток).
Таблица 4
Результаты отлова мелких млекопитающих в степной зоне Крыма с 2015 по 2020 год
| Вид | Количество экземпляров | Индекс доминирования, % | Количество
на 100 ловушек/ суток |
| Cricetulus migratorius | 9 | 0,6 | 0,06 |
| Cricetus cricetus | 4 | 0,2 | 0,03 |
| Crocidura leucodon | 10 | 0,7 | 0,07 |
| Crocidura suaveolens | 258 | 17,2 | 2,0 |
| Microtus arvalis (obscurus) | 21 | 1,4 | 0,16 |
| Microtus socialis | 314 | 19,1 | 2,2 |
| Mus musculus | 349 | 23,3 | 2,7 |
| Mus spicilegus | 44 | 2,9 | 0,3 |
| Rattus norvegicus | 17 | 1,1 | 0,1 |
| Sicista loriger a | 3 | 0,2 | 0,02 |
| Sylvaemus witherbiy | 489 | 32,6 | 3,8 |
| Sylvaemus flavicollis
(tauricus) |
2 | 0,1 | 0,01 |
| Microtus levis
(rossiaemeridionalis ) |
3 | 0,2 | 0,02 |
Доминирующими видами на этой территории Крымского полуострова являются степная мышь (S. witherbyi ) – ИД 32,6 %, домовая мышь (M. musculus) – ИД 23,3 %, общественная полевка (M. socialis) – ИД 19,1 %, малая белозубка (C. suaveolens) – ИД 17,2 %. В отловах встретились в сумме за 5 лет особи данных видов от 489 до 258 экземпляров. К видам со средней численностью особей в отловах можно отнести курганчиковую мышь (Mus spicilegus) и обыкновенную полевку (Microtus arvalis (obscurus)) – 17–21 экземпляров. Наиболее редко (не по причине редкости видов как таковых (за исключением южной мышовки – действительно редкого вида), а в связи с неравномерным распределением точек отлова по разным зонам полуострова) встречались виды: желтогорлая мышь (S. flavicollis (tauricus), восточноевропейская полевка (M. rossiaemeridionalis (levis)), южная (степная) мышовка (S. lorigera ), обыкновенный хомяк (C. cricetus) – 2–4 экземпляра.
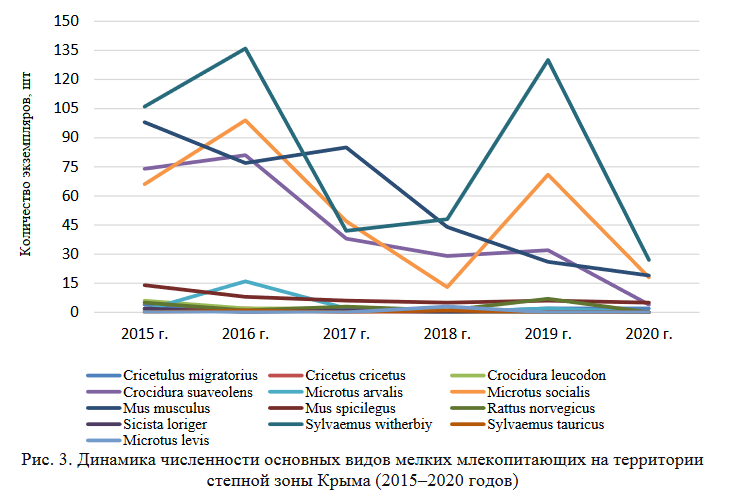
Представляет интерес более детально рассмотреть динамику численности популяций видов отрядов Грызунов и Насекомоядных по годам исследований в этих трех климатических зонах (рис. 1–3).
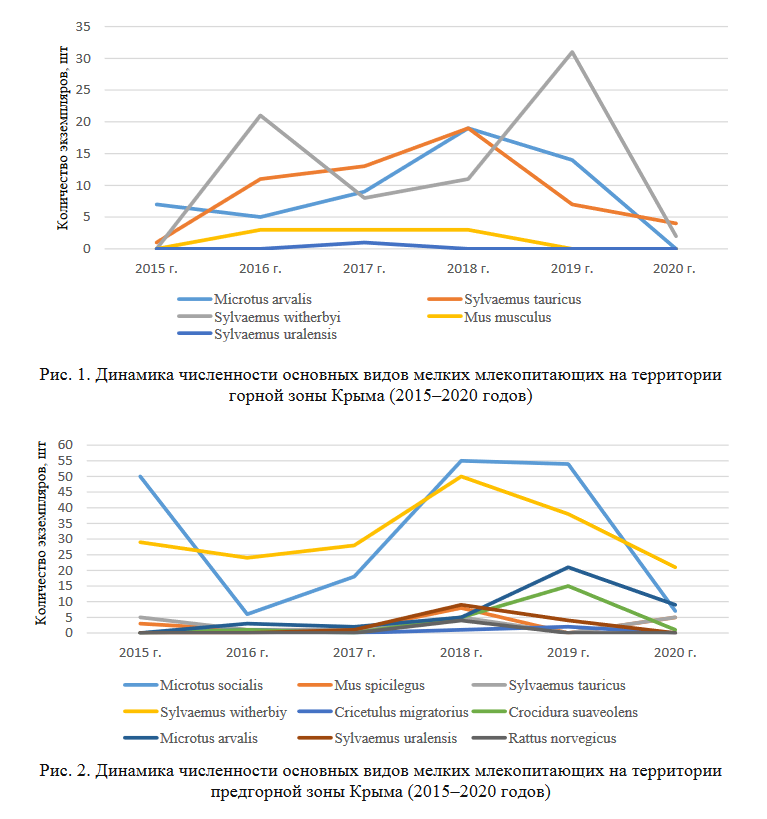
Четко выявляется два максимума по численности экземпляров в отловах на территории горной зоны в 2016 и 2019 годах для степной мыши (S. witherbyi ). Наиболее значимое число особей из популяций желтогорлой мыши (S. flavicollis (tauricus)) и малой лесной мыши (S uralensis) отмечены в 2018 году, для остальных видов эти колебания по годам исследования не существенны.
Проводя динамическое сравнение численности мелких млекопитающих в предгорной зоне (рис. 2) можно отметить, что на данной территории Крымского полуострова наибольшие колебания численности имеют общественная полевка (M. socialis), для которой 2015, 2018, 2019 годы оказались самыми благоприятными для роста популяций данного вида. В 2016 году было отмечено резкое снижение этого показателя. Для степной мыши (S. witherbyi ) пиком численности являются 2018–2019 годы. Остальные виды показывают примерно равномерные колебания численности без резких подъемов и спадов, за исключением 2019 года, когда заметно возрастание популяции малой белозубки (C. suaveolens) и обыкновенной полевки (М. arvalis (obscurus).
Численность основных видов мелких млекопитающих в степной зоне не постоянна и имеет ярко выраженные пики подъема и депрессии численности (рисунок 3). У общественной полевки (M. socialis) пик вылова приходился на 2016 и 2019 годы, а депрессия для данного вида отмечена в 2018 году.
Для малой белозубки (C. suaveolens) пик численности приходился на 2016 год, начиная с середины 2017 года шло снижение отлова особой данного вида. Для степной мыши (S. witherbyi ) пик численности приходился на 2016 и 2019 годы. Снижение этого показателя наблюдалось в период 2017–2018 годы. Для домовой мыши (M. musculus) 2016–2017 годы являлись самыми благоприятными, их численность оставалась стабильной. Начиная с 2018 года, численность особей в отловах этого вида значительно сократилась, остальные виды мелких млекопитающих за весь период исследования данной зоны оставались достаточно стабильные без резких колебаний численности.
К основным причинам исследуемой разногодичной динамики численности ведущих представителей мелких млекопитающих полуострова нужно отнести факторы как природного (в ответ на возникновение благоприятных условий для размножения и увеличения или плотности численности, возможны вспышки эпизоотий, которые приводят к гибели большого числа особей популяции), так и антропогенного характера (изменение кормовой базы и сокращение мест обитания видов мелких млекопитающих вследствие антропогенного преобразования территорий).
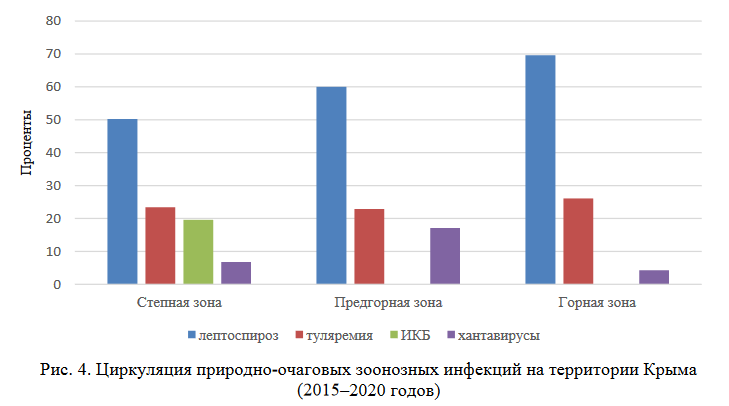
Анализ распределения положительных находок возбудителей природно-очаговых инфекций по природным зонам Крымского полуострова выявил определенные закономерности (рис. 4).
Положительные результаты при исследовании мелких млекопитающих в горной зоне на наличие возбудителей природно-очаговых инфекций выявлены: по туляремии – у обыкновенной полевки (М. arvalis (obscurus) – 9 %, степной мыши (S. witherbyi ) – 1 %; по лептоспирозу — у желтогорлой (S. flavicollis (tauricus)) – 6,4 % и степной мышей (S. witherbyi )
– 4,2 %; по хантавирусам – у степной мыши (S. witherbyi ) – 1 %, носителей иксодовых клещевых боррелиозов по нашим сборам не обнаружено.
Положительные результаты при исследовании мелких млекопитающих предгорной зоны на наличие возбудителей природно-очаговых инфекций выявлены: по туляремии: у общественной полёвки (M. socialis) – 4,5 %, домовой мыши (M. musculus) – 5,1 %; по лептоспирозу – у общественной полевки (M. socialis) – 3,8 %, курганчиковой мыши (M. spicilegus) – 8,3 % и степной мыши (S. witherbyi ) – 9,7 %. Находки на хантавирусы в этой зоне обнаружены у обыкновенной (M. arvalis (obscurus)) – 16,6 % и общественной (M. socialis) полевок – 0,7 %. Возбудители иксодовых клещевых боррелиозов не выявлены.
Исследование мелких млекопитающих, отловленных в степной зоне, выявило циркуляцию возбудителей туляремии у малой белозубки (C. suaveolens), общественной полевки (M. socialis), домовой мыши (M. musculus), южной мышовки (S. loriger a), степной мыши (S. witherbyi ), обыкновенного хомяка (C. cricetus); лептоспироза – у общественной полевки (M. socialis), обыкновенной полевки (М. arvalis (obscurus)), домовой мыши (M. musculus), серой крысы (R. norvegicus), степной мыши (S. witherbyi ), желтогорлой мыши (S. flavicollis (tauricus)) и курганчиковой мыши (M. spicilegus); хантавирусов – у малой белозубки (C. suaveolens), общественной полевки (M. socialis), домовой (M. musculus) и степной (S. witherbyi ) мышей.
Обращает на себя внимание тот факт, что в 2017 году впервые в степной зоне выявлены маркеры возбудителя иксодовых клещевых боррелиозов (ИКБ): у малой белозубки (C. suaveolens), обыкновенной полевки (М. arvalis (obscurus)), общественной полевки (M. socialis), домовой мыши (M. musculus), серой крысы (R. norvegicus) и степной мыши (S. witherbyi ). Ранее эндемичной территорией по ИКБ считалась только горно-предгорная территория.
При обобщении этих результатов, можно отметить, что из всех природно-очаговых зоонозных инфекций лептоспироз регистрировался наиболее часто во всех ландшафтно- климатических зонах с наибольшим количеством выявлений у видов, обитающих в горной зоне (69,6 %).
Положительные находки на туляремию выявляются во всех ландшафтно-климатических зонах практически с одинаковой частотой (22,9–26,1 %).
Основными видами мелких млекопитающих, содержащими возбудитель туляремии по данным проведенных исследований, являются малая белозубка (C. suaveolens), общественная полевка (M. socialis), степная мышь (S. witherbyi ) и домовая мыши (M. musculus), широко распространенные по всей территории Крыма.
Возбудитель хантавирусной инфекции зарегистрирован во всех природных зонах полуострова с преобладанием положительных находок в степной зоне (66,7 %). Основными видами мелких млекопитающих, содержащими возбудитель туляремии по данным проведенных исследований, являются малая белозубка (C. suaveolens), обыкновенная полевка (M. arvalis (obscurus), общественная полевка (M. socialis), степная мышь (S. witherbyi ) и домовая мыши (M. musculus), широко распространенные по всей территории Крыма.
Положительные находки возбудителей иксодовых клещевых боррелиозов (ИКБ) зарегистрированы на территории степной зоны (19,6 % от всех выявленных в этой природной зоне), в горном и предгорном районах полуострова положительные результаты на ИКБ в мелких млекопитающих по нашим данным не отмечены.
ВЫВОДЫ
- В формировании большинства природных очагов зоонозов принимают участие в основном представители фоновых видов мелких млекопитающих: степная (Sylvaemus witherbyi ) и домовая мыши (Mus musculus), общественная полевка (Microtus socialis ), малая белозубка (Crocidura suaveolens).
- Наличие позитивных результатов на лептоспироз и туляремию среди домовых мышей и серых крыс, являющихся синантропами, увеличивается риск заражения людей этими инфекциями на данной территории.
- Происходящие изменения на территории Крымского полуострова природного и антропогенного характера (изменение климата, рост рекреационных нагрузок, расширение числа туристических объектов, активное сельскохозяйственное преобразование территорий) способствуют общей трансформации и расширению природных очагов различных инфекций, что существенно повышает риски осложнения эпидемической ситуации и возникновения вспышек зоонозных инфекций.
- Необходимо проведение постоянного комплексного мониторинга численности в популяциях мелких млекопитающих в разных природных зонах с учетом их зоонозности для разработки мероприятий по предупреждению возникновения эпидемических осложнений с учетом ежегодного роста посещаемости рекреантов полуострова.
Список литературы
Алексеев А. Ф., Чирний Н. Н., Товпинец В. И. Распространение и численность грызунов Крыма // Всесоюзное совещание по проблеме кадастра и учета животного мира: тезисы докладов. – Уфа, 1989. – С. 175–179.
Алымкулова А. А., Мека-Меченко Т. В., Бурделов Л. А., Некрасова Л. Е., Мека-Меченко В. Г., Беляк Л. Г. Зараженность зоонозными инфекциями грызунов Кыргызстана // Научная жизнь. – 2019. – Т. 14, № 3 (91). – С. 391– 398.
Бондаренко Н. В., Поляков И. Я., Стрелков А. А. Вредные нематоды, клещи, грызуны: учебное пособие. – Л.: Колос, 1977. – 264 с.
Бондаренко А. Л., Утенкова Е. О. Природно-очаговые инфекции. – Киров: ГОУ ВПО Киров ГМА Росздрава, 2009. – 268 с.
Громов И. М., Ербаева М. А. Млекопитающие России и сопредельных территорий. Зайцеобразные и грызуны // Труды Зоологического института РАН. – 1995. – Вып. 167. – 521 с.
Дулицкий А. И. Млекопитающие Крыма. – Симферополь: Крымское уч.-пед. гос. изд-во, 2001. – 224 с. Зайцев М. В., Войта Л. Л, Шефтель Б. И. Млекопитающие фауны России и сопредельных территорий.
Насекомоядные. – СПб, 2014. – 391 с.
Карасева Е. В., Телицына А. Ю., Жигальский О. А. Методы изучения грызунов в полевых условиях. – М.: ЛКИ, 2008. – 416 с.
Костин Ю. В., Дулицкий А. И, Костин С. Ю. Эколого-географическая характеристика зонально- биотопических выделов и состав их фауны // Вопросы развития Крыма: Науч.-практ. дискуссионно-аналитический сб. Вып. 11. Биологическое и ландшафтное разнообразие Крыма: проблемы и перспективы. – Симферополь: Сонат, 1999. – С. 35–54.
Красавцев Е. А., Мицура В. М., Демчило А. П., Мамчич Л. П. Зоонозные инфекции и паразитарные болезни: учебное пособие. – Гомель: Гомельский гос. мед. ун-т, 2013. – 224 с.
Кучерук В. В., Карасева Е. В. Cинантропия грызунов и ограничение их численности. – М., 1992. – С. 4–36. Кучерук В. В. Избранные труды по природной очаговости болезней. – Москва: РУСАКИ, 2006. – 306 с.
Леман А. М. Особенности проявления природно-очаговых зоонозных инфекций // Наше сельское хозяйство. – 2020. – № 18 (242). – С. 64–69.
Лисовский А. А., Штефель Б. И., Савельев А. П., Ермаков О. А., Козлов Ю. А., Смирнов Д. Г., Стахеев В. В., Глазов Д. М. Млекопитающие России: список видов и прикладные аспекты // Сборник трудов Зоологического музея МГУ. – М.: Товарищество научных изданий КМК, 2019. – Т. 56. – 191 с.
Маркешин С. Я. Изучение очагов клещевого энцефалита, геморрагической лихорадки с почечным синдромом и Крымской-Конго геморрагической лихорадки в Крыму. – М., 1994. – 160 с.
Методические рекомендации «Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекционных болезней. МР 3.1. 0211-20». – М., 2020. – 45 с. [Электронный ресурс]: режим доступа: https://medilis.ru/file (просмотрено 23.02.2022).
Методическими указаниями «Сбор, учет и подготовка к лабораторному исследованию кровососущих членистоногих в природных очагах опасных инфекционных болезней. МУ 3.1.3012-12». – М., 2012. [Электронный ресурс]: режим доступа: https://docs.cntd.ru/document/1200095231 (просмотрено 23.02.2022).
Нестеренко В. П. Закономерности формирования климатических изменений и их прогноз на территории Крыма // Научные ведомости: Естественные науки. – 2016. – Вып. 36, № 18. – С. 2–39.
Санитарно-эпидемиологические правила «Санитарно-эпидемиологические требования по профилактике инфекционных болезней СанПин 3.3686-21». – М., 2021. – 109 с.
Тарасов М. А. Эколого-эпизоотологический мониторинг в очагах опасных зоонозных инфекционных болезней. – Саратов: СГУ, 2016. – 356 с.
Товпинец Н. Н., Овдиенко Н. С., Быкова Т. И. Особенности природной очаговости некоторых зоонозных инфекций в Крыму в условиях антропогенных ландшафтов // Матер. Всесоюз. конф. «Эпизоотология, эпидемиология, средства диагностики, терапии и специфической профилактики инфекционных болезней, общих для человека и животных». – Львов, 1988. – С. 47–48.
Шефтель Б. И. Методы учета численности мелких млекопитающих // Russian journal of ecosystem ecology. – 2018. – Vol. 3 (3). – Р. 1– 21. DOI: 10.21685/2500-0578-2018-3-4
Шмойлова Р. А. Общая теория статистики: учебное пособие. – М.: Финансы и статистика, 2002. – 480 c.
Adler H., Vonstein S., Deplazes P., Stieger C., Frei R. Prevalence of Leptospira spp. in various species of small mammals caught in an inner-city area// Switzerland. Epidemiology and Infection. – 2002. – Vol. 128 (1). – P. 107–109. https://doi:10.1017/s0950268801006380.
Schmaljohn C., Hjelle B. Hantaviruses: a global disease problem. // Emerging Infectious Diseases – 1997. – N 3. – P. 95– 104. DOI:10.3201/eid0302.970202.
Foley J., Piovia-Scott J. Vector biodiversity did not associate with tick -borne pathogen prevalence in small mammal communities in northern and central California // Ticks Tick Borne Dis. – 2014. – N 5. – P.299–304. DOI.org/10.1016/j.ttbdis.2013.12.003.
Ellis J., Oyston P. C., Green M., Titball R. W. Tularemia // Clinical Microbiology Reviews – 2002. – Vol. 15. – P. 631– 646. DOI.org/10.1128/CMR.15.4.631-646.2002
Combs M. A. Socio-ecological drivers of multiple zoonotic hazards in highly urbanized cities // Global Change Biology. – 2022. – Vol. 28, N 5. – P. 1705–1724.
Vladichak V. V., Kobechinskaya V. G., Kovalenko I. S., Abibulaev D. E., Yakunin S. N., Tikhonov S. N. The results of ecological and topological monitoring of small mammals of the Crimea, taking into account their natural focal zoonosity // Ekosistemy. 2022. Iss. 29. P. 70–79.
The results of the analysis of the long -term dynamics of small mammals distribution in the Crimea are presented. The dominant species in various landscape zones of the peninsula were identified. The role of certain species of small mammals in the functioning of natural foci of various types of infections, which circulate on the territory of the Crimea, was indicated. Leptospirosis was recorded the most often of all natural -focal zoonotic infections in all natural zones with the largest number of detections in species living in the mountain zone (69.6 %). Tularemia was registe red in all natural zones with almost the same frequency (22.9–26.1 %). The research revealed that the main carriers containing the causative agent of tularemia are Crocidura suaveolens , Microtus socialis , Sylvaemus witherbyi and Mus musculus. The causative agent of hantavirus infection was registered with the highest frequency in the steppe zone (66.7 %). Positive results of pathogens of tick-borne borreliosis were recorded in the steppe zone (19.6 %). In the mountainous and foothill zones of the peninsula, these diseases were not identified in small mammals.
Key words: small mammals, zoonosis, natural focal infections, monitoring, background species, Crimea .
Поступила в редакцию 04.03.22 Принята к печати 14.03.22

