Экосистемы, 33: 97–113 (2023) https://ekosystems.cfuv.ru
![]()
УДК 595.792:595.798
Русина Л. Ю.1, Русин А. И.1, Лукашук Е. В.1, Егунова О. Е.2
- Московский зоопарк Москва, Россия
- Хопёрский государственный заповедник
Воронежская область, Россия
lirusina@yandex.ru; alena.egunova@bk.ru
На территории Хоперского государственного заповедника и в его окрестностях в 2021–2022 годах была оценена роль беспозвоночных (Latibulus argiolus, муравьев и шершня Vespa crabro) и позвоночных энтомофагов как факторов смертности расплода и семей социальной осы Polistes nimpha. Встречаемость паразитоида L. argiolus
- гнездах хозяина в разные годы оказалась сходной и составила 19–20 %. По данным наблюдений паразитоиды подолгу ожидали неподалеку от гнезда P. nimpha прекращения активности ос и проявления ими защитного поведения. Успешное заражение семей P. nimpha происходило ранним утром. Возле одного гнезда могло находиться 1–3 самки паразитоида; они его заражали по очереди или одновременно. Cамки L. argiolus 1-й и 2-й генераций проявляли поведенческую реакцию, распределяясь на участках в зависимости от размеров гнезд семей осы-хозяина. Фактор плотности популяции хозяина оказывается опосредованным не только неравномерностью темпов развития семей и их пространственным размещением, но и временным (сезонным) аспектом их развития. Низкая плотность популяции хозяина, при которой паразитоид регулирует численность осы соответствует фазе до выхода рабочих. В 2022 году была отмечена отрицательная корреляция между продуктивностью семей P. nimpha и их зараженностью L. аrgiolus. Модификация численности популяции осы-хозяина паразитоидом L. argiolus происходила из-за изменения сроков начала гнездования хозяина, вызванного спецификой погодных условий в период основания семей в 2022 году, и численной реакции, которая прослеживалась в местах с высокой плотностью семей хозяина, где складывались благоприятные условия для выживания 1-й и 2-й генераций паразитоида. Одним из факторов стабильного сосуществования популяций паразитоида и хозяина могут быть годовые флуктуации в синхронизации их жизненных циклов.
Ключевые слова: социальные осы-полисты, Hymenoptera, Ichneumonidae, Vespidae, Polistes nimpha, Latibulus argiolus, хищники, паразитоиды, функциональная и численная реакция, Хоперский природный заповедник.
ВВЕДЕНИЕ
Изучение стимулов, оказывающих влияние на поведение паразитоидов при поиске, заражении хозяина и проявления ими функциональной и/или численной реакций, представляет как теоретический, так и практический интерес (Викторов, 1976; Хорхордин, 1977; Hassell, 1966, 2000; Hassell, May, 1974; Hassell, Waage, 1984; Ruberson et al., 1991; Comins et al., 1992; May, McLean, 2007). Функциональная реакция паразитоида на рост плотности хозяина выражается в увеличении количества хозяев, зараженных отдельной особью паразитоида (Solomon, 1949). Если хозяин – социальное насекомое, эта реакция может включать как увеличение числа зараженного расплода в гнезде, так и увеличение числа зараженных семей. Функциональная реакция создает предпосылки для внутри- и межгенерационной численных реакций (Hassell, 1966). Первая форма численной реакции проявляется в скоплении паразитоидов в местах скученности гнезд хозяев, а вторая ее форма
- последующих поколениях приводит к увеличению количества паразитоидов вслед за ростом плотности популяции его жертв. Проявление этих реакций у паразитоидов социальных ос Polistes имеет специфику, связанную, с одной стороны, с увеличением числа пригодных для заражения личинок в сезоне и с разными формами защитного поведения хозяина, а с другой
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
![]()
– наличием дискриминационной способности, то есть различению семей, зараженных другим видом паразитоида или паразита (Русина, 2008, 2009, 2011а, 2011б; Русина и др., 2015;
Strassmann, 1981; Lutz et al., 1984; Makino, 1989; Luchetti, 1992; Makino, Sayama, 1994).
При анализе реакций паразитоида на распределение таких хозяев в природе возникает необходимость в оценке структуры поселения социальной осы (типы гнезд и семей), анализе пространственного распределения трофических пятен (для энтомофагов) и в выяснении механизмов формирования того или иного типа распределения, в составлении таблиц выживания, а также в описании специфики защитного поведения (Русина, 2006, 2009;
Strassmann, 1981; Chadab, Rettenmeyer, 1982; Makino, 1983; Makino, Sayama, 1994; Bouwma et al., 2003). В то же время сведений о пространственно-временных аспектах взаимодействия популяций ос и паразитоидов, их динамических характеристиках в разные годы или в разных частях ареала вида-хозяина недостаточно.
Целью нашего исследования стало изучение поведенческой реакции паразитоида
Latibulus argiolus (Rossi, 1790) (Hymenoptera, Ichneumonidae) на биотопические особенности гнездования (плотность и размеры семей на участке обитания) Polistes nimpha (Christ, 1791) (Hymenoptera, Vespidae) в Хоперском государственном природном заповеднике, а также определение условий регуляции им численности хозяина.
МАТЕРИАЛЫ И МЕТОДЫ
Поведенческие реакции паразитоида L. argiolus 1-й и 2-й генераций в условиях свободного выбора семей хозяина P. nimpha при естественном распределении их гнезд были проанализированы нами по данным, собранным преимущественно в левобережной части Хоперского государственного природного заповедника и его окрестностей в июне – августе 2021 и 2022 годов: (окрестности поселка Варварино (48°8´с. ш., 39°49´ в. д.), охранной зоне смотровой площадки «Крымская» (51006’34.74” 41037’19.14”), на поляне возле озера Майорское (51014’56.62” 41046’25.28”).
Территория Хоперского заповедника лежит в юго-восточной части Окско-Донской низменности, в Вороно-Хоперском геоморфологическом районе, занимая отрезок долины реки Хопер протяженностью 35 км. Погодно-климатические особенности района исследования имеют свои особенности и несколько отличаются от климата, типичного для Центрально-Черноземного региона, большей континентальностью, меньшим количеством осадков и периодически (примерно раз в три года) повторяющимися засухами, а также большой частотой весенних заморозков (Бирюков, 2010). По характеру растительности территория принадлежит к Среднерусской (Верхнедонской) подпровинции Восточно-Европейской лесостепной провинции. На территории заповедника преобладают, в основном, леса: на высоком правобережье Хопра и в его пойме – естественные лиственные леса, а на надпойменной террасе – сосновые посадки различного возраста на месте бывшей здесь прежде песчаной степи. Степные растительные группировки были широко распространены до распашки степей в долине Хопра и посадки сосновых насаждений. Сейчас сохранились только небольшие участки, в которых преобладают ковыльно-типчаково-разнотравная, среднепырейная и горичниково-полынная ассоциации (Цвелев, 1988).
Для P. nimpha характерен годичный цикл развития. Перезимовавшие осемененные самки-основательницы весной закладывают первичные гнезда и выращивают первое поколение рабочих особей (рис. 1 a). В случае разрушения первичного гнезда осы строят другое (вторичное) (рис. 1b). Семьи, развиваясь, переходят от выращивания рабочих к продукции половых особей (самцов и будущих основательниц). Распад семей и спаривание происходит в конце лета и осенью. Зимуют будущие основательницы, а самцы и рабочие осенью погибают. Описание гнезд и семей проводили в 2021 году в окрестностях пос. Варварино (25–30 июня, 4–12 июля, 7–10 августа), а в 2022 году в окрестностях пос. Варварино (2–4 июля и 25 июля – 6 августа), на территории поляны возле озера Майорское (28 июля) и в охранной зоне площадки «Крымская» (30 июля).
98
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике

Рис. 1. Семья Polistes nimpha на первичном (a) и вторичном (b) гнездах после выхода рабочих (фото А. И. Русина)
При обнаружении каждого из 264 гнезд были отмечены вид субстратного растения и высота над землей прикрепления основного стебелька к нему. Анализ типа пространственного распределения гнезд и семей P. nimpha включал подсчет коэффициента скученности m (mean crouding, Lloid, 1967) и агрегации R (index of spacing, Clark, Evans, 1954). Коэффициент агрегации рассчитывали по формуле R = rA/rE, где rA – эмпирическое среднее
99
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
![]()
значение ближайших расстояний от одного гнезда к другому (в см); rE — теоретическое среднее значение, высчитывается как 1/2√q; при этом q – плотность гнездования, то есть наблюдаемое общее число гнезд, деленное на общую площадь. Таким образом, R = 2 rA√q. При этом исходили из того, что коэффициент агрегации R равный единице служит свидетельством случайного распределения гнезд; его значения близкие к нулю отражают тенденции к агрегированному распределению, а значения близкие к 2,5 свидетельствуют о равномерном характере распределения (Clark, Evans, 1954). Скученность оценивали как число гнезд, приходящихся на одно гнездо на площадке 10×0 и 15×15 м (Lloid, 1967).
Демографический анализ семьи и ее зараженность паразитами и паразитоидами. При описании структуры поселения регистрировали состав каждой семьи (присутствие самки-основательницы и имаго обоих полов) и подсчитывали количество яиц, личинок I–V возрастов и куколок, а также число ячей гнезда в целом (Русина, 2006). Учитывали следы пребывания паразитоидов, личинки которых съедают куколку хозяина. Определяли, в какой период развития семьи и какой генерацией Latibulus argiolus происходило заражение расплода: (1) – 1-я отродившаяся из перезимовавших коконов генерация паразитоида заражает семью до или после выхода рабочих; съеденными оказываются куколки хозяина, из которых должны были развиться первые или более поздние рабочие; (2) – 2-я генерация заражает семью на стадии поздних рабочих и выращивания полового поколения и 3) – смещанное заражение – в гнезде обнаружены следы заражения расплода хозяина первой (овально-скошенные остатки летних коконов желто-оранжевого цвета) и второй (зимний кокон) генерациями (рис. 2). Отмечали, где в гнезде располагаются ячейки со следами пребывания паразитоида (в центре гнезда над основным стебельком или на периферии). Проводили внимательный осмотр и поиски в ячейках гнезд крышечек темно-серого цвета, которые формируют перед окукливанием личинки грегарного паразитоида Elasmus schmitti Ruschka, 1920 (Hymenoptera, Eulophidae) из мекониев (Gumovsky et al., 2007). Отлавливаемые возле гнезд имаго обоих полов, а также личинки старших возрастов и куколки из гнезд в 2021 году, были осмотрены на наличие гетероморфных дейтонимф клеща Sphexicozela connivens Mahunka, 1970 (Acari, Astigmata, Winterschmidtiidae) и осиного веерокрыла Xenos vesparum Rossi (Strepsiptera, Stylopidae). Определяли экстенсивность клещевой инвазии (доля зараженных особей в выборке) и интенсивность инвазии (число клещей на зараженных личинках, куколках, самках и самцах, в среднем).
Статистические методы. Статистический анализ данных проводили с использованием программы Statistica v. 8.0 (StatSoft, Inc., 1984–2001). При интерпретации статистических результатов руководствовались пособием С. Гланца (1999). Анализ, проведенный по критерию Шапиро-Уилка, показал, что рассматриваемые выборки полученных данных не подчиняются нормальному распределению, поэтому были использованы непараметрические методы статистики. В тексте, таблицах и рисунках описание такого распределения данных представляли в виде Me [25; 75] [min; max] – медианы, 1-й и 3-й квартилей, минимального и максимального значений.
Сравнение частот вариантов гнезд и семей (1 – первичных и вторичных, 2 – зараженных
- не зараженных паразитоидом L. argiolus) проводили с помощью критерия χ2 в разных типах гнездования (одиночное и в скоплениях), а также в разные периоды сезонного развития и/или в разные годы. Связь зараженности семей паразитоидами (определенной по числу и доле ячей с зараженным расплодом от общего числа ячей в гнезде, в %) с размерами семей (учитывали число ячей гнезда, число личинок IV и V возраста, число куколок и число рабочих) оценивали с помощью теста ранговой корреляции Тау Кендалла (Strassmann, 1981). Если хотя бы один из параметров размеров семей давал достоверную корреляцию с показателями зараженности, делали вывод о наличии корреляции между размерами семьи, с одной стороны, и числом, а также долей зараженных ячей, с другой. Связь числа и доли зараженного расплода семей (число ячей с паразитоидами от общего числа ячей в гнезде, в %) с их пространственными параметрами (расстоянием к ближайшему соседу и скученностью) оценивали с помощью теста корреляции Спирмена.
100
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике
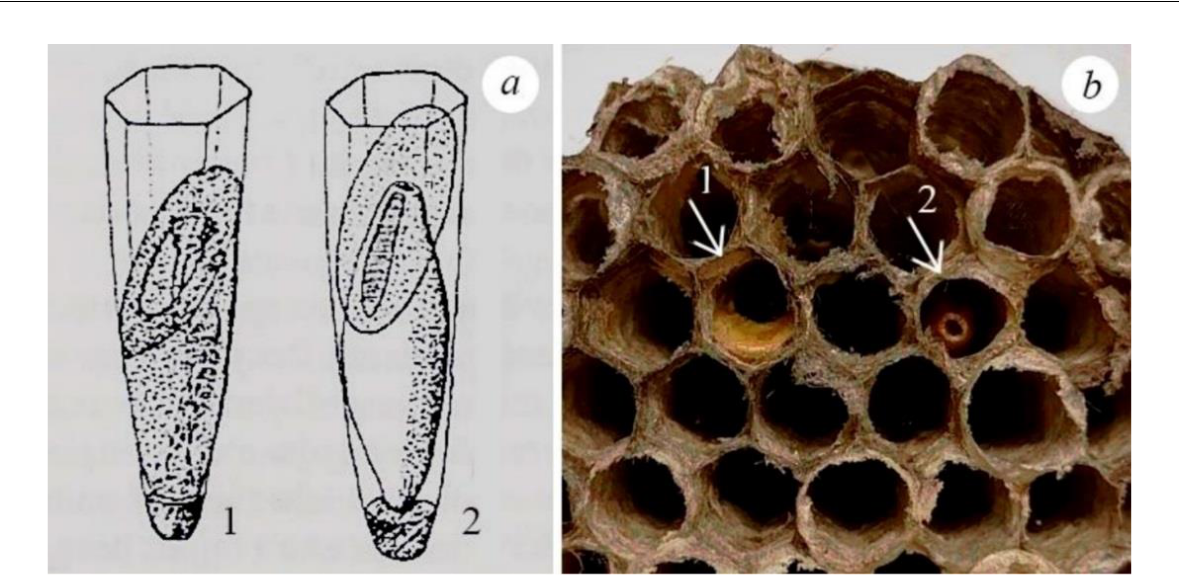
Рис. 2. Ячейки гнезда осы-хозяина Polistes sp.: со следами заражения расплода 1-й (1) и 2-й
-
- генерацией паразитоида Latibulus sp. (фото А. Ю. Косяковой)
- – по Makino, 1983; b – гнезда Polistes nimpha со смешанным заражением семьи Latibulus argiolus 1-й и 2-й генерации.
При сравнении двух независимых выборок (по высоте прикрепления гнезда к растению, расстоянию к соседнему гнезду или по интенсивности заражения семьи 1-й генерацией L. argiolus в разные годы) использовали непараметрический критерий Манна-Уитни. По критерию Крускала–Уоллиса и Данна проводили множественное сравнение выборок семей в 2021 году: (1) – зараженных 1-й генерацией паразитоида L. argiolus; (2) – зараженных его 2-й генерацией и (3) – незараженных; а в 2022 году: (1) зараженных 1-й генерацией паразитоида L. argiolus до выхода рабочих; (2) – зараженных 1-й генерацией после выхода рабочих и (3) – незараженных семей.
Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
РЕЗУЛЬТАТЫ
Особенности гнездования Polistes nimpha в Хоперском природном заповеднике
Все найденные нами 219 гнезд P. nimpha размещались на стеблях травянистых и кустарниковых растений (табл. 1). В большинстве случаев в качестве субстрата для прикрепления гнезда осы P. nimpha использовали подмаренник настоящий (Galium verum L.), полынь Маршалла (Artemisia marschalliana Spreng) и полынь австрийскую (A. аstriaca Jacq.), дербе́нник иволи́стный (Lythrum salicaria L.) и другие. Гнезда крепились к растению, как правило, единственным стебельком, а если несколькими (до 3), то первичный был утолщен и прочен. Форма гнезд P. nimpha округлая с центральным положением первичного стебелька или же с первичным стебельком, смещенным к его верхнему краю. Более холодной весной 2022 года первичные стебельки гнезд P. nimpha были прикреплены к прошлогодним побегам
- verum и A. marschalliana в среднем ниже, чем в 2021 году (табл. 2).
Эта же тенденция сохраняется при сравнении в разные годы высоты прикрепления гнезд
- травянистым растениям, взятых в общей совокупности: 2021 год – 14 [10; 21] [6; 74] см и 2022 год – 6 [4,5; 10] [4; 80] см, тест Манна–Уитни U = 647,0; p < 0,001. Пространственная организация поселений P. nimpha на территории заповедника и его окрестностях отличалась некоторой упорядоченностью. Размещение гнезд ос в пределах участков обитания было
101
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
![]()
Таблица 1
Видовой состав растений, используемых для гнездования осой Polistes nimpha на
территории Хоперского заповедника и его окрестностях
| Вид растений | Встречаемость, % | |||||||
| 1 | 2 | 3 | 4 | |||||
| Сем. Apiaceae | Eryngium campestre | 2,4 | ||||||
| Сем. Asteraceae | Artemisia austriaca Jacq. | 8 | 2,8 | |||||
| A. marschalliana Spreng | 20,6 | 21,25 | 69,4 | |||||
| Achillea millefolium L. | 2,8 | |||||||
| Cirsium incanum (S.G. Gmel.) Fisch | 1,6 | |||||||
| Hieracium umbellatum L. | 3,2 | |||||||
| Tanacetum vulgare L. | 1,6 | |||||||
| Сем. Brassicaceae | Berteroa incana (L.) DC | 1,75 | ||||||
| Сем. Lythraceae | Lythrum salicaria L. | 6,3 | 2,35 | |||||
| Сем. Rosaceae | Pyrus communis L. | 0,6 | ||||||
| Сем. Rubiaceae | Galium verum L. | 42,9 | 57,95 | 71,4 | ||||
| Сем. Poaceae | Bromus inermis Leyss. | 6,3 | 0,6 | |||||
| Elytrigia repens (L.) Desv. ex | 2,8 | |||||||
| Nevski | ||||||||
| Неопределённые виды | 9,5 | 13,1 | 28,6 | 22,2 | ||||
| Число гнезд, в целом | 63 | 106 | 14 | 36 | ||||
Примечание к таблице. 1 – окрестности п. Варварино (2021 г.); 2 – окрестности п. Варварино (2022 г.); 3 – Поляна возле озера Майорское (2022 г.); 4 – охранная зона площадки «Крымская».
оценено в 1-й декаде июля 2021–2022 годов как агрегированное (значения коэффициента агрегации Кларка и Эванса R = 0,192 и 0,102 по годам соответственно), а в конце июля и в августе этих лет – как случайное (R = 1,17 и 1,06). Гнезда располагались как в скоплениях, так
- поодиночке. В первой декаде июля 2022 года по сравнению с 2021 годом гнезда из окрестностей пос. Варварино располагались в среднем дальше друг от друга (тест Манна-Уитни U = 142; p = 0,028) (табл. 2). На разных стадиях сезонного развития семей ос, как в 2021, так и в 2022 году обнаружены статистически значимые различия в структуре поселений. Так, в окрестностях пос. Варварино резко уменьшались число и доля первичных семей в конце июля и в августе по сравнению с началом июля (рис. 3), а возрастала доля вторичных, что связано с повышением активности хищников (χ² = 28,4; df = 2; p < 0,001 и χ² = 23,7; df = 2; p < 0,001, по годам соответственно). В 2022 году, по сравнению с 2021 годом, некоторые скопления резко уменьшались по числу гнезд, а другие – увеличивались. В отдельных местообитаниях в 2022 году осы вообще не загнездились, но отмечено появление новых скоплений.
Осиный веерокрыл X. vesparum на осмотренных имаго самок (N = 126) и самцов (N = 82) не отмечен. Однако на осмотренных имаго P. nimpha обнаружены гетероморфные дейтонимфы клеща S. connivens. Доля зараженных клещом имаго, личинок и куколок, взятых в общей совокупности (экстенсивность инвазии), и число их на зараженных особях (интенсивность инвазии) составили в 2021 году 14,8 % (17 из 115) и 1 [1; 2] [1; 5].
При осмотре гнезд как в 2021, так и в 2022 году не были найдены крышечки паразитоида
E. schmitti.
102
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике
![]()
Таблица 2
Специфика гнездования и заражения семей Polistes nimpha паразитоидом Latibulus argiolus
в Хоперском заповеднике
| Тест | ||||
| Параметры | 2021 г. | 2022 г. | Манна- | |
| Уитни | ||||
| Погодно-климатические условия: температура воздуха, °С | ||||
| Температура воздуха | –6,8 | –3,7 | ||
| в среднем за календарную зиму | ||||
| Сумма отрицательных | ||||
| минимальных температур за | –691,6 | –958,1 | ||
| календарную зиму | ||||
| Среднесуточная температура | 12,6 | 9,1 | ||
| 1-й декады мая | ||||
| Среднесуточная температура | 18,1 | 12,0 | ||
| 2-й декады мая | ||||
| Высота прикрепления гнезда к растениям, cм | ||||
| Galium verum | 13,8 [11; 21] [6; 57] | 6 [5; 8] [3; 25] | * | |
| N=18 | N=19 | |||
| Artemisia marschalliana | 19 [11; 25] [8; 39] | 6 [4; 10] [3; 80] | ** | |
| N=11 | N=50 | |||
| Травянистые растения в целом | 14 [10; 21] [6; 74] | 6 [4,5; 10] [4; 80] | *** | |
| N=54 | N=81 | |||
| Распределение гнезд в скоплениях 10×10 м | ||||
| Дистанции между гнездами, см | 111 [77; 184] [30; 416] | 170 [112; 504] [50; 910] | * | |
| N=34 | N=52 | |||
| Число гнезд | 2 [1; 2] [1; 9] | 3,5 [2; 5,5] [1; 8] | NS | |
| N=13 | N=12 | |||
| Расстояние от гнезда с | 83 [35; 145] [30; 145] | 300 [150; 580] [60; 910] | ||
| L. argiolus 2-й генерации к | ** | |||
| N = 7 | N=11 | |||
| ближайшему соседу | ||||
| Число ячей в гнезде с | 5 [2; 7] [1; 10] | 2,5 [1; 3,5] [1; 8] | NS | |
| L. argiolus 2-й генерации | N = 8 | N=19 | ||
Примечание к таблице: * – p<0,05; ** – p<0,01; *** – p<0,001; NS – статистически незначимые различия.
N – размер выборки.
- 12 (19,1 %, из 63) гнездах в 2021 году и в 32 (20,5 %, из 156) в 2022 году обнаружены следы заражения куколок хозяина самками 1-й и 2-й генераций ихневмонида L. аrgiolus (различия между годами по экстенсивности заражения не найдены: χ² = 0,06, df = 2; p > 0,05).
Типы гнезд Polistes nimpha и особенности их заражения паразитоидом Latibulus argiolus в Хоперском природном заповеднике
Первичные гнезда. В конце июня – первой декаде июля 2021 года в окрестностях пос. Варварино были найдены 11 (22,9 %, из 48 первичных) гнезд осы-хозяина, зараженных паразитоидом L. argiolus, из которых 6 были заражены его 1-й генерацией, 3 – 2-й, а 2 гнезда имели как признаки заражения 1-й (остатки оболочки летних коконов), так и 2-й (зимние коконы) генераций. В 1-й декаде июля 2022 года в этом же поселении было обнаружено 21(26,3 %, из 80 первичных) гнездо, зараженное 1-й генерацией L. argiolus. Однако гнезд,
103
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
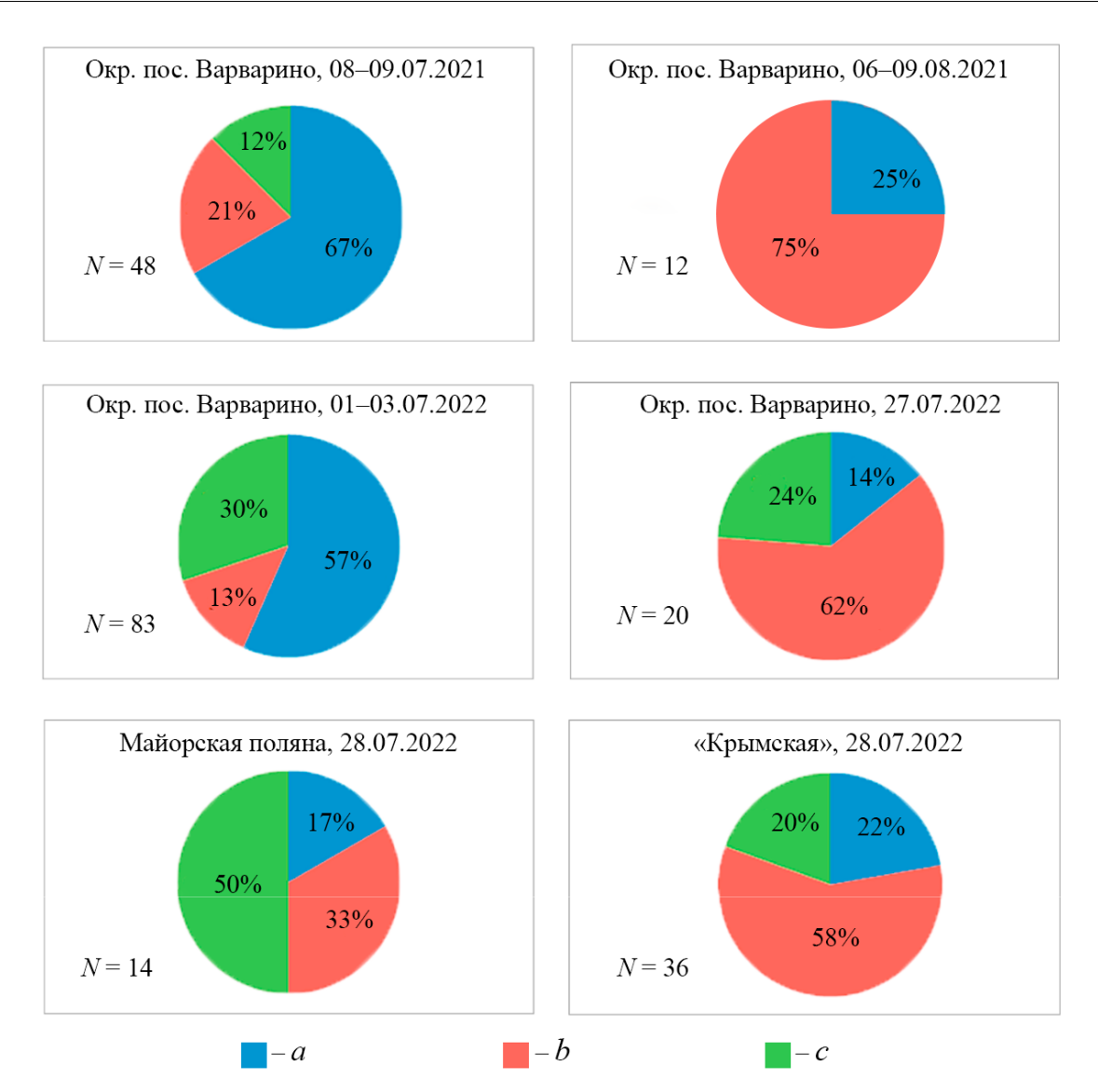
Рис. 3. Категории гнезд и семей Polistes nimpha в локальных поселениях Хоперского заповедника и его окрестностей, описанные на разных этапах сезонного развития в 2021 и 2022 годах
Гнезда: первичное (a), вторичное (b), брошенное (с). N – число гнезд.
зараженных 2-й генерацией, в этом периоде сезонного развития обнаружено не было. По доле первичных семей, зараженных в разные годы различия не найдены: χ² = 0,18, df = 1, р > 0,05. По интенсивности заражения личинок хозяина 1-й генерацией L. argiolus семьи в разные годы также не различались (тест Манна-Уитни U = 69,5; p = 0,09) (табл. 2).
-
- одном гнезде в 2021 году три ячейки со следами паразитоида 2-й генерации располагались над стебельком, а, как известно, именно в них выращивается первая когорта рабочих (Русина, 2006). В значительной части семей (7 из 8) заражение куколок хозяина 1-й генерации паразитоида L. argiolus происходило после выхода рабочих, поскольку ячейки с зараженным расплодом располагались по периферии гнезда. В 2022 году из-за холодной весны гнездование началось позднее (табл. 2), но заражение куколок хозяина 1-й генерации L. argiolus в окрестностях пос. Варварино происходило, по-видимому, в те же сроки. Зараженными оказались семьи, как до выхода рабочих (N = 7), так и после их появления (N = 12). Таких гнезд, зараженных до выхода рабочих, в 1-й декаде июля 2022 года найдено 7. Для
104
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике
![]()
семей, зараженных до выхода рабочих, были характерны гнезда маленьких размеров (29–51 ячей), несмотря на присутствие самки-основательницы. Паразитоиды локализовались в центральных ячеях и поражали личинок, которые должны были дать первую когорту рабочих.
Интересно, что 12.07.21 года в двух гнездах со смешанным заражением рядом с ячейками, в которых находились еще не отродившиеся имаго 2-й генерации наездника, располагались зимние коконы их 1-й генерации следующего года. Отрождение паразитоидов 2-й генерации из двух гнезд наблюдали в лаборатории 24 июля (3 особи), 25 июля и 27 июля (по 1 особи) 2021 года.
На поляне возле озера Майорское 28.07.2022 были найдены 5 гнезд, имевших признаки заражения куколок хозяина L. argiolus (4 из них – со смешанным заражением, а одно – только 1-й генерацией). Гнезд, зараженных 1-й и 2-й генерациями L. argiolus в охранной зоне площадки «Крымская», 30.07.2022 не обнаружили.
- целом, в 2021–2022 годах ячейки со следами пребывания паразитоида были найдены не только в успешных первичных семьях (N = 6 и 20 по годам соответственно), но также среди брошенных (по-видимому, из-за гибели самки-основательницы) (N = 2 и 5) или в гнездах, разоренных хищниками (N = 3 и 4).
Причины гибели семей в некоторых случаях удалось установить, а в других о ней судили по косвенным признакам. Так, 29.06.21 в 10:23 наблюдали, как шершень Vespa crabro Linnaeus, 1758 (Hymenoptera, Vespidae) выедал часть расплода в центре гнезда, оставляя поврежденные ячейки. Это гнездо, насчитывающее 108 ячей, 6 из которых имели следы заражения 1-й генерацией L. argiolus, и 18 мекониев, было покинуто рабочими, а в дальнейшем они основали неподалеку новую семью. В целом обнаружено три брошенных из-за V. crabro гнезда в 2021 и два – в 2022 году (рис. 4 а). Эти гнезда пострадали от хищничества шершня в 2021 году после выхода рабочих, поскольку насчитывали: 43, 65 и 68 ячей (в сотах насчитали 6, 9 и 12 мекониев), а в 2022 году одно гнездо из 23 ячей (0 мекониев) было повреждено до выхода рабочих, а второе 35 ячей (9 мекониев) – после их появления.
Среди основных беспозвоночных хищников у ос-полистов указываются также муравьи (Русина, 2010). В 2021 году в окрестностях пос. Варварино 10 июля наблюдали нападение муравьев Lasius sp. (Hymenoptera, Formicidae) на гнездо, прикрепленное к G. verum. Само гнездо осталось нетронутым, но расплод был полностью разграблен. Интересно, что за день до нападения из этого гнезда выпал в грунт зимний кокон паразитоида. Выпадение коконов, которым предстояло перезимовать, было отмечено еще для трех гнезд хозяина в 2021 году.
Нападение муравьев Myrmica scabrinodis Nylander, 1846, M. lobicornis Nylander, 1846 и
Tetramorium caespitum (Linnaeus, 1758) на три первичные семьи P. nimpha наблюдали также 10, 12 и 13 июля 2022 года. Одно из этих гнезд лежало на поверхности земли, поскольку стебель G. verum был обломлен, другое же, также прикрепленное к G. verum, было заражено 1-й генерацией L. аrgiolus. Нападение муравья T. caespitum на лежащее на земле гнездо, которое насчитывало около 70 ячей, в которых еще имелся расплод, а в одной ячейке был зимний кокон, было отмечено 1.08.2022.
Среди 5 брошенных гнезд в 2022 году со следами заражения семей 1-й генерацией
L. аrgiolus два лежали на земле, а три были прикреплены к растениям G. verum и A. marschaliana. Возможно, что и эти семьи пострадали ранее от нападения муравьев.
Отметим, что в последней декаде июля и первой декаде августа в 2021 и 2022 годах многие первичные гнезда, включая 11 зараженных паразитоидом в 2021 и 19 – в 2022 году, исчезли после нападения птиц и млекопитающих. Только остатки некоторых гнезд были обнаружены неподалеку (рис. 4 b). Подобные воздействия беспозвоночных и позвоночных хищников были описаны и в других популяциях этого и других видов ос-полистов (Русина, 2006, 2010).
Вторичные семьи. Только в одном вторичном гнезде обнаружены 8.08.21 два зимних кокона L. argiolus.
105
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
![]()
Функциональная и численная реакции Latibulus argiolus
При изучении реакций паразитоида на распределение семей хозяина возникает необходимость оценки численности и поведенческой активности, как первого, так и второго.
Так, для проверки предположения о связи зараженности семьи с плотностью гнездования мы проанализировали различия в экстенсивности и интенсивности заражения паразитоидами семей, обнаруженных в скоплениях и поодиночке. По данным, собранным в 1-й половине

Рис. 4. Следы нападения Vespa crabro (a) и позвоночных хищников (b)
(фото А. И. Русина (a) и А. П. Моргачева (b))
июля 2021 года, гнезда в скоплениях не были заражены 1-й генерацией паразитоида чаще, чем одиночные (χ² = 1,52; df = 1; p > 0,05), однако в семьях хозяина из скоплений отмечали высокую частоту проявления специфического защитного поведения. Так, днем, обнаружив самку L. argiolus 2-й генерации, приближающуюся к гнезду или даже запрыгнувшую в него, рабочие P. nimpha начинали быстро перемещаться по соту, расставив крылья, задевая ими края ячей и производя при этом особый звук, что активировало других членов семьи на защиту. Такое же поведение ос отмечено в двух гнездах из скопления на склонах смотровой площадки «Крымская» 30.07.2022, гнездившихся на расстоянии 1,2 м друг от друга. Возле одного из них была отмечена самка L. argiolus 2-й генерации, совершавшая попытки проникнуть в гнездо.
По нашим наблюдениям самки 2-й генерации паразитоида подолгу ожидали неподалеку от гнезда прекращения активности ос, а их безрезультатные попытки проникнуть в гнездо были отмечены не только днем, но и вечером (например, 12.07.2021 в 20:12). Успешное проникновение и откладку яиц L. argiolus 2-й генерации зарегистрировали в 7 семьях с 4:50 до 6:11 5–10.07.2021 и в одной семье 27.07.2022 в 5:17. Возле одного гнезда при этом могло находиться 1–3 самки паразитоида; они его заражали по очереди или одновременно. Так, две самки одновременно откладывали яйца 6.07.2021 в 4:50 утра. Кроме того, было отмечено, что одна и та же самка L. argiolus последовательно откладывала яйца в двух гнездах.
По данным 1 декады июля 2022 года семьи, зараженные 1-й генерацией L. argiolus (взятые в общей совокупности), и незараженные не различались по размерам. Однако, в этом периоде сезонного развития, как показал однофакторный анализ (тест Крускела-Уоллиса), семьи, зараженные после выхода рабочих, были больше по размерам, чем зараженные до выхода рабочих (рис. 5 a и b), и чем незараженные (рис. 5 b и c). Семьи, зараженные до выхода рабочих, имели больше ячей с L. argiolus, чем зараженные после их появления: 3 [3; 5] [3; 5]
106
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике
![]()
- 1 [1; 3] [1; 5], соответственно – тест Манна-Уитни U = 13,5; p < 0,05. Кроме того эти 2 выборки различались по доле ячей в гнезде с зараженным расплодом: 6,5 [6,1; 9,8] [6,1; 10,6]
- 1,9 [1,4; 3,9] [1; 7] – тест Манна-Уитни U = 6,0; p < 0,01.
Паразитоиды 2-й генерации, по данным наблюдений в двух скоплениях, проведенных в 1 декаде июля 2021 года, откладывали свои яйца в более крупные гнезда по числу ячей и числу куколок (рис. 6 a, b). На этом этапе развития семьи, зараженные 1-й генерацией паразитоида, уступали по числу ячей, незараженным (рис. 6а).
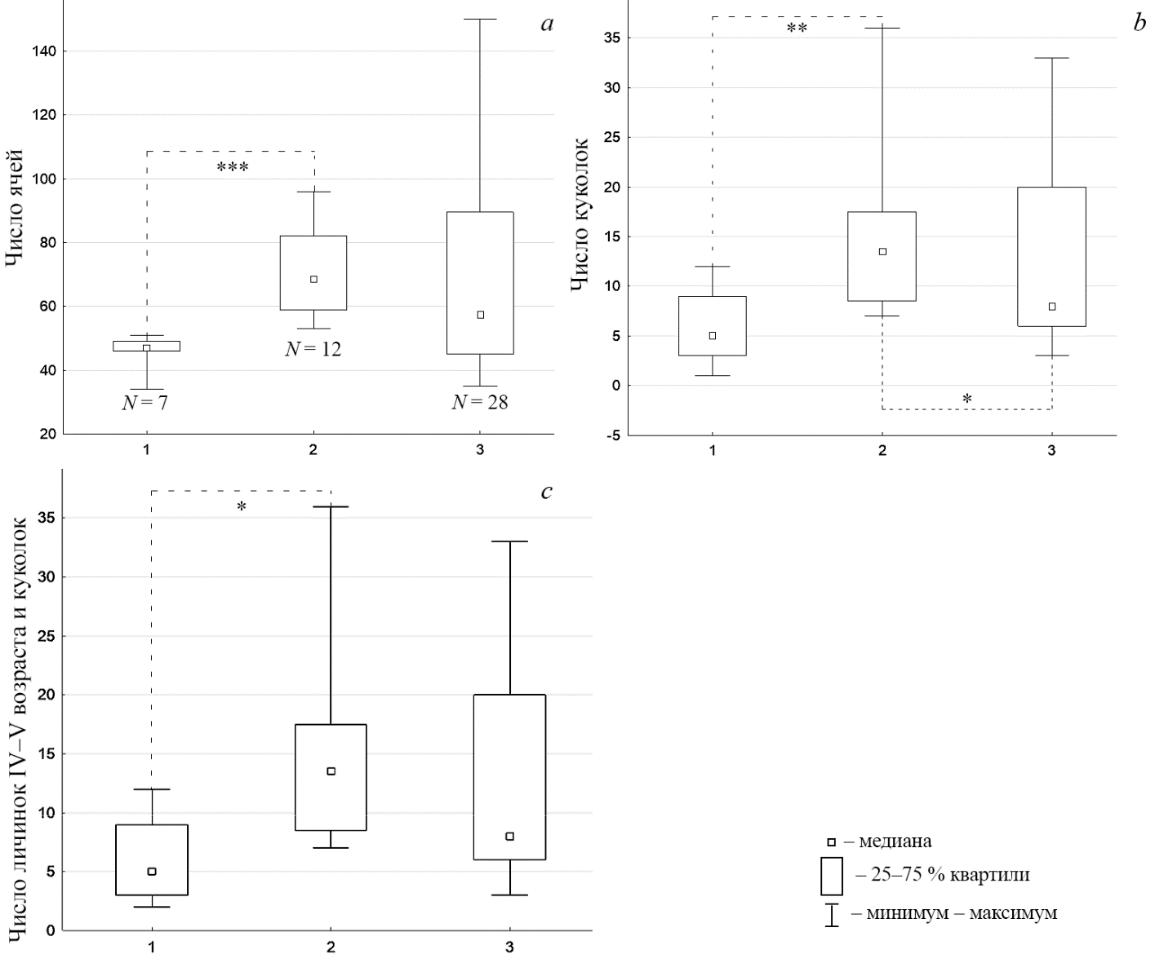
Рис. 5. Размеры семей Polistes nimpha в 2022 году из окрестностей пос. Варварино, зараженных Latibulus argiolus до (1) и после (2) выхода рабочих и незараженных (3)
Попарное сравнение по критерию Данна: * – p<0,05; ** – p<0,01; *** – p<0,001. N – число гнезд.
-
- 2022 году обнаружена отрицательная корреляция как между числом, так и долей зараженных личинок 1-й генерацией и размерами гнезд (для числа ячей: коэффициент Тау Кендалла τ = –0,34; p < 0,05 и τ = –0,57; p < 0,001; для числа куколок: τ = –0,24; p = 0,168 и
- = –0,39; p < 0,05). Однако, статистически значимых корреляций не выявлено между зараженностью семьи L. argiolus и расстоянием от зараженных семей до ближайших соседей, а также долей зараженных семей в скоплении (соответственно, для 1-й генерации в 2022 году: rs = 0,21; p > 0,05 и rs = 0,15; p > 0,05; для 2-й генерации в 2021 году: rs = –0,004; p > 0,05 и rs = 0,33; p = 0,08).
107
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
![]()
ОБСУЖДЕНИЕ
Пространственная структура поселений осы P. nimpha на территории Хоперского заповедника формируется в первую очередь под влиянием необходимых для гнездования биотопов растительных сообществ.
Места локализации внутрипопуляционных группировок, также как и численность гнезд
- них, были в изучаемый период подвержены значительным сезонным и годовым колебаниям. Так, в 2022 году по сравнению с 2021 годом численность гнезд в отдельных скоплениях резко уменьшалась, а в других – увеличивалась. При этом в отдельных местообитаниях осы
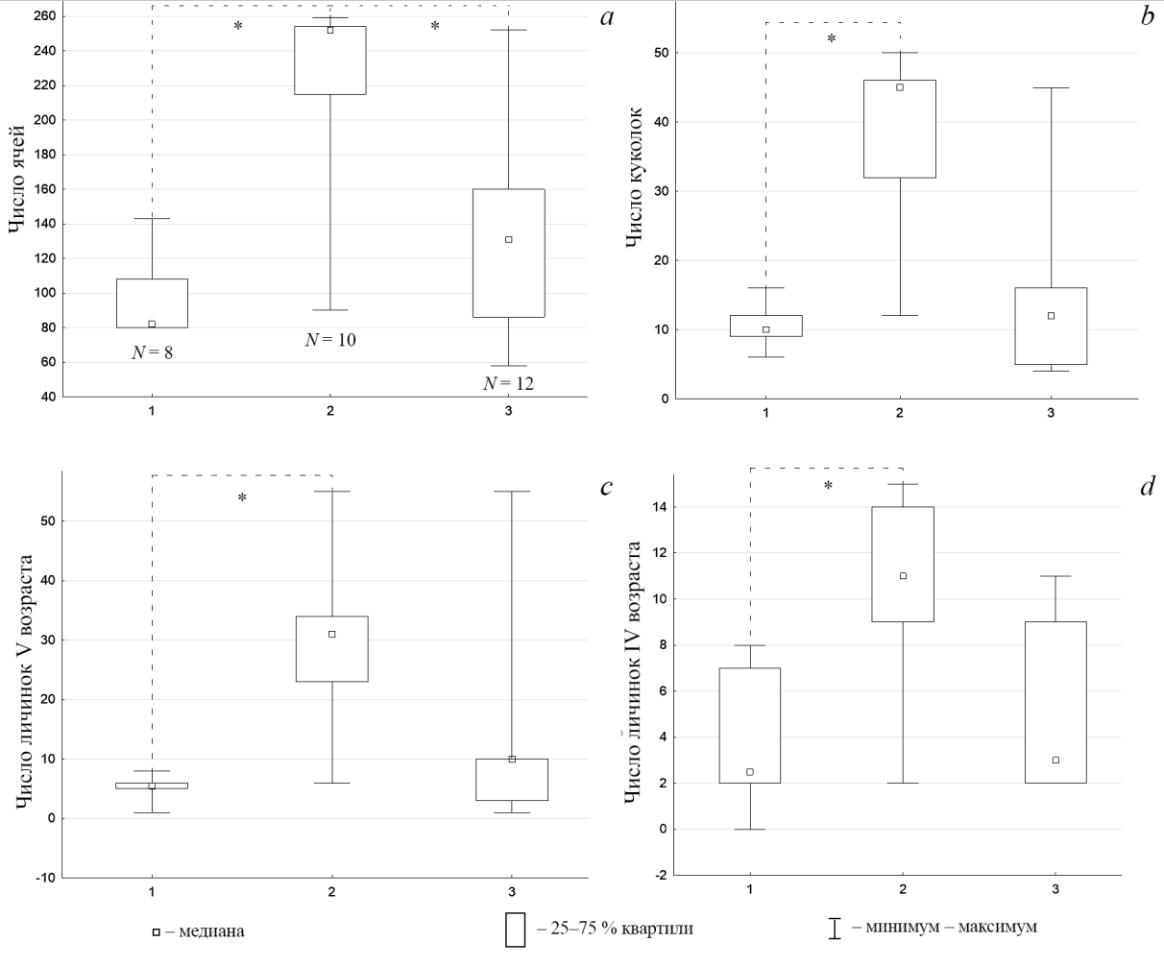
Рис. 6. Размеры семей Polistes nimpha в окрестностях пос. Варварино в 2021 году
На горизонтальной шкале: 1 – семьи, зараженные 1-й генерацией Latibulus argiolus; 2 – семьи, зараженные 2-й генерацией L. аrgiolus; 3 – незараженные семьи. Попарное сравнение по критерию Данна: * – p<0,05. N – число гнезд.
перестали гнездиться, но появились новые скопления в иных местах. Сходные процессы были отмечены и в других частях ареала как у изучаемого P. nimpha, например, на территории Луганского природного заповедника (ЛПЗ), в урочище «Вакаловщина» Сумской обл., так и у других изученных в этом отношении P. dominula (Christ, 1791) и P. mongolicus du Buisson, 1911 (Черноморский биосферный заповедник (ЧБЗ), ЛПЗ, окрестности Херсона и Луганска) (Русина, 2006, 2008–2012; Русина, Шиян-Глотова, 2007; Русина и др., 2010; Русина, Орлова, 2011).
108
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике
![]()
-
- нашем исследовании показано, что агрегированное распределение гнездящихся на растениях семей P. nimpha (по данным, собранным после выхода рабочих) к концу сезона сменяется в результате воздействия хищников на случайное. При этом отмечается частичная или всеобщая гибель семей от хищников в отдельных местообитаниях, а их повышенная выживаемость в других (более защищенных или не обнаруженных хищниками) стациях приводит к увеличению количества личинок и куколок хозяина в ходе сезонного роста гнезд
- заражению их рано утром самками 2-й генерации L. argiolus, проявляющих там функциональную реакцию. Необходимо отметить, что в этой популяции вида хозяина отмечены частые случаи выпадения из его гнезд зимних коконов паразитоида 1-й генерации следующего года и их зарывание в грунт. Распределение зараженных ими гнезд в случае успешной их зимовки в дальнейшем может быть и агрегированным, и случайным. Сходные процессы наблюдали в Провальской степи ЛПЗ (Русина, 2011а). Это тот динамический фон, который постоянно меняет соотношение численности хозяина и паразитоидов. Моделирование процесса десинхронизации взаимодействующих популяций паразитоида и хозяина и влияния этого процесса на плотность популяции хозяина выполнено Годфреем с соавторами (Godfray et al., 1994). Поведенческая реакция у анализируемого вида паразитоида на плотность гнезд и размеры семей хозяина проявляется в различных ее диапазонах. Отмеченный выбор наиболее крупных семей хозяина самками паразитоидов как 1-й (2022 г.), так и 2-й (2021 г.) генерацией, можно рассматривать как проявление поведенческой (функциональной) реакции на плотность пищевого пятна (число личинок в гнезде, пригодных для заражения). Такая же реакция обнаружена у 1-й генерации L. argiolus при гнездовании хозяина на растениях: P. nimpha в ЛПЗ и P. mongolicus в окрестностях Херсона (Русина, Богуцкий, 2009; Русина и др., 2016). Кроме того, при увеличении плотности гнездования P. dominula в укрытиях, где расстояние между соседними гнездами оказывается подчас в десятки раз меньшим, чем при гнездовании на растениях, показано увеличение как доли зараженных семей, так и доли зараженного расплода (Русина, 2008). Последнее может служить показателем усиления деятельности паразитоидов в местах скопления гнезд. Однако, регуляция имеет место, если отмечается зависимость доли зараженных хозяев от их плотности (Викторов, 1976; Hassell, 2000, Русина, 2012). Такая корреляция (отрицательная) числа и доли зараженных личинок и размеров гнезд показана в Хоперском заповеднике лишь для 1-й генерации L. argiolus в 2022 году (по результатам анализа семей хозяина в конце июня), и связана она была с более поздним гнездованием P. nimpha. Различия в размерах семей, зараженных до и после выхода рабочих, несомненно, указывают на некую модификацию паразитоидом численности популяции осы-хозяина. При этом доля зараженных семей в оба года была невысока.
Сходное явление было отмечено холодной весной 2007 года (при анализе взаимоотношений L. argiolus с осой P. nimpha) на территории ЛПЗ (Русина, 2011а). Холодная весна 2004 года на территории ЧБЗ также привела к сдвигу начала гнездования (и последующих фаз) на более поздние сроки у P. dominula (Русина, 2008). Однако, до выхода рабочих семьи были существенно заражены лишь E. schmitti, для которого показан агрегированный тип распределения, а не L. argiolus со случайным типом распределения (Русина, 2008). К заражению семьи до выхода рабочих могут приводить не только специфические погодные условия в период основания семьи, но и высокая плотность гнездования хозяина и высокая численность паразитоида (Makino, Sayama, 1994; Русина, 2012). Так, в ЛПЗ 68 % семей P. nimpha гнездится на кустарниках Caragana frutex L. и Amegdalus nana L., где отмечается более высокая выживаемость семей хозяина и, следовательно, паразитоида; при этом на отдельных участках встречается до 60 семей на 100 м2. Доля зараженных семей ос 1-й генерацией L. argiolus достигала в Стрельцовской степи 68,2 % (Русина, Богуцкий, 2009). По данным 3-х скоплений Стрельцовской степи и 2-х Провальской степи обнаружено, чем ближе располагались гнезда в скоплениях, тем сильнее они были заражены до выхода рабочих. Вместе с тем необходимо отметить, что более точная оценка роли функциональной и численной реакций паразитоида требует выяснения, сколько самок паразитоида участвует в заражении одной семьи.
109
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
![]()
Можно предположить, что наблюдаемое перераспределение L. argiolus в зависимости от скученности хозяев связано с особенностями его репродуктивного поведения и защитного поведения у хозяев или зараженности их семей паразитами. Этот синовигенный паразитоид, как и другие виды рода Latibulus Gistel, 1848 (Makino, 1989), нуждается в дополнительном питании, а зараженность хозяев ограничена тем, что за определенный отрезок времени самка L. argiolus способна отложить лишь созревшую часть яиц даже при постоянном наличии в гнезде пригодных личинок.
Защитное поведение уже было описано у P. exclamans Viereck, 1906 по отношению к
| Chalcoela iphitalis | (Walker, 1859) | (Lepidoptera, Crambidae) | (Strassmann, 1981) и к |
| Elasmus polistis (Burks, 1971) (Hymenoptera, Eulophidae) | (Lutz et al., 1984), у P. | ||
riparius Sk.Yamane & Soi.Yam., 1987 по отношению к Latibulus sp. (Makino, 1989), у P. snelleni (de Saussure, 1862) – к E. japonicus Ashmead, 1904 (Makino, Sayama, 1994), у трех видов ос-полистов Нижнего Приднепровья к L. argiolus (Русина, 2006). Вместе с тем, защитное поведение по отношению к этому виду паразитоида не отмечено у P. albellus Giordani Soika, 1976, гнездящегося вместе с P. nimpha на растениях в разнообразных локальных поселениях Мещерской низменности (Косякова и др., 2021). Интересно, что успешное заражение семей ос при их гнездовании на растениях наблюдали у P. albellus днем, у P. dominula и P. mongolica
- ЧБЗ – в вечернее и ночное время, а у P. nimpha (результаты данного исследования) это происходило ранним утром.
Зараженность имаго P. nimpha S. connivens была не высока и сопоставима с показателями клещевой инвазии у этого вида в Сумской обл. и в ЛПЗ (Русина, Орлова, 2011). Как показано
- ранее проведенных экспериментах, паразитоид L. argiolus, в отличие от E. schmitti, не проявляет поведенческие реакции избегания семей, сильно зараженных клещом или зараженных другим видом паразитоида (Русина, 2011б; Русина и др., 2015).
- целом, наличие разных по составу, структуре и устойчивости поселений способствует поддержанию оптимальной численности ос на территории и выживанию в неблагоприятные годы. При этом, важной составляющей стабильного сосуществования популяций паразитоида и хозяина могут быть годовые флуктуации в синхронизации их жизненных циклов (Briggs, Hoopes, 2004).
Таким образом, мы наблюдаем достаточно большое разнообразие состояний системы взаимодействующих популяций паразитоидов и осы-полиста. Эти состояния могут рассматриваться как варианты, специфичные для разных биоценотических и географических условий обитания, а также могут быть разными фазами динамики взаимодействующих популяций. Вопрос о том, как соотносится с уровнем воздействия энтомофагов (Starr, 1976, 1978) выраженность миграционных процессов и особенностей жизненного цикла, как у ресоциальных ос, так и у их паразитоидов, требует дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Анализ пространственно-временной организации взаимоотношений паразитоида
Latibulus argiolus с осой хозяином Polistes nimpha дал следующее результаты:
-
- При гнездовании хозяина открыто на растениях встречаемость L. аrgiolus как в 2021, так и в 2022 году оказалась сходной и составила 19–20 %. Распределение L. аrgiolus в этих условиях не зависит от характера распределения гнезд хозяина.
- Корреляция между зараженностью семей L. аrgiolus и продуктивностью семей P. nimpha была отмечена только в 2022 году. При зараженности ячей в гнезде свыше 6 % продуктивность семей значительно снижается. Такая высокая зараженность семьи отмечается при раннем (до выхода рабочих) проникновении паразитоида в гнездо. При этом проявлению регулирующего эффекта паразитоида могли способствовать погодно-климатические условия периода основания семей.
- Паразитоиды 1-й и 2-й генераций проявляли функциональную реакцию, заражая более крупные семьи. Наблюдаемая в природе поведенческая реакция у L. argiolus 2-й генерации
110
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике
![]()
обусловлена также действием агрегативного компонента, поскольку выбор для заражения крупных семей отмечался в местах относительного обилия паразитоида.
- Множественность факторов (погода, биологические особенности паразитоидов и хозяина, воздействие беспозвоночных и позвоночных хищников, зараженность клещом и др.) делают систему взаимодействия паразитод-хозяин сложноорганизованной, динамичной и трудно предсказуемой. Одним из факторов стабильного сосуществования популяций паразитоида и хозяина могут быть сезонные и многолетние флуктуации в синхронизации их жизненных циклов.
Благодарности. Выражаем глубокую признательность дирекции и сотрудникам Хоперского природного заповедника за предоставленную возможность и содействие в проведении исследования, а также А. П. Моргачеву, Е. А. Моргачевой, У. А. Куликовой и А. С. Скворцову за активное участие в поиске гнезд и наблюдениях. Искренне благодарим Е. С. Нескрябину за помощь в определении растений, Е. Б. Федосееву за определение муравьев, С. Я. Резника, С. А. Белокобыльского и С. П. Иванова за ценные замечания при обсуждении результатов и работе над рукописью.
Список литературы
Викторов Г. А. Экология паразитов-энтомофагов. – М.: Наука, 1976. – 152 с.
Бирюков В. И. 2010. Погодно-климатическая характеристика Хопёрского заповедника // Проблемы мониторинга природных процессов на особо охраняемых природных территориях (Материалы международной научно-практической конференции, посвящённой 75-летию Хопёрского государственного природного заповедника). – Воронеж: ВГПУ, 2010. – С. 24–26.
Гланц С. Медико-биологическая статистика. – М.: Практика, 1999. – 459 с.
Косякова А. Ю., Гилев А. В., Ноймейер Р. П., Русина Л. Ю. Фенотипическая изменчивость осы Polistes albellus Giordani Soika, 1976 (Hymenoptera, Vespidae) // Энтомологическое обозрение. – 2021. – Т. 100, № 4. – С. 728–754.
Русина Л. Ю. Осы-полисты в природных и антропогенных ландшафтах Нижнего Приднепровья. // Херсон:
Издательство Херсонского государственного университета, 2006. – 200 с.
Русина Л. Ю. Реакция паразитоидов бумажной осы Polistes dominulus (Christ) (Hymenoptera, Vespidae, Polistinae) на распределение хозяина // Энтомологическое обозрение. – 2008. – Т. 87, № 3. – С. 514–536.
Русина Л. Ю. Структурно-функциональная организация популяций ос-полистов (Hymenoptera, Vespidae) // Труды Русского энтомологического общества. – 2009. – Т. 79. – С. 1–217.
Русина Л. Ю. Некоторые аспекты взаимоотношений муравьев Hymenoptera, Formicidae и ос-полистин Hymenoptera, Vespidae // Зоологический журнал. – 2010. – Т. 89, № 12. – С. 1520–1530.
Русина Л. Ю. Пространственно-временны́е аспекты взаимоотношений паразитоида Latibulus argiolus (Rossi) (Hymenoptera, Ichneumonidae) с ресоциальной осой-хозяином Polistes nimpha (Christ) (Hymenoptera, Vespidae) // Труды Зоологического института РАН. – 2011а. – Т. 315, № 1. – С. 53–62.
Русина Л. Ю. Дискриминационная способность паразитоидов Elasmus schmitti (Hymenoptera, Eulophidae) и Latibulus argiolus (Hymenoptera, Ichneumonidae) из семей ос-полистов (Hymenoptera, Vespidae) // Зоологический журнал. – 2011б. – Т. 90, вып. 10. – С. 1197–1203.
Русина Л. Ю. Роль паразитоидов в регуляции численности популяции ос-полистов Hymenoptera, Vespidae:
Polistinae // Энтомологическое обозрение. – 2012. – Т. 91, № 4. – С. 691–703.
Русина Л. Ю., Богуцкий М. П. Осы-полисты Луганского природного заповедника // Рослинний і тваринний світ та його охорона. Наукові праці Луганського природного заповідника. – 2009. – Вип. 1 (присвячений 40-річному ювілею Луганського природного заповідника). – С. 164–177.
Русина Л. Ю., Богуцкий М. П., Русин И. Ю., Рева А. В., Орлова Е. С. Численная реакция первой генерации Latibulus argiolus (Rossi) (Hymenoptera: Ichneumonidae) в поселениях хозяев Polistes nimpha (Christ) и P. gallicus (Linnaeus) (Hymenoptera: Vespidae) // Евразиатский энтомологический журнал. – 2016. – Вып. 15, № 1. – С. 116– 122.
Русина, Л. Ю., Орлова К. С. Связь фенотипической изменчивости будущих основательниц Polistes nimpha (Hymenoptera, Vespidae, Polistinae) с характером их зараженности в личиночном состоянии клещом Sphexicozela connivens (Acari, Astigmata, Winterschmidtiidae) // Энтомологическое обозрение. – 2011. – Т. 90, вып. 2. – С. 34–40.
Русина Л. Ю., Орлова К. С., Говорун А. В. Фенотипическая структура популяции осы Polistes nimpha (Christ) (Hymenoptera: Vespidae) на территории урочища Вакаловщина Сумской обл. // Природничий альманах. Біологічні науки. – 2010. – Вып. 14. – С. 151–161.
Русина Л. Ю., Орлова К. С., Фирман Л. А. Реакция паразитоидов социальной осы Polistes dominula (Christ, 1791) на клещевую инвазию хозяина // Кавказский энтомологический бюллетень. – 2015. – Вып. 11, № 1. – С. 85– 89.
111
Русина Л. Ю., Русин А. И., Лукашук Е. В., Егунова О. Е.
![]()
Русина Л., Шиян-Глотова А. Осы-полисты в окрестностях г. Луганска // Природничий альманах. – 2007. – Вип 9. – С. 154–164.
Хорхордин Е. Г. Основные концепции и подходы к изучению реакций энтомофагов на плотность вредителей // Успехи современной биологии. – 1977. – Т. 84, № 2. – С. 305–314.
Цвелёв Н. Н. Флора Хопёрского государственного заповедника. – Л.: Наука. Ленинградское отделение, 1988. – 192 с.
Briggs C. J., Hoopes M. F. Stabilizing effects in spatial parasitoid-host and predator-prey models: a review // Theoretical Population Biology. – 2004. – Vol. 65. – P. 299–315.
Bouwma A. M., Bouwma P. E., Nordheim E. V., Jeanne R. L. Founding swarms in a tropical social wasp: adult mortality, emigration distance, and swarm size // Journal of Insect Behavior. – 2003а. – V. 16, N 3. – P. 439–452.
Chadab R., Rettenmeyer C. W. Comparative behavior of social wasps when attached by army ants or other predators and parasites // Proc. 9th. Int. Cong. Int. Union Study Soc. Insects. – 1982. – P. 270–274.
Clark P. J., Evans F. C. Distance to nearest neighbor as a measure of spatial relationship in populations // Ecology. – 1954. – Vol. 35, N 4. – P. 445–453.
Comins H. N., Hassel M. P., May R. M. The spatial dynamics of host parasitoids system // Journal of Animal Ecology. – 1992. – Vol. 61. – P. 735–748.
Godfray H. C. J., Hassell M. P., Holt R. D. The population dynamic consequences of phenological asynchrony between parasitoids and their hosts // Journal of Animal Ecology. – 1994. – Vol. 63. – P. 1– 10.
Gumovsky A., Rusina L., Firman L. Bionomics, morphological and molecular characterisation of Elasmus schmitti and Baryscapus elasmi (Hymenoptera: Chalcidoidea, Eulophidae), parasitoids associated with a paper wasp, Polistes dominulus (Vespoidea, Vespidae) // Entomological Science. –2007. – Vol. 10. – P. 21–34.
Hassell M. P. Evaluation of parasite and predator responses // Journal of Animal Ecology. – 1966. – Vol. 35, N 1. – P. 35–75.
Hassell M. P. Host–parasitoid population dynamics // Journal of Animal Ecology. – 2000. – Vol. 69. – P. 534–566. Hassell M. P., May R. M. Aggregation of predators and insect parasites and its effect on stability // Journal of Animal
Ecology. –1974. – Vol. 43. – P. 567–594.
Hassell M. P., Waage J. K. Host-parasitoid population interactions // Annual Review of Entomology. –1984. – Vol.
29. – P. 89–114.
Lloyd M. Mean crowding // Journal of Animal Ecology. – 1967. – Vol. 36, – P. 1–30.
Luchetti D. Note su Latibulus argiolus parassitoide di alcune specie di Polistes // Bollettino dell’Associazione Romana di Entomologia. – 1992. – Vol. 47. – P. 99–102.
Lutz G. G., Strassmann J. E., Hughes C. R. Nest defense by the social wasps, Polistes exclamans and P. instabilis (Hymenoptera: Vespidae) against the parasitoid Elasmus polistis (Hym.: Chalcidoidea: Eulophidae) // Entomological News. – 1984. – Vol. 95, N 2. – P. 47–50.
Makino S. Biology of Latibulus argiolus (Hymenoptera: Ichneumonidae), a parasitoid of the paper wasp Polistes
biglumis (Hymenoptera: Vespidae) // Kontyu. – 1983. – Vol. 51, N 3. – P. 426–434.
Makino S. Losses of workers and reproductives in colonies of the paper wasp Polistes riparius (Hymenoptera, Vespidae) due to the parasitic wasp Latibulus sp. // Researches on Population Ecology. – 1989. – Vol. 31, N 1. – P. 1–10.
Makino S., Sayama K. Bionomics of Elasmus japonicus (Hymenoptera, Elasmidae), a parasitoid of a paper wasp, Polistes snelleni (Hymenoptera, Vespidae) // Japanese Journal of Entomology. –1994. – Vol. 62, N 2. – P. 377–383.
May R. M., McLean A. R. Theoretical ecology: Principles and applications. – Oxford: Oxford University Press, 2007. – 257 p.
Ruberson J. R., Tauber M. J., Tauber C. A., Gollands B. Parasitization by Edovum puttleri (Hymenoptera: Eulopidae) in relation to host density in the field // Ecological Entomology. – 1991. – Vol. 16, – P. 81–89.
Solomon M.G. The natural control of animal populations // Journal of Animal Ecology. – 1964. – Vol. 49, N 18. – P.
1–35.
Starr C. K. Nest reutilization by Polistes metricus (Hymenoptera: Vespidae) and possible limitation of multiple foundress associations by parasitoids // Journal of the Kansas Entomological Society. – 1976. – Vol. 49. – P. 142–144.
Starr C. K. Nest reutilization in North American Polistes (Hymenoptera: Vespidae): two possible selective factors // Journal of the Kansas Entomological Society. – 1978. – Vol. 51, N 3. – P. 394-397.
Strassmann J. E. Parasitoids, predators, and group size in the paper wasp Polistes exclamans // Ecology. – 1981. – Vol. 62, N 5. – P. 1225–1233.
112
Реакция паразитоида Latibulus argiolus (Rossi, 1790) (Ichneumonidae) на особенности гнездования хозяина Polistes nimpha (Christ, 1791) (Vespidae) в Хоперском природном заповеднике
![]()
Rusina L. Yu., Rusin A. I., Lukashuk E.V., Egunova O. E. Reaction of the parasitoid Latibulus argiolus (Rossi, 1790) (Ichneumonidae) to nesting peculiarities of the host Polistes nimpha (Christ, 1791) (Vespidae) in Khopyor Nature Reserve // Ekosistemy. 2023. Iss. 33. P. 98–113.
The role of invertebrates (Latibulus argiolus, ants and hornet Vespa crabro) and vertebrate entomophages as factors of mortality of brood and colonies of the social wasp Polistes nimpha was estimated in the territory of Khopyor Nature Reserve and in its vicinity in 2021–2022. In different years the occurrence of L. argiolus parasitoids in the host’s nests was similar and amounted to 19–20%. According to observations, parasitoids waited for a long time near the nest of P. nimpha when the wasps activity and their protective behavior ceased. Successful infestations of P. nimpha colonies took place in early morning. There could be 1–3 female parasitoids near one nest; they infested it in turn or simultaneously. L. argiolus females of the 1st and 2nd generations showed a behavioural response, distributing in areas depending on the size of nests of host wasp colonies. The factor of host population density turns out to be mediated not only by uneven pace of colony development and their spatial location, but also by temporary (seasonal) aspects of their development. Low density of the host population, at which the parasitoid regulates the wasp abundance, corresponds to the pre-emergence phase of Polistes life cycle. In 2022, there was a negative correlation between productivity of P. nimpha colonies and their infestation with L. argiolus. Modification of the host wasp population by the parasitoid L. argiolus resulted from the changes in the host nesting caused by the specific weather conditions in 2022. Moreover, the numerical reaction was observed in places with a high density of host colonies, where favorable conditions for the survival of the 1st and 2nd generations of the parasitoid were formed. One of the factors of stable coexistence of parasitoid and host populations may be annual fluctuations in the synchronization of their life cycles.
Key words: social wasps, parasitoids, Hymenoptera, Ichneumonidae,Vespidae, Polistes nimpha, Latibulus argiolus, predators, functional and numerical reactions, Khopyor Nature Reserve.
Поступила в редакцию 22.01.23
Принята к печати 17. 02.23
113

