| Экосистемы, 36: 209–224 (2023) | https://ekosystems.cfuv.ru |
| УДК 592–152.41(262.5+262.54) | DOI 10.5281/zenodo.10378069 |
Распространение Phoronis в биоценозах Черного и Азовского морей
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
nboltacheva@mail.ru, e.lisitskaya@gmail.com, nrevkov@yandex.ru
На основании собственного материала, собранного в 2010–2022 годы, и литературных данных проанализировано распространение представителя рода Phoronis в биоценозах Черного и Азовского морей. Все обнаруженные форонисы отнесены к виду Phoronis cf. psammophila. Отмечены их эколого-морфологические отличия от типичных представителей вида из других морей. Черноморские экземпляры более мелкие: длина тела – до 16 мм, диаметр – 0,25–0,75 мм, длина щупалец – 0,25–1,65 мм, количество щупалец – 33–60, тогда как для P. psammophila из других морей указано 60–190 щупалец. Половозрелые особи имели длину тела от 6,5 мм. Актинотрохи черноморского форониса зарегистрированы в планктоне с мая по октябрь в диапазоне температур 17,6–25,6 °С. Максимальная встречаемость личинок (61,5 %) отмечена при температуре воды 20–21,9 °С. Расширены представления о батиметрических границах обитания форониса в Черном море – от 2 до 110 м. Вид впервые обнаружен в Азовском море, где он зарегистрирован при солености воды 12,53–14,39 ‰, что расширяет соленостный диапазон обитания вида. Установлено, что в Азово-Черноморском бассейне форонис обитает преимущественно на сильно заиленных грунтах. Наибольшая плотность форониса – 1828 экз./м2 – отмечена в западной части Каркинитского залива на глубине 35 м. В Черном море форонис зарегистрирован преимущественно
- биоценозах Mytilus galloprovincialis, Pitar rudis и Terebellides stroemi, в Азовском море – в биоценозе с доминированием Anadara kagoshimensis.
Ключевые слова: зообентос, Phoronida, Phoronis psammophila, актинотроха, Черное море, Азовское море.
ВВЕДЕНИЕ
-
- типу Phoronida относятся исключительно морские широко распространенные в Мировом океане донные беспозвоночные, обитающие на заиленных грунтах и образующие в отдельных биотопах обширные поселения. В настоящее время данный тип животных включает 11 видов (Emig, de Mittelwihr, 2023). Однако, количество описанных в разное время видов личинок форонид (актинотрох Phoronis) превышает 30 (Temereva, Neretina, 2013;
Temereva et al., 2016).
Впервые актинотроху Phoronis, в дальнейшем названную Actinotrocha metschnikoffi, из Одесского залива Черного моря описал И И. Мечников (Metschnikoff, 1869, 1871, цит. по Selys-Longchamps, 1907). Actinotrocha metschnikoffi неоднократно находили в планктоне Новороссийской и Севастопольской бухт в конце 19 – начале 20-го века (Зернов, 1904, 1913),
- 30-х годах 20-го века в Каркинитском заливе (Галаджиев, 1948). Взрослая форма этого форониса была описана как новый вид Phoronis euxinicola Selys-Longchamps, 1907. В течение длительного времени находки форонид в бентосе Черного моря относили именно к этому виду (Зернов, 1913; Киселева, 1968; Маринов, 1990; Северо-западная часть…, 2006; Petrova,
Stoykov, 2013), впоследствии признанному «nomen nudum» (Emig, de Mittelwihr, 2023).
Исследования зообентоса Каркинитского залива и всей северо-западной части Черного моря показали довольно широкое распространение форониса, который был идентифицирован как Phoronis psammophila Cori, 1889 (Băcescu et al., 1971; Золотарев, Повчун, 1986; Повчун, 1990, 1992; Золотарев, 1994; Emig et al., 2003). У турецких берегов этот вид был впервые зарегистрирован в 2000 году (Emig et al., 2003). В тот же период С. С. Эмиг (Emig, 1982)
синонимизировал личинку Actinotrocha metschnikoffi с Actinotrocha sabatieri Roule, 1896,
которая является типичной личинкой P. psammophila.
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
![]()
-
- румынского побережья был указан и другой вид – Phoronis hippocrepia Wright, 1856
(Iacobescu, 1969, цит. по Băcescu et al., 1971). Однако, по мнению C. С. Emig, данная идентификация P. hippocrepia сомнительна, а обнаруженные образцы, вероятно, принадлежат
P. psammophila (Emig et al., 2003).
- некоторых списках видов форонид для Черного моря помимо перечисленных двух видов указан третий – Phoronis muelleri Selys-Longchamps, 1903 (Темерева, 2017; Emig, de Mittelwihr, 2023). Данный вид известен для Средиземного моря (Emig et al., 2003; Çinar, 2014),
однако сведений о его конкретных находках в Черном море нам найти не удалось. Таким образом, единственным видом, находки которого в Черном море подтверждены специалистами, является P. psammophila (Emig et al., 2003; Çinar, 2014).
Цель нашей работы – проанализировать распространение Phoronis в различных биоценозах Черного и Азовского морей.
МАТЕРИАЛ И МЕТОДЫ
Материалом для наших исследований послужили сборы макрозообентоса из экспедиций НИС «Профессор Водяницкий» (рейсы № 64, 68, 70, 72, 84, 86, 90, 96, 103, 122) в 2010–2022 годы. Работы проведены на шельфе северной части Черного моря от берегов Румынии до Кавказского побережья (район Туапсе), а также в юго-западной части Азовского моря. Станции выполнены в диапазоне глубин от 10 до 137 м (табл. 1). Использованы материалы дночерпательных проб, собранных с 291 станции. Отбор донных осадков осуществляли с помощью дночерпателя «Океан-50» (площадь захвата 0,25 м2). Грунт промывали через сита с наименьшим диаметром 1 мм. Материал фиксировали 4 % раствором формалина. Пробы разбирали в лаборатории под микроскопом МБС-9, часть фиксированных экземпляров форонисов использовали для морфометрических исследований. В работе использованы архивные данные отдела экологии бентоса ИнБЮМ. Анализ батиметрического распределения форониса выполнен на материалах, собранных в северо-западной части Черного моря (153 станции). На каждый из рассмотренных диапазонов глубин, взятых с интервалом 20 м, приходилось от 10 до 66 станций.
Для анализа нахождения личинок форониса в планктоне использованы прибрежные сборы меропланктона (всего 286 проб), выполненные в 2010–2022 годы в бухтах юго-западного Крыма, в акватории поселков Кацивели и Никита (Южный берег Крыма) и в прибрежье Карадага (юго-восточный Крым). Меропланктон собирали сетью Джеди с диаметром входного отверстия 36 см и ячеей мельничного газа 135 мкм, облавливали слой 0– 10 м. Глубина на станциях отбора проб составляла 13–15 м. Материал разбирали в живом виде, используя микроскопы МБС-9 и Микмед-5. В пробах подсчитывали личинок форониса. Фотографии актинотрох выполнены фотокамерой «Sony cyber-shot 16.2». Встречаемость актинотрох в разные сезоны рассчитана на основании 134 проб, взятых на внешнем рейде Севастополя.
- данной работе мы обратили свое внимание на место форониса в составе различных комплексов донной фауны. В биоценотический анализ включены 72 станции, на которых присутствовал форонис. Рассмотрено вхождение форониса в биоценотические комплексы, выделенные как на основе процедуры многомерного анализа данных, так и по простому доминированию видов на станциях по методу В. П. Воробьёва (1949). Многомерный анализ данных выполнен в пакете программ PRIMER (Cluster, MDS, SIMPER анализы) (Clarke, 1993; Clarke, Gorley, 2001). Выделение биоценотических комплексов (фаунистическая классификация) проведено на основе трансформированной (присутствие/отсутствие видов) матрицы данных по станциям. Для минимизации стресс-фактора (Clarke, 1993; Clarke, Gorley, 2001) учтены виды с встречаемостью более 10 % (отмечены на 7 и более станциях из 72). В качестве меры сходства станций использована статистика Брэя-Куртиса (Bray, Curtis, 1957). Определение руководящих видов выделенных пространственных группировок бентоса (комплексов) производилось на основе их вклада (по нетрансформированным значениям биомасс) во внутрикомплексное сходство.
210
Распространение Phoronis в биоценозах Черного и Азовского морей
![]()
Таблица 1
Координаты станций, выполненных в 2010–2022 годы на НИС «Профессор Водяницкий»
в Азово-Черноморском бассейне, на которых обнаружен форонис
| Координаты | м | Координаты | м | |||||||||
| № | № | № | № | |||||||||
| Глубина, | Грунт | Глубина, | Грунт | |||||||||
| рейса/ | стан | °N | °E | рейса/ | стан | °N | °E | |||||
| дата | ции | дата | ции | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| 64/ | 84/ | |||||||||||
| VII. | 15 | 45,01632 | 33,226867 | 70 | И | IV. | 26 | 44,860668 | 35,3234 | 51 | И | |
| 2010 | 2016 | |||||||||||
| 4 | 45,2986 | 31,38891 | 52 | ИР | 1 | 45,20325 | 33,10955 | 18 | ИР | |||
| 11 | 45,64033 | 30,6059 | 27 | ИР | 2 | 45,26433 | 32,898 | 44 | ИР | |||
| 68/ | 15 | 46,08833 | 31,09883 | 34 | И | 3 | 45,6265 | 32,71033 | 28 | ИП | ||
| 16 | 45,98184 | 31,08953 | 35 | И | 7 | 45,74567 | 33,02983 | 20 | ИР | |||
| XI. | 86/ | |||||||||||
| 2010 | 19 | 45,50134 | 31,13704 | 46 | ИР | 8 | 45,75417 | 33,06533 | 14 | ИР | ||
| VI. | ||||||||||||
| 23 | 45,96709 | 31,35875 | 22 | ИП | 2016 | 39 | 45,52944 | 36,42517 | 11 | И | ||
| 26 | 45,95515 | 31,58244 | 23 | ИР | 48-а | 44,88 | 33,35333 | 65 | ИП | |||
| 29 | 45,7458 | 31,58567 | 33 | ИР | 48 | 44,8799 | 33,3386 | 70 | ИР | |||
| 7 | 44,32642 | 34,19455 | 33 | ИП | 49 | 44,7885 | 33,45367 | 55 | ИП | |||
| 9 | 44,66805 | 35,3846 | 94 | И | 50 | 44,76617 | 33,3865 | 86 | ИР | |||
| 24 | 46,0582 | 31,222033 | 31 | ИР | 3 | 45,14667 | 33,12062 | 41 | ИП | |||
| 29 | 45,76 | 32,2433 | 35 | ИР | 4 | 45,20753 | 32,82515 | 55 | И | |||
| 90/ | ||||||||||||
| 30 | 45,81298 | 32,4892 | 35 | И | 5 | 45,08984 | 32,55284 | 81 | И | |||
| X. | ||||||||||||
| 70/ | 31 | 45,91408 | 32,738683 | 26 | И | 9 | 45,29137 | 32,05017 | 50 | И | ||
| 2016 | ||||||||||||
| VII. | ||||||||||||
| 34 | 45,9224 | 33,270767 | 11 | ИР | 17 | 45,834917 | 36,00925 | 12 | И | |||
| 2011 | ||||||||||||
| 36 | 45,89655 | 33,183567 | 11 | И | 20 | 45,499817 | 36,507867 | 11 | ИР | |||
| 38 | 45,78367 | 33,017833 | 19 | И | 23 | 44,061667 | 35,571667 | 23 | И | |||
| 39 | 45,68549 | 32,766033 | 27 | И | 2 | 45,60369 | 32,71745 | 26 | ИР | |||
| 40 | 45,57849 | 32,5145 | 34 | И | 3 | 45,58768 | 32,76983 | 20 | И | |||
| 42 | 45,15297 | 33,11495 | 36 | И | 5 | 45,69628 | 32,76843 | 27 | ИР | |||
| 43 | 45,04992 | 33,061117 | 87 | И | 6 | 45,72285 | 32,98145 | 20 | ИР | |||
| 4 | 44,5038 | 33,3506 | 102 | И | 8 | 45,78553 | 32,99762 | 20 | И | |||
| 5 | 33,4011 | 44,4712 | 104 | ИР | 96/ | 9 | 45,73717 | 32,71747 | 28 | ИП | ||
| 8 | 34,984 | 44,7828 | 52 | И | 11 | 45,25415 | 32,51668 | 55 | ИР | |||
| VII. | ||||||||||||
| 72/ | 13 | 44,8339 | 35,3 | 63 | И | 2017 | 12 | 45,22015 | 32,83478 | 56 | ИП | |
| 14 | 44,8925 | 35,2358 | 39 | И | 13 | 45,26018 | 32,88137 | 45 | И | |||
| V. | ||||||||||||
| 2013 | 26 | 45,5851 | 32,5189 | 30 | ИР | 15 | 44,8797 | 33,3581 | 74 | И | ||
| 30 | 45,5645 | 32,6733 | 25 | ИР | 16 | 44,6255 | 33,2328 | 110 | И | |||
| 31 | 45,6106 | 32,582 | 28 | ИР | 20 | 44,402317 | 33,698433 | 62 | И | |||
| 32 | 46,4198 | 31,159 | 20 | ИР | 28 | 44,871167 | 35,23855 | 51 | ИР | |||
| 47 | 45,0747 | 33,2365 | 37 | ПР | 39 | 44,529767 | 33,341267 | 102 | И | |||
211
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
![]()
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| 1 | 44,73223 | 33,26221 | 97 | И | 40 | 45,70037 | 32,46075 | 37 | ИР | |||
| 2 | 44,766 | 33,38843 | 88 | И | 103/ | 39 | 44,46483 | 33,59198 | 69 | ИР | ||
| 84/ | IX. | |||||||||||
| 3 | 45,70215 | 32,7665 | 27 | И | 131 | 44,15129 | 38,83814 | 95 | ИР | |||
| 2018 | ||||||||||||
| IV. | ||||||||||||
| 4 | 45,53893 | 32,44097 | 42 | И | 192 | 44,945923 | 35,286892 | 25 | ИР | |||
| 2016 | 122/ | |||||||||||
| 20 | 44,9912 | 35,574718 | 31 | И | VI. | 199 | 44,948361 | 35,345593 | 30 | И | ||
| 2022 | ||||||||||||
| 21 | 44,916385 | 35,582433 | 40 | И | 200 | 44,94503 | 35,372907 | 37 | И | |||
Примечание к таблице. И – ил; ИР – заиленный ракушечник; ИП – заиленный песок; ПР – песок с ракушечником.
РЕЗУЛЬТАТЫ
Phoronis cf. psammophila в бентали. В бентосных пробах всего обнаружено 892 экземпляра Phoronis. Форонисы находились в тонких трубках, инкрустированных мелкими песчаными или илистыми частицами. Фиксированные особи – желтовато-белого цвета. У особей, хранившихся в формалине несколько месяцев, заметна розовато-оранжевая пигментация в проксимальной части щупалец лофофора (рис. 1 a).
Длина тела форонисов (без лофофора) составляла от 5 до 16 мм, в среднем – 9,7±0,6 мм (n=31 экз.). Диаметр тела в основании лофофора – от 0,25 до 0,5 мм, в среднем – 0,33±0,01 мм. Диаметр тела в области ампулы – от 0,3 до 0,75 мм, в среднем – 0,5±0,02 мм. Число щупалец составляло 51±2 (n=15 экз.). Медиальные и латеральные щупальца лофофора имели одинаковую длину – от 0,25 до 1,65 мм, в среднем 1±0,07 мм (n=21 экз.). Лофофор переходного типа между овальным и подковообразным. У некоторых особей отмечены укороченные щупальца одной длины – можно предположить, что особи находились на стадии регенерации после их утери (рис. 1 b). У двух из промеренных особей в кроне щупалец лофофора были отмечены яйца, собранные в одно скопление (рис. 1 c). Размеры этих самок составляли 6,5 и 10,8 мм, диаметр яиц – 50–70 мкм. Самки были обнаружены в пробах, собранных на глубине 30–35 м в августе 2011 года (Каркинитский залив) и июне 2022 года (р-н Карадага).
Форонис был отмечен в пробах макрозообентоса, собранных в юго-западной части Азовского моря и практически на всей обследованной части шельфа Черного моря – на 76-ти из 291 выполненных станций (рис. 2). Он обнаружен на глубинах от 11 м до глубин, близких к предельным для обитания макрозообентоса в Черном море – 110 м.
Наиболее широко форонисы распространены на обширном шельфе северо-западной части Черного моря (СЗЧМ). Показатели его встречаемости и плотности поселений в этом районе различались на разных глубинах (рис. 3). Наибольшие средние значения плотности отмечены на глубине 20–39 м, с её увеличением плотность уменьшалась. Однако, встречаемость форониса на указанной глубине была ниже, чем на 80–99 м. Максимальная численность форониса (1828 экз./м2) отмечена в Каркинитском заливе на глубине 35 м.
Форонис предпочитает илистый грунт. Из всех станций, на которых он был обнаружен, на 48,6 % отмечен илистый грунт, на 38,9 % – заиленный ракушечник, на 11,1 % – заиленный песок и на 1,4 % станций – песок с ракушечником (см. табл. 1).
Phoronis cf. psammophila в пелагиали. В планктонных пробах, собранных у черноморского побережья Крыма, обнаружены личинки форонид – актинотрохи Phoronis. Личинки встречались на разных стадиях развития (рис. 1 d, e). Размеры наиболее мелких личинок составляли 168–200 мкм, они имели шесть коротких щупалец, прозрачное тело с просвечивающимся кишечником и черными пигментными пятнами. Максимальный размер личинок, обнаруженных в планктоне и находящихся на более поздних стадиях развития, достигал 750 мкм. Эти актинотрохи имели более длинные щупальца, их число не превышало
- Тело прозрачное, в полости тела просматривались органы пищеварения. По всему телу
212
Распространение Phoronis в биоценозах Черного и Азовского морей
![]()
хорошо заметны черные пигментные пятна, у основания щупалец – яркая оранжевая пигментация.
Исследования меропланктона в разных районах Крымского побережья в период 2010– 2022 годы (см. рис. 2) показали следующее. В юго-западной части (акватория Севастополя – от Качи до Балаклавы) актинотрохи Phoronis встречались в планктоне в единичных экземплярах. Их максимальная численность (9 экз./м3) отмечена в мае 2011 года на внешнем рейде Севастопольской бухты, где глубина составляет 10–13 м. У южного берега Крыма (акватории поселков Кацивели и Никита) за трехлетний период круглогодичного отбора проб личинки форонид зарегистрированы не были. В юго-восточной части у берегов Карадага, как
- в юго-западной части Крыма, актинотрохи Phoronis в летний период встречались постоянно, но их численность не превышала 7 экз./м3.
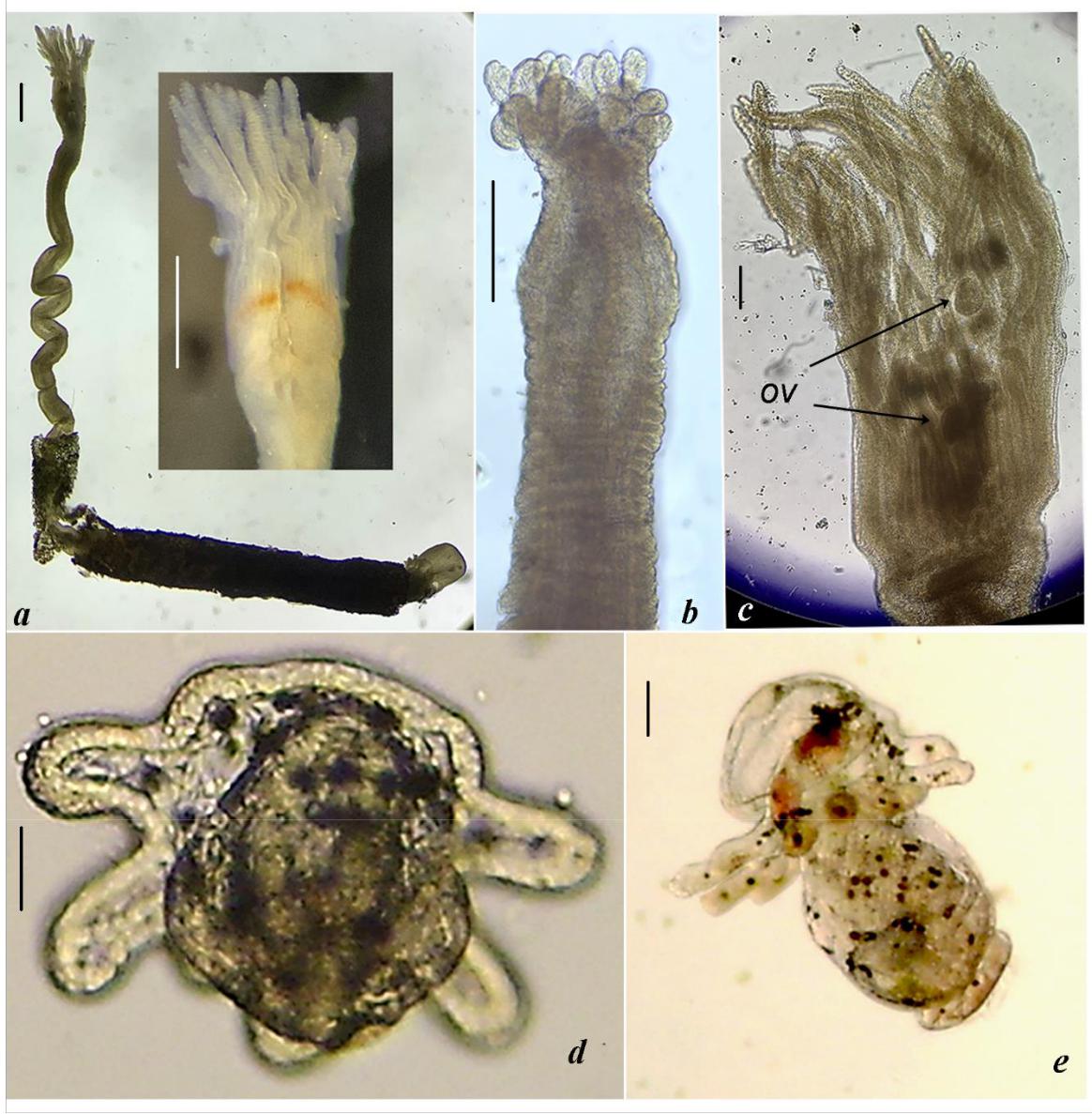
Рис. 1. Phoronis cf. psammophila
a – общий вид с частью трубки и лофофор; b – передний конец особи на стадии регенерации; c – лофофор со скоплением яиц (ov) среди щупалец. Актинотроха Phoronis на разных стадиях развития: d – личинка с 6 щупальцами; e – личинка с 14 щупальцами. Мерная линейка: a, b – 40 мкм, c, е –
- мкм; d – 50 мкм.
213
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
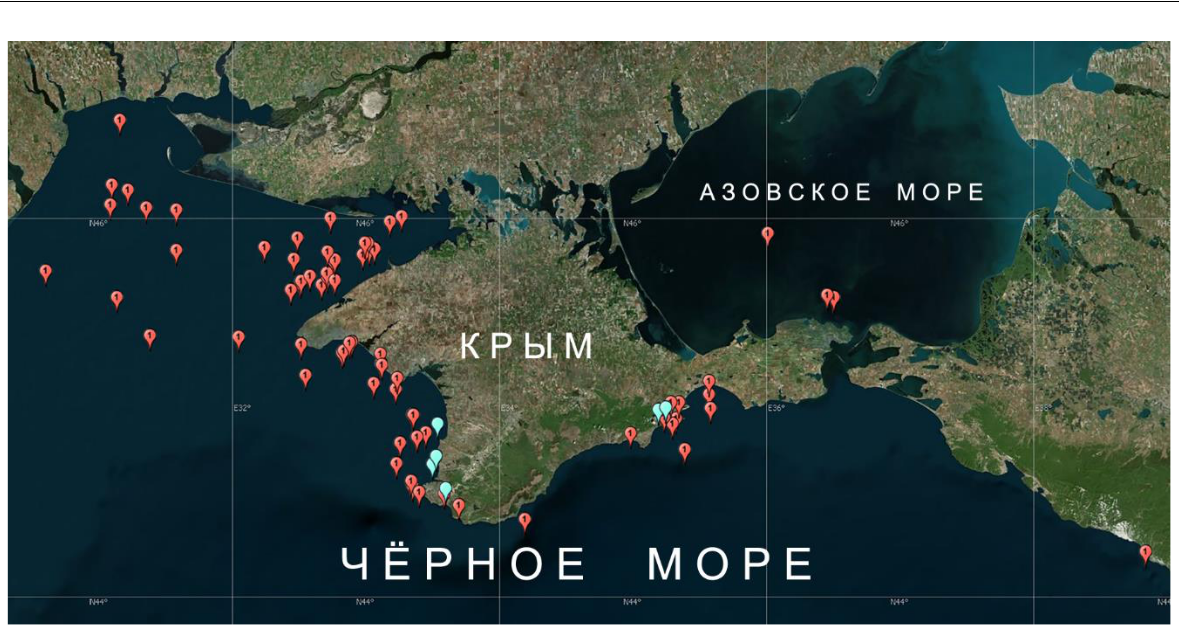
Рис. 2. Карта-схема мест обнаружения в Азово-Черноморском бассейне Phoronis cf. psammophila в бентосе (красные метки) и актинотрох Phoronis в планктоне (голубые метки)
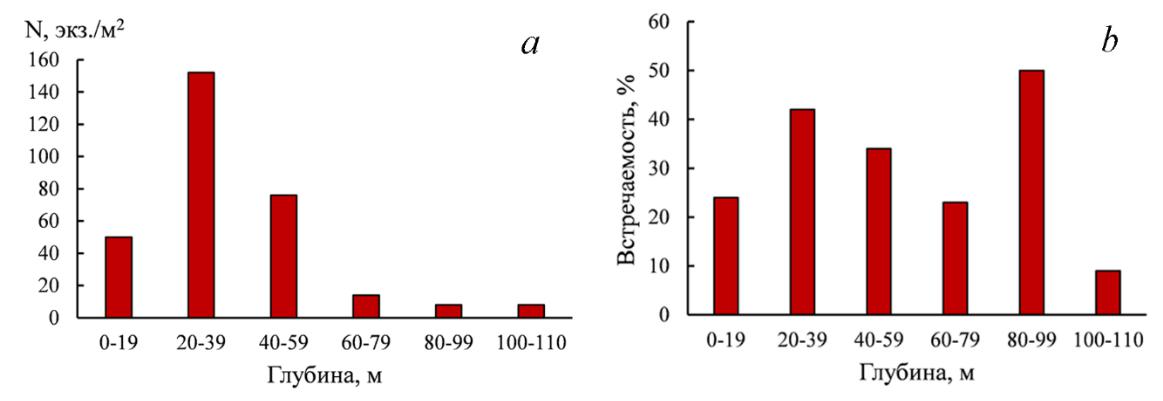
Рис. 3. Плотность (a) и встречаемость (b) Phoronis cf. psammophila на разных глубинах
-
- северо-западной части Черного моря
- целом, актинотрохи Phoronis были зарегистрированы в планктоне с мая по октябрь. Сроки появления личинок существенно зависели от температуры воды. Актинотрохи появлялись в планктоне при прогреве воды до 17,6 С, и встречались на 25 % выполненных при данных температурных условиях станциях. По мере возрастания температуры воды увеличивалась и встречаемость личинок – до 61,5 % в температурном диапазоне 20–21,9 С. За весь период наблюдений при температуре воды ниже 17 С и выше 25,6 С личинки зарегистрированы не были (рис. 4).
Phoronis cf. psammophila в фаунистических комплексах и биоценозах. Общий список видов, отмеченных в пробах совместно с форонисом довольно обширен. Он включает 208 видов, представляющих практически все таксоны в ранге типа, обычные для черноморской фауны: Annelida (58 видов Polychaeta и не идентифицированные до вида представители
Oligochaeta), Arthropoda (49 видов), Mollusca (66), Bryozoa (8), Cnidaria (12), Echinodermata (3), Chordata (8). Представители Nemertea, Plathelmintes, Porifera до вида не идентифицированы.
214
Распространение Phoronis в биоценозах Черного и Азовского морей
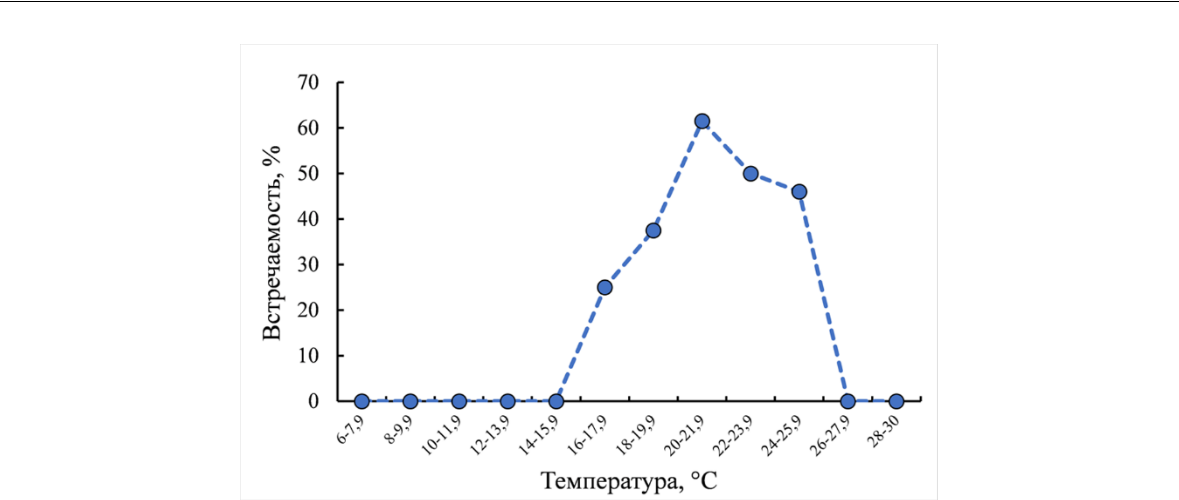
Рис. 4. Встречаемость актинотрох Phoronis при различной температуре воды в районе Севастополя в период 2010–2022 годы
По результатам иерархической кластеризации станций выделены два крупных фаунистических комплекса – кластеры станций А и В (представлены соответственно 30 и 29 станциями), два малочисленными комплекса – кластеры С и D (соответственно 9 и 3 станции) и одна маргинальная станция – обозначена как E (рис. 5 a, b).
Комплексы A, B, C и E – описывают фаунистическую привязку обитания форониса на шельфе Черного моря, комплекс D – на юго-западном участке Азовского моря. Станции комплекса B расположены в относительно глубоководной зоне (средняя глубина – 68 м) Крымского шельфа. Станции остальных фаунистических комплексов относительно мелководны, со средними глубинами: A – 28 м, C – 26 м, D – 11 м, E – 18 м (рис. 6).
По доминирующим видам, оцененным по их вкладу во внутрикомплексное сходство (программа Simper) на основе нетрансформированных значений биомасс выделенные черноморские комплексы можно обозначить как: A – Pitar rudis, B – Terebellides stroemi,
- – Mytilus galloprovincialis (табл. 2). Комплекс E, отмеченный нами на одной станции, по доминирующему по биомассе виду может быть обозначен как Gouldia minima. Комплекс D, выделенный для станций Азовского моря, характеризовался доминированием Anadara kagoshimensis.
Выделяя биоценозы в районах обитания форониса с использованием метода В. П. Воробьева (1949) – по биомассе доминирующего вида – приходим к следующим выводам. Станции, на которых был встречен форонис, в 34 % случаев относились к биоценозу Mytilus galloprovincialis, в 18 % случаев – к биоценозу Pitar rudis, в 15 % – к биоценозу Terebellides stroemi. Средняя глубина в указанных биоценозах составляла 40, 27 и 72 м соответственно. На 4 % станций отмечено численное доминирование Melinna palmata Grube, 1870, на отдельных станциях доминировали Nephtys hombergii, Gouldia minima (Montagu, 1803), Chamelea gallina (Linnaeus, 1758), Papillicardium papillosum (Poli, 1791), Tritia reticulata, Ciona intestinalis (Linnaeus, 1767).
Наибольшая средняя плотность форониса (104±79 экз./м2) зарегистрирована в биоценозе Mytilus galloprovincialis. В биоценозах Pitar rudis и Terebellides stroemi она составляла 73±29
- 52±34 экз./м2 соответственно. В Азовском море на всех станциях на глубине 10–12 м зарегистрирован биоценоз Anadara kagoshimensis. Плотность форониса составляла 2– 20 экз./м2.
Из многощетинковых червей в биоценозе Mytilus galloprovincialis по численности преобладали Prionospio cirrifera Wirén, 1883 (средняя плотность 864 экз./м2), Melinna palmata
(средняя плотность 4266 экз./м2), Nephtys hombergii (средняя плотность 161 экз./м2). На отдельных станциях доминировали Aricidea (Strelzovia) claudiae Laubier, 1967, Heteromastus
215
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
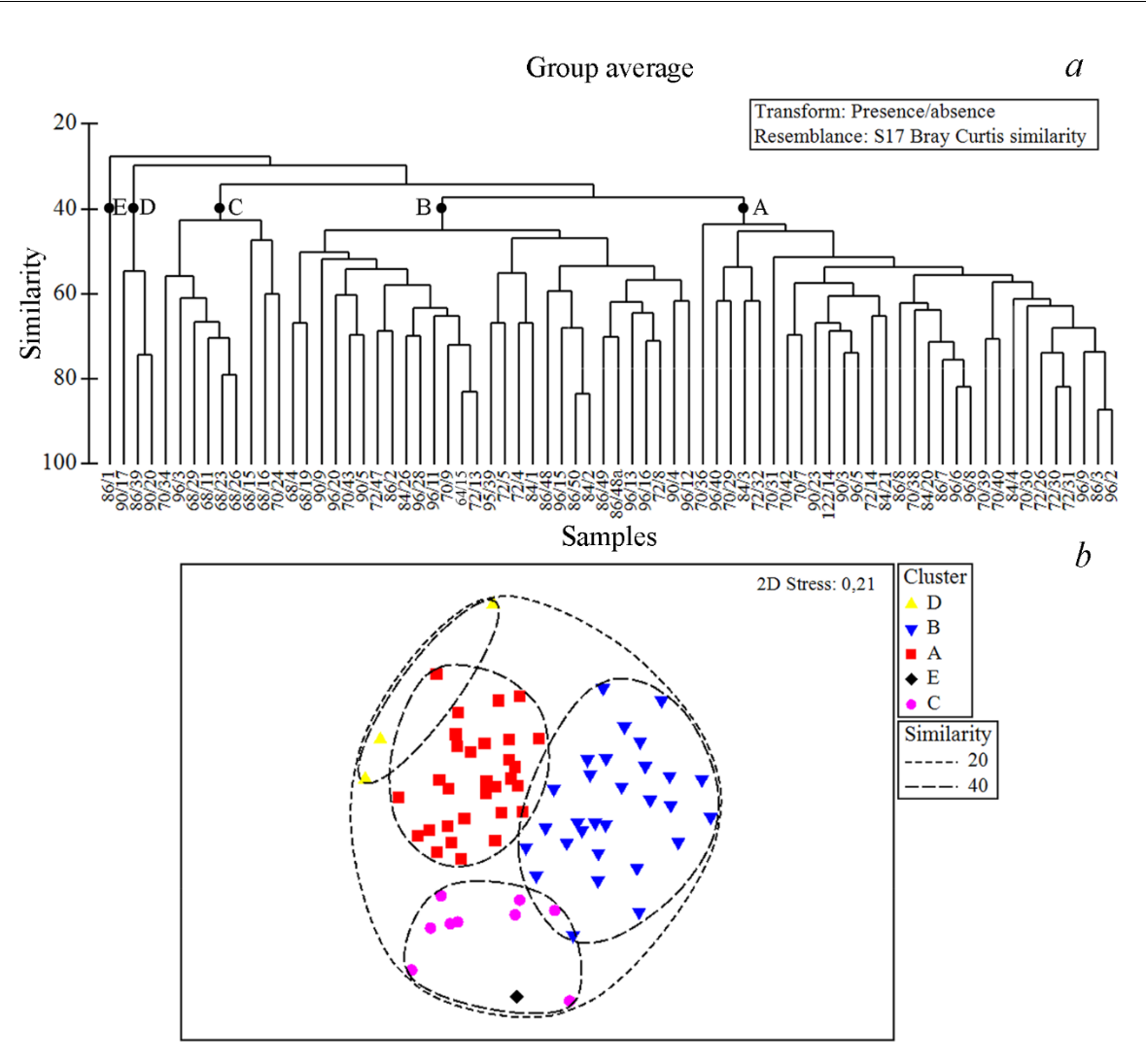
Рис. 5. Иерархическая кластеризация (a) и ординация станций (b), на которых обнаружен форонис
В дендрограмме указаны номера рейсов и станций.
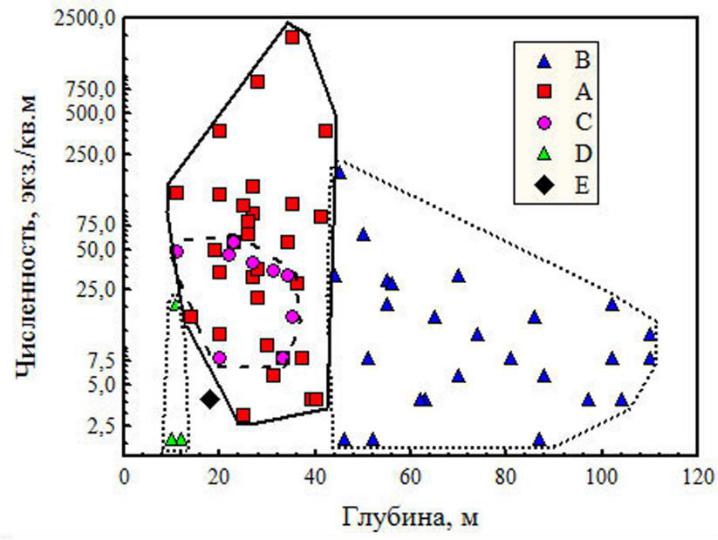
Рис. 6. Ординация численности форониса и его фаунистических комплексов по глубине
216
Распространение Phoronis в биоценозах Черного и Азовского морей
![]()
Таблица 2
Наиболее значимые виды в фаунистических комплексах, выделенных на основе процедуры
многомерного анализа данных, и позиция в этих комплексах Phoronis cf. psammophila
| Кластеры | Виды-лидеры по вкладу во | Виды-лидеры по средней биомассе, | |
| станций | внутрикомплексное сходство станций, % | г/м2 | |
| Pitar rudis (Poli, 1795) – 42,59 | Mytilus galloprovincialis (Linnaeus, | ||
| Nephtys hombergii Savigny in Lamarck, 1818 – | 1758) – 86,03 | ||
| A | 18,05 | Pitar rudis – 26,83 | |
| Tritia reticulata (Linnaeus, 1758) – 9,43 | Tritia reticulata – 11,19 | ||
| (P. cf. psammophila – 0,3/19) | (P. cf. psammophila – 0,61/17) | ||
| Terebellides stroemi Sars, 1835 – 37,72 | Mytilus galloprovincialis – 91,65 | ||
| Modiolula phaseolina (R. A. Philippi, | |||
| Mytilus galloprovincialis – 23,11 | |||
| B | 1844) – 4,31 | ||
| Nephtys hombergii – 18,35 | |||
| Terebellides stroemi – 4,07 | |||
| (P. cf. psammophila – 0,24/16) | |||
| (P. cf. psammophila – 0,02/36) | |||
| Mytilus galloprovincialis – 91,7 | Mytilus galloprovincialis – 181,63 | ||
| Ascidiella aspersa – 14,56 | |||
| Mytilaster lineatus (Gmelin, 1791) – 2,99 | |||
| C | Polititapes aureus (Gmelin, 1791) – | ||
| Ascidiella aspersa (Müller, 1776) – 1,86 | |||
| 8,84 | |||
| (P. cf. psammophila – 0,04/22) | |||
| (P. cf. psammophila – 0,04/32) | |||
| Anadara kagoshimensis (Tokunaga, 1906) – | Anadara kagoshimensis – 246,69 | ||
| 89,48 | |||
| Nephtys hombergii – 13,56 | |||
| D | Nephtys hombergii – 6,00 | ||
| Amphibalanus improvisus – 6,19 | |||
| Amphibalanus improvisus (Darwin, 1854) – 4,41 | |||
| (P. cf. psammophila – 0,01/9) | |||
| (P. cf. psammophila – 0,01/7) | |||
Примечание к таблице. Для форониса после черты показана позиция в ранжированном ряду видов.
filiformis (Claparède, 1864), Aonides paucibranchiata Southern, 1914, Dipolydora quadrilobata (Jacobi, 1883). В биоценозе Pitar rudis численное преимущество было у Aricidea claudiae (средняя плотность 583 экз./м2), также доминировали Nephtys hombergii, Heteromastus filiformis, Prionospio cirrifera. В биоценозе Terebellides stroemii помимо самого доминанта среди полихет преобладали те же виды – Nephtys hombergii, Aricidea claudiae, Melinna palmata. Среди субдоминантов на отдельных станциях отмечены также Eunereis longissima (Johnston, 1840) и Micronephthys longicornis (Perejaslavtseva, 1891) (на илистых грунтах), Sabellaria taurica (Rathke, 1837) и Lagis neapolitana (Claparède, 1869) (на песках) и Sigambra tentaculata (Treadwell, 1941) (на заиленных ракушечниках). В Азовском море в биоценозе Anadara kagoshimensis отмечено доминирование Nephtys hombergii, Polydora cornuta Bosc, 1802, Streblospio gynobranchiata Rice & Levin, 1998.
ОБСУЖДЕНИЕ
-
- трех видов форонид, когда-либо указанных для Черного моря, имеются определенные морфологические и экологические особенности. Все собранные в период нашего исследования форонисы обнаружены на заиленных рыхлых грунтах. При изучении фауны жестких субстратов Крымского прибрежья представители форонид зарегистрированы не были (Болтачева и др., 2015). В то же время, для румынского побережья Черного моря приведен вид Phoronis hippocrepia (Băcescu et al., 1971; Emig et al., 2003), который является перфоратором, обитает на камнях, раковинах моллюсков (Emig, 1982). В период размножения
- P. hippocrepia образуются два скопления эмбрионов в лофофоральной полости (Emig, 1979). У обнаруженных нами особей отмечено одно скопление эмбрионов, что характерно для P. psammophila (Темерева, Малахов, 2009). У третьего вида, фигурирующего в списках видов форонид Черного моря – Phoronis muelleri – при размножении яйца свободно выметываются в воду, скопления эмбрионов в лофофоре не образуются (Emig, 1982; Temereva, Malakhov, 2012). Кроме этого, данный вид характеризуется различной длиной щупалец лофофора, тогда
217
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
![]()
как у P. psammophila все щупальца одинаковой длины (Emig, 1979). У всех проанализированных нами экземпляров щупальца были равной длины. Мы не проводили гистологических исследований, необходимых для корректной идентификации форонисов, однако, учитывая перечисленные выше морфологические и экологические особенности, обнаруженные нами экземпляры соответствуют лишь одному из трех, указанных для Черного моря видов, и мы полагаем, что это – P. cf. psammophila.
Сравнивая полученные нами данные с описанием P. psammophila, можно отметить ряд морфометрических особенностей. Для данного вида указаны следующие размеры тела: длина – до 80–190 мм, диаметр – 0,5–2 мм, длина щупалец 1,5–2,5 мм (Emig, 1979; Темерева 2017). Черноморские экземпляры более мелкие: длина тела – до 16 мм, диаметр – 0,25– 0,75 мм, длина щупалец – 0,25–1,65 мм. Отчасти это может быть связано с методами фиксации, так как известно, что при фиксировании длина тела форонисов уменьшается в 2– 2,5 раза (Selys-Longchamps, 1907). Возможно, меньшие размеры P. psammophila в Черном море по сравнению с другими морями связаны с пониженной соленостью воды в Азово-Черноморском бассейне (14–18 ‰). Количество щупалец также отличается – черноморские экземпляры имели 33–60, для P. psammophila из других морей указано 60–190 щупалец (Emig, 1979; Темерева, 2017). Форониды, обнаруженные Е. Н. Темеревой (2020) у Кавказского побережья Черного моря и определенные ею как P. psammophila, также имели морфологические признаки (длина тела 8–10 мм и диаметр 0,16–0,3 мм, число щупалец 40, строение лофофофра), отличающие их от типичных представителей вида. Автор предположила, что это были молодые (возможно, недавно метаморфизировавшие) экземпляры. В наших сборах были обнаружены половозрелые особи, имеющию в лофофорах скопления эмбрионов, поэтому можно допустить, что половозрелость у данного вида в Черном море наступает при довольно маленьких размерах тела – от 6,5 мм и более.
Известно, что в Средиземном море (залив Марселя) форонисы P. psammophila со зрелыми гонадами встречаются в весенне-летний период, а их максимальная встречаемость в 1970 году (70–80 %) отмечена в июне-июле (Emig, 1982). О размножении форонисов можно судить по наличию их личинок в планктоне. Известно, что актинотрох Phoronis в Черном море отмечали
- 1902–1912 годы ежегодно в мае – августе (Зернов, 1904, 1913). В различных участках СЗЧМ,
- том числе в Каркинитском заливе и Придунайском районе, актинотрохи Phoronis были отмечены в небольших количествах в летние сезоны 1930-х и 1973–2003 годы (Галаджиев, 1948; Северо-западная часть…, 2006). В сентябре–октябре 1984 года актинотрохи форониса были обнаружены в юго–западной части Черного моря (Прибосфорский район) (Мурина, Казанкова, 1987). В западной части Каркинитского залива в 1932 году максимальная численность актинотрох (Actinotrocha metschnikoffi) – 25 экз./м3 – была отмечена в августе (Галаджиев, 1948). В августе 2011 года актинотрохи были обнаружены в планктоне Феодосийского и Каркинитского заливов, где их численность достигала соответственно 11 и 63 экз./м3 (устное сообщение Ю. А. Загородней). В наших материалах численность личинок форониса у западных и восточных берегов Крыма не превышала 7 экз./м3. Они встречались в планктоне с мая по октябрь, с максимальной плотностью в июне – июле. Температурный диапазон нахождения в планктоне личинок форониса – 17,6–25,6 С, максимальная встречаемость актинотрох (61,5 %) отмечена при температуре воды 20–21,9 С.
- начала 20-го века и до 60-х годов представителей Phoronis в бентосе Черного моря находили в единичных экземплярах и считали достаточно редкими (Зернов, 1913; Прокудина, 1952; Киселева, Славина, 1966; Киселева, 1968; Bacescu et al., 1971). Они были отмечены в бентосе у берегов Румынии (Băcescu et al., 1971), в Одесском регионе (Северо-западная часть…, 2006), Севастопольской бухте (Зернов, 1913), у берегов юго-восточного Крыма (район Карадага) (Прокудина, 1952), у берегов Кавказа в районе Анапы (Миловидова, 1967), Туапсе и от Адлера до Батуми (Киселева, Славина, 1966; архивн. данные). Их относили либо к Phoronis euxinicola (Киселева, Славина, 1966; Миловидова, 1967; Киселева, 1968; Маринов, 1990; Северо-западная часть…, 2006), либо к Phoronis sp. (Прокудина, 1952; Киселева, 1981, 1985; Золотарев, Повчун, 1986). Для побережья Болгарии в этот период они не были известны
218
Распространение Phoronis в биоценозах Черного и Азовского морей
![]()
(Вълканов, 1957). Следует отметить, что в сводном списке видов беспозвоночных СЗЧМ указано, что к 1960-м годам в этом районе были отмечены лишь актинотрохи, находки взрослого форониса были известны лишь южнее острова Змеиный в румынских водах (Виноградов и др., 1967). В этот же период у западных берегов Крыма данный вид тоже не был отмечен (Киселева, Славина, 1964).
Результаты исследований зообентоса в 1980-х годах показали широкое распространение Phoronida в Черном море. Форонисы были обнаружены у южного берега Крыма в Ялтинском заливе, где их средняя плотность достигала 190 экз./м2 (Киселева, 1985). Вид стал массовым
- Болгарского побережья, его численность достигала 450 экз./м2 (Маринов, 1990). В 1979– 1989 годы было отмечено широкое распространение форониса и в СЗЧМ, где он входил в состав многих биоценозов, причем, в некоторых его средняя плотность достигала 216–236 экз./м2 (Золотарев, Повчун, 1986; Повчун, 1990; Золотарев, 1994). Форонисов из этих сборов C. C. Emig определил как P. psammophila (Повчун, 1987, 1990; Золотарев, 1994; Emig et al., 2003). Указанное увеличение численности и более широкое распространение форонисов могло быть связано с повышением эвтрофирования вод Черного моря в тот период. Ответной реакцией экосистем бентали на органическое обогащение придонных вод (при условии их хорошей аэрации) явилось увеличение численности и биомассы бентоса и, в особенности, видов-фильтраторов (Ревков, 2011; Болтачева, Заика, 2018), к которым и относятся форониды. В СЗЧМ этот процесс проявился наиболее ярко, к тому же в этом регионе было отмечено заиление обширных площадей дна вследствие донного тралового промысла (Самышев, Золотарев, 2018), что, возможно, способствовало формированию благоприятного субстрата для распространения форониса.
Исследования в начале 21 века расширили сведения об ареале P. psammophila в Черном море. Вид был отмечен в турецких водах у Трапезунда (Emig et al., 2003), в озере Донузлав (Западный Крым) (Болтачева и др., 2002; Ревков и др., 2021), в Керченском проливе и прибрежье Керченского полуострова (Терентьев, 2001; Терентьев, Колесников, 2021). По устному сообщению С. В. Алёмова, в 2009 году в Керченском проливе (район острова Тузла)
плотность поселений форониса достигала 563 экз./м2. Было подтверждено наличие P. psammophila в донных биоценозах у кавказского побережья (Темерева, 2017, 2020). Форонисов по-прежнему находили у берегов Болгарии, но авторы относили их к несуществующему (не валидному) виду P. euxinicola (Stoykov, Uzunova, 2001; Petrova, Stoykov, 2013).
Наши исследования подтвердили широкое распространение форониса – от берегов Румынии до Кавказского побережья. При этом, новыми стали сведения о его обитании у западных берегов Крыма – от Севастополя до мыса Тарханкут. Форонис впервые был отмечен
- юго-западной части Азовского моря, что явилось следствием повышения его солености с соотвествующими элементами понтизации фауны (Болтачева и др., 2022).
P. psammophila – космополит, тропическо-низкобореальный вид, широко распространенный в Тихом, Атлантическом и Индийском океанах, в Средиземном море у побережья Испании, Италии, Турции, Греции, Кипра (Emig et al., 2003; Темерева, 2017; Emig, de Mittelwihr, 2023). Вид является мелководным, в Средиземном море его находки ограничены глубинами 0,5–69 м (Emig et al., 2003). В северо-западной части Черного моря P. psammophila был зарегистрирован на глубинах до 89 м (Самышев, Золотарев, 2018). В материалах из рейсов НИС «Профессор Водяницкий» форонисы обнаружены в диапазоне глубин 11–110 м, при этом глубоководные находки сконцентрированы в районе юго-западного Крыма. У Кавказского побережья вид обнаружен на глубине 95 м. На небольшой глубине (2–10 м) форонисы обнаружены в районе Севастополя – в Севастопольской, Балаклавской (наши неопубликованные данные), Камышовой (устное сообщение С. В. Алёмова) бухтах и в озере Донузлав (Ревков и др., 2021).
P. psammophila – эвритермный вид, в Средиземном море отмечен в диапазоне температур от 0 до 28 °С (Emig, 1966). В районах обнаружения форониса в Черном море температура поверхностного слоя вод меняется от 0 °С в зимний сезон до 28–29 С в летний, на глубине 35–40 м температура колеблется от 8 до 13 °С, глубже 50–55 м залегает квазиоднородный
219
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
![]()
слой с температурой воды около 8 °С (Иванов, Белокопытов, 2011). То, что форонисы распространены не только на малых глубинах, но и на глубине 50–110 м при постоянной низкой температуре, позволяет предположить, что здесь они находятся в зоне выселения, так как размножение этого вида при такой температуре не происходит. P. psammophila обитает при солености от 18,0 (Черное море) до 38,5 ‰ (Средиземное море) (Emig et al., 2003). Нами
- Азовском море форонисы обнаружены и при солености 12,53–14,39 ‰ (Болтачева и др.,
2022).
Считается, что P. psammophila предпочитает мелкозернистые, иногда заиленные пески (Темерева, 2017). Именно на песках отмечена наибольшая плотность этого вида – 18000 экз./м2, однако он встречается и на илистых грунтах, ракушечнике, в зарослях морских трав
Zostera, Posidonia, Cymodocea (Emig, 1982; Emig et al., 2003). Показано, что содержание Сорг в некоторой степени влияет на численность P. psammophila (Emig, 1966). По нашим данным на черноморском шельфе форонис обитает преимущественно на илистых или сильно заиленных грунтах. Лишь на 11,1 % станций, где был обнаружен форонис, грунты были представлены слабо заиленным песком. Его наибольшая плотность – 1828 экз./м2 – отмечена в западной части Каркинитского залива на илистом с примесью крупного ракушечника грунте (глубина 35 м). В Севастопольской и Балаклавской бухтах форонис также обнаружен на илистых грунтах, в ряде случаев, имеющих признаки сероводородного заражения (наши неопубликованные данные). В Донузлаве форонис найден на устричниках, а также в зарослях харовых водорослей Lamprothamnium papulosum (K. Wallroth) J. Groves, 1916 (Болтачева и др., 2002; Ревков и др., 2021). У Турецкого побережья Черного моря P. psammophila отмечен в зарослях Cymodocea nodosa (Ucria) Ascherson, 1870 (Emig et al., 2003). Анализ распределения форониса в Одесском регионе (СЗЧМ) показал, что на илистых грунтах его встречаемость составляет 39,6 %, на ракушечнике – 2,9 %, на чистых песках вид не был зарегистрирован (Воробьева и др., 2017).
-
- настоящее время форонис в Черном море стал массовым видом и входит в состав различных биоценозов. Его обнаружение в диапазоне глубин 11–110 м, охватывающем практически всю обитаемую для макрозообентоса зону черноморской бентали, свидетельствует о широкой экологической валентности данного вида и возможности вхождения в различные локальные и поясные донные биоценозы, формирующие вертикальную структуру черноморской бентали. Результаты оценки вхождения форониса в различные биоценотические комплексы/биоценозы бентали с помощью методов многомерной статистики и методом Воробьёва оказались в определённой мере сходными. Как
- первом, так и во втором случае мы имеем дело с одними и теми же наиболее значимыми ценозообразующими видами: Pitar rudis, Terebellides stroemi и Mytilus galloprovincialis.
Однако, каждый из обозначенных комплексов/биоценозов представлен разным количеством формирующих их станций. Так комплекс и биоценоз Pitar rudis образованы соответственно
30 и 13, Terebellides stroemi – 29 и 11, Mytilus galloprovincialis – 9 и 23 станциями из их общего массива. Методическая суть различия указанных двух методов заключается в том, что в первом (основан на методах многомерной статистики) за основу берётся сходство станций по набору обнаруженных на них видов, а затем определяется вид, который может претендовать на роль лидера выделенной группировки. По второму методу станцию напрямую относят к определенному биоценозу по доминирующему на ней по биомассе виду. Приведенные нами краткие пояснения указывают на важность учета методических подходов при сравнительном анализе материалов, получаемых разными исследователями.
-
- СЗЧМ в 1979–1989 годы P. psammophila чаще всего встречался на илистых и ракушковых грунтах в биоценозе мидии (Самышев, Золотарев, 2018). Интересно, что весной 1982 года здесь на месте подвергшегося замору биоценоза мидии возник временный биоценоз P. psammophila, в котором форонис был видом, доминирующим как по численности, так и по сырой массе (Самышев, Золотарев, 2018). У южного берега Крыма (прибрежье Ялты) в биоценозе мидии средняя плотность форониса достигала 190 экз./м2 (Киселева, 1985). Довольно часто этот вид встречался в биоценозе Terebellides stroemi, характерном для илистых грунтов на глубине более 40 м. Высокую встречаемость форониса (до 40 %) в этом
220
Распространение Phoronis в биоценозах Черного и Азовского морей
![]()
биоценозе указывали и ранее (Повчун, 1990; Самышев, Золотарев, 2018). Форонис характерен для биоценозов Melinna palmata и Nephtys hombergii, также приуроченных к илистым грунтам.
- 80-х годах 20-го века встречаемость данного вида в указанных биоценозах составляла 100 и 67 % соответственно (Самышев, Золотарев, 2018). В Каркинитском заливе в течение ряда лет выделяли биоценоз Abra nitida, в котором отмечали высокие значения численности (216 экз./м2) и встречаемости (100 %) форониса (Золотарев, Повчун, 1986; Самышев, Золотарев, 2018). Форонис обнаружен в этом биоценозе в Каркинитском заливе и нами. Как и в исследованиях прошлых лет (Киселева, Славина, 1966; Миловидова, 1967; Терентьев, 2001; Самышев, Золотарев, 2018), так и в настоящее время он зарегистрирован в биоценозах Chamelea gallina и Gouldia minima. У берегов юго-восточного Крыма форонис впервые отмечен нами в характерном для данного района биоценозе Pitar rudis.
Кроме перечисленных выше видов полихет-доминантов Melinna palmata, Terebellides stroemi, Nephtys hombergii, форонисы часто встречались совместно с Prionospio cirrifera, Heteromastus filiformis, Aricidea claudiae, Dipolydora quadrilobata. Все эти полихеты являются обитателями илистых или сильно заиленных грунтов.
ЗАКЛЮЧЕНИЕ
На основании анализа эколого-морфологических особенностей форонисов можно прийти к выводу, что обнаруженные нами экземпляры соответствуют виду P. cf. psammophila, однако, отмечены некоторые отличия от типичных представителей вида. Черноморские экземпляры гораздо более мелкие: длина тела – до 16 мм, диаметр – 0,25–0,75 мм, длина щупалец – 0,25– 1,65 мм. Количество щупалец также отличается – черноморские экземпляры имели 33–60, а для P. psammophila из других морей указано 60–190 щупалец. Отмечены половозрелые особи
- длиной тела от 6,5 мм. Актинотрохи Phoronis встречались в планктоне с мая по октябрь в диапазоне температур 17,6–25,6 °С. Максимальная встречаемость личинок (61,5 %) зарегистрирована при температуре воды 20–21,9 °С.
- настоящее время P. cf. psammophila широко распространен в Черном море – от берегов Румынии до кавказского побережья в диапазоне глубин 2–110 м. Нами впервые этот вид отмечен в Азовском море при более низкой, чем в Черном море солености (12,53–14,39 ‰). В Азово-Черноморском бассейне форонис обитает преимущественно на илистых или сильно заиленных грунтах. Его наибольшая плотность – 1828 экз./м2 – отмечена в западной части Каркинитского залива на заиленном крупном ракушечнике на глубине 35 м. В Черном море основными биоценозами обитания форониса являются Mytilus galloprovincialis, Pitar rudis и Terebellides stroemi, в Азовском море – биоценоз Anadara kagoshimensis.
Благодарности. Выражаем благодарность за помощь в сборе материала научным сотрудникам ИнБЮМ Д. В. Подзоровой, С. В. Щурову, О. А. Трощенко.
Работа выполнена в рамках государственного задания ФИЦ ИнБЮМ по темам: «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана» (№ гос. регистрации 121030100028-0) и «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» (№ гос. регистрации 121030300149-0).
Список литературы
Болтачева Н. А., Колесникова Е. А., Ревков Н. К. Фауна макрозообентоса лимана Донузлав (Черное море) // Экология моря. – 2002. – Вып. 62. – С. 10–15.
Болтачeва Н. А., Ковалeва М. А., Макаров М. В., Бондаренко Л. В. Многолетние изменения макрофауны скал в зоне верхней сублиторали у Карадага (Чёрное море) // 100 лет Карадагской научной станции им. Т. И. Вяземского: сб. науч. тр. / [Ред. А. В. Гаевская, А. Л. Морозова]. – Симферополь, 2015. – С. 530–548.
221
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
![]()
Болтачева Н. А., Заика В. Е. Моллюски Chamelea gallina и Mytilus galloprovincialis верхней сублиторали:
многолетние изменения // Биология Черного моря у берегов Юго-Восточного Крыма / [Ред. Н. С. Костенко]. –
Симферополь: ИТ «АРИАЛ», 2018. – С. 87–96.
http://karadag.com.ru/static/media/images/books/nature_and_history/THE%20BIOLOGY%20OF%20THE%20BLACK
Болтачева Н. А., Ревков Н. К., Надольный А. А., Аннинская И. Н. Донная фауна юго-западной части Азовского моря. Таксономический состав и биоценотическая организация макрозообентоса в 2016–2017 гг. // Морской биологический журнал. – 2022. – T. 7, № 2. – С. 3–22. https://doi.org/10.21072/mbj.2022.07.2.01
Виноградов К. А., Лосовская Г. В., Каминская Л. Д. Краткий обзор видового состава беспозвоночных северо-западной части Черного моря (по систематическим группам) // Биология северо-западной части Черного моря. – Киев: Наукова думка, 1967. – С. 177–201.
Воробьев В. П. Бентос Азовского моря // Труды АзЧерНИРО. 1949. – Вып. 13. – 193 с.
Воробьева Л. В., Кулакова И. И., Синегуб И. А. и др. Одесский регион Черного моря: гидробиология
пелагиали и бентали / [Ред. Б. Г. Александров]. – Одесса: Астропринт, 2017. – 324 с.
Вълканов А. Каталог на нашата черноморска фауна // Трудове на Морската биологична станция. – 1957. – Т. 19. – С. 1–61. (на болгарском).
Галаджиев М. А. Сравнительный состав, распределение и количественные соотношения зоопланктона Каркинитского залива и открытого моря в районе южного берега Крыма // Труды Севастопольской биологической станции. – 1948. – Т. 6. – С. 173–223.
Зернов С. А. К вопросу о годичной смене планктона у Севастополя // Известия Императорской Академии Наук. – 1904. – Т. XX, № 4. – C. 119–134.
Зернов С. А. К вопросу об изучении жизни Черного моря // Записки Императорской Академии наук. – 1913. – Сер. 8. – Т. 32, № 1. – 299 с.
Золотарев П. Н. Структура биоценозов бентали Северо-Западной части Черного моря и ее трансформация под воздействием антропогенных факторов: автореф. дис. … канд. биол. наук: 03.00.10 Гидробиология. – Керчь: ЮГНИРО. – 1994. – 16 с.
Золотарев П. Н., Повчун А. С. Макрозообентос глубоководной части Каркинитского залива Черного моря // Экология моря. – 1986. – Вып. 22. – С. 48–57. https://repository.marine-research.ru/items/feefe725-527a-4b8f-ad13-e004444bd834
Иванов В. А., Белокопытов В. Н. Океанография Черного моря. – Севастополь: Морской гидрофизический институт, 2011. – 212 с.
Киселёва М. И. Класс форониды-Phoronoidea // Определитель фауны Чёрного и Азовского морей. Т. 1: Свободноживущие беспозвоночные: простейшие, губки, кишечнополостные, черви, щупальцевые. – Киев, 1968. – С. 418–420.
Киселева М. И. Бентос рыхлых грунтов Черного моря. – Киев: Наукова думка, 1981. – 165 с. https://repository.marine-research.ru/items/18a45e11-1f8b-4ddc-937d-42f68b777b42
Киселева М. И. Характеристика донных сообществ Ялтинского залива в разные сезоны 1979–82 гг. – Севастополь, 1985. – 31 с. – Деп. в ВИНИТИ 28.03.85, No 2165-85 Деп. https://rest.marine-research.ru/api/core/bitstreams/021b431b-8d8e-474c-be7a-acc058f60462/content
Киселёва М. И., Славина О. Я. Донные биоценозы у западного побережья Крыма // Труды Севастопольской биологической станции. – 1964. – Т. 15. – С. 152–177.
Киселёва М. И., Славина О. Я. Количественное распределение макробентоса у побережья Кавказа. // Распределение бентоса и биология донных животных в южных морях. – Киев: Наукова думка, 1966. – С. 55–74.
Маринов Т. М. Зообентосът от Блългарския сектор на Черно море. – София: Издателство на българската академия на науките, 1990. – 195 с. (на болгарском).
Миловидова Н. Ю. Донные биоценозы бухт северо-восточной части Черного моря // Донные биоценозы и биология бентосных организмов Черного моря. – Киев: Наукова думка, 1967. – С. 3 –17.
Мурина Г.-В. В., Казанкова И. И. Личинки донных беспозвоночных в планктоне Черного моря // Экология моря. – 1987. – Вып. 25. – С. 30–37.
Повчун А. С. Формирование сообщества черноморской мидии. Сообщение I // Экология моря. – 1987. – Вып. 27. – С. 18 – 27.
Повчун А. С. Изменения донных сообществ Каркинитского залива Черного моря за 50 лет // Гидробиологический журнал. – 1990. – Т. 26, № 5. – С. 20–27.
Повчун А. С. Изменения донных сообществ Каркинитского залива // Многолетние изменения зообентоса Черного моря / [Ред. Заика В. Е.]. – Ин-т биологии южных морей им. А. О. Ковалевского НАН Украины. – Киев: Наукова думка, 1992. – С. 105–137.
Прокудина Л. А. Каталог фауны и флоры Черного моря района Карадагской биологической станции // Труды Карадагской биологической станции. – 1952. – Вып. 12. – С. 116–126.
Ревков Н. К. Макрозообентос украинского шельфа Черного моря. Современное состояние зооресурсов бентали Азово-Черноморского бассейна. В книге: Промысловые биоресурсы Черного и Азовского морей / [Ред. В.
- Еремеев, А. В. Гаевская, Г. Е. Шульман, Ю. А. Загородняя]. – Севастополь: ЭКОСИ-Гидрофизика, 2011. – С. 140–162.
Ревков Н. К., Болтачева Н. А., Ревкова Т. Н., Бондаренко Л. В., Щуров С. В., Лукьянова Л. Ф. Донная фауна озера Донузлав (Черное море) в условиях промышленной добычи песка // Экосистемы. – 2021. – № 27. – С. 5–22.
222
Распространение Phoronis в биоценозах Черного и Азовского морей
![]()
Самышев Э. З., Золотарев П. Н. Механизмы антропогенного воздействия на бенталь и структуру донных биоценозов северо-западной части Черного моря. – Севастополь: ООО «Колорит», 2018. – 208 с. DOI:
10.21072/978-5-6042012-2-0 https://rest.marine-research.ru/api/core/bitstreams/4f277018-34d2-42a2-937e-f383c69fa9af/content
Северо-западная часть Черного моря: биология и экология / [Ред. Зайцев Ю. П., Александров Б. Г.,
Миничева Г. Г.]. – Киев: Наук. Думка, 2006. – 701 с.
Темерева Е. Н. Синопсис мировой фауны форонид (Phoronida). Научный доклад. – Москва, 2017. – 73 с. https://publications.hse.ru/mirror/pubs/share/direct/313103520?ysclid=lomkr8f0c9980666175
Темерева Е. Н. Форониды Черного моря // Сборник тезисов II Всероссийской научно-практической школы-конференции «Наземные и морские экосистемы Причерноморья и их охрана» 28 сентября – 02 октября 2020 г. Карадагская научная станция им. Т. И. Вяземского – природный заповедник РАН Республика Крым, пгт. Курортное. – 2020. – С. 245–247.
Темерева Е. Н., Малахов В. В. Развитие форонид (Phoronida, Lophophorata) // Ученые записки Казанского Государственного университета. – 2009. – Т. 151, кн. 2. – Естественные науки. – С. 8–33.
Терентьев А. С. Биоценоз Chamelea на шельфе Опукского природного заповедника // Заповедники Крыма на рубеже тысячелетий. – Симферополь, 2001. – С. 115–117.
Терентьев А. С. Колесников М. В. Донные сообщества Керченского пролива Черного моря // Труды ГОИН. – 2021. – Вып. 222. – С. 251–270.
Băcescu M., Müller G. I. & Gomoiu M. T. Foronide. In: Ecologia Marine – cercetari de ecologie bentala in Marea Neagra // Editions de l’Académie de la République Socialiste de Roumanie, 1971. – Vol. 4. – P. 241 (357 pp.) (in Roumanian).
Bray J. R., Curtis J. T. An ordinzation of the upland forest communities of South Wiskonsin // Ecol. Monogr. – 1957. – Vol. 27. – P. 325–347.
Çinar M. E. Checklist of the phyla Platyhelminthes, Xenacoelomorpha, Nematoda, Acanthocephala, Myxozoa, Tardigrada, Cephalorhyncha, Nemertea, Echiura, Brachiopoda, Phoronida, Chaetognatha, and Chordata (Tunicata, Cephalochordata, and Hemichordata) from the coasts of Turkey // Turkish Journal of Zoology. – 2014. – Vol. 38. – P. 698– 722.
Clarke K. R. Non-parametric multivariate analyses of changes in community structure // Australian Journal of Ecology. – 1993. – Vol. 18. – P. 117–143.
Clarke K. R., Gorley R. M. PRIMER v5: User Manual. – Tutorial. Primer–E: Plymoith. – 2001. – 92 p.
Emig C. C. Anatomie et écologie de Phoronis psammophila Cori (Golfe de Marseille; Etang de Berre) // Recueil Des De La Travaux Station Marine D’endoume. – 1966. – Vol. 40. – P. 161–248.
Emig C. C. British and other Phoronids: Synopses of the British Fauna // Academic Press: New York, 1979. – N 13. – 57 pp.
Emig C. C. The biology of Phoronida // Advances in Marine Biology. – 1982. – Vol. 19. – P. 1–89.
Emig C. C., Çinar M. E., Ergen Z. Phoronida from the Eastern Mediterranean and Black Sea // Cahiers de Biologie Marine. – 2003. – Vol. 44 (2). – P. 185–190.
Emig C. C., de Mittelwihr C. Phoronid@. Phoronida Database 2023. Available at 10.03.2023. http://paleopolis.rediris.es/Phoronida/
Petrova E., Stoykov S. Biocenological investigations of the macrozoobenthos in the northern part of the Bulgarian Black Sea coast in depths up to 30 // Bulgarian Journal of Agricultural Science. 2013. – Vol. 19 (Supplement 1). – P. 16– 20.
Selys-Longchamps M. Phoronis. Fauna und Flora des Golfes von Neapel // R. Friedländer & Sohn, Berlin, 1907. – Vol. 30. – 280 pp.
Stoykov S., Uzunova S. Dynamics of macrozoobenthos in the Southern Bulgarian Black Sea coastal and open-sea areas // Mediterranean Marine Sciences. – 2001. – Vol. 2 (1). – P. 27–35.
Temereva E. N., Malakhov V. V. Embryogenesis in phoronids // Invertebrate Zoology. – 2012. – Vol. 8 (1). – P. 1–
39.
Temereva E. N., Neretina T. V. A distinct phoronid larva: morphological and molecular evidence // Invertebrate Systematics. – 2013. – Vol. 27, N 6. – Р. 622–633.
Temereva E. N., Neretina T. V., Stupnikova A. N. An original description of the larval stages of Phoronis australis Haswell, 1883 and an analysis of the world fauna of phoronid larvae/ Russian Journal of Marine Biology. – 2016. – Vol. 41, N 2. – P. 128–138.
223
Болтачева Н. А., Лисицкая Е. В., Ревков Н. К.
![]()
Boltachova N. А., Lisitskaya E. V., Revkov N. К. Distribution of Phoronis in the biocenoses of the Black Sea and the Sea of Azov // Ekosistemy. 2023. Iss. 36. P. 209–224.
The distribution of representative of the genus Phoronis in the biocenoses of the Black Sea and the Sea of Azov was analyzed both on the bases of the material collected by the authors in 2010–2022 and other data. The discovered phoronids were attributed to the species Phoronis cf. psammophila. Their ecological and morphological differences from typical representatives of the species found in other seas are indicated. Black Sea specimens were smaller: with body length up to 16 mm, diameter – 0.25–0.75 mm, tentacle length – 0.25–1.65 mm, number of tentacles – 33–60. For P. psammophila from other seas, 60–190 tentacles were reported. Mature individuals had a body length of 6.5 mm or more. Actinotroch larvae of the Black Sea phoronid were recorded in plankton from May to October in the temperature range of 17.6–25.6 ˚С. The highest occurrence of larvae (61.5%) was observed at a water temperature of 20–21.9 ˚C. The bathymetric boundaries of Phoronis habitat in the Black Sea were found to extend from 2 to 110 m. Phoronis cf. psammophila was first found in the Sea of Azov, where it was recorded at a water salinity of 12.53–14.39 ‰. This expands the salinity range of the species’ habitat. It was specified that in the Azov-Black Sea basin, this phoronid predominantly inhabits heavily silted sediments. The highest density of Phoronis cf. psammophila (1828 ind./m2) was recorded in the western part of Karkinitsky Bay at a depth of 35 m. In the Black Sea, this species was recorded mainly in the biocenoses of Mytilus galloprovincialis, Pitar rudis, and Terebellides stroemi, in the Sea of Azov it was registered in the biocenosis with dominance of Anadara kagoshimensis.
Key words: zoobenthos, Phoronida, Phoronis psammophila, actinotroch larvae, Black Sea, Sea of Azov.
Поступила в редакцию 01.07.23
Принята к печати 07.11.23
224

