РАСПРЕДЕЛЕНИЕ ЧЛЕНИСТОНОГИХ В НОРЕ И ГНЕЗДЕ БЕРЕГОВОЙ ЛАСТОЧКИ (RIPARIA RIPARIA (LINNAEUS, 1758)) (AVES: PASSERIFORMES) НА СЕВЕРЕ НИЖНЕГО ПОВОЛЖЬЯ
DISTRIBUTION OF ARTHROPODS IN THE BURROW AND NEST OF SAND MARTIN (RIPARIA RIPARIA (LINNAEUS, 1758)) (AVES: PASSERIFORMES) IN THE NORTHERN PART OF THE LOWER VOLGA REGION
JOURNAL: «EKOSISTEMY», Issue 41, 2025
Publication text (PDF):Download
UDK: 595.4+595.6/.7
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Kondratev E. N.1, Sazhnev A. S.2,3, Anikin V. V.1
1Saratov State University named after N. G. Chernyshevsky, Saratov, Russia
2Institute of Biology of Inland Waters named after I. D. Papanin of the Russian Academy of Sciences, Borok, Russia
3Joint Directorate of the Mordovian State Nature Reserve named after P. G. Smidovich, Saransk, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2025-41-106-119
PAGES: from 106 to 119
STATUS: Published
LANGUAGE: Russian
KEYWORDS: nest-dwellings species, sand martin, birds, consortium, Saratov oblast.
ABSTRACT (ENGLISH):
The research conducted on the territory of Saratov oblast in the Khvalynsky district, from 2020 to 2023. Between 2020 and 2022, arthropods were manually collected from burrows, while in 2023, the method of trap-cylinders was used. The latter method was utilized to study three colonies of sand martins (Riparia riparia) located in the villages of Demkino, Apaliha and Kulatka. Nest material was extracted from burrows during excavation, placed in individual zip-lock bags labeled for transportation, and placed on a Tullgren funnel. The results revealed a total of 4873 arthropod specimens belonging to 21 orders were collected. Specifically, 3,799 specimens were collected from nests and 1,074 specimens were obtained from burrows (using trap-cylinders). Different years exhibited varying dominant orders of arthropods in nests and burrows. Thus, the order Coleoptera were dominant in nests in 2020 and 2021, and Mesostigmata predominated in 2022 and 2023. Conversely, Diptera was the dominant group in burrows, with Coleoptera and Mesostigmata serving as subdominant and recedent groups, respectively. Calculation of the biotope confinement index showed that nest and burrow had their own characteristic complex of arthropods, in nest the dominant groups included Mesostigmata, Sarcoptiformes, Poduromorpha, Entomobryomorpha, Thysanoptera, Coleoptera, and Siphonaptera, while in burrows, the predominant groups comprised Opiliones, Trombidiformes, Araneae, Hemiptera, Hymenoptera, and Diptera. It was determined that free-living species (representatives of the families Phoridae, Muscidae, and Drosophilidae) dominated in burrows, with no association to either the nest or the nest owner, accounting for 80% of the total abundance. The dominant assemblages in nests consisted of three species (Androlaelaps casalis, Tetramorium sp., and Haploglossa nidicola), which were prevalent across most colonies. Groups that dominated in burrows were either recedents and/or subrecedents in nests or entirely absent, suggesting a buffering role of the burrow that acts as a barrier to the movement of flying insects. Due to the isolation of nest-dwelling communities containing eudominants, the overall species abundance and alpha diversity of arthropods in the nests and burrows in sand martin nests were found to be notably low.
ВВЕДЕНИЕ
Гнезда птиц представляют собой микробиоценозы, в которых складываются условия, отличающиеся от внешней среды (Deeming, Reynolds, 2015) и пригодных для обитания представителей Acariformes, Parasitiformes, Heteroptera, Lepidoptera, Coleoptera, Diptera, Siphonaptera и других (Hicks, 1959, 1962, 1971; Нельзина, 1971, 1977; Сажнев, Кондратьев, 2019, 2020; Кондратьев и др., 2021; Аникин, Кондратьев, 2022). Специфичность гнездовой фауны, ее дифференциация по топическим и трофическим связям с хозяином гнезда позволяют рассматривать гнездо как консорцию (Раменский, 1952; Песенко, 1982), где членистоногие, выступают в качестве консортов, которые концентрируются вокруг гнезда и его хозяина – «ядра консорции», или её детерминанта (источника трофических и топических ресурсов). В отличие от классического определения консорции (Мазинг, 1966; Работнов, 1969) в гнездах нет автотрофного продуцента, поэтому их рассматривают как гетеротрофные консорции (Василевич, 1983; Кривохатский, 1989).
По расположению в пространстве гнездо береговой ласточки Riparia riparia (Linnaeus, 1758) представляет собой субтерральный (норы в обрывах) сложный многолетний нидоценоз (Сажнев, Матюхин, 2020), в котором системообразующими типами консортивных связей выступают трофические, топические (субстратно-стациальные) и фензивные (Kondratev et al., 2023), поэтому для норных сообществ характерно наличие как облигатных и/или факультативных нидиколов, так и «случайных» видов, которые используют норы опосредованно, например, для укрытия.
Большинство работ по членистоногим из гнезд ласточек-береговушек (Nordberg, 1936; Hicks, 1959, 1962, 1971; Нельзина, 1971, 1977; Krištofík et al., 1994; Сажнев, Кондратьев, 2019, 2020; Корнеев и др., 2020; Кондратьев и др., 2021; Аникин, Кондратьев, 2022), посвящены фауне гнезд. Сравнение сообществ членистоногих в норе и в гнезде птиц не проводились.
Цель данной работы – изучить комплексы членистоногих из гнезд и нор береговой ласточки на территории Саратовской области.
МАТЕРИАЛ И МЕТОДЫ
Исследования проводили на территории Саратовской области в Хвалынском районе с 2020 по 2023 год. В 2020–2022 годах проводили ручной сбор членистоногих в норе (рис. 1., табл. 1). Помимо ручного сбора применяли метод ловчих цилиндров (Голуб и др., 2021). Данным методом было обследовано 24 норы в трех колониях (села Демкино и Апалиха, деревня Кулатка) береговой ласточки. В качестве ловчих цилиндров использовали пластиковые емкости объемом 50 мл. Фиксатором был раствор 70 % этилового спирта. Цилиндры устанавливали в норы на расстоянии 5 см от входа. Верхний срез цилиндра размещали наравне с поверхностью почвы в норе. Экспонирование ловушек длилось с 28 июня по 7 июля 2023 года.
Гнездовой материал извлекали из нор при их раскапывании, помещали в индивидуальный zip-пакет с этикеткой, для дальнейшей транспортировки и камеральной обработки. Членистоногих собирали с помощью термофотоэклектора в течении двух-трех часов (Голуб и др., 2021). После обработки в термофотоэклекторе гнездовой материал
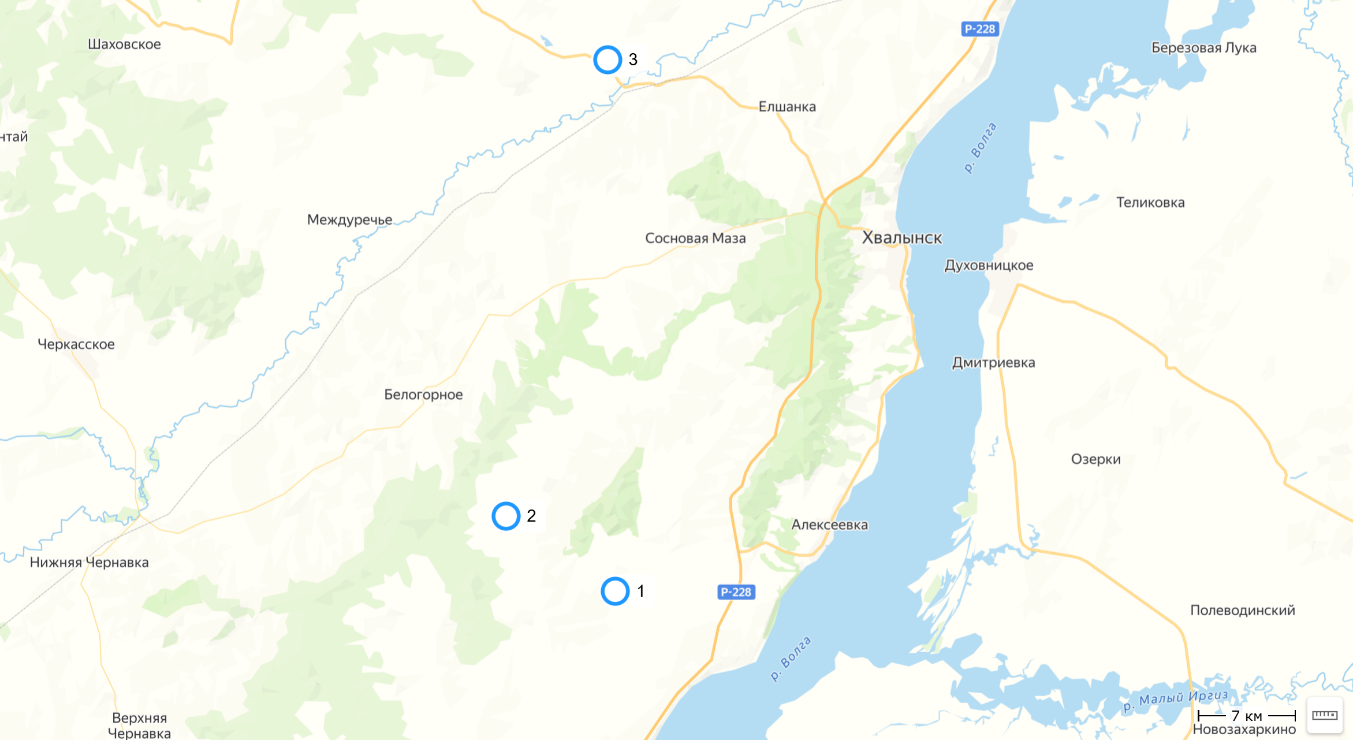
Рис. 1. Пункты сбора материала в Хвалынском районе Саратовской области
1 – песчаный карьер в окрестностях села Демкино, 2 – песчаный карьер в окрестностях села Апалиха, 3 – заброшенный песчаный карьер в окрестностях деревни Кулатка.
Таблица 1
Места сбора материала
| Дата | Локалитет | Широта | Долгота |
|---|---|---|---|
| 25.06.2020; 30.07.2020; 08.07.2021; 04.11.2021; 28.06.2022; 04.11.2022; 07.07.2023 | Хвалынский р-н, окрестности села Демкино, песчаный карьер | 52.267003 | 47.796580 |
| 08.07.2021; 04.11.2021; 28.06.2022; 04.11.2022; 29.06.2023 | Хвалынский р-н, окрестности села Апалиха, песчаный карьер | 52.317167 | 47.678037 |
| 28.06.2023; 07.07.2023 | Хвалынский р-н, окрестности деревни Кулатка, заброшенный песчаный карьер | 52.618220 | 47.787902 |
дополнительно разбирали вручную на наличие членистоногих, не прошедших через сито. Затем содержимое пробы переносили в чашку Петри и предварительно дифференцировали на отряды и таксоны высокого ранга под стереоскопическим микроскопом МБС-10.
Индекс биотопической приуроченности рассчитывали по формуле (Песенко, 1982):
где ИБП – индекс биотопической приуроченности; nij – число особей i-го вида в j-ой выборке объемом Nj; ni – число особей этого вида во всех сборах общим объемом N.
Индекс видового разнообразия Шеннона рассчитывался по формуле (Southwood, Henderson, 2000):
где HN – индекс Шеннона (по численности); S – видовое богатство; pi – доля i-го вида в сообществе.
Индекс Реньи (exp(Hα)) рассчитывался по формуле (Tothmeresz, 1995):
где exp(Hα) – индекс Реньи; S – видовое богатство; pi – доля i-го вида в сообществе.
Статистическая обработка проводилась с помощью MS Office Excel и PAST 4.17.
При идентификации материала использовали следующие источники: определение клещей (Брегетова, 1956; Гиляров, 1975, 1977, 1978; Krantz, Walter, 2009; Mašán et al., 2016), трипсов (Бей-Биенко, 1964), двукрылых (Бей-Биенко, 1969, 1970; Нарчук, 2003) и блох (Бей-Биенко, 1970) было проведено первым автором по стандартным методикам; определение жуков проводили преимущественно по Die Käfer Europas (Lompe, 2023), оно выполнено А.С. Сажневым (Борок), определение чешуекрылых проведено В.В. Аникиным (Саратов) по современным ключам (Slamka, 2013, 2019; Gaedike, 2015, 2019; Аникин и др., 2016; Anikin et al., 2017) с изготовлением препаратов гениталий для микрочешуекрылых по стандартной методике (Robinson, 1976).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенных исследований в трех колониях береговой ласточки было выявлено 4873 экз. членистоногих, относящихся к 21 отрядам (табл. 2).
Из гнезд было собрано 3799 экз., из ловчих цилиндров 1074 экз. Из них в гнездах в заброшенной колонии деревни Кулатка членистоногих не обнаружено, в селе Апалиха собрано 28 таксонов (1730 экз.), в селе Демкино 47 таксонов (2176 экз.).
Из нор в цилиндры в деревни Кулатка собрано 18 таксонов (37 экз.), в селе Апалиха 47 таксонов (335 экз.), а в селе Демкино 28 таксонов (700 экз.).
Количество собранных экземпляров и таксонов из гнезд по годам представлено на рисунке 1.
Таблица 2
Состав членистоногих в гнезде и норе береговой ласточки Riparia riparia (Linnaeus, 1758)
| Таксон | ЖС | Н | Гн | Σ | % |
| 1 | 2 | 3 | 4 | 5 | 6 |
| Arachnida | |||||
| Opiliones | |||||
| Opiliones | imago | 5 | — | 5 | 0,10 |
| Pseudoscorpiones | |||||
| Dactylochelifer | imago | 1 | — | 1 | 0,02 |
| Ixodida | |||||
| Ixodes lividus Koch, 1844 | imago/ larvae | 1 | 21 | 22 | 0,45 |
| Mesostigmata | |||||
| Nenteria sp. | imago | — | 1 | 1 | 0,02 |
| Pergamasellus delicatus Evans, 1957 | imago | — | 3 | 3 | 0,06 |
| Rhodacarellus sp. | imago | — | 1 | 1 | 0,02 |
| Ameroseius delicatus Berlese, 1918 | imago | — | 5 | 5 | 0,10 |
| Melichares sp. | imago | — | 12 | 12 | 0,25 |
| Eulaelaps stabularis (C.L.Koch, 1836) | imago | — | 4 | 4 | 0,08 |
| Androlaelaps casalis (Berlese, 1887) | imago | 29 | 1483 | 1512 | 31,03 |
| Hypoaspis heselhausi Oudemans, 1912 | imago | — | 2 | 2 | 0,04 |
| Gaeolaelaps aculeifer (Canestrini, 1884) | imago | — | 4 | 4 | 0,08 |
| G. expolitus (Berlese, 1904) | imago | — | 1 | 1 | 0,02 |
| Euandrolaelaps karawaiewi (Berlese, 1904) | imago | — | 1 | 1 | 0,02 |
| Stratiolaelaps miles (Berlese, 1892) | imago | — | 31 | 31 | 0,64 |
| Laelaptidae sp. | larvae | — | 9 | 9 | 0,18 |
| Laelaptidae sp. | protonymphs | 1 | 35 | 36 | 0,74 |
| Laelaptidae sp. | deytonymphs | 1 | 158 | 159 | 3,26 |
| Trombidiformes | |||||
| Anystis sp. | imago | 1 | — | 1 | 0,02 |
| Sphaerolichus sp. | imago | — | 2 | 2 | 0,04 |
| Parasitengona | imago | — | 1 | 1 | 0,02 |
| Caeculidae | imago | — | 1 | 1 | 0,02 |
| Sarcoptiformes | |||||
| Oribatida | imago | — | 3 | 3 | 0,06 |
| Acarus siro Linnaeus, 1758 | imago | — | 21 | 21 | 0,43 |
| Araneae | |||||
| Araneae | imago | 8 | 6 | 14 | 0,29 |
Таблица 2 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 |
| Chilopoda | |||||
| Lithobiomorpha | |||||
| Lithobius crassipes L.Koch, 1862 | imago | — | 1 | 1 | 0,02 |
| Diplopoda | |||||
| Julida | |||||
| Julus terrestris Linnaeus, 1758 | imago | 1 | 1 | 2 | 0,04 |
| Collembola | |||||
| Poduromorpha | |||||
| Mesaphorura yosii (Rusek, 1967) | imago | — | 27 | 27 | 0,55 |
| Hemisotoma thermophila (Axelson, 1900) | imago | 1 | 22 | 23 | 0,47 |
| Proisotoma minuta (Tullberg, 1871) | imago | — | 186 | 186 | 3,82 |
| Entomobryomorpha | |||||
| Tomocerus vulgaris (Tullberg, 1871) | imago | — | 1 | 1 | 0,02 |
| Entomobrya sp. | imago | 3 | — | 3 | 0,06 |
| Pseudosinella sexoculata Schött, 1902 | imago | — | 87 | 87 | 1,79 |
| Insecta | |||||
| Orthoptera | |||||
| Melanogryllus desertus (Pallas, 1771) | imago | 1 | — | 1 | 0,02 |
| Psocoptera | |||||
| Liposcelis divinatorius (Müller, 1776) | imago | — | 2 | 2 | 0,04 |
| Thysanoptera | |||||
| Thysanoptera | second instar larvae | — | 1 | 1 | 0,02 |
| Haplothrips tritici (Kurdjumov, 1912) | imago | — | 4 | 4 | 0,08 |
| Hemiptera | |||||
| Hemiptera | larvae | — | 3 | 3 | 0,06 |
| Cicadellidae | imago | 31 | — | 31 | 0,65 |
| Aphis sp. | imago | 14 | — | 14 | 0,31 |
| Emblethis sp. | imago | 1 | — | 1 | 0,02 |
| Oeciacus hirundinis Lamarck, 1816 | imago | — | 6 | 6 | 0,12 |
| Brachycarenus tigrinus (Schilling, 1829) | imago | 2 | — | 2 | 0,04 |
| Heterogaster artemisiae Schilling, 1829 | imago | 2 | — | 2 | 0,04 |
| Stictopleurus crassicornis (Linnaeus, 1758) | imago | 1 | — | 1 | 0,02 |
| Corizus hyoscyami (Linnaeus, 1758) | imago | 3 | — | 3 | 0,06 |
| Hymenoptera | |||||
| Platygastroidea | imago | 1 | — | 1 | 0,02 |
| Braconidae | imago | 5 | — | 5 | 0,10 |
| Sapygidae | imago | 4 | — | 4 | 0,08 |
| Proctotrupidae | imago | 5 | — | 5 | 0,10 |
| Megaspilidae | imago | 3 | — | 3 | 0,06 |
| Vespidae | imago | 18 | — | 18 | 0,37 |
| Ichneumonidae | imago | 3 | — | 3 | 0,06 |
| Tetramorium sp. | imago | 113 | 37 | 150 | 3,08 |
| Formica cf. rufa Linnaeus, 1761 | imago | 5 | — | 5 | 0,10 |
| Coleoptera | |||||
| Carabidae | larvae | — | 6 | 6 | 0,12 |
| Haploglossa nidicola (Fairmaire, 1852) | imago / larvae | 164 | 1397 | 1561 | 31,86 |
| Lordithon lunulatus (Linnaeus, 1761) | imago | 1 | — | 1 | 0,02 |
| Amischa analis (Gravenhorst, 1802) | imago | 1 | — | 1 | 0,02 |
Таблица 2 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 |
| Saprinus rugifer (Paykull, 1809) | imago | 2 | 14 | 16 | 0,35 |
| Euspilotus perrisi (Marseul, 1872) | imago | 12 | — | 12 | 0,25 |
| Pleurophorus caesus (Creutzer, 1796) | imago | — | 1 | 1 | 0,02 |
| Scarabaeidae | imago | — | 4 | 4 | 0,08 |
| Cetonia aurata (Linnaeus, 1761) | imago | 2 | — | 2 | 0,04 |
| Agrilus hyperici (Creutzer, 1799) | imago | — | 1 | 1 | 0,02 |
| Anthrenus flavidus Solsky, 1876 | imago | 1 | — | 1 | 0,02 |
| Attagenus sp. | larvae | — | 2 | 2 | 0,04 |
| Elateridae | larvae | — | 2 | 2 | 0,04 |
| Agriotes ustulatus (Schaller, 1783) | imago | 1 | — | 1 | 0,02 |
| Lampyris noctiluca (Linnaeus, 1767) | imago | — | 1 | 1 | 0,02 |
| Xyleborinus saxeseni (Ratzeburg, 1837) | imago | 1 | 1 | 1 | 0,04 |
| Anthicus flavipes (Panzer, 1797) | imago | — | 1 | 1 | 0,02 |
| Corticaria sp. | imago | — | 1 | 1 | 0,02 |
| Lagria sp. | larvae | — | 1 | 1 | 0,02 |
| Chrysomelidae | larvae | — | 5 | 5 | 0,10 |
| Chaetocnema hortensis (Geoffroy, 1785) | imago | — | 1 | 1 | 0,02 |
| Bruchus pisorum (Linnaeus, 1758) | imago | 1 | — | 1 | 0,02 |
| Spermophagus sericeus (Geoffroy, 1785) | imago | 1 | — | 1 | 0,02 |
| Adalia bipunctata (Linnaeus, 1758) | imago | 1 | — | 1 | 0,02 |
| Blaps lethifera Marsham, 1802 | imago | 1 | — | 1 | 0,02 |
| Ceutorhynchus gallorhenanus F.Solari, 1949 | imago | 1 | — | 1 | 0,02 |
| Anaspis sp. | imago | 1 | — | 1 | 0,02 |
| Lepidoptera | |||||
| Infurcitinea rumelicella (Rebel, 1903) | larvae | 1 | 33 | 34 | 0,70 |
| Niditinea fuscella (Linnaeus, 1758) | imago | 1 | — | 1 | 0,02 |
| Wegneria panchalcella (Staudinger, 1871) | imago | 1 | — | 1 | 0,02 |
| Monopis spilotella (Tengstrom, 1848) | imago | 1 | — | 1 | 0,02 |
| Caloptilia fidella (Reutti, 1853) | imago | — | 1 | 1 | 0,02 |
| Loxostege sticticalis [Hubner, 1825] | imago | — | 2 | 2 | 0,04 |
| Polypogon tentacularia (Linnaeus, 1758) | imago | 1 | — | 1 | 0,02 |
| Rhyacia simulans (Hufnagel, 1766) | imago | — | 1 | 1 | 0,02 |
| Spaelotis ravida (Denis & Schiffermüller, 1775) | imago | 2 | — | 2 | 0,04 |
| Caradrina kadenii (Freyer, 1836) | imago | 1 | — | 1 | 0,02 |
| Casignetella eltonica Anikin, 2005 | imago | — | 2 | 2 | 0,04 |
| Diptera | |||||
| Bombyliidae | imago | 7 | — | 7 | 0,14 |
| Phoridae | imago | 158 | — | 158 | 3,24 |
| Tachinidae | imago | 9 | — | 9 | 0,17 |
| Sciaridae | imago | 19 | — | 19 | 0,39 |
| Drosophilidae | imago | 101 | — | 101 | 2,06 |
| Lonchopteridae | imago | 1 | — | 1 | 0,02 |
| Sarcophagidae | larvae | 3 | — | 3 | 0,06 |
| Muscidae | imago | 193 | — | 293 | 6,02 |
| Scenopinidae | imago | 3 | — | 3 | 0,06 |
| Syrphidae | imago | 3 | — | 3 | 0,06 |
| Stratiomyidae | imago | 1 | — | 1 | 0,02 |
Таблица 2 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 |
| Chironomidae | imago | 2 | — | 2 | 0,04 |
| Culicidae | imago | 1 | — | 1 | 0,02 |
| Platypalpus | imago | 1 | — | 1 | 0,02 |
| Dolichopodidae | imago | 6 | — | 6 | 0,12 |
| Ceratopogon sp. | larvae | — | 39 | 39 | 0,80 |
| Empididae | larvae | — | 1 | 1 | 0,02 |
| Crossopalpus sp. | imago | — | 2 | 2 | 0,04 |
| Siphonaptera | |||||
| Ceratophyllus styx Rothschild, 1900 | imago | 3 | 107 | 110 | 2,25 |
| Всего: | 1074 | 3799 | 4873 | 100 | |
Примечание к таблице. ЖС – стадия жизненного цикла, Н – число экз. собранных в норе, Гн – число экз. обнаруженных в гнезде.
Рис. 1. Количество таксонов и экземпляров, собранных в гнездах по годам (в %):
S – число таксонов, N – число экземпляров
В разные годы различные отряды доминировали в гнездах и в норе (рис. 2а). Так в гнездах в 2020 и 2021 годах доминировали представители отряда Coleoptera (в 2020 – 49,63 %, в 2021 – 48,86 %). В 2022 и 2023 это были клещи из отряда Mesostigmata (в 2022 – 60,6 %, в 2023 – 86,4 %), в то время как в норе доминирующей группой были представители Diptera (47,95 %), Coleoptera (16,88 %) являлись субдоминантами, а Mesostigmata (2,89 %) рецедентами (рис. 2б).
В колонии, расположенной в селе Апалиха доминировали гамазовые клещи (69,41 %), на втором месте были жуки (20,43 %). В селе Демкино доминирующей группой были жуки (52,31 %), в то время как на втором месте были гамазиды (26,69 %) (рис. 3а). В значительной мере были представлены в Апалихе – клопы (1,97 %), в Демкино – блохи (5,1 %) и коллемболы (10,74 %). В гнездах, собранных в колонии в деревне Кулатка членистоногих найдено не было.
В норе в колониях в селе Демкино и деревне Кулатка доминировали двукрылые (в Демкино 73,51 %, в Кулатке 43,24 %) (рис. 3б), в Кулатке также доминировали перепончатокрылые (24,32 %). В Апалихе, наоборот, доминировали жуки (37,91 %).
Рис. 2. Распределение доминирующих групп членистоногих по годам: в гнезде (а) и норе (б)
1 – Mesostigmata, 2 – Poduromorpha, 3 – Hemiptera, 4 – Hymenoptera, 5 – Coleoptera, 6 – Diptera, 7 – Siphonaptera.
Рис. 3. Распределение доминирующих групп членистоногих по колониям в гнезде (а) и норе (б)
1 – Mesostigmata, 2 – Poduromorpha, 3 – Hemiptera, 4 – Hymenoptera, 5 – Coleoptera, 6 – Diptera, 7 – Siphonaptera.
Расчет индекса биотопической приуроченности (для которого выраженную степень приуроченности считали > ±0,5) показал (исключены отряды, представленные менее 5 экз.), что гнездо и нора имеют свой характерный комплекс доминантных групп, в гнезде это Mesostigmata, Sarcoptiformes, Poduromorpha, Entomobryomorpha, Thysanoptera, Coleoptera и Siphonaptera; в норе – Opiliones, Trombidiformes, Araneae, Hemiptera, Hymenoptera и Diptera (рис. 4). В первом случае комплекс состоит из нидикольной и почвенной фауны, во втором это свободноживущая фауна, которая активно передвигается.
Было установлено, что в норе доминируют свободноживущие виды, которые не связаны ни с гнездом, ни с хозяином гнезда, доля таких видов по численности составляет 80 % в норе. Состав доминантных группировок в гнезде на исследуемых участках состоит из трех видов (Androlaelaps casalis (Berlese, 1887), Tetramorium sp. и Haploglossa nidicola (Fairmaire, 1852)), которые преобладают в большинстве колоний. Представители семейств Phoridae, Muscidae и Drosophilidae доминируют в норе. Группы, доминирующие в норе, входили в состав рецедентов и/или субрецедентов в гнезде или вообще отсутствовали, что указывает на то, что
Рис. 4. Соотношение таксонов в гнезде и в норе по индексу биотопической приуроченности
1 – Opiliones, 2 – Ixodida, 3 – Mesostigmata, 4 – Trombidiformes, 5 – Sarcoptiformes, 6 – Araneae,
7 – Poduromorpha, 8 – Entomobryomorpha, 9 – Thysanoptera, 10 – Hemiptera, 11 – Hymenoptera,
12 – Coleoptera, 13 – Lepidoptera, 14 – Diptera, 15 – Siphonaptera.
наличие расстояния между входом норы и гнездом отрицательно влияет на возможность перемещения насекомых, что подтверждается и экспериментальными данными (Tomás et al., 2020).
Несмотря на существенную разницу в количестве экземпляров (N = 974 и 3809 экз. в норах и гнездах соответственно) в генерализованных выборках из нор и гнезд ласточек, статистически значимых различий между ними не обнаружено (t-критерий Стьюдента = 1,374; p = 0,1706) в виду довольно высокой степени участия в исследуемых сообществах единично отмеченных и случайных видов членистоногих лабильного комплекса и слабой выравненности сообществ.
Индексы разнообразия по численности также не высоки, например, индекс Шеннона для сообществ членистоногих нор равен HN = 2,639 экз./бит против HN = 1,770 экз./бит – для гнезд. Низкое значение индекса Шеннона в гнезде связано с высоким доминированием двух видов: Haploglossa nidicola – в целом 31,86 % и Androlaelaps casalis – 31,03 %, в отличии от норы где доли видов распределены равномернее.
Оценку согласованной встречаемости видов в изученных сообществах жесткокрылых проводили по индексу Брея-Кёртиса и визуализировали методом сетевой диаграммы (круговой тип) ассоциированности видов (рис. 5), где точками (узлы) обозначены виды сообществ, а гранями – связи между ними (порог сходства 90 %). Величина узлов пропорциональна количеству связей, а толщина линий – величине сходства.
В результате внутри сообществ было выделено 2 кластера: первый образовали виды приуроченные к гнездово-норовым комплексам, это хищный нидикол Haploglossa nidicola, а также паразитирующие на ключевом виде (береговой ласточке) Ixodes lividus и Androlaelaps casalis; вторую пару ассоциированных видов составили факультативный клептобионт
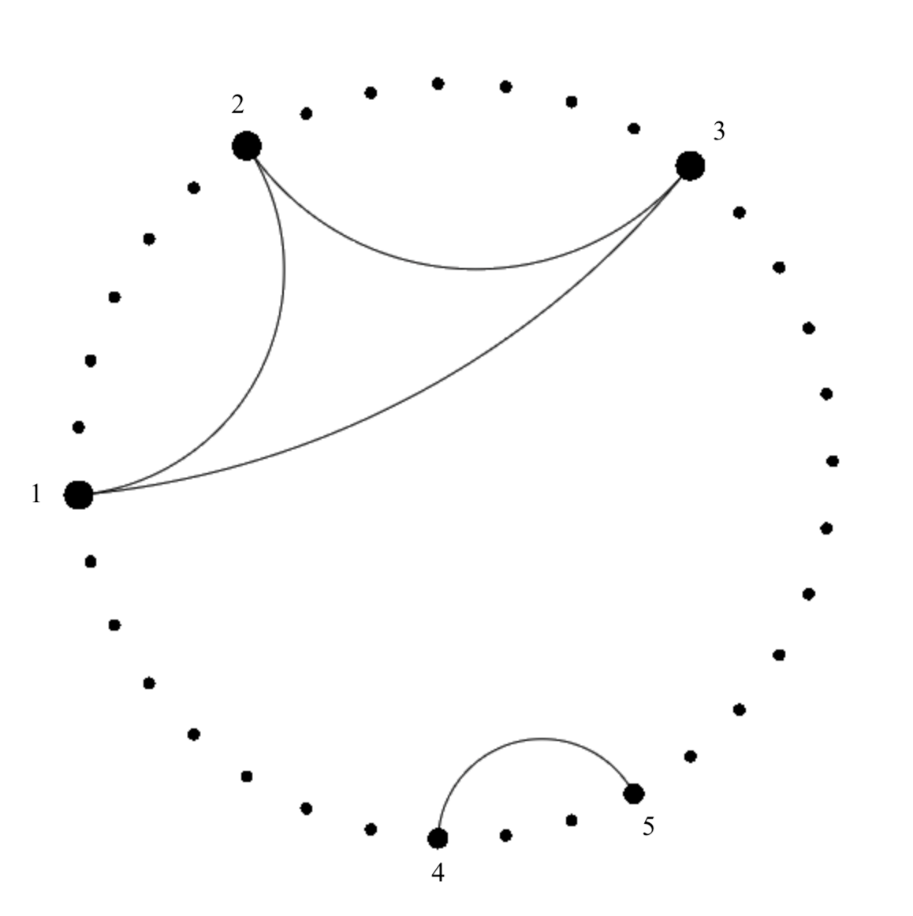
Рис. 5. Сетевая диаграмма ассоциированности видов исследованных сообществ жесткокрылых нор и гнезд береговой ласточки
Точками обозначены виды сообществ, наиболее связанные из них (порог сходства 90 %) обозначены цифрами: 1 – Haploglossa nidicola; 2 – Androlaelaps casalis; 3 – Ixodes lividus; 4 – Solenopsis fugax;
5 – Pseudosinella sexoculata.
Solenopsis fugax и детритофаг Pseudosinella sexoculata, который, вероятно, связан с норами в виду их микроклиматических условий и наличия разлагающихся органических веществ.
За счет наличия эудоминантов и в целом обособленности нидикольных сообществ общее обилие видов и альфа-разнообразие членистоногих в гнездах и норах ласточек имеет весьма низкие показатели, что отражено на графиках доминирования-разнообразия (рис. 6), на которых степень крутизны падения кривых сопоставима с уменьшением общего разнообразие и усилением доминирования одного или нескольких видов.
Чтобы избежать произвольного выбора индекса разнообразия при сравнении сообществ членистоногих нор и гнезд для каждого мы использовали профили разнообразия (рис. 6), позволяющие сравнить одновременно несколько индексов единой группы, зависящие от одного непрерывного параметра (Tothmeresz, 1995). Для этого применили экспоненциальную функцию индекса Реньи – exp(Hα), которая зависит от параметра α (при α=0 функция дает общее число видов в сообществах, при α=1 – индекс, пропорциональный индексу Шеннона, а при α=2 – индекс, аналогичный индексу Симпсона). Если профили двух сообществ пересекаются, то диверсификации несопоставимы. Используя анализ разрежения (кривая накопления видов) оценили выявленное и потенциально возможное разнообразие сообществ беспозвоночных сравниваемых участков норово-гнездовых комплексов (рис. 7). Стоит отметить, что генерализованные данные показывают, что выборочные усилия при сборе материала были недостаточны (в первую очередь за счет неравноценного применения ловчих цилиндров при сборе материала в норах). Изученность сообществ гнезд выше – график приближается к асимптоте, что говорит о том, что выявленное видовое богатство может быть увеличено, однако, близко к прогнозируемому. Потенциальное число видов, полученное путем случайных перестановок выборок (bootstrapping), находится в пределах 111,0±49,5 – 173,7±111,4 видов.
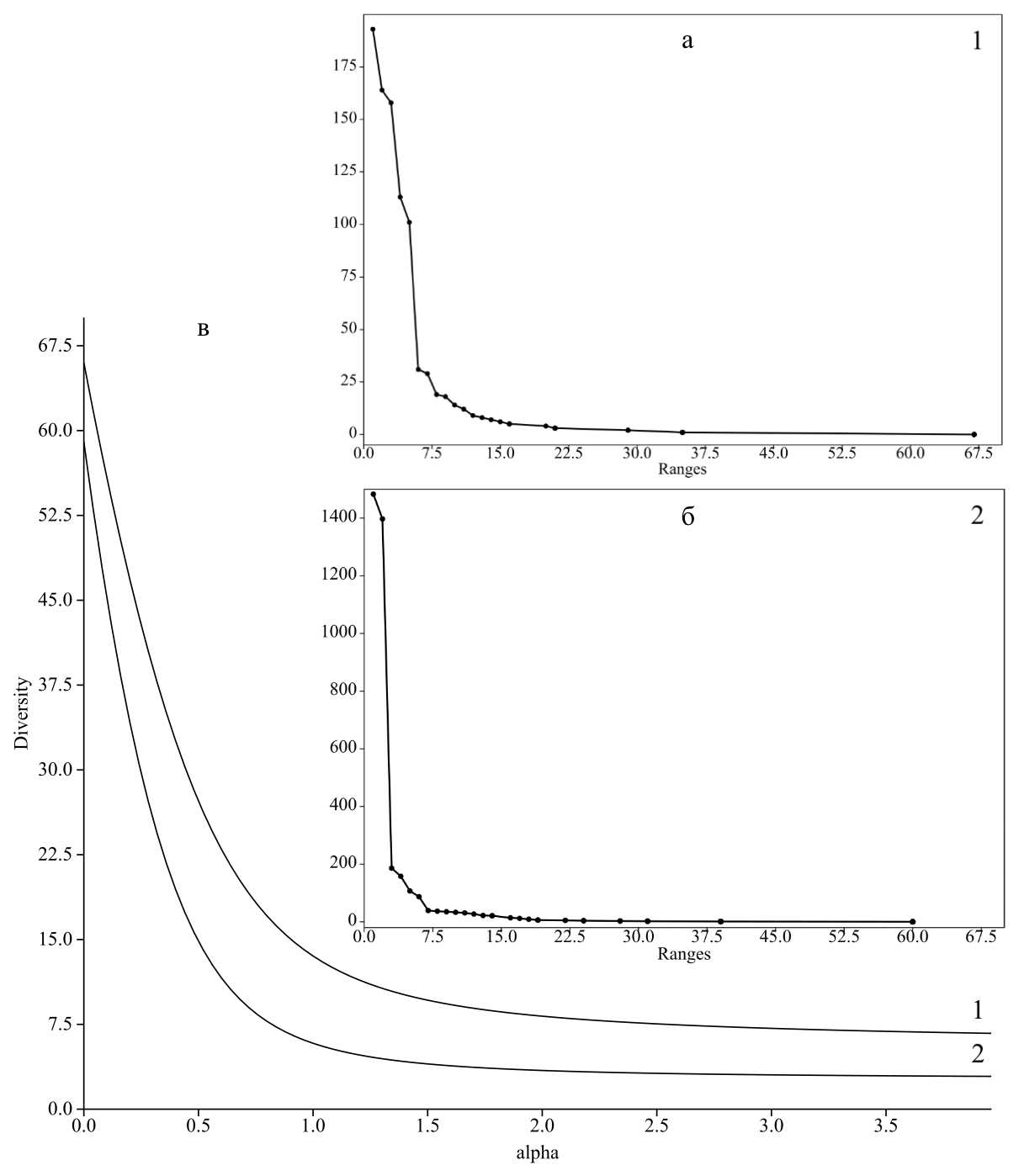
Рис. 6. Кривые значимости видов (доминирования-разнообразия) (a, б) сообществ членистоногих нор (1) и гнезд (2) береговой ласточки, а также профили разнообразия (в), построенные по параметрам экспоненты индекса Реньи – exp(Hα)
ЗАКЛЮЧЕНИЕ
Впервые на данной территории проведено комплексное экологическое обследование с изучением элементов комплекса членистоногих из гнезда и из норы. В результате проведенных исследований в гнездах и норе было выявлено 4873 экз. членистоногих, относящихся к 109 таксонам, 21 отрядам (Opiliones – 1, Pseudoscorpionida – 1, Ixodida – 1, Mesostigmata – 12, Araneae – 1, Trombidiformes – 4, Sarcoptiformes – 2, Diplopoda – 1, Chilopoda – 1, Poduromorpha – 3, Entomobryomorpha – 3, Orthoptera – 1, Psocoptera – 1,
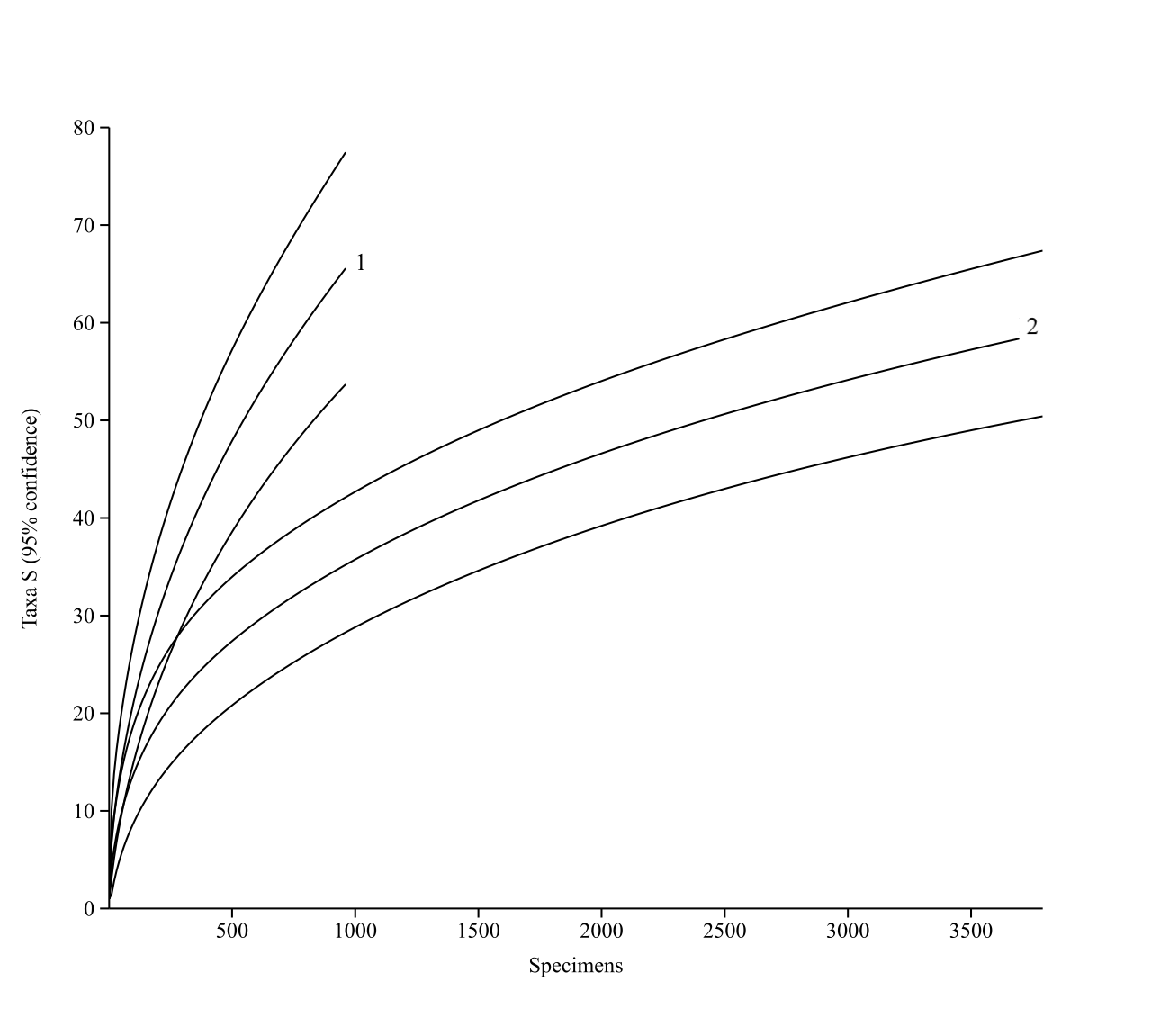
Рис. 7. Кривые разрежения сообществ членистоногих нор (1) и гнезд (2)
береговой ласточки (доверительный интервал 95 %)
По оси ординат – число таксонов (Taxa S); по оси абсцисс – число экземпляров (Specimens).
Thysanoptera – 1, Hemiptera – 9, Hymenoptera – 9, Coleoptera – 28, Lepidoptera – 11, Diptera – 20, Siphonaptera – 1). Доминантную группировку составляют 6 таксонов: A. casalis, Tetramorium sp., H. nidicola, представители семейств Phoridae, Muscidae, Drosophilidae.
Наблюдается различие в составе доминирующих групп между гнездами и норами. Так в гнездах преобладают нидикольные и почвенные виды, тогда как в норах — свободноживущие виды. Индекс Шеннона для сообществ нор выше, чем для гнезд, что связано с высоким доминированием в гнезде двух видов нидиколов – A. casalis и H. nidicola. В выборках из нор и гнезд береговой ласточки, статистически значимых различий между выборками не обнаружено в виду довольно высокой степени участия в исследуемых сообществах единично отмеченных и случайных видов членистоногих и слабой выравненности сообществ.
Благодарности. Авторы выражают признательность к.б.н. К. А. Гребеникову (ВНИИКР), д.б.н. А. А. Хаустову (ТюмГУ), д.б.н. А. Б. Бабенко (ИПЭЭ РАН), к.б.н. Р. А. Сайфутдинову (ИПЭЭ РАН), Ю. С. Волковой (УлГПУ) за помощь в определении материала.
- Аникин В. В., Золотухин В. В., Кириченко Н. И. Минирующие моли-пестрянки Lepidoptera: Gracillariidae Среднего и Нижнего Поволжья. – Ульяновск: Издательство «Корпорация технологий продвижения», 2016. – 152 с.
- Аникин В. В., Кондратьев Е. Н. Распределение экологических групп чешуекрылых (Lepidoptera, Insecta) в гнездах береговой ласточки (Riparia riparia (Linnaeus, 1758)) на территории Саратовской области // Поволжский экологический журнал. – 2022. – Вып. 2. – С. 232–241. https://doi.org/10.35885/1684-7318-2022-2-232-241
- Определитель насекомых европейской части СССР. Т. 1. Низшие, древнекрылые, с неполным превращением / [Ред. Г. Я. Бей-Биенко]. – М-Л: Наука, 1964. – 936 с.
- Определитель насекомых европейской части СССР. Т. 5. Ч. 1. Двукрылые, Блохи / [Pед. Г. Я. Бей-Биенко]. – Л: Наука, 1969. – 806 с.
- Определитель насекомых европейской части СССР. Т. 5. Ч. 2. Двукрылые, Блохи / [Pед. Г. Я. Бей-Биенко]. – Л: Наука, 1970. – 943 с.
- Брегетова Н. Г. Гамазовые клещи (Gamasoidea): краткий определитель. – М, Л: Издательство АН СССР, 1956. – 247 с.
- Василевич В. И. Очерки теоретической фитоценологии. – Л: Наука. Ленинградское отделение, 1983. – 248 с.
- Определитель обитающих в почве клещей. Sarcoptiformes / [Ред. М. С. Гиляров]. – М: Наука, 1975. – 491 с.
- Определитель обитающих в почве клещей. Mesostigmata / [Pед. М. С. Гиляров]. – М: Наука, 1977. – 718 с.
- Определитель обитающих в почве клещей. Trombidiformes / [Pед. М. С. Гиляров]. – М: Наука, 1978. – 271 с.
- Голуб В. Б., Цуриков М. Н., Прокин А. А. Коллекции насекомых: сбор, обработка и хранение материала (2е изд.). – M: Товарищество научных изданий КМК, 2021. – 358 с.
- Кондратьев Е. Н., Корнеев М. Г., Порщаков А. М., Матросов А. Н. Гамазовые клещи гнезд береговой ласточки (Riparia riparia (Linnaeus, 1758)) на территории Саратовской области // Паразитология. – 2021. – Т. 55, № 4. – С. 346–352.
- Корнеев М. Г., Поршаков А. М., Яковлев С. А., Матросов А. Н., Сажнев А. С. Членистоногие – обитатели нор береговой ласточки Riparia riparia (Linnaeus, 1758) (Aves: Hirundinidae) на территории Саратовской области // Известия Саратовского университета. Новая серия. Сер. Химия. Биология. Экология. – 2020. – Т. 20, № 2. – С. 189–199. https://doi.org/10.18500/1816-97752020-20-2-189-199
- Кривохатский В. А. Исследования обитателей нор млекопитающих СССР // Вестник Ленинградского Университета. Серия 3. – 1989. – Вып. 4. – С. 13–18.
- Мазинг В. В. Консорции как элементы функциональной структуры биогеоценозов // Труды Московского общества испытателей природы. – 1966. – Т. 27, № 2. – С. 117–126.
- Нарчук Э. П. Определитель семейств двукрылых насекомых фауны России. – Санкт-Петербург: Наука, 2003. – 250 с.
- Нельзина Е. Н. Структура норовых микробиоценозов на примере малого суслика и некоторых видов песчанок // Паразитология. – 1971. – Т. 5, № 3. – С. 266–273.
- Нельзина Е. Н. Основные таксономические группировки организмов, участвующие в формировании гнездово-норовых микробиоценозов // Паразитология. – 1977. – Т. 11, № 4. – С. 326–332.
- Песенко Ю. Н. Принципы и методы количественного анализа в фаунистических исследованиях. – М: Наука, 1982. – 287 с.
- Работнов Т. А. Некоторые вопросы изучения ценотических популяций // Бюллетень Московского общества испытателей природы. Отделение биологии. – 1969. – Т. 74, № 1. – С. 147–149.
- Раменский Л. Г. О некоторых принципиальных положениях современной геоботаники // Ботанический журнал. – 1952. – Т. 37, № 2. – С. 181–201.
- Сажнев А. С., Кондратьев Е. Н. Материалы по фауне жесткокрылых-нидиколов (Insecta: Coleoptera) из нор ласточек-береговушек Riparia riparia (Linnaeus, 1758) (Aves: Hirundinidae) Саратовской области // Полевой журнал биолога. – 2019. – Т. 1, № 4. – С. 193–197. https://doi.org/10.18413/26583453-2019-1-4-193-197
- Сажнев А. С., Кондратьев Е. Н. Жесткокрылые (Insecta: Coleoptera) из нор ласточек-береговушек Riparia riparia (Linnaeus, 1758) (Aves: Hirundinidae) Саратовской области // Полевой журнал биолога. – 2020. – T. 2, № 4. – C. 276–281. https://doi.org/10.18413/2658-3453-2020-2-4-276-281
- Сажнев А. С., Матюхин А. В. Материалы к фауне жесткокрылых (Insecta: Coleoptera) нидоценозов птиц // Полевой журнал биолога. – 2020. – T. 2, №1. – С. 14–23. https://doi.org/10.18413/2658-3453-2020-2-1-14-23
- A manual of acarology / [Eds. G. W. Krantz, D. E. Walter] – Texas: Texas Tech University, 2009. – 816 p.
- Anikin V. V., Sachkov S. A., Zolotuhin V. V. «Fauna LepidopterologicaVolgo-Uralensis»: from P. Pallas to presentdays. – Munich, Vilnius: Museum Witt Munich & Nature Research Center Vilnius, 2017. – 696 p.
- Gaedike R. Microlepidoptera of Europe. Tineidae I (Dryadaulinae, Hapsiferinae, Euplocaminae, Scardiinae,Nemapogoninae and Meessiinae). – Leiden, Boston: Brill, 2015. – 308 p.
- Gaedike R. Microlepidoptera of Europe. Tineidae II (Myrmecozelinae, Perissomasticinae, Tineinae, Hieroxestinae,Teichobiinae and Stathmopolitinae). – Leiden, Boston: Brill, 2019. – 248 p.
- Hicks E. A. Check-list and bibliography on the occurrence of insects in bird’s nests. – Iowa: The Iowa State College Press, 1959. – 681 p.
- Hicks E. A. Check-list and bibliography on the occurrence of insects in bird’s nests. Supplement I // Iowa State College Journal of Science. – 1962. – Vol. 36. – P. 233–347.
- Hicks E. A. Check-list and bibliography on the occurrence of insects in bird’s nests. Supplement II // Iowa State College Journal of Science. – 1971. – Vol. 46. – P. 123–338.
- Kondratev E. N., Sazhnev A. S., Anikin V. V., Mironoiva A. A. Using the heterocentric model in population-consortium analysis of the nest-dwelling arthropods of the sand martin (Riparia riparia (Linnaeus, 1758)) in Saratov region // Russian journal of ecosystem ecology. – 2023. – Vol. 8, N 2. – P. 22–31. https://doi.org/10.21685/2500-0578-2023-2-2
- Krištofík J., Šustek S., Gajdoš P. Arthropods in nests of the Sand Martin (Riparia riparia Linnaeus, 1758) in South Slovakia // Biologia, Bratislava. – 1994. – Vol. 49, N 5. – P. 683–690.
- Lompe A. Die Käfer Europas [Electronic resource]. – 2023. – Available at: http://coleonet.de (viewed by 22.10.2024)
- Mašán P., Özbek H. H., Fenďa P. Two new species of Pachylaelaps Berlese, 1888 from the Iberian Peninsula, with a key to European species (Acari, Gamasida, Pachylaelapidae) // ZooKeys. – 2016. – Vol. 603. – P. 71–95. https://doi.org/10.3897/zook-eys.603.9038
- Nests, eggs, and incubation: new ideas about avian reproduction / [Eds. D. C. Deeming, S. J. Reynolds]. – Oxford: Oxford University Press, 2015. – 296 p.
- Nordberg S. Biologisch-ökologische Untersuchungen uber die Vogelnidicolen // Acta zoologica Fennica. – 1936. – Vol. 21. – P. 1–168.
- Robinson G. The preparation of slides of Lepidoptera genitalia with special reference to the Microlepidoptera // Entomologist’s Gazette. – 1976. – Vol. 27. – P. 127–132.
- Slamka F. Pyraloidea of Europe (Lepidoptera). Pyraustinae, Spilomelinae. Identification. Distribution. Habitat. Biology. – Bratislava: Coronet Books Inc. 2013. – Vol. 3. – 357 p.
- Slamka F. Pyraloidea of Europe (Lepidoptera). Phycitinae. Identification. Distribution. Habitat. Biology. – Bratislava: Coronet Books Inc. 2019. – Vol. 4, Part 1. – 432 p.
- Southwood T. R. E., Henderson P. A. Ecological Methods (3rd ed.). – Oxford: Blackwell Science Ltd, 2000. – 592 p.
- Tomás G., Ruiz-Castellano C., Ruiz-Rodríguez M., Soler J. J. Smaller distance between nest contents and cavity entrance increases risk of ectoparasitism in cavity-nesting birds // Journal of Avian Biology. – 2020. – Vol. 51, N 7. – P. 1–9.
- Tothmeresz B. Comparison of different methods for diversity ordering // Journal of Vegetation Science. – 1995. – Vol. 6. – P. 283–290.

