ПЕРВЫЙ ФАКТ УСПЕШНОГО ГНЕЗДОВАНИЯ
ОБЫКНОВЕННОГО ФЛАМИНГО PHOENICOPTERUS ROSEUS PALLAS, 1811 (AVES, PHOENICOPTERIFORMES) В КРЫМУ
THE FIRST EVIDENCE OF SUCCESSFUL NESTING OF THE GREATER FLAMINGO (PHOENICOPTERUS ROSEUS PALLAS, 1811 (AVES, PHOENICOPTERIFORMES) IN CRIMEA
JOURNAL: «EKOSISTEMY», Issue 38, 2024
Publication text (PDF): Download
UDK: 598.244.4 (477.75)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Grinchenko A. B., Prokopov G. A.1,2
1V.I. Vernadsky Crimean Federal University, Simferopol, Russia
2 A. O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2024-38-171-186
PAGES: from 171 to 186
STATUS: Published
LANGUAGE: Russian
KEYWORDS: Phoenicopterus roseus, nesting, Crimean Peninsula, Sivash Bay, threats, wildlife sanctuary.
ABSTRACT (ENGLISH):
Over the past decade, the Sivash Bay has undergone significant transformations due to the blocking of the North Crimean Canal. It resulted in a considerable increase in salinity, which facilitated the establishment of a feeding base for the Greater Flamingo (Phoenicopterus roseus Pallas, 1811), characterized by a substantial development of brine shrimp (Artemia sp.) and chironomid larvae (Chironomidae). The warm winters of recent years and the establishment of a rest zone in the Sivash Bay near the base of the Arabat Spit led to the formation of a nesting colony of the Greater Flamingos. The establishment of the colony commenced in mid-April 2024, with egg-laying beginning in the first decade of May, and the first chicks hatching in late May to early June. The colony reached its maximum size by June 22, comprising 320 adult birds and approximately 110 chicks of two generations, along with over 30 nests still incubated by flamingos. Preliminary data regarding the molting patterns of flamingos in Crimea were collected. It was revealed that nesting birds exhibit a sequential molting pattern, allowing them to retain their flight capability. The formation of a flamingo breeding colony is unique for the Russian Federation. To preserve the breeding conditions of these birds, it is essential to expand the wildlife sanctuary of regional significance “Arabatsky” to the base of the Arabat Spit, including the adjacent waters of the Sivash Bay. Furthermore, a resting zone of at least 2 km should be designated around the sandy spit where the flamingo colony was formed in 2024, prohibiting the harvesting of Chironomidae and Artemia sp., as well as banning windsurfing.
ВВЕДЕНИЕ
Обыкновенный, или розовый фламинго (Phoenicopterus roseus Pallas, 1811) – самый многочисленный среди фламинго всех современных видов этой группы. Численность гнездовой европейской популяции оценивается в 45–62 тыс. пар, зимующей – 172–264 тыс. особей (European birds…, 2017, Белик, 2021). Существующий тренд в целом свидетельствует об увеличении европейской популяции (European birds…, 2017).
Состояние глобальной популяции оценивается как LC, или LR/lc – вызывающее наименьшие опасения. При этом, в России вид находится на границе ареала и включен в Красную книгу Российской Федерации в статусе 3 – редкий вид; У – уязвимый (в России по шкале МСОП – VU С2b); III приоритет природоохранных мер (Джамирзоев и др., 2021). Статус в Красной книге Республики Крым – 3 (редкий), как редкий пролетный и залетный вид (Кучеренко, 2015).
Розовый фламинго – долгоживущий, высококолониальный вид, характеризующийся высокими способностями к расселению (Geraci et al., 2012). Гнездовой ареал вида, в силу приуроченности к особым биотопам – солёным мелководным озёрам с островами, разорван и охватывает тропические и субтропические регионы Европы, Африки и Азии. В пределах ареала, в зависимости от условий, этот вид является оседлым, кочующим или перелетным.
Основные места гнездования фламинго в европейской части – Франция, Испания, Турция (Белик, 2021). Ближайшие к Крыму восточные гнездовые популяции известны в западном Казахстане на северо-востоке Каспия (Ковшарь, Карпов, 2016). Численность и характер пребывания там птиц сильно колеблется в зависимости от уровня Каспийского моря. При наступлении неблагоприятных условий гнездовая группировка перемещается на восток, где формирует крупную гнездовую колонию на озере Тенгиз (Кассал, 2021).
Несмотря на разобщенность, популяции фламинго сохраняют высокую генетическую и морфологическую идентичность (Geraci et al., 2012).
Общая численность фламинго в пределах СССР в тёплое время года оценивалась в 50 тыс. особей (Дементьев и др., 1951). При этом в России до настоящего времени розовый фламинго на гнездовании отмечен не был (Белик, 2021, Джамирзоев и др., 2021).
В северном Причерноморье в первой половине XX века фиксировались редкие залеты этого вида, в основном одиночных молодых птиц (Костин, 1983; Тарина, Костин, 2011). В последней трети прошлого столетия количество встреч увеличилось, при этом кроме одиночных особей уже наблюдались группы фламинго до 10 птиц (Бескаравайный, Костин, 1999; Тарасова, 2006). В начале XXI века фламинго в северном Причерноморье из залетного вида постепенно перешел в статус пролетного и зимующего, кроме одиночных птиц и небольших групп иногда численность особей в наблюдаемых стаях доходила до нескольких десятков, увеличилось и время пребывания вида в регионе, его можно было встретить практически круглогодично. Залеты фламинго в Крым с 1990 года участились, а в последние годы стали регулярными и на более продолжительное время, время в равнинной части Крымского полуострова (Тарасова, 2006; Кучеренко, 2015). До 2015 года фиксировались в основном встречи одиночных фламинго и небольших групп, причём преобладали молодые птицы. Позже, с 2016 года фламинго стали появляться в Крыму в том числе и группами в десятки особей, часто большинство из них были половозрелыми особями (Кучеренко та ін., 2017; Сикорский, 2022; Бескаравайный, 2023; наши данные).
Цель работы – установление факта гнездования охраняемого вида розовый фламинго в Крыму и выявление особенностей формирования колонии.
МАТЕРИАЛ И МЕТОДЫ
При написании работы использованы результаты регулярных учётов и эпизодических наблюдений колониальных гидрофильных птиц на косах и островах залива Сиваш. Наблюдения за гнездовой колонией проводились регулярно, с последней декады мая 2024 года до конца июля с интервалом в 1–2 недели. Также проводились наблюдения за состоянием протоки между косой, на которой образовалась колония и Арабатской стрелкой: глубина, течение, наличие кормовых объектов.
Колония фламинго располагалась в южной части Восточного Сиваша (рис. 1), на песчано-ракушечниковой косе, отшнуровавшейся от Арабатской стрелки севернее села Соляного (рис. 2). За длительный период существования косы, она была перемыта в нескольких местах, в том числе у основания. Общая протяженность косы – 3,4 км, ширина наибольшей протоки – более 300 м, средняя ширина косы составляет 45 м, максимальная – 115 м. Высота косы над уровнем воды визуально не превышает 0,3–0,8 м. Расстояние от южной оконечности косы до Арабатской стрелки около 1,7 км. В зависимости от преобладающих течений и ветров, стрелка постепенно изменяет свою конфигурацию. Глубины залива между косой и стрелкой изменяются от 0,5 до 2,3 м. Мощность иловых отложений на дне залива закономерно увеличивается по мере приближения к косе и может достигать 1,5 м. Летом в заливе появляются придонные и плавающие маты нитчатых водорослей, основу которых составляет Cladophora siwaschensis K.I.Meyer 1922. Они могут занимать значительные площади и выполняют структурно-функциональную роль в экосистеме водоёма (Anufriieva et al., 2022).
Наблюдения за птицами велись с разных точек, но не ближе 1,5 км от колонии что бы не потревожить насиживающих птиц, как правило, в промежутке с 5 до 8 часов утра и в вечерние часы, когда марево не мешало наблюдению.
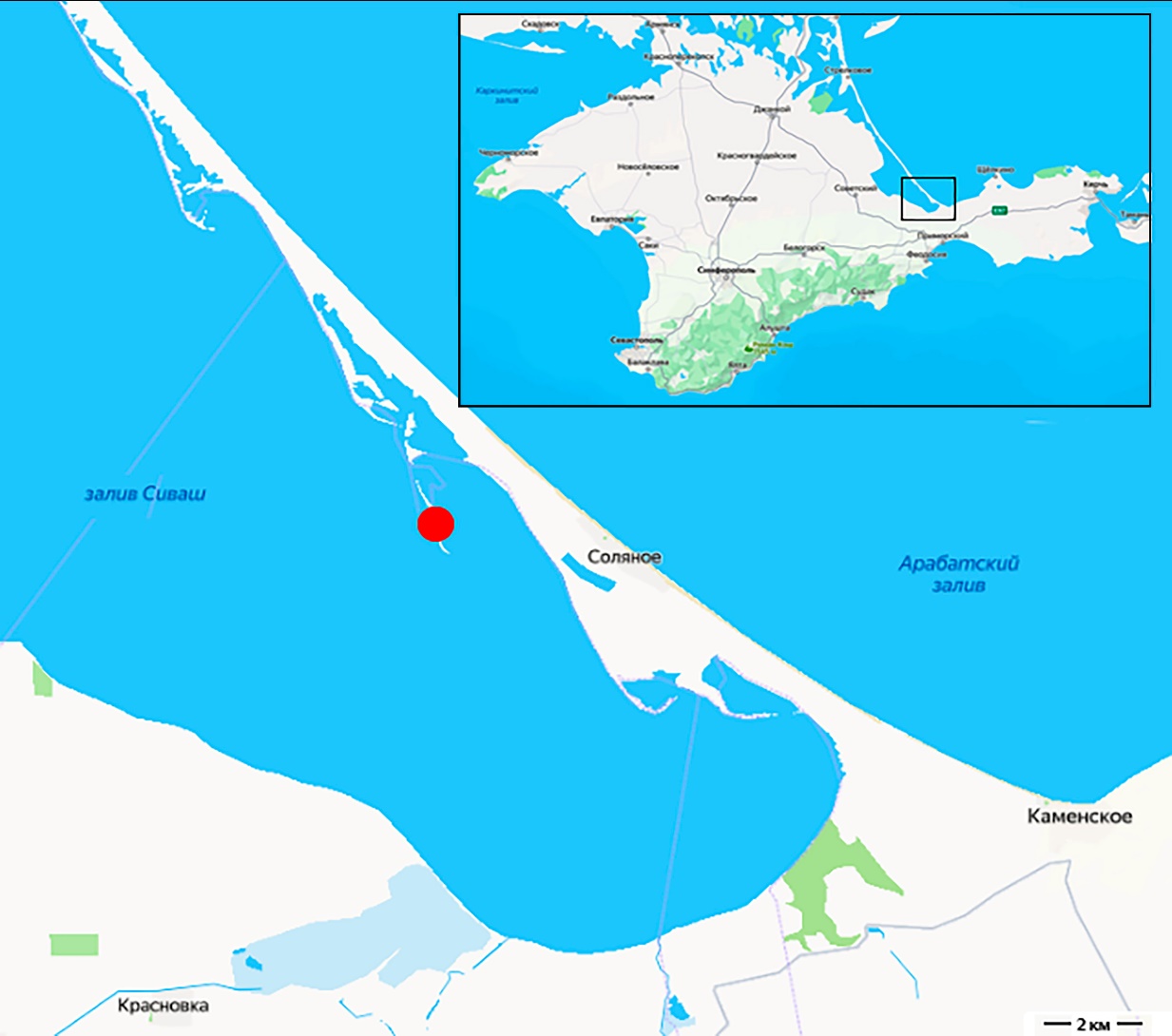
Рис. 1. Расположение колонии фламинго в заливе Сиваш (красный круг)
При наблюдениях использовались бинокли 8–10-кратным увеличением и подзорная труба YUKON 6-100×100 Spektiv. Для камеральной работы, уточнения полученных данных и фактического подтверждения наблюдений применяли фотографирование цифровой фотокамерой Canon EOS 90D с объективом Canon EF 100-400mm f/4.5-5.6L IS II USM, в том числе с использованием телеконвертера Canon EF 1.4X III и штативов.
РЕЗУЛЬТАТЫ
В результате мониторинговых исследований, проводимых нами в последние годы в Западном Крыму, а также на Центральном и Восточном Сиваше, неоднократно фиксировались одиночные птицы и группы фламинго. В частности, отметим наши регистрации птиц с 2020 года (более ранние наблюдения в основном опубликованы разными авторами):
02.02.2020 – Ярылгачская бухта, 2 птицы;
10.06.2020 – озеро Джарылгач, 8 птиц;
12.09.2020 – озеро Сасык-Сиваш, 4 птицы;
29.09.2020 – Сакское озеро в районе Новофёдоровки, одна птица;
20.10.2020 – озеро Джарылгач, 10 птиц;
17.11.2020 – Ярылгачская бухта, 11 птиц, из них 2 молодые (рис. 1);
29.09.2021 – группа из 22 фламинго у основания Арабатской стрелки, среди них 3 молодые птицы;

Рис. 2. Общий вид колонии фламинго в южной части Восточного Сиваша
09.11.2021 – озеро Ярылгач, 22 фламинго;
15.05.2022 – озеро Джарылгач, 20 птиц, из них 3 молодых;
01.07.2022 – плотная группа из 42 взрослых птиц в лагуне Сиваша в 8 км северней Дмитровки, там же на косах колонии – 2000 пар чайконосой крачки (Gelochelidon nilotica (J. F. Gmelin, 1789)), 100 – речной крачки (Sterna hirundo Linnaeus, 1758), 20 – малой крачки (Sternula albifrons (Pallas, 1764)), 1400 пар черноголовой чайки (Ichthyaetus melanocephalus (Temminck, 1820)), 500 – морского голубка (Chroicocephalus genei (Brème, 1839)) и 30 пар шилоклювки (Recurvirostra avosetta Linnaeus, 1758). Примечательно, что колонии большого баклана (Phalacrocorax carbo (Linnaeus, 1758)) в 2022 ещё не сформировались;
07.09.2022 – Джанкойский сброс (севернее с. Чайкино), группа из 20 птиц, из них 3 молодые, там же скопление турухтанов (Philomachus pugnax (Linnaeus, 1758)) – более 8 тыс. птиц;
20.02.2023 – залив Сиваш в районе села Львово – 7 птиц, из них 2 молодые;
06.01.2024 – одиночная молодая птица зимовала в западной части Донузлава.
Большой вклад в наблюдения за птицами в Западном Крыму внесли М. Н. Косарева и В. В. Репях. Частично данные о регистрации фламинго в последние годы, в том числе и по нашим наблюдениям, опубликованы ранее (Кучеренко та ін., 2017; Костин, 2020; Прокопов, Гринченко, 2021; Сикорский, 2022; Anufriieva et al., 2022; Бескаравайный, 2023).
Отметим, что в последние годы в группах взрослых птиц регулярно отмечаются молодые особи (рис. 3).
В начале 2024 года начали регистрироваться отдельные стаи фламинго на севере Керченского полуострова. 29 февраля Н. А. Литвинюк (личное сообщение) наблюдала стаю фламинго в 115 особей в Арабатском заливе у села Щёлкино. Стая остановилась в заливе на расстоянии более 500 м от берега в плотном скоплении. При этом отдельные птицы отлетали в разные стороны на неопределённое расстояние, затем возвращались. Несколько позже, 3 марта, Т. Колесникова сняла видео со стаей фламинго там же (Арабатский залив), насчитывавшей уже 156 птиц.
По сообщению В. А. Бузуна формирование колонии в районе Арабатской стрелки началось в начале апреля – фламинго начали концентрироваться на ракушечной косе, в заливе появились отдельные пары с элементами брачного поведения.
Во время очередных мониторинговых работ на Восточном Сиваше 26.05.2024, в восточной части водоема недалеко от села Соляного, на аккумулятивной песчано-ракушечной косе, отделенной от Арабатской стрелки, нами была найдена гнездовая колония розовых фламинго (рис. 4a). На косе кроме размножающейся группировки фламинго, в восточной части располагалась колония большого баклана, состоящая из четырех субколоний, общей численностью около 650 размножающихся пар. Западную оконечность косы занимало поселение чаек хохотуний (Larus cachinnans Pallas, 1811) численностью около 120 пар.

Рис. 3. Группа фламинго в Ярылгачской бухте с двумя молодыми птицами (17.11.2020)
Гнезда фламинго располагались чуть западнее центра косы, между поселениями чаек хохотуний и больших бакланов и занимала гребень косы. Видимая часть колонии была вытянута более чем на 35 м вдоль косы, гнезда – более 50, располагались плотно друг к другу, почти смыкаясь краями, визуально расстояние между ними было 20–30 см. Гнезда представляли собой в основном усеченные сверху конусы высотой от 20 до 40 см, но часть их была значительно ниже, а на западном участке поселения птицы насиживали кладки почти на уровне грунта, видимо здесь гнезда представляли собой очень низкие постройки, либо располагались ниже водораздельной части косы – в глубине колонии. Пространство в глубину колонии просматривалось плохо, поэтому можно предполагать, что на самом деле гнёзд было больше.
Всего мы насчитали порядка 50 птиц, насиживающих кладки. Вдоль гнезд плотной полосой стояли ещё около 65 фламинго в спокойных позах. Все птицы в районе колонии были половозрелыми особями с ярко выраженным розовым оттенком оперения. В 35–40 м от колонии рыхлой группой держались 13 молодых особей, отличавшихся более мелкими размерами и бледной окраской. Еще 30 птиц находилось на кормежке в разных местах залива. Таким образом, общую численность гнездовой группировки можно оценить в 160–170 птиц. За время наших наблюдений, а это около трех часов, каждые 20–30 минут из колонии на кормежку вылетало от 2 до 7 птиц и столько же возвращалось. Кормились фламинго на мелководье вдоль берега, разлетаясь в трех разных направлениях и иногда перемещаясь между кормящимися группами, во время кормовых перелетов они удалялись от поселения на расстояние до 2 км. Мы застали колониальное поселение на стадии насиживания кладок, что практически совпадает со сроками гнездования вида на Каспии (Чекменев, 1964) и в Центральном Казахстане (Волков, 1984).
По итогам наблюдения за колонией 08 июня 2024 года учтено более 240 взрослых птиц. Колония разделилась на две части: гнездовую, в которой 30–35 птиц сидели на гнёздах и около 50 взрослых фламинго стояли за ними (рис. 4b) и «ясли» с птенцами, число которых превышало 60, причём часть птенцов была в тёмном пуху и ростом с треть взрослой птицы (рис. 4c). Это свидетельствует о том, что при первом посещении колонии в части гнёзд уже были 1–3-х дневные птенцы, а значит, исходя из сроков высиживания яиц (Спангенберг, 1951; Johnson, Cézilly, 2007), яйца были отложены в начале мая, сооружение гнёзд происходило в конце апреля. Десяток птиц ещё токует. В дальней части косы отмечена отдельная группа из 25–27 птиц, они были более светлые (возможно молодые). Около 30 птиц кормились на мелководье.

Рис. 4. Изменение структуры колонии фламинго в течение месяца
a – общий вид колонии (26.05.2024); b, c – разделение колонии на две части – гнездовую и «ясли» (08.06.2024); d, e – колония с птенцами двух возрастов и птицами, сидящими на гнёздах (22.06.2024); f – часть колонии с «яслями», передвигающаяся по косе (08.07.2024).
Колония большого баклана, находящаяся севернее колонии фламинго, заметно увеличилась – до 1500 пар и насчитывает 8 субколоний. В части гнёзд, учтённых ранее, значительно подросли птенцы. У хохотуньи птенцы в 3/4 взрослой птицы. В южной части косы сформировалась смешанная колония морского голубка – около 200 пар и чегравы (Hydroprogne caspia (Pallas, 1770)) 50–100 пар. Кроме того, вдоль косы находились 5–6 одиночных розовых пеликанов (Pelecanus onocrotalus Linnaeus, 1758) и отдельная группа пеликанов из 10 птиц в дальней части, ближе к основанию.
По результатам учётов 22 июня 2024 года размер колонии фламинго увеличился, учтено более 320 взрослых фламинго, 100–110 птенцов двух возрастов, в гнездовой части колонии 30–35 птиц на гнёздах (рис. 4 d, e). Это свидетельствует о том, что синхронизация гнездования происходила внутри трёх групп. То есть, колония увеличивается за счёт подлёта новых групп взрослых птиц. Таких групп было, по крайней мере, три. Следует отметить, что наличие разновозрастных птенцов в колонии, может быть, связано с тем, что приоритет гнездования имеют взрослые птицы, молодые делают кладку позже. Это так называемый случай деспотического распределения, описанный для старых колоний на юге Испании (Rendón et al., 2001). В нашем случае ситуация иная – колонию изначально сформировали взрослые птицы. Конфликтных ситуаций в этой группе мы не наблюдали. Со временем размер колонии закономерно увеличился. В целом колония молодая и небольшая, места для гнездования достаточно, что исключает жесткие конкурентные отношения.
Птицы выглядят здоровыми, окрашены штатно, птенцы растут довольно быстро. Это свидетельствует о достаточной кормовой базе в месте гнездования. Часть колонии с «яслями» стала более мобильна и перемещается вдоль косы. Разлëт за кормом идëт в нескольких направлениях. Часть птиц летит на запад, часть, в северном направлении, вдоль Арабатской стрелки и незначительная часть в южном. Вылет осуществляется одиночно, парами и группами до 39 особей.
На момент проведения наблюдений из колонии большого баклана птенцы уже вылетели, часть взрослых и молодых птиц начали кочёвку вдоль побережья, часть остались сидеть на косе. У хохотуньи также в большинстве случаев птенцы вылетели, примерно у 1 % наблюдаются пуховые птенцы, видимо, у птиц, потерявших кладки. Смешанная колония морского голубка и чегравы разлетелась.
Также отмечено, что расстояние, на котором фламинго проявляют беспокойство составляет порядка 400 м. Они останавливаются, поднимают головы, начинают группироваться в плотное скопление. При этом они также активно реагируют на беспокойство птиц, находящихся поблизости. Сидящие на гнёздах фламинго при беспокойстве распушаются, увеличивая свой визуальный объём, отпугивая потенциального хищника.
По учету 08 июля 2024 года численность птиц и структура колонии практически не изменилась. Часть птиц продолжает сидеть на гнёздах. «Ясли» с подросшими птенцами активно перемещаются по косе. Мы наблюдали как молодые птицы с сопровождающими их взрослыми дружно поднялись и начали перемещаться к южному краю косы. Там они остановились минут на 30 (рис. 4f), после чего начали движение в обратном направлении. Старшие птенцы начали разминать крылья. Некоторые перемещаются по косе самостоятельно, или в сопровождении взрослой птицы. Также наблюдали кормление взрослых птенцов одновременно 5–6 пар. В норме кормление птенцов происходит ночью и в вечернее время (Rendón, 2012). Косвенно это может свидетельствовать о снижении кормовой базы.
В указанный период наблюдений отмечено, что на южную часть восточного Сиваша пришло около 50 000 пролётной пеганки (Tadorna tadorna (Linnaeus, 1758)), которая активно кормилась в заливе, составляя конкуренцию фламинго, поскольку пищевой спектр фламинго и пеганки в значительной степени перекрывается – в питании преобладают артемия и личинки комаров-звонцов (Лысенко, 1991).
По учету 15 июля 2024 года было зарегистрировано 210–220 взрослых птиц. Уже не было группы молодых птиц, а также холостых взрослых птиц, ранее находившихся в колонии. Видимо, не гнездившиеся особи с молодыми птицами ушли на кочёвку. Кроме того, часть взрослых птиц стала улетать из колонии парами, оставляя подросших птенцов, которые стали самостоятельно разбредаться по косе. Однако, самостоятельного кормления птенцов мы не наблюдали, что, вероятно, связано с тем, что уже в 2–3-х м от косы начинаются глубины, превышающие 1,5 м. В целом, количество взрослых птиц, опекающих «ясли» уменьшилось. Число птиц, сидящих на гнёздах, осталось прежним.
У сопутствующих видов – отмечена интенсивная линька большого баклана, количество пеганки не уменьшилось, птицы интенсивно кормились, сидя на воде.
В процессе наблюдения за колонией, мы собрали первичные сведения о линьке фламинго в Крыму. Известно, что сроки, частота и полнота линьки варьируются в зависимости от возраста особей и от того, размножались ли они в течение года (Ogilvie, Ogilvie, 1986). При этом для фламинго характерна активная линька оперения во время гнездования (Андрусенко, 2007). Для успешной линьки необходима хорошая кормовая база (Кошкин, 2012).
Пройдя по кромке берега 26 июля около двух километров, мы собрали в основном перья плечевых и подмышечных групп оперения фламинго, кроме этого, попадались маховые, рулевые (хвостовые) и немного контурных (рис. 5). Находили перья, главным образом, взрослых птиц, но встречались и перья молодых особей. У некоторых летящих птиц четко просматривалось отсутствие парами, то есть с каждой стороны, первостепенных или второстепенных маховых перьев, также видны светлые пятна от сменившихся покровных перьев (рис. 6). Линька последовательная – птицы способности к полету не теряют. То есть она растянута во времени – пока одна пара перьев не подросла другая не выпадает.
Удалось наблюдать две стратегии питания. На начальном этапе (в мае – июне) птицы кормились преимущественно на мелководье – топчась, взмучивая ил с личинками комаров-звонцов и фильтруя его. В июле больше птиц стало кормиться на глубине, практически погружаясь, «ныряя» для добычи корма (рис. 7).

Рис. 5. Перья, собранные по береговой линии в местах линьки фламинго
a, i – подмышечные; b – маховое; c–g рулевые (d – молодой птицы), h – кроющее перо крыла.
ОБСУЖДЕНИЕ
Следует констатировать, что успешному гнездованию фламинго предшествовало формирование благоприятных природно-антропогенных условий. Прежде всего, это изменение гидрологии, и, как следствие, продуктивности экосистемы залива Сиваш. Дело в том, что базовым кормовым ресурсом фламинго является жаброногий рачок артемия (Artemia sp.) (Britton et al., 1986) и личинки комаров-звонцов (хирономиды, или мотыль) (Chironomidae) (Abdulali, 1964).

Рис. 6. Постепенно линяющие фламинго: у верхнего отсутствует пара маховых, хорошо видны пестрины на месте сменяющихся покровных и подмышечных перьев

Рис. 7. Добыча еды фламинго в глубоком месте: тёмные пятна на шее свидетельствуют о систематическом питании таким способом
До введения в строй Северо-Крымского канала, солёность Сиваша в южной части достигала 200 ‰, в районе села Соляного велась добыча поваренной соли. После ввода в эксплуатацию Северо-Крымского канала и начала выращивания риса (в 1970–80 гг. площади рисовых чеков достигали 20 тыс. га, а поливных земель в целом – 400 тыс. га), объёмы сброса пресной воды достигали в 1985 году более 600 млн м3 (Shadrin et al., 2018). Это привело к распреснению Сиваша и превращение его в высокопродуктивный солоноватоводный водоём со средней солёностью 18–22 ‰ (Дьяков и др., 2013).
Современный этап формирования экосистемы Сиваша связан с перекрытием Северо-Крымского канала в апреле 2014 года. Экосистема Сиваша начала стремительно перестраиваться в результате роста солёности, в частности, в южной части залива до 80–112 ‰ (Shadrin et al., 2018; Sergeeva et al., 2019; Anufriieva et al., 2022; Borovskaya et al., 2022; Shadrin et al., 2024). Это привело к гибели пресноводных и солоноватоводных организмов и формированию экосистемы гипергалинного водоёма, характеризующегося невысоким видовым разнообразием с преобладанием ряда организмов, дающих высокую численность и биомассу. В частности, в бентосе начинают преобладать личинки комаров-звонцов, главным образом, Baeotendipes noctivagus (Kieffer, 1911), которые могут достигать численности от 200 до 1400 экз. м 3 (Anufriieva et al., 2022). В 2022 году промышленные запасы личинок хирономид в Сиваше были оценены в 779,5 т (Мирзоян и др., 2023).
Основную массу планктонных организмов составляют цисты, науплии и взрослые стадии артемии. Средняя общая численность рачков может колебаться от 326 тыс. до 1,4 млн экз. м 3 (Shadrin et al., 2024). Общий запас взрослых стадий артемии в целом по заливу в 2022 году оценивался в пределах 1135,5 т, запас цист – 1790,7 т (Мирзоян и др., 2023). В соответствии с тенденцией увеличения численности и биомассы артемии предполагалось, что Сиваш может стать одним из крупнейших в мире мест размножения этого рачка (Anufriieva, Shadrin, 2020).
Значительной численности могут достигать мелкие рачки гарпактикоиды Nitocra typica Boeck, 1865 (11 тыс. экз. м 3) и Cletocamptus retrogressus Schmankevitsch, 1875 (1400 экз. м-3) (Shadrin et al., 2024).
Представленные факты свидетельствуют, что к моменту гнездования фламинго в заливе Сиваш сформировалась достаточная кормовая база. Это подтверждается и нашими наблюдениями. Так, в местах нагона 26 мая 2024 года, можно было наблюдать значительные скопления артемии и цист (рис. 8). Но такие скопления регистрировались довольно локально. При взмучивании прибрежного ила, хорошо было видно поднимающихся личинок комаров-звонцов, хотя численность их мы не оценивали.
Следующим важным условием успешного размножения фламинго является минимизация фактора беспокойства. Здесь выделяется 2 главных фактора – естественный и антропогенный. В Присивашье довольно много хищников, которые способны разорить колонию. К ним относятся: волк (Canis lupus Linnaeus, 1758), шакал (Canis aureus Linnaeus, 1758), лисица (Vulpes vulpes (Linnaeus, 1758)) и енотовидная собака (Nyctereutes procyonoides (Gray, 1834)). В 1984 году в Кызыл-Агачском заповеднике на юго-западном побережье Каспийского моря, гнездовая колония фламинго в 200 пар исчезла из-за хищничества шакалов (Стоцкая, Кривенко, 1988). Проникновение лисы и енотовидной собаки на косы с гнездовыми колониями чайковых в Центральном и Восточном Сиваше нам приходилось наблюдать неоднократно. Два года назад видели следы волка, ходившего на гнездовую колонию большого баклана и хохотуньи в районе Акташского озера.
Следы волка и тропинки вдоль солончака, протоптанные лисой, мы наблюдали при каждом посещении места наблюдения за колонией. В связи с этим крайне важна изоляция колонии то хищников. Естественной защитой здесь выступает протока, отделяющая косу от Арабатской стрелки, она расширяется под действием течений последние 30 лет. В настоящее время ее ширина достигает более 300 м и глубина 1,3–1,7 м при глубине ила 0,2–0,4 м, что является серьезным препятствием для проникновения на данную сушу наземных хищников, представленных в этом районе.

Рис. 8. Скопление в прибрежной полосе взрослой, преимущественно погибшей артемии и цист (26.05.2024, Сиваш, район с. Соляное)
Антропогенный фактор часто имеет определяющее значение для формирования колоний. С 2014 года Сиваш стал пограничной территорией и постоянно патрулировался по крымской стороне российскими вертолетами, в том числе и в ночное время, в следствии чего колониальные поселения там исчезли. В 2022-м году, когда патрулирование прекратилось, нами было зафиксировано появление колониальных поселений нескольких видов чайковых на островах и косах в Сиваше. С 2023 года там стали появляться колонии большого баклана. В мае 2023 года, на косе, где в 2024 году сформировалась колония фламинго, гнездились только чайки хохотуньи и большие бакланы.
Другим важным фактором, негативно влияющим на колониальные поселения птиц в плане беспокойства с одной стороны и подрывающим кормовую базу птиц с другой, является санкционированная добыча в Сиваше водных биологических ресурсов. Добыча хирономид пользователями Российской Федерации стала проводиться в заливе Сиваш с 2014 года. В климатических условиях Сиваша вылов хирономид осуществляется круглогодично с января по декабрь мотыльницами, ручными сачками и рамками-ситами с использованием насосов или помп для взмучивания ила. По официальным данным, объем добычи этого ресурса в 2019 году достиг 690,2 т, в 2021 году – 584,7 т. Рекомендованный вылов цист артемии устанавливался в объеме от 1,5 до 501,8 т (в 2017 году). При этом вылов цист и рачков артемии осуществлялся нерегулярно и варьировал в пределах 0,4–98,9 т (Мирзоян и др., 2023). Примечательно, что в последние годы активная добыча мотыля привела на озере Джарылгач (северо-западный Крым) к резкому сокращению численности летующих и гнездящихся птиц, в том числе занесённых в Красную книгу – шилоклювки, кулика-сороки (Haematopus ostralegus Linnaeus, 1758), ходулочника (Himantopus himantopus (Linnaeus, 1758)), а большого кроншнепа (Numenius arquata (Linnaeus, 1758)) и вовсе перестали регистрировать.
В данных условиях благоприятным для птиц стало сокращение площади акватории и периода промысла хирономид и артемии из-за вводимых Минобороны России ограничений.
Следующим негативным антропогенным фактором являются развитие кайтсерфинга и виндсерфинга на мелководьях Сиваша. Особенно при кайтсерфинге птиц пугает змей-парашют, поднимающийся над водой на высоту более 20 м. У птиц он ассоциируется с крупным пернатым хищником, вызывая панику и разлёт колонии. Кроме того, практически всегда находятся энтузиасты, желающие попасть на косу, где расположилась колония – одни с целью собрать птенцов и яйца, другие просто посмотреть, сделать эффектные фотографии. Так по причине повышенного к ним интереса, группа фламинго покинула озеро Джарылгач, хотя птицы держались там несколько месяцев, та же судьба постигла пару фламинго, посетившую бухту Казачью в Севастополе весной 2020 года.
Отметим, что негативным последствием беспокойства является и то, что птицы покидают гнёзда, оставляя их на разорение. Этим пользуется прежде всего хохотунья, колония которой располагается в непосредственной близости от колонии фламинго. Эти чайки расклёвывают яйца и молодых птенцов (Salathé, 1983). На сегодняшний день от разорения колонию на Сиваше спасает то, что она находится в пограничной зоне и доступ на косу закрыт.
Немаловажным вопросом являются предпосылки появления крупных групп фламинго в Крыму. 16 сентября 2017 года на Центральном Сиваше, в его северной части – полуостров Чокрак, Херсонская область, на момент исследования, территориально относившийся к Украине, З. О. Петровичем и А. С. Настаченко был найден участок с 12 готовыми гнёздами, со следами выведения птенцов и одним недостроенным гнездом фламинго, на основании чего был сделан вывод о том, что здесь располагалась гнездовая колония, там же, в километре от гнёзд была зарегистрирована группа фламинго, включающая 23 взрослых птицы и 3 молодых, двухмесячных, нелётных (Петрович, Настаченко, 2017). Наличие колонии и регистрацию группы размножавшихся фламинго также подтвердили В. М. Попенко и Ю. А. Андрющенко (Попенко, Андрющенко, 2017).
В 2023 году больше 500 фламинго образовали гнездовую колонию под Одессой на Тузловских лиманах, в результате вывелось 192 птенца. В этой группе птиц присутствовали фламинго с кольцами Франции, Турции и Испании (Копытко, 2023). Две окольцованных там молодых птицы были зарегистрированы на зимовке в Болгарии и Турции. В мае 2024 года, по сообщению И. Русева, на Тузловские лиманы прилетело уже 1500 фламинго.
Перемещение такого количества птиц за пределы ареала и образование новых поселений всегда имеет причину. Тем более, что наблюдения фиксируют векторный характер постепенного увеличения присутствия вида в регионе.
Один из возможных факторов, запустивших этот процесс – потепление климата, что могло и отодвинуть на север границу возможного обитания вида, и вызвать трансформацию части биотопов в исконном ареале (Буянов, Осипенко, 2018) с потеплением климата также связывают участившиеся случаи регистрации фламинго в Краснодарском крае (Лохман и др., 2020).
Нельзя обойти тот факт, что в 2021 году при пересыхании на значительной площади озера Туз (Турция) – вода отступила более чем на 10 км, произошла гибель более 5000 нелётных птенцов фламинго (в последние годы в период размножения здесь регистрировалось увеличение числа гнездящихся птиц, в 2019 году было выведено более 20 тыс. птенцов). Причиной гибели стала невозможность добычи птицами достаточного количества пищи, а причиной пересыхания водоёма – изменение климата в результате аридизации (Aydin-Kandemir, Erlat, 2023) и отбор воды на сельскохозяйственные нужды из каналов, питающих озеро. Отметим, что гибель более 500 птенцов фламинго регистрировали здесь и раньше, но тогда списали это на наземных хищников (Balkiz et al., 2009), хотя интенсивные негативные изменения на озере, связанные с недостатком воды регистрировались с 2000 года.
Возможно, этот кризис мест гнездования спровоцировал выселение части популяции. Аналогичные явления наблюдалось в Казахстане, когда появлению постоянных гнездовых колоний на озерах Центрального Казахстана Шалкартениз, Тенгиз и других способствовало неуклонное сокращение площади Каспийского моря и утрата мест гнездования, что обусловило выселение фламинго с морских побережий и миграцию на восток (Кассал, 2021).
Добавим, что весенняя миграция восточной популяции фламинго происходит преимущественно вдоль побережий Каспийского моря, что уменьшает вероятность появления птиц этой группировки в Крыму (Коблик, 2001; Кассал, 2021).
Что касается предсказаний гнездования фламинго в Крыму и формирования к 2022 году «основной гнездовой колонии» (Сикорский, 2023), то, как отмечалось ранее (Бескаравайный, 2023), для этого нет оснований. На протяжении многих лет мы проводим мониторинговые работы на всей акватории Крымской части Сиваша, и группы фламинго, разной численности, в последние годы встречались нам практически ежегодно, но гнездового поведения до 2024 года мы не наблюдали ни разу. Кроме того, нами уже была отмечена вероятность гнездования фламинго в Крыму при условии отсутствии фактора беспокойства (Прокопов, Гринченко, 2021), однако данные условия до 2024 года не могли быть соблюдены, о чём сказано выше.
Относительно возможности постоянного гнездования фламинго в Крыму прогнозы пока строить рано, но можно отметить, что одним из факторов, лимитирующих гнездование вида на Каспии – это хищничество чайки хохотуньи в компоненте с фактором беспокойства. Из лимитирующих факторов также отмечена гибель птицы от удара о провода высоковольтной линии, проходящей в районе озера Джарылгач. Отметим также браконьерство, фактор беспокойства, о которых говорилось ранее. Возможна гибель птиц во время экстремальных зимних похолоданий.
Вся территория Крыма, за исключением населённых пунктов и ООПТ федерального значения относится к охотничьим угодьям. Охота на водоплавающую дичь начинается с 1 сентября и заканчивается 20 января. Начало охоты – большой стресс для птицы. Для фламинго это критический период. После начала охоты все фламинго, за которыми мы ранее наблюдали, особенно на озере Джарылгач, улетали от места беспокойства на значительное расстояние, в том числе за пределы полуострова.
Первоочередной задачей для сохранения и расширения гнездовой колонии фламинго в южной части Восточного Сиваша, является расширение государственного заказника «Арабатский» с включением кос и акватории залива с созданием зоны строгой заповедности в радиусе, как минимум, в 2 км от гнездовья, строгим запретом посещения этой зоны и ограничениями по добыче водных биологических ресурсов в южной части Сиваша.
Положительную роль в сохранении и расширении гнездовой популяции фламинго в Крыму могут стать биотехнические мероприятия. Вдоль Арабатской стрелки есть ещё косы, основание которых может быть перекопано и колонии будут защищены от наземных хищников. Также можно рассмотреть возможность создания дополнительных островов на мелководьях солёных озёр.
Имеется и положительный опыт подобных мероприятий. Во Франции сохранение гнездовий фламинго осуществляется активно с патрулированием территории и применением биотехнических мероприятий, вплоть до отлова хохотуньи, наносившей значительный урон, поедая яйца и маленьких птенцов (Johnson, Cézilly, 2007). В 2012 году искусственный остров для размножения фламинго, площадью 6,5 гектаров был создан в дельте р. Гедиз (Измир, Турция). В 2023 году фламинго вывели здесь 16 тыс. птенцов. Для сохранения колонии, территория максимально изолирована от внешних воздействий, колония огорожена, чтобы туда не могли попасть хищники. Там установлены видеокамеры, и все желающие могут наблюдать за жизнью птиц, находясь в визит-центре. При этом взрослые птицы могут кормиться недалеко от побережья, где развита туристическая инфраструктура и, при соблюдении определённых правил, желающие могут непосредственно наблюдать за ними.
ЗАКЛЮЧЕНИЕ
В 2024 году в южной части Восточного Сиваша сформировались условия для формирования гнездовой колонии розового фламинго. Начало формирования колонии пришлось на конец апреля, в конце мая – начале июня появились первые птенцы. В течение июня колония увеличивалась за счёт прибывающих птиц. Максимальное число зарегистрированных взрослых особей составило 320 птиц, птенцов – 110 двух генераций. На момент обследования в 20-х числах июля часть птиц ещё сидела на гнёздах. Установлено, что у размножающихся птиц проходит последовательная линька, при которой они не теряют способность к полёту.
На момент обследования взрослые птицы и птенцы выглядели хорошо, вели себя спокойно, что свидетельствует о подходящих условиях, в том числе кормовых. Что подтверждает выводы исследователей, изучавших формирование экосистемы Сиваша на последних этапах.
Изоляция колонии от потенциальных наземных хищников была осуществлена за счёт перемыва песчано-ракушечной косы и образования острова, на котором и загнездились фламинго. Формированию колонии также способствовало снятие фактора беспокойства со стороны человека за счёт поддержания приграничного режима и ограничений, введённых Минобороны России.
Изучение динамики перемещения фламинго в последние годы и закономерностей, выявленных различными исследователями, позволило прийти к выводу, что загнезившиеся в Крыму птицы – выходцы из Турции и южной Европы, расширяющие гнездовой ареал на север в результате климатических и антропогенных изменений природных условий.
Отметим, что на Сиваше все подходящие для гнездования островные системы и косы заселены в норме чайками хохотуньями поэтому шанс благополучно вывести потомство у фламинго может быть только при отсутствии спугивания птиц с гнезд в результате воздействия антропогенного фактора. Рамки которого в Крыму очень широки, начиная от деятельности военных по защите территории полуострова от ракетных атак, до посещения островов и кос рыбаками, сёрферами и бердвочерами. Поэтому для сохранения гнездовых стаций фламинго важно расширение государственного заказника «Арабатский» с созданием зоны абсолютного покоя в радиусе 2 км от колонии. Кроме того, успешному гнездованию птиц и увеличению будут способствовать биотехнические мероприятия, проводимые в негнездовое время, в том числе создание искусственных островов на мелководьях.
Учитывая консерватизм фламинго по отношению к местам гнездования и зимовки (Спангенберг, 1951), можно предположить, что при соблюдении соответствующих климатических условий и природоохранных мероприятий, птицы будут возвращаться к колонии на Сиваше многие годы.
Благодарности. Авторы выражают признательность М. Н. Косаревой за всестороннюю помощь в подготовке публикации и обсуждение рукописи, Н. А. Литвинюк (ФГБУ «Заповедный Крым») и В. А. Бузуну за предоставление информации о регистрации фламинго, к. б. н. М. М. Бескаравайному (КНС – ПЗ РАН – филиала ФИЦ ИнБЮМ) за оказание всесторонней консультативной помощи.
Работа выполнена в рамках государственного задания ФИЦ ИнБЮМ по теме «Изучение особенностей структуры и динамики пресноводных экосистем Северного Причерноморья» (№ гос. регистрации 123101900019-5). Частично исследования были профинансированы в рамках работ по ведению государственного учёта численности объектов животного мира, государственного мониторинга и государственного кадастра объектов животного мира Республики Крым в 2020 году.
Андрусенко Н. Н. Биология и территориальные связи казахстанских фламинго // Selevinia: Зоологический ежегодник Казахстана и Центральной Азии. – 2007. – С.124–130.
Бескаравайный М. М. Новые данные о распространении и численности некоторых охраняемых видов птиц Крыма // Экосистемы. – 2023. – № 36. – С. 133–147.
Бескаравайный М. М., Костин С. Ю. Структура и распределение зимней гидрофильной орнитофауны южного берега Крыма // Проблемы изучения фауны юга Украины. – Одесса; Мелитополь, 1999. – С. 19–33.
Буянов И. Ю., Осипенко Я. С. Влияние климатических факторов на кочевки вида Рhoenicopterus roseus // Актуальные проблемы лесного комплекса. – 2018. – № 51. – С. 107–111.
Волков Е. Н. О некоторых особенностях размножения фламинго в Центральном Казахстане // Изучение и охрана заповедных объектов. – Алма–Ата, 1984. – С. 44–45.
Дементьев Г. П., Мекленбурцев Р. Н., Судиловская А. М., Спангенберг Е. П. Птицы Советского Союза. Т. 2. Отряд фламинго. – М.: Советская наука, 1951. – С. 221–227.
Джамирзоев Г. С., Букреев С. А., Караваев А. А. Розовый фламинго Phoenicopterus roseus (Pallas, 1811) // Красная книга Российской Федерации, том «Животные». 2–ое издание. – М.: ФГБУ «ВНИИ Экология», 2021. – С. 551–552.
Дьяков Н. Н., Белогудов А. А., Тимошенко Т. Ю. Оценка составляющих водного баланса залива Сиваш // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. – Севастополь: ЭКОСИ–Гидрофизика, 2013. – Вып. 27. – С. 439–445.
Кассал Б. Ю. Развитие северной части азиатской популяции розового фламинго Phoenicopterus roseus // Байкальский зоологический журнал. – 2021. – № 2. – С. 66–88.
Коблик Е. А. Отряд фламингообразные – Phoenicopteriformes // Разнообразие птиц (по материаламэкспозиции Зоологического музея МГУ). – М.: Издательство МГУ, 2001. – Т. 1. – С. 194–201.
Ковшарь В. А., Карпов Ф. Ф. О необычном месте гнездования фламинго на Каспийском море // Selevinia: Зоологический ежегодник Казахстана и Центральной Азии. – 2016. – Т.24. – С. 20.
Копытко В. Украинские фламинго. Впервые под Одессой вылупилось почти две сотни птенцов (фото) // РБК– Украина (проект Styler). – Одесса, 25.09.2023. Электронный ресурс. Режим доступа: https://www.rbc.ua/ukr/styler/ukrayinski–flamingo–vpershe–pid–odesoyu–vilupilos–1695645864.html
Костин С. Ю. Каталог птиц Крыма. – Симферополь: ИТ «Ариал», 2020. – 244 с.
Костин Ю. В. Птицы Крыма. – М.: Наука, 1983. – 240 с.
Кошкин А. В. О линьке первостепенных маховых у обыкновенного фламинго (Phoenicopterus roseus Pall.) на оз. Тениз (Центральный Казахстан) // Материалы Международной научной конференции «Животный мир Казахстана и сопредельных территорий», посвящённой 80–летию Института зоологии Республики Казахстан. – Алматы, 2012. – С. 265–266.
Кучеренко В. М., Прокопенко С. П., Жеребцова Т. А., Жеребцов Д. Ю. Нові дані по рідкісних птахах Криму // Беркут. – 2017. – Т. 26, вип. 1. – С. 1–4.
Кучеренко В. Н. Фламинго обыкновенный Phoenicopterus roseus (Pallas, 1811) // Красная книга Республики Крым: Животные / отв. ред. С. П. Иванов, А. В. Фатерыга. – Симферополь: Ариал, 2015. – С. 307.
Лохман Ю. В., Солоха А. В., Гожко А. А., Короткий Т. В. Встречи фламинго Phoenicopterus roseus на юге России (Краснодарский край) // Русский орнитологический журнал. – 2020. – Т. 29, № 1920. – С. 2048–2053.
Лысенко В. И. Фауна Украины: в сорока томах. Т. 5: Птицы, Выпуск 3. Гусеобразные. – Киев: Наукова думка, 1991. – 208 с.
Мирзоян А. В., Саенко Е. М., Дудкин С. И. Сырьевая база промысловых беспозвоночных в Азовском море и динамика ее освоения в 2000–2022 гг. // Водные биоресурсы и среда обитания. 2023. Т. 6, № 4. С. 51–67.
Петрович З. О., Настаченко О. С. Фламінго (Phoenicopterus roseus) – новий гніздовий вид фауни України // Беркут. – 2017. – Т. 26, вип. 1. – С. 5–7.
Попенко В. М., Андрющенко Ю. А. Гнездование розового фламинго (Phoenicopterus roseus) в Украине // Бранта. – 2017. – № 20. – С. 220–223.
Прокопов Г. А., Гринченко А. Б. 8.2.1. Животный мир // Доклад о состоянии и охране окружающей среды Республики Крым в 2020 году. – Симферополь, 2021. – С. 131–151.
Сёмик А. М., Жугайло С. С., Окуневич В. А., Замятина Е. М., Пугач М. Н., Филиппова Т. В. Оценка состояния промысловых беспозвоночных залива Сиваш и среды их обитания по результатам мониторинга 2021–2022 гг. // Труды АзНИИРХ. Сборник научных трудов. – Ростов–на–Дону, 2023. – С. 77–88.
Сикорский И. А. Встречи розового фламинго Phoenicopterus roseus в Крымском Приморье и на сопредельных территориях // Устойчивое развитие особо охраняемых природных территорий. Том 9. Сборник статей IX Всероссийской (национальной) научно–практической конференции (6–8 октября 2022, Сочи). – Сочи: ГКУ КК «Природный орнитологический парк в Имеретинской низменности», Донской издательский центр, 2022. – С. 359–366.
Спангенберг Е. П. Отряд фламинго // Птицы Советского Союза. – М.: Советская наука, 1951. – Т. 2. – С. 341–349.
Стоцкая Е. И., Кривенко В. Г. Редкие виды по материалам Всесоюзного учета колониальных гнездовий околоводных и морских птиц // Ресурсы редких животных РСФСР, их охрана и воспроизводство. – М., 1988. – С. 39–46.
Тарасова Е. С. Обыкновенный фламинго (Phoenicopterus roseus) в Украине // Бранта. – 2006. – Вып. 9. – С. 197–200.
Тарина Н. А., Костин С.Ю. Аннотированный список птиц филиала КрПЗ «Лебяжьи острова» // Научные записки природного заповедника «Мыс Мартьян». – 2011. – Вып. 2. – С. 177–215.
Чекменев Д. И. Очерки по биологии колониально гнездящихся птиц озера Тенгиз // Труды Института зоологии АН КазССР. – Алма–Ата: Наука, 1964. – Т. 24. – С. 70–76.
Abdulali H. On the food and other habits of the Greater Flamingo (Phoenicopterus roseus Pallas) in India // Journal of the Bombay Natural History Society. – 1964. – Vol. 61 – P. 60–68.
Anufriieva E., Kolesnikova E., Revkova T., Latushkin A., Shadrin N. Human–Induced Sharp Salinity Changes in the World’s Largest Hypersaline Lagoon Bay Sivash (Crimea) and Their Effects on the Ecosystem // Water. – 2022. – Vol. 14, N 403. – P. 1–13. https://doi.org/10.3390/w14030403
Anufriieva E., Shadrin N. The long–term changes in plankton composition: Is Bay Sivash transforming back into one of the world’s largest habitats of Artemia sp. (Crustacea, Anostraca)? // Aquaculture Research. – 2020. – Vol. 51. – P. 341– 350.
Aydin–Kandemir F., Erlat E. Assessment of the relationship of the salt–covered area and the groundwater storage/drought indicators in the disappearing Lake Tuz in Turkey (1985–2021) // Environmental Monitoring and Assessment. – 2023. – Vol. 195, N 2. – P. 333–342.
Balkiz O., Özesmi U., Pradel R., Germain C., Siki M., Amat Juan A., Rendón–Martos M., Baccetti N., Bechet A. An update of the greater flamingo Phoenicopterus roseus in Turkey // Proceedings of the IVth International Workshop on the Greater Flamingo in the Mediterranean region and northwest Africa. – 2009. – P. 30–33.
Borovskaya R., Krivoguz D., Chernyi S., Kozhurin E., Khorosheltseva V., Zinchenko E. Surface water salinity evaluation and identification for using remote sensing data and machine learning approach // Journal of Marine Science and Engineering. – 2022. – Vol. 10, №. 2. – P. 1–13: е257.
Britton R. H., Robert de Groot E., Johnson A. R. The daily cycle of feeding activity of the Greater Flamingo in relation to the dispersion of the prey Artemia // Wildfowl. – 1986. – Vol. 37. – P. 151–155.
Geraci J., Béchet A., Cézilly F., Ficheux S., Baccetti N., Samraoui B., Wattier R. Greater flamingo colonies around the Mediterranean form a single interbreeding population and share a common history // Journal of Avian Biology. 2012. – Vol. 43 – P. 341–354.
Johnson A., Cézilly F. The Greater Flamingo. – London: T & AD Poyser, 2007. – 250 pp.
Ogilvie M., Ogilvie C. Flamingos. – London, UK.: Alan Sutton Publishing Limited, Gloucester, 1986. – 121 pp.
Rendón M. A., Garrido A., Guerrero J. C., Rendón–Martos M., Amat J. A. Crop size as an index of chick provisioning in the Greater Flamingo Phoenicopterus roseus // Ibis. – 2012. – Vol. 154. – P. 379–388.
Rendón M. A., Garrido A., Ramírez J. M., Rendón–Martos M., Amat J. A. Despotic establishment of breeding colonies of greater flamingos, Phoenicopterus ruber, in southern Spain // Behavioral Ecology and Sociobiology. – 2001. – Vol. 50 – P. 55–60. https://doi.org/10.1007/s002650100326
Sadrin N. V., Anufriieva E. V., Kipriyanova L. M., Kolesnikova E. A., Latushkin A. A., Romanov R. E., Sergeeva N. G. The political decision caused the drastic ecosystem shift of the Sivash Bay (the Sea of Azov) // Quaternary International. – 2018. – Vol. 475. – P. 4–10.
Salathé T. La predation du flamant rose Phoenicopterus ruber roseus par le goeland leucophée Larus cachinnans en Camargue // Revue d’Ecologie (La Terre et la Vie). – 1983. – Vol. 37. – P. 87–115.
Sergeeva N.G., Shadrin N.V., Anufriieva E.V. Long–term changes (1979–2015) in the nematode fauna in Sivash Bay (Sea of Azov), Russia, worldwide the largest hypersaline lagoon, during salinity transformations // Nematology. – 2019. – Vol. 21. – P. 337–347.
Shadrin N., Latushkin A., Yakovenko V., Prazukin A., Anufriieva E. Daily and other short–term changes in the ecosystem components of the world’s largest hypersaline lagoon Bay Sivash (Crimea) // Regional Studies in Marine Science. – 2024. – Vol. 77. – P. 1–11. https://doi.org/10.1016/j.rsma.2024.103643.

