Экосистемы, 32: 85–89 (2022) https://ekosystems.cfuv.ru
![]()
УДК 57.021:57.052:577.29
Новиков И. А.1, Яцкова Е. В.2, Пузанова Е. В.1, Билык А. И.1, Шармагий А. К.2, Оберемок В. В.1, 2
- Крымский федеральный университет имени В. И. Вернадского Симферополь, Республика Крым, Россия
i.nowikow2012@mail.ru, 17obruchka@mail.ru, bilyk.ai97@mail.ru, voloberemok@gmail.com
- Ордена Трудового Красного Знамени Никитский ботанический сад – Национальный научный центр РАН Ялта, Республика Крым, Россия
vercful@mail.ru, alexander_sharma@mail.ru
Pseudococcus viburni Signoret – космополитичный полифаг родом из Южной Америки, активно распространяющийся на Восток с конца XIX века и поражающий сельскохозяйственные и декоративные культуры. Калиновый мучнистый червец характеризуется теми же особенностями, что и остальные представители подотряда Грудохоботные: ослабляет растение, заражает вирусами, провоцирует развитие сажистых грибов. Для борьбы с ним до сих пор вынуждены применять химические инсектициды, так как достойных по эффективности и стоимости биологических препаратов на рынке нет. В данной статье мы предлагаем новый способ борьбы с калиновым мучнистым червецом, основанный на блокировании работы 28S, 18S и 5,8S рибосомальной РНК. Этот метод характеризуется безопасностью для нецелевых объектов, высокой эффективностью и биоразлагаемостью действующего вещества – немодифицированного антисмыслового ДНК-олигонуклеотида (олигонуклеотидного инсектицида, или ДНК-инсектицида, или олинцида). Нами были изучены три ДНК-фрагмента, комплементарные трём рибосомальным генам 28S, 18S и 5,8S рРНК: Альфа-11, Бета-11 и Гамма-11 соответственно. Наилучший результат показал ДНК-инсектицид Бета-11, с помощью которого удалось добиться смертности 78,31 % вредителей на третьи сутки, а олигонуклеотидные инсектициды Альфа-11 и Гамма-11 на третий день показали невысокий уровень смертности: 38,87 % и 36,52 % соответственно. Однако на 14 день из-за отрождения новых особей смертность от олигонуклеотидного инсектицида Бета-11 снизилась до 51,24 %, тогда как олинцид Альфа-11 вызвал смертность 63,42 %, а олинцид Гамма-11 66,69 %. По-видимому, для более эффективной работы необходимо проводить совместную обработку олигонуклеотидными инсектицидами. Полученные результаты показывают перспективность разработки олинцидов для контроля численности калинового мучнистого червеца.
Ключевые слова: антисмысловые технологии, ДНК-инсектициды, олигонуклеотидные инсектициды, олинциды, калиновый мучнистый червец, калина вечнозелёная, Pseudococcus viburni, Viburnum tinus, защита растений.
ВВЕДЕНИЕ
Мучнистые червецы Pseudococcidae – группа насекомых-вредителей, которая наносит значительный экономический ущерб мировому сельскому хозяйству и декоративным насаждениям. Примерно 22 % мучнистых червецов являются полифагами, 20 % обитают на травах (например, сахарном тростнике), 16 % встречаются на растениях цитрусовых и тропических фруктов, а, к примеру, кофе поражает 6 % мучнистых червецов (Franco et al., 2009).
Калиновый мучнистый червец паразитирует на 258 родах растений-хозяев, относящихся
- 91 семействам (García et al., 2016), и может давать от трех до четырех поколений в год (da Silva et al., 2017). Повреждения растению наносят имаго и личинки, питаясь на побегах, листьях, соцветиях и плодах (Gura et al., 2019). Вредители предпочитают располагаться в пазухах листьев, на нижней стороне листовой пластинки и верхушках молодых растений. Данное насекомое считается основным вредителем винограда, поражает также сливу, грушу, вишню, яблоню, айву, малину, ежевику, авокадо, апельсин, люцерну, картофель, томаты, огурец, нут, чечевицу и другие виды растений в зависимости от региона (Dapoto et al., 2011).
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Новиков И. А., Яцкова Е. В., Пузанова Е. В., Билык А. И., Шармагий А. К., Оберемок В. В.
![]()
Потеря урожая происходит, когда мучнистые червецы поражают плоды или выделяют падь, покрывающую плоды, которая служит средой для роста и развития сажистых плесневых грибов (Ciadosporium spp.) (Daane et al., 2008). Также мучнистые червецы являются распространителями вирусов, таких как вирус, ассоциированный со скручиванием листьев виноградной лозы (Cooper et al., 2018).
- качестве инсектицидов для борьбы с калиновым мучнистым червецом применяют метидатион, профенофос, диазинон или бупрофезин, а также их смеси с минеральным маслом или силиконовыми адьювантами (Sazo, 1995; Sazo et al., 2008). Однако эти методы не оправдывают себя, так как вызывают резистентность у насекомого-вредителя, а также наносят значительный ущерб окружающей среде. Биологические методы борьбы используют значительно реже, что связано с их низкой эффективностью и трудоемкостью процесса
(Gunawardana, Hemachandra, 2020).
Недавние исследования по использованию ДНК-инсектицидов против насекомых из подотряда Sternorrhyncha показали их высокую эффективность (Oberemok et al., 2019; Gal’chinsky et al., 2020; Useinov et al., 2020).
Цель работы – разработать и апробировать эффективный олигонуклеотидный инсектицид для контроля численности калинового мучнистого червеца.
МАТЕРИАЛЫ И МЕТОДЫ
На основе имеющихся в GenBank последовательностей были разработаны три целевых олинцида: Альфа-11 (5′ GGTCGCGACGT 3′), Бета-11 (5′ GGAATCGAACC 3′) и Гамма-11 (5′ CCTCAGACAGG 3′), блокирующие работу 28S, 18S и 5,8S рРНК P. viburni соответственно.
Олигонуклеотиды синтезировали на автоматическом ДНК-синтезаторе АСМ-800 (БИОССЕТ, Россия) стандартным фосфорамидитным методом на универсальном твердом носителе UniLinker 500Å (ChemGenes, США). Удаление олигонуклеотидов с твердофазного носителя и снятие защитных групп проводили при температуре 55 ºС в течение ночи с использованием концентрированного раствора аммиака. После раствор фильтровали и упаривали в вакууме на ротационном испарителе (Heidolph, Германия). Полученное твердое вещество растворяли в деионизированной воде до нужной концентрации, измеряя её на спектрофотометре NanoDrop Lite (Thermo Fisher Scientific, США).
Соответствие синтезированных фрагментов ДНК определяли с помощью анализатора BactoSCREEN на базе масс-спектрометра MALDI-ToF (Литех, Россия). Соотношение массы (m) к заряду (z) олигонуклеотидов измеряли в виде положительных ионов с 3-гидроксипиколиновой кислотой в качестве матрицы в соотношении 2:1. Теоретическое отношение m/z рассчитывали в программе ChemDraw 18.0.
Обработки олигонуклеотидными инсектицидами против калинового мучнистого червеца проводились на Южном берегу Крыма в Никитском ботаническом саду с июня по ноябрь 2022 года на растениях калины Viburnum tinus L. Обработку проводили с помощью ручного пульверизатора раствором олигонуклеотидов в деионизированной воде с концентрацией 100 мг/л в трехкратной повторности. Эффект от применения отмечали с третьего по четырнадцатый день после обработки целевыми олигонуклеотидными инсектицидами. Смертность насекомых рассчитывали с учетом отношения погибших особей к общему количеству насекомых, приходящихся на 10 листьев растения при помощи бинокулярного микроскопа Nikon SMZ 745T (Nikon Instruments Inc.,США). В среднем для каждой группы было использовано 108 насекомых.
Для оценки достоверности различий между средними показателями опытных групп и контролем использовали непараметрический критерий хи-квадрат Пирсона (χ2) с поправкой Йейтса (GraphPad Software, США).
86
Первый опыт применения олигонуклеотидных инсектицидов
для контроля численности калинового мучнистого червеца Pseudococcus viburn
![]()
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Измерение соответствия синтезированных олигонуклеотидов, определенное с помощью метода MALDI-TOF, показало, что все олигонуклеотиды соответствуют своей структуре, и полученное соотношение m/z отличается от теоретически рассчитанного не более чем на 10 единиц (табл. 1).
Таблица 1
Результаты анализа синтезированных олигонуклеотидов методом MALDI-TOF
| Олигонуклеотиды | Полученное | Теоретическое | |
| соотношение m/z | соотношение m/z | ||
| Альфа-11 | 3372,56 | 3372,60 | |
| Бета-11 | 3348,36 | 3349,62 | |
| Гамма-11 | 3325,41 | 3325,61 | |
Смертность насекомых от олинцидов наблюдали уже на третий день эксперимента. Использование Бета-11, направленного на блокирование 18S рРНК P. viburni, показало смертность 78,31 % на третий день (χ2=108,3, p<0,001, N=223, dF=1), тогда как после использования олинцида Альфа-11, блокирующего 28S рРНК, и олинцида Гамма-11, блокирующего 5,8S рРНК, обнаружили примерно одинаковую смертность на третий день. Для олинцида Альфа-11 смертность составила 38,87 % (χ2=27,1, p<0,001, N=225, dF=1), а для олинцида Гамма-11 36,52 % (χ2=27,1, p<0,001, N=225, dF=1).
На четырнадцатый день эксперимента олинциды Альфа-11 и Гамма-11 также показывали близкие результаты и смертность насекомых составила 63,42 % (χ2=84,6, p<0,001, N=233, dF=1) и 66,69 % (χ2=90,4, p<0,001, N=224, dF=1) соответственно. В то же время, олинцид Бета-11 показал отрицательную динамику 51,24 % мертвых особей на четырнадцатый день (χ2=58,2, p<0,001, N=231, dF=1). Нами обнаружено, что отрицательная динамика объясняется отрождением новых особей первого возраста, которые и повлияли на расчет смертности.
Если сравнивать эффективность олинцидов между собой, то очевидно, что блокирование 18S рРНК с помощью олинцида Бета-11 вызывает большую смертность и быстрее позволяет добиться снижения численности вредителей, чем блокирование 5,8S и 28S рРНК. Однако, исходя из того, что олинциды являются контактными инсектицидами, можно рекомендовать проводить повторную обработку на третьи или четвёртые сутки, чтобы добиться максимальной эффективности, уничтожая отродившихся из яиц нимф. Также перспективным является возможность совместного применения нескольких олинцидов в одной формуле препарата.
Важно отметить, что ДНК-инсектициды могут решить или улучшить проблему устойчивости к инсектицидам. Если использовать короткие одноцепочечные фрагменты очень консервативных частей генома насекомого-вредителя, устойчивость к инсектицидам будет расти медленнее, потому что потенциальные мутации, изменяющие целевые рибосомальные гены, в консервативных частях происходят с очень низкой скоростью. Таким образом, если мы не в состоянии остановить генетические процессы, приводящие к резистентности насекомых-вредителей к химическим инсектицидам, мы могли бы замедлить её появление, используя олинциды на основе очень консервативных участков функционально важных генов, таких как рибосомальные гены (Drouin, Tsang, 2012). Этот подход имеет огромную ценность, а разработки в этой области могут поспособствовать развитию безопасного и дешевого сельского хозяйства, поддерживаемого ДНК-инсектицидами. Даже биологические и ботанические методы борьбы не способны конкурировать с олинцидами в
87
Новиков И. А., Яцкова Е. В., Пузанова Е. В., Билык А. И., Шармагий А. К., Оберемок В. В.
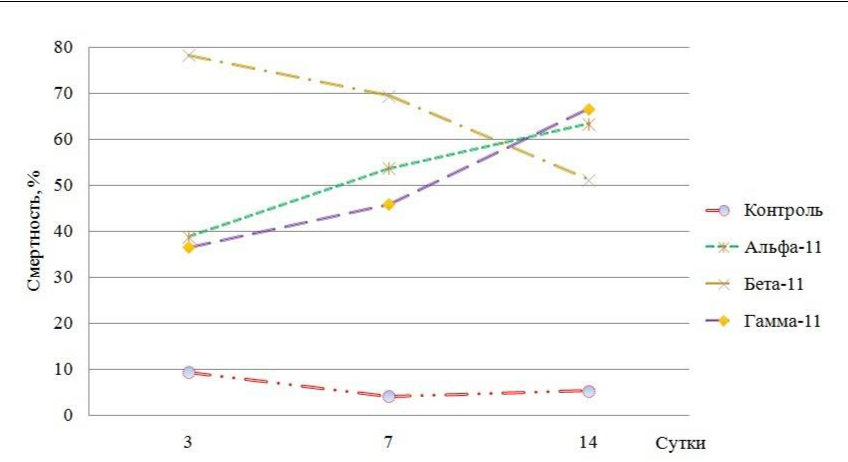
Рис. 1. Смертность личинок Pseudococcus viburni при блокировании
разных рибосомальных РНК
Для Альфа-11 и Бета-11 различия с контрольной группой достоверны (p<0,05).
вопросах резистентности, так как формирование симбиотических взаимоотношений между растением, насекомым-вредителем, их микробиомами и вирусами, затрагивает, как правило неконсервативные участки генома (Pélissié et al., 2018; Oberemok et al., 2021).
ЗАКЛЮЧЕНИЕ
Успешно разработаны и апробированы три олинцида, блокирующие работу 28S, 18S и 5,8S рРНК калинового мучнистого червеца, показавшие высокую инсектицидную активность на четырнадцатый день после обработки в дозировке 100 мг/л.
Исходя из полученных данных, можно предположить, что воздействие на 18S рибосомальной РНК предпочтительнее, чем на 5,8S или 28S рРНК, а также рекомендовать совместное использование трех олинцидов Альфа-11, Бета-11 и Гамма-11 для достижения более высокого инсектицидного эффекта.
Данная гипотеза требует проведения ряда дополнительных экспериментов, в том числе и на других видах насекомых-вредителей из семейства Pseudococcidae.
Исследование выполнено в рамках государственного задания «Разработка олигонуклеотидных конструкций для получения избирательных и высокоэффективных препаратов для медицины и сельского хозяйства» (регистрационный номер FZEG-2021-0009).
Список литературы
Гура Н. А., Стрюкова Н. М., Шипулин А. В. Диагностика Pseudococcus viburni (Signoret) и его отличие от карантинного вида Pseudococcus comstocki (Kuwana) // Фитосанитария. Карантин растений. 2019. Вып. 1, № 27. P. 29–36.
Cooper M. L., Daugherty M. P., Jeske D. R., Almeida R. P. P., Daane K. M. Incidence of Grapevine Leafroll Disease: Effects of Grape Mealybug (Pseudococcus maritimus) Abundance and Pathogen Supply. Journal of economic entomology. 2018. Vol. 111, N 4. P. 1542–1550.
Da Silva V., Nondillo A., Galzer E., Garcia M., Botton M. Effect of host plants on the development, survivorship, and reproduction of Pseudococcus viburni (Hemiptera: Pseudococcidae) // Florida Entomologist. – 2017. – Vol. 100. – N 4. – P. 718–724.
88
Первый опыт применения олигонуклеотидных инсектицидов
для контроля численности калинового мучнистого червеца Pseudococcus viburn
![]()
Daane K. M., Cooper M. L., Triapitsyn S. V., Andrews J. W., Ripa R. Parasitoids of obscure mealybug, Pseudococcus viburni (Hem.: Pseudococcidae) in California: establishment of Pseudaphycus flavidulus (Hym.: Encyrtidae) and discussion of related parasitoid species // Biocontrol Science and Technology. 2008. N 18. Р. 43–57.
Dapoto G. L., Olave A., Bondoni, M., Giganti, H. Obscure Mealybug (Pseudococcus viburni) In Pear Trees in The Alto Valle of Rio Negro andNeuquen, Argentina // ActaHorticulturae. 2011. Vol. 2, N 909. P. 497–504.
Drouin G., Tsang C. 5S rRNA gene arrangements in protists: a case of nonadaptive evolution // Journal of molecular evolution. 2012. Vol. 74, N 5 6. P. 342–351.
Franco J. C., Zada A., Mendel Z. Novel Approaches for the Management of Mealybug Pests // Biorational Control of Arthropod Pests. 2009. P. 233–278.
Gal’chinsky N., Useinov R., Laikova K., Novikov I., Gorlov M., Plugatar Y., Oberemok V. A breakthrough in the efficiency of contact DNA insecticides: rapid high mortality rates in the sap-sucking insects Dynaspidiotus britannicus Comstock and Unaspis euonymi Newstead // Journal of Plant Protection Research. 2020. Vol. 60. P. 220 223.
García Morales M., Denno B. D., Miller D. R., Miller G. L., Ben-Dov Y., Hardy N. B. ScaleNet: a literature-based
model of scale insect biology and systematics / Database: the journal of biological databases and curation. 2016. bav118.
Gunawardana D., Hemachandra Ks. Mass Rearing of Mealybug Predator, Cryptolaemus montrouzieri Mulsant (Coleoptera: Coccinellidae) on two Mealybug Species, Planococcus minor and Pseudococcus viburni // Tropical Agricultural Research. 2020. Vol. 31, N 1. P. 31 41.
Kosztarab M. P. Scale insects of Northeastern North America. Identification, biology, and distribution // Virginia Museum of Natural History Martinsburg. 1996. P. 650.
Oberemok V. V., Puzanova Y. V., Kubyshkin A. V., Kamenetsky-Goldstein R. Top Three Strategies of ss(+)RNA Plant Viruses: Great Opportunists and Ecosystem Tuners with a Small Genome // Viruses. 2021. Vol. 13, N 11. P. 2304.
Pélissié B., Crossley M. S., Cohen Z. P., Schoville S. D. Rapid evolution in insect pests: the importance of space and time in population genomics studies // Current opinion in insect science. 2018. Vol. 26. P. 8–16.
Sazo L. Control de chanchitosblancosenfrutales de hojacaduca // Misceláneas Agrícolas. 1995. N 41. P. 60–63. Sazo L., Araya J. E., de la Cerda J. Effect of a siliconate coadjuvant and insecticides in the control of mealybug of grapevines, Pseudococcus viburni (Hemiptera: Pseudococcidae) // International Journal of Agriculture and Natural
Resources. – 2008. – Vol. 35, N 2. – P. 177 184.
Signoret V. Essaisur les cochenilles ougall insectes (Homoptères – Coccides) // Annales de la Societe Entomologique de France. 1875. N 5. P. 305–352.
Useinov R., Gal’chinsky N., Yatskova E., Novikov I., Puzanova Y., Trikoz N., Sharmagiy A., Plugatar Y., Laikova K., Oberemok V. To bee or not to bee: creating DNA insecticides to replace non-selective organophosphate insecticides for use against the soft scale insect Ceroplastes japonicus Green // Journal of Plant Protection Research. 2020. Vol. 60, N 4. P. 406–409.
Novikov I. A., Yatskova E. V., Puzanova Ye. V., Bilyk A. I., Sharmagiy A. K., Oberemok V. V. The first experience of using oligonucleotide insecticides for the obscure mealybug Pseudococcus viburni Signoret control // Ekosistemy. 2022. Iss. 32. P. 85–89.
Pseudococcus viburni Signoret is a cosmopolitan polyphage native to South America, actively spreading to the East since the end of the XIX century and affecting agricultural and ornamental crops. The obscure mealybug is characterized by the same features as the rest of the representatives of the suborder Sternorrhyncha: it weakens the plant, infects it with viruses, provokes the development of sooty mold. Mainly chemical insecticides are used for its control, as there are no effective and low-cost biological preparations on the market today. In this article, we propose a new approach for the obscure mealybug control, based on blocking the work of 28S, 18S, and 5.8S ribosomal RNAs. This method is characterized by safety for non-target organisms, high efficiency and biodegradability of the active substance – unmodified antisense DNA oligonucleotide (oligonucleotide insecticide, or DNA insecticide, or olinscide). We studied three DNA fragments complementary to the three ribosomal genes 28S, 18S and 5.8S rRNA: Alpha-11, Beta-11, and Gamma-11, respectively. DNA insecticide Beta-11 demonstrated the best result and caused high mortality rate: 78.31 % on the 3rd day, meanwhile oligonucleotide insecticides Alpha-11 and Gamma-11 on the 3rd day showed lower mortality rate: 38.87 % and 36.52 %, respectively. However, on 14th day, due to the hatching of new individuals, mortality rate of the oligonucleotide insecticide Beta-11 decreased to 51.24 %, while olinscide Alpha-11 caused 63.42 % mortality and olinscide Gamma-11 66.69 %. Apparently, combined treatment with oligonucleotide insecticides Alpha-11, Beta-11, and Gamma-11 is necessary for more effective performance. The obtained results reveal the perspective of using olinscides for the obscure mealybug control
Key words: antisense technologies, DNA insecticides, oligonucleotide insecticides, olinscides, the obscure mealybug, Pseudococcus viburni, Viburnum tinus, plant protection.
Поступила в редакцию 12.12.22
Принята к печати 30.12.22
89

