Экосистемы, 36: 187–202 (2023) https://ekosystems.cfuv.ru
УДК 504.45, 543.31, 582.261/.279 DOI 10.5281/zenodo.10377549
О гидрохимическом и альгологическом составе некоторых водных объектов бассейна реки Иж в зимне-ранневесенний период 2023 года
Госькова С. М.1, 2, Алтынцев А. В.2, Дедюхин А. С.3, Смирнов К. Д.4
- Тобольская комплексная научная станция Тобольск, Россия
- Удмуртский государственный университет Ижевск, Россия
- Строительная компания «Контакт» Ижевск, Россия
- Испытательная лаборатория Polymet Trading Limited Ижевск, Россия
goskovasm@tobscience.ru, igz-tsb@udsu.ru, barser.07@mail.ru, smkrl@yandex.ru
В статье обсуждаются гидрохимические и экологические параметры некоторых водных объектов бассейна реки Иж (Удмуртская республика, Россия). Приводятся данные о концентрациях в воде реки Иж, её притоков и находящихся на них проточных водоёмов растворённых форм азота (как суммы азота нитратов, нитритов и аммония), фосфора (в составе ортофосфатов), серы (в составе сульфатов) и 10 тяжёлых металлов (свинца, кадмия, меди, никеля, цинка, железа, марганца, хрома, ванадия и молибдена) в период от подлёдного состояния до таяния снега и их сопоставление с общемировыми значениями для пресных вод из литературных данных. Выявляются точки с превышением ПДК для хозяйственно-питьевого водопользования и точки с максимальными показателями по исследуемым параметрам. Обсуждаются критерий соотношения азот/фосфор и его влияние на таксономический состав альгофлоры, трофический статус исследованных водных объектов в зимне-ранневесенний период и лимитирующие развитие водорослей химические факторы. Также приведено сравнение данных по Ижевскому водохранилищу за 2011 и 2023 годы по 5 показателям (содержания в воде нитратов, ортофосфатов, железа, марганца и меди). Сведения о содержании в пробах ионов биогенных элементов и тяжёлых металлов сопровождаются данными об их роли в метаболизме водорослевых клеток и токсичности. Публикуется таксономический список обнаруженных в пробах воды водорослей, включающий 56 видов из 41 рода, 7 классов,
- отделов, рассматривается их развитие в лабораторных условиях и влияние химического состава воды на формирование альгофлоры.
Ключевые слова: биогенные элементы, тяжёлые металлы, водоросли, река Иж, Ижевское водохранилище, Ижевск.
ВВЕДЕНИЕ
Имеющиеся в литературе сведения о химическом составе поверхностных вод бассейна реки Иж довольно отрывочны, как и данные об их альгофлоре: результаты гидрохимических исследований Ижевского водохранилища в 2010–2011 годах описаны в монографии «Биологические и химические эффекты антропогенного эвтрофирования Ижевского водохранилища» (Котегов и др., 2013). Также сведения о некоторых показателях, превышающих предельно-допустимые концентрации (ПДК), и общей динамике развития фитопланктона доступны из статьи «Состояние фитопланктона Ижевского пруда в районе водозабора МУП города Ижевска «Ижводоканал» в 2002-2005 годах» (Иванова, Шарипова, 2006) и государственного доклада «О состоянии и об охране окружающей среды Удмуртской республики в 2021 году» (Государственный доклад…, 2022).
Цель нашей работы – получить первичную информацию о химическом составе воды нескольких притоков реки Иж и расположенных на них проточных водоёмов и выяснить таксономический состав водорослей в зимне-ранневесенний период 2023 года.
МАТЕРИАЛЫ И МЕТОДЫ
В этой статье представлены данные по содержанию растворённых биогенных элементов (в форме нитратов, нитритов, иона аммония, ортофосфатов и сульфатов) и десяти тяжёлых металлов (железа, меди, марганца, цинка, молибдена, никеля, свинца, ванадия, кадмия и хрома) в 36 пробах природной воды из 23 точек, взятых в период с февраля по апрель 2023 года. Кроме того, приведён список видов водорослей.
Пробы воды отбирались из рек и проточных водоёмов бассейна реки Иж в период с 5 февраля по 3 апреля 2023 года на 9 водных объектах в 23 точках – от 1 до 9 точек на каждом объекте, обозначенных на карте (рис. 1):
река Карлутка (открытая вода):
Кар1 – 56°51′26″ с. ш., 53°13′59″ в. д. Кар2 – 56°50′18″ с. ш., 53°15′01″ в. д.
река Подборенка:
П1 – 56°52′38″ с. ш., 53°11′59″ в. д. П2 – 56°51′27″ с. ш., 53°11′20″ в. д.
река Селычка, пруд:
С1 – 57°09′38″ с. ш., 53°09′41″ в. д. С2 – 57°09′41″ с. ш., 53°09′46″ в. д. С3 – 57°09′14″ с. ш., 53°09′56″ в. д. С4 – 57°09′08″ с. ш., 53°09′50″ в. д.
река Иж выше Ижевского водохранилища:
В1 – 56°55′40″ с. ш., 53°04′52″ в. д. В2 – 56°55′46″ с. ш., 53°04′47″ в. д. В3 – 56°56′14″ с. ш., 53°04′27″ в. д. В4 – 56°56′00″ с. ш., 53°04′32″ в. д.
Ижевское водохранилище:
И.п.1 – 56°51′24″ с. ш., 53°09′56″ в. д. И.п.2 – 56°51′00″ с. ш., 53°11′39″ в. д. И.п.3 – 56°51′27″ с. ш., 53°09′56″ в. д.
река Иж в городской черте (открытая вода):
Иж1 – 56°50′20″ с. ш., 53°11′54″ в. д. Иж2 – 56°50′00″ с. ш., 53°12′10″ в. д. Иж3 – 56°49′43″ с. ш., 53°12′07″ в. д.
река Позимь (открытая вода):
Поз – 56°48′07″ с. ш., 53°13′34″ в. д.
река Иж ниже городских очистных сооружений:
М2 – 56°47′26″ с. ш., 53°13′22″ в. д. М1 – 56°47′21″ с. ш., 53°13′11″ в. д.
река Малиновка, пруд и канал:
Мал.п. – 56°51′40″ с. ш., 53°06′28″ в. д. Канал – 56°51′31″ с. ш., 53°06′55″в. д.
Объём проб – 1 л в каждой точке отбора. Забор воды проводился в каждой точке отбора по всему столбу воды. Всего было собрано и проанализировано 36 проб. Фильтрацию отобранных проб осуществляли при помощи бумажных фильтров, после чего осадок перемещали в прозрачные пластиковые контейнеры объёмом 120 мл и добавляли 100 мл воды, отделённой от общего объёма пробы. Затем контейнеры переносились в помещение с температурой 20–25 °C и естественным освещением.
Видовой состав присутствовавших в пробах водорослей выявляли в первый день после отбора проб; повторно – спустя две недели.
Измерение массовых концентраций тяжёлых металлов (ТМ) было осуществлено по методике ПНД Ф 14.1:2.253-09 (М 01-46-2013) при помощи атомно-абсорбционного спектрометра с электротермической атомизацией «МГА-915МД».
Измерение концентраций ионов биогенных элементов (БЭ) было выполнено при помощи спектрофотометра «UNICO 2100» следующими методами:
– нитраты – фотометрическим методом с салициловой кислотой (ПНД Ф 14.1:2:4.4-95);
– нитриты – фотометрическим методом с реактивом Грисса (ПНД Ф 14.1:2:4.3-95);
– аммоний-ион – фотометрическим методом с реактивом Несслера (ПНД Ф 14.1:2.1-95);
– ортофосфаты – фотометрическим методом с аскорбиновой кислотой (ГОСТ 18309-2014);
– сульфаты – турбидиметрическим методом с хлористым барием (ПНД Ф 14.1:2.159-2000).
Водоросли были идентифицированы с использованием определителей (Царенко, 1990; Куликовский и др., 2016) и электронной базы данных AlgaeBase (2023). Номенклатура таксонов приведена по AlgaeBase (2023).
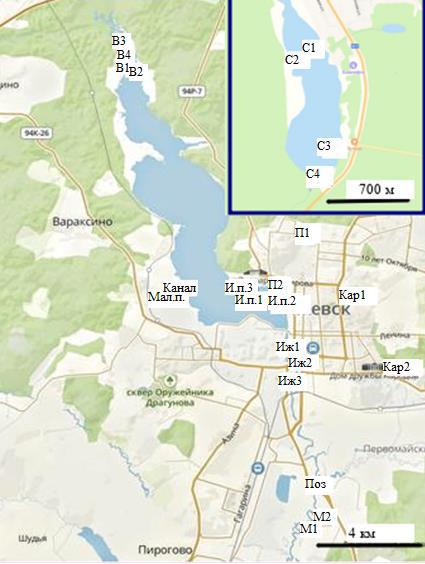
Рис. 1. Карта водных объектов и расположение точек отбора проб. На вставке участок реки Селычка (использован сервис Яндекс Карты)
Таблица 1
Содержание ионов биогенных элементов (мг/дм3) и соотношение N/P в пробах воды из
водных объектов бассейна реки Иж
|
Дата |
Точка отбора и |
|||||||||||
|
отбора |
NO3— |
NO2— |
NH4+ |
oPO43- |
SO42- |
N/P |
||||||
|
номер пробы |
||||||||||||
|
пробы |
||||||||||||
|
06.02 |
Карлутка 1 |
30,6 |
0,02 |
0,30 |
0,03 |
48 |
794 |
|||||
|
Карлутка 2 |
46,0 |
0,02 |
<0,10 |
0,02 |
48 |
1733 |
||||||
|
02.03 |
Карлутка 1/2 |
38,4 |
0,20 |
0,20 |
<0,01 |
45 |
8900 |
|||||
|
27.02 |
Карлутка 2/2 |
42,2 |
0,02 |
0,20 |
0,03 |
47 |
1077 |
|||||
|
11.03 |
Карлутка 1/3 |
18,4 |
0,25 |
<0,10 |
0,05 |
45 |
264 |
|||||
|
Карлутка 2/3 |
23,0 |
0,28 |
0,25 |
0,02 |
48 |
913 |
||||||
|
03.04 |
Карлутка 1/4 |
17,5 |
0,06 |
0,30 |
0,02 |
– |
700 |
|||||
|
Карлутка 2/4 |
24 |
0,14 |
0,10 |
0,01 |
– |
1833 |
||||||
|
06.02 |
Подборенка 1 |
3,0 |
0,01 |
<0,10 |
0,01 |
25 |
226 |
|||||
|
Подборенка 2 |
5,8 |
<0,01 |
<0,10 |
0,02 |
– |
218 |
||||||
|
28.02 |
Позимь 1 |
16,8 |
0,05 |
<0,10 |
0,07 |
– |
190 |
|||||
|
12.03 |
Позимь 1/2 |
11,8 |
0,06 |
2,40 |
<0,01 |
25 |
4550 |
|||||
|
Ижевский |
1,2 |
<0,01 |
<0,10 |
<0,01 |
– |
270 |
||||||
|
пруд 1 |
||||||||||||
|
06.02 |
||||||||||||
|
Ижевский |
5,8 |
0,02 |
0,10 |
0,02 |
– |
233 |
||||||
|
пруд 2 |
||||||||||||
|
13.03 |
Ижевский |
5,2 |
0,01 |
1,60 |
<0,01 |
– |
2420 |
|||||
|
пруд 2/2 |
||||||||||||
|
06.02 |
Ижевский |
20,0 |
<0,01 |
<0,10 |
0,02 |
– |
753 |
|||||
|
пруд 3 |
||||||||||||
|
01.04 |
Ижевский |
17 |
0,05 |
<0,10 |
0,03 |
– |
428 |
|||||
|
пруд 3/2 |
||||||||||||
|
05.02 |
Иж 1 |
4,6 |
0,01 |
0,10 |
0,02 |
– |
186 |
|||||
|
Иж 2 |
2,2 |
0,01 |
<0,10 |
<0,01 |
– |
500 |
||||||
|
13.03 |
Иж 1/2 |
3,0 |
0,20 |
0,15 |
0,06 |
– |
45 |
|||||
|
Иж 2/2 |
3,1 |
0,25 |
0,20 |
0,01 |
13 |
310 |
||||||
|
03.04 |
Иж 1/3 |
7,2 |
0,02 |
0,25 |
0,02 |
– |
303 |
|||||
|
Иж 2/3 |
9,0 |
0,03 |
0,25 |
0,02 |
– |
372 |
||||||
|
20.03 |
Иж 3 |
6,0 |
0,15 |
<0,10 |
0,01 |
24 |
467 |
|||||
|
20.02 |
Воложка 1 |
2,6 |
0,03 |
<0,10 |
0,02 |
– |
100 |
|||||
|
Воложка 2 |
2,8 |
0,01 |
0,10 |
0,02 |
17 |
118 |
||||||
|
01.03 |
Воложка 3 |
4,6 |
0,03 |
0,25 |
0,05 |
12 |
77 |
|||||
|
Воложка 4 |
4,2 |
0,01 |
0,10 |
0,02 |
– |
167 |
||||||
|
Селычка 1 |
11,0 |
0,12 |
<0,10 |
0,16 |
– |
50 |
||||||
|
26.02 |
Селычка 2 |
14,6 |
0,02 |
<0,10 |
0,02 |
22 |
550 |
|||||
|
Селычка 3 |
3,0 |
1,30 |
<0,10 |
0,03 |
18 |
119 |
||||||
|
Селычка 4 |
13,4 |
0,60 |
<0,10 |
<0,01 |
– |
3200 |
||||||
|
20.03 |
Медведево 2 |
17,6 |
0,32 |
0,10 |
0,62 |
30 |
21 |
|||||
|
Медведево 1 |
12,4 |
0,34 |
0,10 |
0,35 |
– |
27 |
||||||
|
Малиновский |
44,0 |
0,01 |
0,10 |
<0,01 |
34 |
10000 |
||||||
|
06.02 |
пруд |
|||||||||||
|
Канал |
20,0 |
0,02 |
<0,10 |
0,08 |
7 |
225 |
||||||
Примечание к таблице. Жирным шрифтом выделены максимальные концентрации ионов; на красном фоне – значения, превышающие ПДКх.–п. по СанПиН 2.1.4.1074-01. Пробы Карлутка 1, 1/2, 1/3, 1/4 – из точки Кар1; Карлутка 2, 2/2, 2/3, 2/4 – из точки Кар2; Подборенка 1, Подборенка 2 – из точек П1 и П2; Позимь 1, Позимь 1/2 – из точки Поз; Ижевский пруд 2 и 2/2, 3 и 3/2 – из точек И.п.2 и И.п.3 соответственно; Ижевский пруд 1 – И.п.1; Иж 1, 1/2, 1/3 – из точки Иж1; Иж 2, 2/2, 2/3 – из точки Иж2; Воложка 1, 2, 3, 4 – из точек В1, В2, В3, В4; Селычка 1, 2, 3, 4 – из точек С1, С2, С3, С4; Медведево 1, 2 – из точек М1, М2; Малиновский пруд – из точки Мал.п.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследуемые БЭ учитывались только в гидролизованной форме, непосредственно доступной для потребления фитопланктоном, то есть растворённый неорганический азот как сумма нитратного, нитритного и аммонийного азота, фосфор ортофосфатов и сульфаты.
Азот. Основные азотосодержащие вещества водорослевой клетки – аминокислоты, нуклеиновые кислоты и хлорофилл. Крупные вакуоли могут содержать значительное количество неорганического азота. На белки и аминокислоты приходится 65–85 % общего азота клетки. Белки составляют 30–60 % клеточной массы, являясь основной азотосодержащей макромолекулярной фракцией. Свободные аминокислоты содержат до 6– 12 % общего азота клетки, однако это значение снижается при его дефиците в среде (Geider, La Roche, 2002). У диатомовых водорослей небольшое количество азота связано в хитиновых структурах.
NO3—: 1,2 – 46,0 мг/дм3 (диапазон полученных значений; то же в последующем). ПДКх.-п. – 45,0 мг/дм3 (СанПиН 2.1.4.1074-01), ПДКрыб. – 40,0 мг/дм3 (Нормативы…, 2020). Здесь и в дальнейшем ПДК для воды хозяйственно-питьевого значения (ПДКх.–п.) указаны по СанПиН 2.1.4.1074-01, ПДК для воды водных объектов рыбохозяйственного значения – по Приказу Министерства сельского хозяйства Российской Федерации от 13.12.2016 №552 (Нормативы…, 2020).
Нитратный азот составляет большую часть растворённого азота. Содержание нитратов в подземных водах обычно значительно выше, чем в поверхностных. Высокое содержание нитратов характерно для выходящих на поверхность грунтовых вод центральной части Удмуртии. Зимой грунтовое питание малых рек и низкая биологическая продукция приводят
- высоким концентрациям нитратов, снижающимся при снеготаянии. NO2—: <0,01 – 1,30 мг/дм3. ПДК – 3,0 мг/дм3, ПДКрыб. – 0,08 мг/дм3.
Нитритный азот присутствует в природной воде как промежуточное звено в цепи нитрификации органического вещества. Его высокие значения сигнализируют о свежем органическом загрязнении. В исследованных пробах содержание нитритов было низким, за исключением пробы «Селычка 3» из нижней части пруда на реке Селычка.
NH4+: <0,10 – 2,40 мг/дм3. ПДКх.–п. – 2,5 мг/дм3, ПДКрыб. – 0,5 мг/дм3.
Не подвергшийся нитрификации аммоний из органических донных отложений может потребляться цианобактериями. Диапазон концентраций в исследованном материале оказался широким с заметным повышением значений при таянии снега.
Фосфор. Фосфор связан преимущественно в нуклеиновых кислотах и фосфолипидах. Наибольшее его количество (около 30 %) содержится в РНК. Неорганический фосфор присутствует в клетках в виде полифосфатных включений, способных содержать до 40 % общего фосфора клетки (Geider, La Roche, 2002). Большая часть фосфора поступает в водоёмы
- поверхностными водами, несущими частицы почвы, в виде смеси орто-, пиро- и полифосфатов, фосфорных эфиров и фосфонатов. В воде соединения фосфора гидролизуются, в том числе ферментативно, до ортофосфата, единственно доступного для потребления бактериями и водорослями (Chorus, Spijkerman, 2021).
PO4 3- (ортофосфаты): <0,01–0,62 мг/ дм3. ПДКх.–п. – 3,5 мг/дм3, ПДКрыб. – 0,05–0,2 мг/дм3 (в зависимости от трофического статуса водоёма).
Фосфор считается основным лимитирующим элементом для развития флоры пресных водоёмов. Поступление фосфора в водотоки с талой водой часто является максимальным за годичный цикл (Rosenberg, Schroth, 2017). Для водоёмов выделяют три основных трофических статуса, исходя из существующих данных по предельно-допустимым концентрациям фосфора. Так, согласно РД 52.24.382-2019, олиготрофные водоёмы содержат до 0,05 мг/дм3 фосфора, мезотрофные – до 0,15 мг/дм3, эвтрофные – до 0,20 мг/дм3. Наибольшие концентрации среди изученных проб соответствовали мезотрофному и эвтрофному статусу, а именно: 0,11 и 0,20 мг/дм3 в пересчёте на фосфор в точках М1 и М2 соответственно. В большей части проб содержание фосфора было низким.
Отношение N/P является основным показателем трофического уровня аквасистемы (Liang et al., 2020). Среднее молярное значение 16:1 (7:1 по массе) считается оптимальным для роста морского фитопланктона, несмотря на видоспецифичность диапазона оптимума. Тем не менее, молярное отношение N/P клетки должно находиться в пределах 10–50 (Сorelli, 1999). Разница потребностей в азоте и фосфоре между водорослевыми группами используется для прогнозирования динамики их вегетации. Так, в описанном в «The nitrogen: phosphorus ratio as a factor…» (Bulgakov, Levich, 1999) лабораторном эксперименте при N/P 5–10 (по массе) доминировали цианобактерии, а при 20–50 – зелёные водоросли. При исследовании канадских озёр, где отношение NO3—/PO43— рассматривалось как приближенное к N/P, цианобактерии доминировали при NO3—/PO43— 3,25–6,5 (по массе), а зелёные водоросли – при NO3—/PO43— 13–32,5 (Hushchyna, Nguyen-Quang, 2017). Применительно к пресноводным водоёмам среда считается азот-лимитированной при N/P<10 и фосфор-лимитированной – при N/P>17. С увеличением N/P трофность снижается. Концентрация хлорофилла, являющаяся основным показателем уровня первичной продукции водоёма, находится в более тесной связи
- содержанием общего фосфора, чем с содержанием общего азота, особенно в олиго-мезотрофных условиях. В гиперэвтрофных условиях оба элемента могут быть лимитирующими. Увеличение концентрации хлорофилла приводит к уменьшению отношения N/P (Ekholm, 2008).
Для всех рассмотренных водных объектов в это время года характерно фосфорное лимитирование (табл. 1). Таксономический состав водорослей в пробах и их развитие показали, что при относительно низких в данном контексте значениях N/P 20–40, а также достаточном содержании фосфора был возможен рост диатомовых водорослей, и прежде всего Melosira varians. При значениях N/P 70–120 и содержании фосфора от 0,2 мг/дм3 развивались хлорофитовые и харофитовые водоросли. Цианобактерии незначительно развились в некоторых пробах со значениями N/P 100–250 и содержанием фосфора до 0,3 мг/дм3. Несовпадение с литературными данными можно объяснить отличием концентраций кремния в сравниваемых водных объектах (в нашем случае рассматривались проточные системы с преимущественно грунтовым в зимний период питанием, предполагающим высокое содержание кремния, дефицит которого в других случаях, в том числе рассмотренных в литературе озёр, мог исключить диатомовые водоросли из состава доминантов), существенной разницей физических условий исследования, заданных сезоном и типом водных объектов, и в силу этой причины – изначально разным таксономическим составом водорослей. Кроме того, относительно небольшие объёмы проб и размер выборки в нашем исследовании могли увеличить вероятность случайных явлений.
Сера. SO42-: 7–48 мг/дм3. ПДКх.–п. – 500 мг/дм3, ПДКрыб. – 100 мг/дм3.
Пресные воды характеризуются большим диапазоном концентраций серы (5–500 мг/дм3), что часто приводит к её недостатку для гидрофлоры. В морских экосистемах ситуация противоположна: содержание серы обычно не является лимитирующим фактором и к тому же оно не претерпевает значительных сезонных колебаний. Растительными клетками сера потребляется в виде сульфата, после этого, в хлоропластах, сульфат-ион восстанавливается до сульфида и включается в состав цистеина, который затем может быть трансформирован в метионин и глутатион (Giordano et al., 2008). В морских водорослях большая часть серы связывается в несущем осмолитическую функцию диметилсульфониопропионате. Важно отметить, что некоторые пресноводные водоросли сохраняют способность к его синтезу, несмотря на низкие концентрации сульфатов (Toda et al., 2023). Отдельные группы пресноводных водорослей способны также к выделению летучих серосодержащих соединений и тиоэфиров (Xuwei et al., 2022). Кроме того, серосодержащие мембранные белки являются важным фактором устойчивости водорослей к действию ТМ (Ferrari et al., 2022).
Pb: <2,0–32,67 мкг/дм3. ПДКх.–п. – 30 мкг/дм3, ПДКрыб. – 6 мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от
9300 мкг/дм3 в 1970-х годах до 116100 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020).
Таблица 2
Содержание тяжёлых металлов (мкг/дм3) в пробах воды из водных объектов
бассейна реки Иж
|
Точка и |
||||||||||
|
номер |
Pb |
Cd |
Cu |
Ni |
Zn |
Fe |
Mn |
Cr |
V |
Mo |
|
пробы |
||||||||||
|
Кар1 |
3,72 |
<0,2 |
12,45 |
<5,0 |
6,22 |
1315,11 |
41,42 |
2,68 |
<1,0 |
1,756 |
|
Кар2 |
11,18 |
0,482 |
34,16 |
6,27 |
21,05 |
901,20 |
137,21 |
4,12 |
1,640 |
2,340 |
|
Кар1/2 |
32,67 |
0,303 |
10,37 |
5,17 |
19,67 |
824,19 |
58,90 |
3,92 |
<1,0 |
2,223 |
|
Кар2/2 |
26,63 |
0,595 |
41,41 |
8,97 |
35,28 |
800,42 |
73,61 |
7,02 |
2,180 |
7,342 |
|
Кар1/3 |
9,05 |
0,239 |
21,25 |
5,24 |
30,97 |
534,14 |
44,49 |
3,73 |
<1,0 |
3,196 |
|
Кар2/3 |
16,35 |
0,428 |
48,60 |
6,85 |
54,43 |
685,79 |
62,34 |
5,58 |
1,775 |
4,382 |
|
П1 |
2,91 |
<0,2 |
5,56 |
<5,0 |
11,18 |
738,80 |
36,79 |
2,51 |
<1,0 |
1,472 |
|
П2 |
2,97 |
<0,2 |
4,02 |
<5,0 |
7,00 |
411,67 |
72,66 |
2,76 |
<1,0 |
1,134 |
|
Поз1 |
25,53 |
0,297 |
51,21 |
6,70 |
30,01 |
1523,54 |
53,38 |
4,18 |
2,130 |
4,533 |
|
Поз1/2 |
8,11 |
<0,2 |
43,35 |
<5,0 |
31,00 |
816,52 |
30,34 |
2,88 |
<1,0 |
2,089 |
|
С1 |
<2,0 |
<0,2 |
1,15 |
<5,0 |
<5,0 |
282,86 |
7,49 |
<2,5 |
<1,0 |
<1,0 |
|
С2 |
<2,0 |
<0,2 |
3,43 |
<5,0 |
6,25 |
310,13 |
10,33 |
<2,5 |
<1,0 |
<1,0 |
|
С3 |
<2,0 |
<0,2 |
2,80 |
<5,0 |
<5,0 |
171,13 |
11,65 |
<2,5 |
<1,0 |
<1,0 |
|
С4 |
2,05 |
<0,2 |
5,06 |
<5,0 |
5,78 |
394,70 |
15,66 |
2,82 |
<1,0 |
<1,0 |
|
В1 |
<2,0 |
<0,2 |
3,65 |
<5,0 |
<5,0 |
158,21 |
19,64 |
<2,5 |
<1,0 |
<1,0 |
|
В2 |
<2,0 |
<0,2 |
2,18 |
<5,0 |
<5,0 |
74,23 |
14,69 |
<2,5 |
<1,0 |
1,120 |
|
В3 |
<2,0 |
<0,2 |
5,40 |
<5,0 |
7,14 |
315,62 |
24,17 |
2,90 |
<1,0 |
1,244 |
|
В4 |
<2,0 |
<0,2 |
3,25 |
<5,0 |
5,85 |
208,94 |
13,83 |
<2,5 |
<1,0 |
<1,0 |
|
И.п.1 |
<2,0 |
<0,2 |
1,51 |
<5,0 |
6,10 |
250,10 |
11,37 |
<2,5 |
<1,0 |
<1,0 |
|
И.п.2 |
<2,0 |
<0,2 |
3,27 |
<5,0 |
8,41 |
146,30 |
27,06 |
<2,5 |
<1,0 |
<1,0 |
|
И.п.3 |
2,01 |
<0,2 |
7,53 |
<5,0 |
5,86 |
513,08 |
21,59 |
<2,5 |
<1,0 |
<1,0 |
|
И.п.2/2 |
<2,0 |
<0,2 |
2,42 |
<5,0 |
10,03 |
338,24 |
25,80 |
<2,5 |
<1,0 |
<1,0 |
|
Иж1 |
2,23 |
<0,2 |
4,53 |
<5,0 |
<5,0 |
199,25 |
26,82 |
<2,5 |
1,284 |
<1,0 |
|
Иж2 |
2,40 |
<0,2 |
3,19 |
<5,0 |
<5,0 |
416,12 |
15,80 |
<2,5 |
1,154 |
1,017 |
|
Иж1/2 |
2,84 |
<0,2 |
7,83 |
<5,0 |
7,36 |
453,73 |
33,14 |
<2,5 |
<1,0 |
<1,0 |
|
Иж2/2 |
3,46 |
<0,2 |
5,31 |
<5,0 |
7,51 |
402,87 |
35,68 |
<2,5 |
<1,0 |
1,358 |
|
Иж3 |
4,45 |
<0,2 |
10,39 |
<5,0 |
10,90 |
514,74 |
38,28 |
<2,5 |
<1,0 |
<1,0 |
|
М2 |
8,80 |
<0,2 |
25,72 |
<5,0 |
22,80 |
682,43 |
44,53 |
4,23 |
<1,0 |
2,356 |
|
М1 |
5,26 |
<0,2 |
16,11 |
<5,0 |
13,01 |
433,83 |
26,81 |
2,85 |
<1,0 |
1,029 |
|
Мал.п. |
2,14 |
<0,2 |
4,15 |
5,01 |
<5,0 |
207,40 |
5,59 |
2,60 |
<1,0 |
<1,0 |
|
Канал |
4,08 |
<0,2 |
8,49 |
<5,0 |
<5,0 |
285,26 |
25,44 |
<2,5 |
<1,0 |
<1,0 |
Примечание к таблице. Выделенные красным цветом значения превышают ПДКх.–п. по СанПиН 2.1.4.1074-01. Максимальные концентрации элементов выделены жирным шрифтом. Обозначения проб соответствуют таковым в таблице 1: Кар1, 2, 1/2, 2/2, 1/3, 2/3 – Карлутка 1, 2, 1/2, 2/2, 1/3, 2/3; П1, П2 – Подборенка 1, 2; Поз1, Поз1/2 – Позимь 1, 1/2; С1, 2, 3, 4 – Селычка 1, 2, 3, 4; В1, 2, 3, 4 – Воложка 1, 2, 3, 4; И.п.1, 2, 3, 2/2 – Ижевский пруд 1, 2, 3, 2/2; М1, 2 – Медведево 1, 2; Мал.п. – Малиновский пруд. Даты отбора проб приведены в таблице 1.
Содержание в речных водах от 1 до 23 мкг/дм3 (Грушко, 1979). Функции свинца в метаболизме водорослей неизвестны. В высоких концентрациях (от 2000 мкг/л) приводит к аномалиям в морфологии, а также ингибирует фотосинтез (Zakeri, Abu Bakar, 2013).
Полученные нами значения содержания Pb сильно варьируют во времени. Повышение содержания элемента наблюдалось в черте города. В пробе Кар 1/2 из реки Карлутки было зафиксировано незначительное превышение ПДК свинца.
Cd: <0,2–0,595 мкг/дм3. ПДКх.–п. – 1мкг/дм3 , ПДКрыб. – 5 мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от
800 мкг/дм3 в 1970-х годах до 25300 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020). В незагрязнённых речных водах концентрации не превышают 1 мкг/дм3 (Логинова, Лопух, 2011). Кадмий не причисляют к необходимым для водорослей микроэлементам, хотя существует предположение, что наряду с цинком и кобальтом он играет роль в ассимиляции углерода (Markham et al., 1980). По экспериментальным сведениям, кадмий ингибирует рост водорослевых культур в концентрациях от 0,5 мкг/л (Huiling et al., 2012). Также известно, что макроводоросли способны аккумулировать кадмий (Markham et al., 1980). По нашим данным,
- одной из карлутских проб (Кар 2/2) было зафиксировано превышение вышеуказанного порога токсичности.
Cu: 1,15–51,21 мкг/дм3. ПДКх.–п. – 1000 мкг/дм3, ПДКрыб. – 1мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от
5900 мкг/дм3 в 1970-х годах до 119900 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020).
Концентрация в незагрязнённых пресных водах от 2 до 30 мкг/дм3 (Логинова, Лопух, 2011). Медь является необходимым элементом в системах фотосинтеза и дыхания, однако при
высоких концентрациях Cu становится одним из самых токсичных для водорослей металлом:
- эксперименте рост зелёных водорослей прекращался при концентрациях от 2000 мкг/л (Huiling et al., 2012). Токсическое воздействие этого элемента в основном связано с конкурентным ингибированием других металл-зависимых систем в живых клетках (Brand et al., 1986).
Ni: <5,0–8,97 мкг/дм3. ПДКх.–п. – 100 мкг/дм3, ПДКрыб. – 10 мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от
1400 мкг/дм3 в 1970-х годах до 80900 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020).
Концентрация в незагрязнённых речных водах от 0,8 до 10 мкг/дм3 (Логинова, Лопух, 2011). В подземных водах содержание никеля тысячекратно возрастает. Этот переходный металл входит в состав отдельных ферментов, основными из которых являются Ni-зависимые уреаза и супероксиддисмутаза (Frausto da Silva, Williams, 2001; Ahmad, Ashraf, 2011; Broadley et al., 2012; Polacco et al., 2012; Kleiven, 2014). Также никель способен ингибировать внутриклеточные биохимические процессы с участием марганца, поскольку оба этих элемента имеют сходную структуру (Frausto da Silva, Williams, 2001). Есть сведения, что при высоких концентрациях Ni подавляет рост диатомовых водорослей (Fezy et al., 1979).
Zn: <5,0–54,43 мкг/дм3. ПДКх.–п. – 5000 мкг/дм3, ПДКрыб. – 10 мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от
52200 мкг/дм3 в 1970-х годах до 1180000 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020).
Содержание элемента в речных водах от 3 до 120 мкг/л (Логинова, Лопух, 2011).
Цинк является структурным компонентом ряда дегидрогеназ (глутаматдегидрогеназы, алкогольдегидрогеназы и другие), фосфолипазы, щелочной фосфатазы, Cu/Zn-зависимой супероксиддисмутазы, а также рибулозо-1,5-бисфосфаткарбоксилазы и карбоангидразы, участвующих в процессе фотосинтеза (Brown et al., 1993; Krämer, Clemens, 2005; Srivastava, Gupta, 1996). Кроме того, выявлена существенная роль цинка в транскрипции и синтезе нуклеиновых кислот (Krämer, Clemens, 2005; Xu et al., 2012), поскольку он входит в состав ферментов гистондиацетазы, ДНК- и РНК-полимераз (Krämer, Clemens, 2005), а также принимает регулятивное участие в трансляции (Krämer, Clemens, 2005; Sharma et al., 1982).
Цинк является наиболее распространённым в ионной форме микроэлементом цитоплазмы аэробных организмов (Frausto da Silva, Williams, 2001), однако при высоких концентрациях он может быть токсичен для клеток водорослей (Manahan, 2010).
Feобщ.: 74,23–1523,54 мкг/дм3. ПДКх.–п. – 300 мкг/дм3, ПДКрыб. – 100 мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от 967100
мкг/дм3 в 1970-х годах до 1479500 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020). Среднее содержание элемента в речной воде от 3 до 1560 мкг/дм3 (Никаноров, 2001). В подземных водах содержание элемента может быть в сотни раз выше. Потребность в железе для дыхания и роста у клетки морской водоросли составляет примерно 10 ммоль на 1 моль C (5 % от массы углерода), для азотфиксирующих цианобактерий – 200 ммоль на 1 моль C (93 % от массы углерода) (Morel et al., 1991).
-
- исследованных пробах концентрации железа довольно высоки. Этот элемент не является лимитирующим для развития водной флоры на данной территории. Повышенное
содержание железа в зимний период характерно для придонных слоёв воды высокотрофных водоёмов, однако в рассмотренном случае концентрации были выше в водотоках. Часто концентрация железа убывала вниз по течению, указывая на малый вклад донных отложений как биогенного источника элемента, а также на частичное депонирование в водотоках в виде гидроксида или в биомассе.
Mn: 5,59–137,21 мкг/дм3. ПДКх.–п. – 100 мкг/дм3, ПДКрыб. – 10 мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от 444800 мкг/дм3 в 1970-х годах до 518000 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020). Содержание элемента в речной воде от 1 до 160 мкг/дм3 (Логинова, Лопух, 2011).
Марганец встречается в водной среде в растворённой и коллоидной формах. Элемент способен накапливаться в донных отложениях и биомассе (Švec et al., 2016). В клетках водорослей входит в состав фотосистемы II, а также ряда белков, в том числе и ферментов (Frausto da Silva, Williams, 2001; Kleiven, 2014). Кроме того, отмечено влияние данного микроэлемента на рост водорослей (Rousch, Sommerfeld, 1999; Liu et al., 2018).
Cr: <2,5–7,02 мкг/дм3. ПДКх.–п. – 50 мкг/дм3, ПДКрыб. – 90 мкг/дм3.
Общемировые средние значения содержания элемента в поверхностных водах: от 4900 мкг/дм3 в 1980-х годах до 138400 мкг/дм3 в 2010-х годах (Qiaoqiao et al., 2020). Содержание элемента в незагрязнённых речных водах от 0,1 до 10 мкг/л (Логинова, Лопух, 2011). Хром не является необходимым элементом в метаболизме какой-либо водорослевой группы и может ингибировать клеточное деление в концентрациях от 1000 мкг/дм3 (Wilson et al., 2019).
V: <1,0–2,180 мкг/дм3. ПДКх.–п. – 100 мкг/дм3, ПДКрыб. – 1 мкг/дм3.
Среднее содержание элемента в речной воде от 0,2 до 40 мкг/дм3 (Грушко, 1979). Известно об участии ванадия в процессе синтеза хлорофилла у зелёных водорослей. Сведения
- его способности заменять молибден в нитрогеназе цианобактерий не нашли подтверждений. При концентрациях от 100 мкг/дм3 ванадий оказывает ингибирующий эффект на рост водорослей, влияя на ядерный аппарат. Высокое содержание ванадия приводит у зелёных водорослей к утолщению клеточных стенок и повышенной вакуолизации. Дефицит ванадия может проявляться в избыточном накоплении крахмала (Lee et al., 1979).
Полученные нами данные указывают на постоянное присутствие ванадия в нижнем течении Карлутки, а также на падение концентрации элемента в других точках с началом снеготаяния.
Mo: <1,0–7,342 мкг/дм3. ПДКх.–п. – 250 мкг/дм3, ПДКрыб. – 1 мкг/дм3.
Диапазон концентраций элемента в речных водах от 2,1 до 10,6 мкг/дм3 (Логинова, Лопух, 2011). Молибден входит в состав ряда растительных ферментов (молибдоэнзимов) и нитрогеназы цианобактерий. Для водорослей он значительно менее токсичен, чем другие ТМ
– до концентраций в десятки мг/дм3 (Molybdenum…, 2021). Полученные данные указывают на стабильное присутствие элемента в определённых точках независимо от таяния. На участках с низким содержанием ионов металла Mo способен стать лимитирующим фактором в развитии водорослей, однако из-за высокой мобильности элемента большая часть дефицитного ресурса может быть связана в биомассе.
Как видно из таблицы 3, пробы, отобранные в нижнем течении Карлутки, содержали самые высокие концентрации ТМ в течение всего периода наблюдений. С нижним течением реки Позимь и её притоком Карлуткой была связана наибольшая часть максимальных концентраций как ТМ, так и БЭ. Вероятно, это связано с прохождением этих рек в нижнем течении по территориям с высоким антропогенным воздействием.
Сравнение с данными по Ижевскому водохранилищу за 2011 год показывает снижение содержания нитратов, фосфатов, железа и марганца, а также повышение содержания меди (табл. 4). Поиск причин этих изменений требует дополнительных комплексных исследований.
-
- изученных пробах было выявлено 56 видов водорослей из 41 рода (табл. 5), однако некоторые были идентифицированы только по неорганическим остаткам. Наибольшим разнообразием представлен класс Bacillariophyceae (40 видов), менее разнообразны
Таблица 3
Распределение максимумов содержания тяжёлых металлов и ионов биогенных элементов
|
Концентрация |
Точка отбора и номер пробы |
|||||||||
|
Карлутка |
Позимь |
|||||||||
|
1 |
1/2 |
2 |
2/2 |
2/3 |
1 |
1/2 |
Селычка3 |
Медведево2 |
||
|
max |
Pb |
NO3—, |
Cd, Ni, |
Zn |
Fe, Cu |
NH4+ |
NO2— |
PO43- |
||
|
Mn |
Cr, V, Mo |
|||||||||
|
submax |
Fe |
Cd |
Pb, Zn, |
Cu, Cr, |
V, Mo |
|||||
|
Mn |
Ni |
|||||||||
|
s.submax |
NH4+ |
Fe |
NO3— |
Cd, V, |
Pb, Ni |
Cu, Zn |
NO2—, |
|||
|
Mo |
Cr |
|||||||||
Таблица 4
Сравнительная таблица концентраций некоторых элементов в воде Ижевского
водохранилища в 2011 (Котегов и др., 2013) и 2023 годах
|
БЭиТМ |
Февраль 2011 года |
Февраль 2023 года |
||
|
D |
M |
D |
M |
|
|
NO3—, мг/л |
0,37–38,60 |
6,57 |
1,2–20,00 |
5,87 |
|
PO43-, мг/л |
0,05–0,71 |
0,16 |
<0,01–0,05 |
0,02 |
|
Fe, мкг/л |
<100–570 |
393 |
74,23–513,08 |
259,77 |
|
Mn, мкг/л |
<10–95,00 |
36,80 |
11,37–72,66 |
25,20 |
|
Cu, мкг/л |
1,19–3,40 |
2,20 |
1,51–7,53 |
3,85 |
Примечание к таблице. D – диапазон значений; M – среднее значение.
представители класса Cyanophyceae из отдела Cyanobacteria (7 видов), классов Trebouxiophyceae и Chlorophyceae отдела Chlorophyta (6 видов); классы Zygnematophyceae, Xanthophyceae и Chrysophyceae представлены одним видом каждый.
-
- реке Карлутка водорослевая флора была представлена единичными мелкими диатомовыми. В пробах из пруда на реке Селычка наблюдалось большое разнообразие створок крупных бентосных диатомовых; в точке С1 – заметное количество цианобактерий;
- пробе из точки С3 Oocystis быстро увеличил численность наряду с Closterium. Свежие пробы из точек В1-В4 содержали большое количество минерализованных ножек Anthophysa; диатомовые наблюдались единично; в пробах развились нити Cladophora. В пробах из Ижевского водохранилища были многочисленны створки Ulnaria, другие диатомовые встречались единично; в пробе из точки И.п.1 в массе развилась Tribonema vulgare. В Иже ниже водохранилища отмечалось значительное количество планктона и перифитона, сложенных преимущественно Tabellariaceae и Ulnariaceae; в пробах развился Nostoc. Ниже по течению, в точках М1-М2, диатомовые были также многочисленны, со значительной долей вынесенных в планктон бентосных форм; в свежих пробах присутсвовали гормогонии цианобактерий; в пробе из точки М1 массово развилась Melosira varians.
При переносе альгологических проб в лабораторные условия и соответствующей смене светового и температурного режимов цианобактерии, даже при заметном начальном присутствии, не переходили к массовому развитию. Также очень умеренным был рост зелёных водорослей, в то время как диатомовые или десмидиевые водоросли быстро увеличивали численность и массу. Преобладание диатомовых в холодное время года типично для водотоков умеренных широт, и в наших пробах они продолжали доминировать при смене
Таблица 5
Таксономический состав водорослей, обнаруженных в пробах воды
из водных объектов бассейна реки Иж
|
Водный |
Таксономический состав |
|
|
объект |
||
|
C: Oscillatoria sp. |
||
|
Карлутка |
Phormidium sp. |
|
|
B: Pinnularia septentrionalis Krammer, 2000 |
||
|
Pinnularia flexuosa Cleve, 1895 |
||
|
Surirella librile (Ehrenberg) Ehrenberg, 1845 |
||
|
Navicula sp. |
||
|
C: Chroococcus sp. |
||
|
Isocystis sp. |
||
|
Merismopedia sp. |
||
|
Oscillatoria sp. |
||
|
B: Amphora ovalis (Kützing) Kützing, 1844 |
||
|
Anomoeoneis sphaerophora Pfitzer, 1871 |
||
|
Aulacoseira sp. |
||
|
Cocconeis sp. |
||
|
Cyclotella meneghiniana Kützing, 1844 |
||
|
Cymbella amplificata Krammer, 2002 |
||
|
Gyrosigma attenuatum (Kützing) Rabenhorst, 1853 |
||
|
Gyrosigma sp. |
||
|
Iconella biseriata (Brébisson) Ruck & Nakov, 2016 |
||
|
Селычка |
Melosira varians C. Agardh, 1827 |
|
|
Navicula sp. |
||
|
Nitzschia angustata (W. Smith) Grunow, 1880 |
||
|
Nitzschia sygmoidea (Nitzsch) W.Smith, 1853 |
||
|
Rhoicosphenia curvata (Kützing) Grunow, 1860 |
||
|
Surirella librile (Ehrenberg) Ehrenberg, 1845 |
||
|
Surirella peisonis Pantocsek, 1902 |
||
|
Surirella robusta Ehrenberg, 1841 |
||
|
Ulnaria biceps (Kützing) Compère, 2001 |
||
|
Ulnaria ulna (Nitzsch) Compère, 2001 |
||
|
Chl: Coelastrum sp. |
||
|
*Oocystis sp. |
||
|
Pediastrum duplex Meyen, 1829 |
||
|
Stauridium tetras (Ehrenberg) E.Hegewald, 2005 |
||
|
Z: *Closterium ehrenbergii Meneghini ex Ralfs, 1848 |
||
|
Cr: Anthophysa vegetans (O.F.Müller) F.Stein, 1878 |
||
|
B: Amphora ovalis (Kützing) Kützing, 1844 |
||
|
Cocconeis sp. |
||
|
Воложка |
Gyrosigma attenuatum (Kützing) Rabenhorst, 1853 |
|
|
Gomphonema parvulum (Kützing) Kützing, 1849 |
||
|
Navicula sp. |
||
|
Chl: Cladophora sp. |
||
|
C: Nostoc sp. |
||
|
B: Cyclotella meneghiniana Kützing, 1844 |
||
|
Cymatopleura аpiculata W. Smith, 1853 |
||
|
Cymbella hantzschiana Krammer, 2002 |
||
|
Иж |
Diatoma vulgaris Bory, 1824 (лентовидные колонии крупных клеток, |
|
|
зигзагообразные – мелких) |
||
|
Eunotia sp. |
||
|
Gomphoneis sp. |
||
|
Melosira varians C.Agardh, 1827 |
||
|
Navicula reinhardtii (Grunow) Grunow, 1880 |

|
Ulnaria acus (Kützing) Aboal, 2003 |
||
|
Ulnaria ulna (Nitzsch) Compère, 2001 |
||
|
Chl: Actinastrum hantzschii Lagerheim, 1882 |
||
|
X: Tribonema vulgare Pascher, 1925 |
||
|
Ижевское |
B: Ulnaria ulna (Nitzsch) Compère, 2001 |
|
|
Nitzschia cnf. rectiformis Hustedt, 1943 |
||
|
водохранили |
||
|
Cymatopleura apiculata W. Smith, 1853 |
||
|
ще |
||
|
Anomoeoneis sphaerophora Pfitzer, 1871 |
||
|
Pinnularia perspicua Krammer, 2000 |
- Tribonema vulgare Pascher, 1925
ПодборенкаB: Ulnaria ulna (Nitzsch) Compère, 2001
Nitzschia cnf. rectiformis Hustedt, 1943
|
Канал и |
C: Oscillatoria sp. |
|
|
B: Nitzschia sp. |
||
|
Малиновский |
||
|
Navicula sp. |
||
|
пруд |
||
|
Chl: Cladophora sp. |
||
|
B: Nitzschia linearis W. Smith, 1853 |
||
|
Позимь |
Ulnaria ulna (Nitzsch) Compère, 2001 |
|
|
Encyonema sp. |
||
|
C: Lyngbya sp. |
||
|
Oscillatoria sp. |
||
|
B: Meridion circulare (Greville) C. Agardh, 1831 |
||
|
*Melosira varians C. Agardh, 1827 |
||
|
Sellaphora sp. |
||
|
Frustulia saxonica Rabenhorst, 1853 |
||
|
Медведево |
Navicula radiosa Kützing, 1844 |
|
|
Diatoma vulgaris Bory, 1824 |
||
|
Pinnularia sp. |
||
|
Cymbella hantzschiana Krammer, 2002 |
||
|
Nitzschia regula Hustedt, 1922 |
||
|
Nitzschia linearis W. Smith, 1853 |
||
|
Nitzschia cnf. rectiformis Hustedt, 1943 |
||
|
Fragilaria vaucheriae (Kützing) J. B. Petersen, 1938 |
Примечание к таблице. С – Cyanobacteria, Chl – Chlorophyta, B – Bacillariophyceae, Z – Zygnematophyceae, Cr – Chrysophyceae, X – Xanthophyceae; * – активно развивавшиеся виды. Жирным шрифтом отмечены виды, присутствовавшие в пробах в живом состоянии на протяжении периода наблюдения. Карлутка – пробы из точек К1 и К2; Селычка – из точек С1, С2, С3, С4; Воложка – из точек В1, В2, В3, В4; Иж – из точек Иж1, Иж2, Иж3; Ижевское водохранилище – из точек И.п.1, И.п.2, И.п.3; Подборенка – из точек П1 и П2; Малиновский пруд – из точки Мал.п.; Позимь – из точки Поз; Медведево – из точек М1 и М2.
физических условий, уступив только в одном случае (в пробе «Селычка 3») десмидиевым. Это заставляет предположить, что неоднократно наблюдавшееся нами в летние месяцы явление «цветения воды» в водоёмах Ижевска, связанное с быстрым ростом цианобактерий, обусловлено в большей степени сменой химических, а не физических характеристик среды. Состав воды в начале вегетационного периода и конкуренция со стороны других групп водорослей не благоприятствуют их массовому росту даже при повышении температуры.
ЗАКЛЮЧЕНИЕ
Анализ проб на содержание БЭ и ТМ показал значительный диапазон концентраций: по 5 показателям из 15 (нитратам, аммонию, железу, марганцу и свинцу) было зафиксировано незначительное превышение ПДК для хозяйственно-питьевого водопользования как минимум в одной пробе. Соотношение N/P варьировало в пределах от 21 до 10000. Все рассмотренные водные объекты на момент исследования характеризовались фосфорным лимитированием. Трофический статус большинства из них был оценен как олиготрофный, с исключением для точек М1 и М2, находящихся вблизи городских очистных сооружений (мезотрофный и эвтрофный соответственно). Наибольшие концентрации БЭ и ТМ фиксировались чаще всего в Карлутке (максимальные значения по 9 показателям).
В пробах были обнаружены 56 видов водорослей из 7 классов 4 отделов. Наибольшее разнообразие отмечалось в пробах из Селычкинского пруда и Ижа к югу от города, в том числе за счёт створок бентосных диатомовых. Наиболее развитый фитопланктон был отмечен в реке Иж в городской черте.
В свежих пробах диатомовые водоросли значительно превосходили другие группы по видовому разнообразию и массе. При развитии в условиях лаборатории в некоторых пробах наблюдался быстрый рост диатомовых или десмидиевых водорослей. Кроме того, умеренный рост показали зелёные водоросли, а цианобактерии, напротив, не увеличили массу. Исходя из этого, можно предположить, что эпизодическое доминирование представителей Cyanobacteria в летнее время в открытых водоемах связано с изменением химического состава природной воды.
Данные для временного отрезка с конца подлёдного периода до пика половодья дают основу для наблюдения сезонной экологической динамики вод бассейна реки на рассматриваемой территории.
Благодарности. Авторы благодарят Н. И. Науменко, А. П. Мейерса-Цемашевича, Д. Е. Нигер, Е. Д. Нигера, И. М. Бляхеровича, В. И. Киссера, В. Ю. Перминова, В. В. Туганаева, А. С. Тюрикову и М. С. Юнусова за содействие и ценные комментарии при выполнении данной работы.
Список литературы
ГОСТ 18309-2014 Вода. Методы определения фосфорсодержащих веществ. – М.: Стандартинформ, 2019. – 24 с.
Государственный доклад «О состоянии и об охране окружающей среды Удмуртской республики в 2021 году» [Электронное издание] / Министерство природных ресурсов и охраны окружающей среды Удмуртской Республики; АУ «Управление охраны окружающей среды и природопользования Минприроды Удмуртской Республики». – Ижевск, 2022. – 279 с. – Режим доступа: https://www.minpriroda-udm.ru/images/1305/gosd2021.pdf (просмотрено: 10.07.2023)
Грушко Я. М. Вредные неорганические соединения в промышленных сточных водах: Справочник. – Л.: Химия, 1979. – 160 с.
Иванова Н. А., Шарипова Л. А. Состояние фитопланктона Ижевского пруда в районе водозабора МУП города Ижевска «Ижводоканал» в 2002-2005 годах // Вестник Удмуртского университета. Серия Биология. – 2006. – 10. – С. 17–24.
Котегов Б. Г., Аксенова Н. П., Захаров В. Ю., Холмогорова Н. В., Фефилова К. К. Биологические и химические эффекты антропогенного эвтрофирования Ижевского водохранилища: Монография / [Ред. Б. Г. Котегова]. – Ижевск: Удмуртский университет, 2013. – 177 с.
Куликовский М. С., Глущенко А. М., Генкал С. И., Кузнецова И. В. Определитель диатомовых водорослей России. – Ярославль: Филигрань, 2016. – 804 с.
Логинова Е. В., Лопух П. С. Гидроэкология: курс лекций. – Минск: БГУ, 2011. – 300 с.
Никаноров А. М. Гидрохимия. – СПб: Гидрометеоиздат, 2001. – 449 с.
Нормативы качества воды водных объектов рыбохозяйственного значения, в том числе нормативы предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения. Приложение к приказу Министерства сельского хозяйства Российской Федерации от 13 декабря 2016 № 552 «Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения» (с изменениями от 12 октября 2018 г., 10 марта 2020 г.) [Электронное ресурс]. – Информационно-правовой портал Гарант.ру. – 2020. – Режим доступа: https://base.garant.ru/71586774/53f89421bbdaf741eb2d1ecc4ddb4c33/ (просмотрено 14.10.2023).
ПНД Ф 14.1:2.1-95 Количественный химический анализ вод. Методика выполнения измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера. – Москва, 2017. – 22 с.
ПНД Ф 14.1:2:4.3-95 Количественный химический анализ вод. Методика измерений массовой концентрации нитрит-ионов в питьевых, поверхностных и сточных водах фотометрическим методом с реактивом Грисса. – Москва, 2011. – 22 с.
ПНД Ф 14.1:2:4.4-95 Количественный химический анализ вод. Методика выполнения измерений массовой концентрации нитрат-ионов в природных и сточных водах фотометрическим методом с салициловой кислотой. – Москва, 2011. – 18 с.
ПНД Ф 14.1:2.159-2000 Количественный химический анализ вод. Методика выполнения измерений массовой концентрации сульфат-ионов в пробах природных и сточных вод турбидиметрическим методом. – Москва, 2005. –
- с.
ПНД Ф 14.1:2.253-09 (М 01-46-2013). Методика измерений массовой концентрации алюминия, бария, бериллия, ванадия, железа, кадмия, кобальта, лития, марганца, меди, молибдена, мышьяка, никеля, свинца, селена, серебра, стронция, титана, хрома, цинка в пробах природных и сточных вод атомно-абсорбционным методом с электротермической атомизацией с использованием атомно-абсорбционного спектрометра модификаций МГА-915, МГА-915М, МГА-915МД. – Москва, 2013. – 36 с.
РД 52.24.382-2019 Массовая концентрация фосфатного фосфора в водах. Методика измерений фотометрическим методом. – Ростов-на-Дону, 2019. – 31 с.
СанПиН 2.1.4.1074-01 Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения. Нормы качества питьевой воды. – Москва, 2002. – 103 с.
Царенко П. М. Краткий определитель хлорококковых водорослей Украинской ССР. – Киев: Наукова думка, 1990. – 208 с.
Ahmad M. S. A., Ashraf M. Essential roles and hazardous effects of nickel in plants // Reviews of Environmental Contamination and Toxicology. Edited by D. M. Whitacre. – New York: Springer, 2011. – P. 125–167. DOI: 10.1007/978-1-4614-0668-6_6.
AlgaeBase [Electronic resource]. – 2023. – Available at: https://www.algaebase.org/ (date of access: 10.07.2023) Brand L. E., Sunda W. G., Guillard R. R. L. Reduction of marine phytoplankton reproduction rates by copper and
cadmium // Journal of Experimental Marine Biology and Ecology. – 1986. – Vol. 96, issue 3. – P. 225–250. DOI:
10.1016/0022-0981(86)90205-4.
Broadley M., Brown P., Cakmak I., Rengel Z., Zhao F. Function of nutrients: micronutrients // Marschner’s Mineral Nutrition of Higher Plants. Edited by P. Marschner. London: Academic, 2012. – P. 191–248. DOI: 10.1016/B978-0-12-384905-2.00007-8.
Brown P. N., Cakmak I., Zhang O. Form and function of zinc in plants. Chapter 7 // Zinc in Soils and Plants: Proceedings of the International Symposium on «Zinc in Soils and Plants» Held at The University of Western Australia, 27-28 September, 1993. – Edited by A. D. Robson. Dordrecht–Boston–London: Kluwer Academic Publishers, 1993. – P. 90–106. DOI: 10.1007/978-94-011-0878-2_7.
Bulgakov N. G., Levich A. P. The nitrogen: phosphorus ratio as a factor regulating phytoplankton community
structure // Archiv für Hydrobiologie. – 1999. – Vol. 146, N 1. – P. 3–22. DOI: 10.1127/archiv-hydrobiol/146/1999/3.
Chorus I., Spijkerman E. What Colin Reynolds could tell us about nutrient limitation, N:P ratios and eutrophication control // Hydrobiologia. – 2021. – Vol. 848, N 12. – P. 95–111. DOI: 10.1007/s10750-020-04377-w.
Correlli D. L. Phosphorus: A Rate Limiting Nutrient in Surface Waters // Poultry Science. – 1999. – Vol. 78, issue 5. –
P. 674–682. DOI: 10.1093/ps/78.5.674.
Ekholm P. N:P ratios in estimating nutrient limitation in aquatic [Electronic resource] // Mitigation options for nutrient reduction in surface water and groundwaters. – Helsingfors: Finnish Environment Institute, 2008. – P. 11–14. – Available at: https://www.cost869.alterra.nl/fs/fs_npratio.pdf (date of access: 11.07.2023)
Ferrari M., Marieschi M., Cozza R., Torelli A. Role of Sulfate Transporters in Chromium Tolerance in Scenedesmus acutus M. (Sphaeropleales) // Plants. – 2022. – Vol. 11, Issue 2. – Art. 223. DOI: 10.3390/plants11020223.
Fezy J. S., David F., Spencer D. F., Greene R. W. The effect of nickel on the growth of the freshwater diatom Navicula pelliculosa // Environmental pollution. – 1979. – Vol. 20, issue 2. – P. 131–137. DOI: 10.1016/0013-9327(79)90065-X.
Frausto da Silva J. J., Williams R. J. R. The biological chemistry of the elements: The Inorganic Chemistry of Life. –
Oxford: Oxford University Press, 2001. – 584 p.
Geider J. R., La Roche J. Redfield revisited: variability of C:N:P in marine microalgae and its biochemical basis //
European Journal of Phycology. – 2002. – Vol. 37, issue 1. – P. 1–17. DOI: 10.1017/S0967026201003456.
Giordano M., Norici A., Ratti S., Raven J. Role of sulfur for algae: acquisition, metabolism, ecology and evolution // Sulfur metabolism in phototrophic organisms. Advances in photosynthesis and respiration. – Vol. 27. – Dordrecht: Springer, 2008. – P. 397–415. DOI: 10.1007/978-1-4020-6863-8_20.
Huiling Ouyang, Xiang-Zhen Kong, Wei He, Ning Qin, Q. S. He, Yan Wang, Rong Wang, F. L. Xu. Effects of five heavy metals at sub-lethal concentrations on the growth and photosynthesis of Chlorella vulgaris // Chinese science bulletin. – 2012. – Vol. 57, issue 25. – P. 3363–3370. DOI: 10.1007/s11434-012-5366-x.
Hushchyna K., Nguyen-Quang T. Using the modified Redfield ratio to estimate harmful algal blooms // Environmental problems. – 2017. – Vol. 2, N 2. – P. 101–108. Corpus ID: 219707962.
Kleiven W. Elemental Composition in various Marine Brown, Green and Red Macroalgae with respect to Season and Tissue-Age. – Trondheim: Norwegian University of Science and Technology, Department of Biology, 2014. – 102 p.
Krämer U., Clemens S. Functions and homeostasis of zinc, copper and nickel in plants // Molecular Biology of Metal Homeostasis and Detoxification: From Microbes to Man. – Berlin: Springer-Verlag, 2005. – P. 215–271. DOI: 10.1007/4735_96.
Lee K., Nalewajko C., Jack T. R. Effects of vanadium on freshwater algae // Fisheries and marine service technical report. – 1979. – N 862. – P. 297–310.
Liang Z., Soranno P. A., Wagner T. The role of phosphorus and nitrogen on chlorophyll a: evidence from hundreds
of lakes // Water research. – 2020. – Vol. 185. – P. 1–39. DOI: 10.1016/j.watres.2020.116236.
Liu J., Tan K., He L., Qiu Y., Tan W., Guo Y., Wang Zh., Sun W. Effect of limitation of iron and manganese on microalgae growth in fresh water // Microbiology Society. – 2018. – Vol. 164, issue 12. – P. 1514–1521. DOI: 10.1099/mic.0.000735.
Manahan S. E. Environmental chemistry. Ninth Edition. – Boca Raton, Florida: CRC Press, 2010. – 786 p. ISBN:
978-1-4200-5920-5
Markham J. W., Kremer B. P., Sperling K. R. Effect of cadmium on Laminaria saccharina in culture // Marine Ecology Progress Series. – 1980. – Vol. 3, N 1. – P. 31–39.
Molybdenum Water Quality Guidelines for the Protection of Freshwater Aquatic Life, Livestock, Wildlife and Irrigation. British Columbia Ministry of Environment and Climate Change Strategy 2021. Water quality guideline series, WGJ–07. – Victoria, British Columbia, 2021. – 67 p. ISBN: 978-1-988314-15-0
Morel F., Rueter J., Price N. Iron nutrition of phytoplankton and its possible importance in the ecology of ocean regions with high nutrient and low biomass // Oceanography. – 1991. – Vol. 4, N 2. – P. 56–61. DOI: 10.5670/OCEANOG.1991.03.
Polacco J. C., Mazzafera P., Tezotto T. Opinion: nickel and urease in plants: still many knowledge gaps // Plant
Science. – 2013. – Vol. 199–200. – P. 79–90. – DOI: 10.1016/j.plantsci.2012.10.010.
Qiaoqiao Zhou, Nan Yang, Youzhi Li, Bo Ren, Xiaohui Ding, Hualin Bian, Xin Yao. Total concentrations and sources of heavy metal pollution in global river and lake water bodies from 1972 to 2017 // Global Ecology and
Conservation. – 2020. – Vol. 22. – Art. E00925. – P. 1–11. – Available at:
https://www.sciencedirect.com/science/article/pii/S2351989419309357. DOI: 10.1016/j.gecco.2020.e00925.
Rosenberg B. D., Schroth A. W. Coupling of reactive riverine phosphorus and iron species during hot transport moments: impacts of land cover and seasonality // Biogeochemistry. – 2017. – Vol. 132, № 1–2. – P. 103–122. DOI: 10.1007/s10533-016-0290-9.
Rousch J. M., Sommerfeld M. R. Effect of manganese and nickel on growth of selected algae in pH buffered medium // Water Research. – 1999. – Vol. 33, Issue 10. – P. 2448–2454. DOI: 10.1016/S0043-1354(98)00474-6.
Sharma C. P., Sharma P. N., Bisht S. S., Nautiyal B. D. Zinc deficiency induced changes in cabbage // Plant Nutrition: Proceedings of the Ninth International Plant Nutrition Colloquium. – Warwick: Farnham Royal Bucks, 1982. – P. 601– 606. DOI: 10.1007/978-94-011-0878-2_7.
Srivastava P. C., Gupta U. C. Trace Elements in Crop Production. – Lebanon: Science Publishers, 1996. – 356 p. Švec P., Kováčik J., Hedbavný J., Babula P., Rotková G., Klejdus B. Impact of Anions, Cations, and pH on
Manganese Accumulation and Toxicity in the Green Alga Scenedesmus quadricauda // Water, Air, & Soil Pollution. – 2016. – Vol. 227. – Art. 161. DOI: 10.1007/s11270-016-2859-2.
Toda K., Obolkin V., Ohira S.-I., Saek K. Abundant production of dimethylsulfoniopropionate as a cryoprotectant by freshwater phytoplankton in ice-covered Lake Baikal // Research Quare. – 2023. – License CC BY 4.0. – P. 2–15. – Available at: https://assets.researchsquare.com/files/rs-2468095/v1/c373d2d7d0a251a8198409af.pdf?c=1675205333. DOI: 10.21203/rs.3.rs-2468095/v1.
Wilson W., Zhang Q., Rickaby R. E. M. Susceptibility of algae to Cr toxicity reveals contrasting metal management strategies // Limnology and oceanography. – 2019. – Vol. 64, issue 5. – P. 2271–2282. DOI: 10.1002/lno.11183.
Xu Y., Shi D., Aristilde L., Morel F. M. M. The effect of pH on the uptake of zinc and cadmium in marine phytoplankton: Possible role of weak complexes // Limnology and Oceanography. – 2012. – Vol. 57, issue 1. – P. 293– 304. DOI: 10.4319/lo.2012.57.1.0293.
Xuwei D., Linwei R., Ren R., Min T., Jing Zh., Lantian W., Yunzhi Y., Xinli W., Xi Y., Ping X. Phosphorus accelerates the sulfur cycle by promoting the release of malodorous volatile organic sulfur compounds from Mycrocystis in freshwater lakes // Science of the Total Environment. – 2022. – Vol. 845, issue 4. – Art. 157280. DOI: 10.1016/j.scitotenv.2022.157280.
Zakeri H. A., Abu Bakar L. Copper-, Lead- and Mercury-Induced Changes in Maximum Quantum Yield, Chlorophyll A Content and Relative Growth of Three Malaysian Green Macroalgae // Malaysian Journal of Fundamental and Applied Sciences. – 2013. – Vol. 9, N 1. – P. 16–21.
Goskova S. M., Altyntsev A. V., Dedyukhin A. S., Smirnov K. D. Hydrochemical and algal composition of some water bodies in the basin of the Izh river during the winter-early spring period in 2023 // Ekosistemy. 2023. Iss. 36. P. 187–202.
Some hydrochemical and ecological criteria of water bodies in the basin of Izh river (the Udmurt Republic, Russia) are considered in this article. It provides data on concentrations of dissolved nitrogen (the sum of nitrate, nitrite and ammonium nitrogen), phosphorus of orthophosphate, sulphur and 10 heavy metals (lead, cadmium, copper, nickel, zink, iron, manganese, chromium, vanadium and molybdenum) in the water of the Izh river and its tributaries and reservoirs in the period between ice-cover state and spring flood. The data are compared with global average values for fresh water. Concentrations exceeding standards accepted for water consumption and maximum concentrations are revealed. The criterion of nitrogen/phosphorus ratio and its influence on the taxonomic composition of algal flora, trophic status of the studied water bodies during the winter-early spring period and the limiting chemical factors for algal development are discussed. The paper gives comparison of data for five indicators (water content of nitrates, orthophosphates, iron, manganese and copper) for the Izhevsk reservoir for 2011 and 2023. Data on the content of nutrient ions and heavy metals in samples is accompanied by information about functions of chemical elements in metabolism of algal cells and about their toxicity. A taxonomic list of algae found in water samples including 56 species from 41 genera, 7 classes, 4 divisions is published. Moreover, their development in laboratory conditions and the influence of chemical composition of water on the formation of algoflora are considered.
Key words: biogenic elements, heavy metals, algae, Izh river, Izhevsk Reservoir, Izhevsk.
Поступила в редакцию 11.08.23
Принята к печати 18.10.23
