ОБ ЭКОЛОГИЧЕСКОЙ НИШЕ CLEMATIS FLAMMULA В СООБЩЕСТВАХ ЮЖНОГО БЕРЕГА КРЫМА
ECOLOGICAL NICHE OF THE CLEMATIS FLAMMULA IN THE COMMUNITIES OF THE SOUTHERN COAST OF CRIMEA
JOURNAL: «EKOSISTEMY», Issue 41, 2025
Publication text (PDF):Download
UDK: 582.675.1:574.3:502.72(477.75)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Bagrikova N. A., Reznikov O. N., Korzhenevsky V. V.
Nikitsky Botanical Garden – National Scientific Center of the Russian Academy of Sciences, Yalta, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2025-41-79-89
PAGES: from 79 to 89
STATUS: Published
LANGUAGE: Russian
KEYWORDS: alien plants, ordination and cluster analysis, plant communities, environmental factors, ecological scales, protected areas, Crimean Peninsula.
ABSTRACT (ENGLISH):
This study presents the results of research on the adaptation of the invasive species Clematis flammula in various forest and disturbed communities in the lower belt of the southern macroslope of the Main Ridge of the Crimean Mountains. A geobotanical investigation conducted from 2019 to 2021 using the Braun-Blanquet ecological and floristic approach. Ordination and cluster analyses were performed using the PAST 3.26 software. Twelve factors were examined: light (Lc), thermal regime (Tm), aridity-humidity (Om), cryoregime (Cr), climate continentality (Kn), soil moisture (Hd), humidity fluctuation (fH), substrate acidity (Cr), salt regime (anionic composition) (Tr), carbonate content (Ca), nitrogen content (Nt), and granulometric composition of the substrate (Ae). The parameters of the ecological niches of the Clematis flammula and the communities were determined using the phytoindication method. The broad range of the fundamental ecological niche of Clematis flammula concerning most edapho-climatic factors facilitates the species to integrate into plant communities with varying degrees of disturbance. The studied communities are similar in terms of climate continentality, thermal regime, cryoregime, aridity-humidity and substrate acidity: however, they differ significantly in soil moisture, humidity fluctuation, and the content of carbonates and mineral nitrogen in the soil. A comparative analysis of the fundamental niche of the Clematis flammula and the realized niche of communities indicates that the environmental conditions in sparse downy-oak-juniper communities belonging to the Quercetea pubescentis class meet the requirements of the species to the greatest extent. The findings confirm the high degree of adaptation of the species to the natural conditions of the Southern Coast of Crimea.
ВВЕДЕНИЕ
Стремительный рост вторжения чужеродных растений определяет глобальный характер проблемы, так как инвазионные виды являются одной из основных причин потери природного биоразнообразия во всем мире, а исследования актуальны и востребованы. Изучение инвазионных видов c позиций концепции экологической ниши на основе применения методов фитоиндикации занимает одно из первых мест в современной экологии (Mack, 2000, Селедец, 2013; Петросян и др., 2023), так как этот подход позволяет определить их положение на градиентах эдафо-климатических факторов, в определенной степени установить каким образом различные виды могут нормально функционировать в конкретном экотопе, выявить механизмы адаптации чужеродных видов к различным условиям среды и установить закономерности их распространения при разных уровнях антропогенного воздействия на локальном, региональном и даже на глобальном уровнях (Корженевский, 1992; Wiens, Graham, 2005; Tingley et al., 2014; Santamarina et al., 2023). Инвазионный вид в процессе вселения и натурализации в новых условиях среды сохраняет, расширяет или сужает пространство своей ниши в результате изменений реализованной ниши фитоценозов, а также глобального потепления климата в последние десятилетия (Pearman et al., 2008; Плугатарь и др., 2022), при этом инвазионные виды могут существенно влиять на аборигенные виды, если их экологические ниши схожи (Bello et al., 2021). Эти исследования играют важную роль при разработке стратегий сохранения биоразнообразия сообществ, а также прогнозирования реакции видов на изменяющиеся условия среды в антропоцене (Павлов и др., 2010; Liu et al., 2020; Петросян и др., 2023).
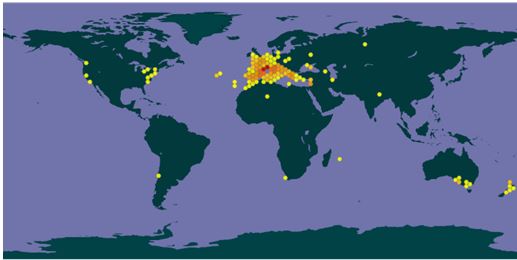
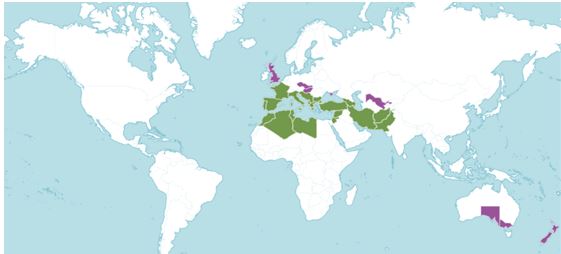
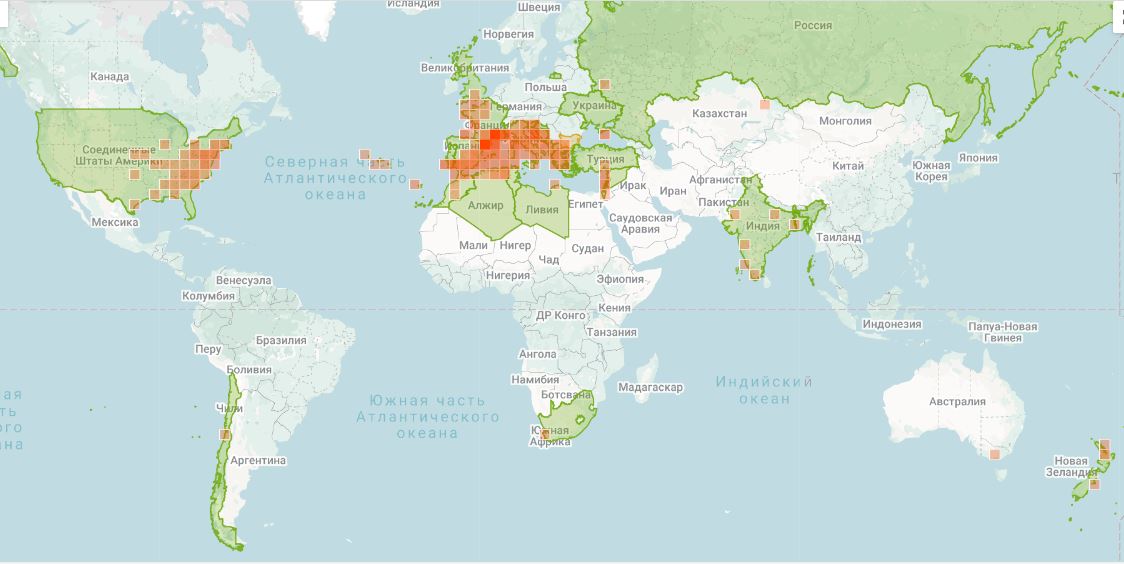
При изучении путей инвазии за последние сотни лет установлено, что именно интродукция является основным путем для распространения более чем половины всех инвазионных растений по всему миру, в том числе на территории Крымского полуострова. В Крыму 52 вида, имеющих 1-й, 2-й и 3-й инвазионные статусы, относятся к введенным в разное время в культуру растениям (Bagrikova, Skurlatova, 2021). Одним из таких видов является Clematis flammula L., который в нативном ареале в Западном Закавказье, Южной Европе, Северной Африке, Малой и Передней Азии (Tutin, 1964, POWO, 2025; GBIF, 2025) распространен в разреженных лесах и зарослях кустарников, а также в составе термофильных средиземноморских сосновых, дубовых, смешанных лесов, рассматриваемых в порядке Quercetalia pubescenti-petraea Klika 1933, в том числе связанных с ними сообществ маквиса, входящих в класс Quercetea ilicis Br.-Bl. ex A. et O. Bolòs 1950 (Rivas-Martínez, 1995; Biondi et al., 2003; Tsiourlis et al., 2009; Di Pietro et al., 2010; Stupar et al., 2015 и др.). Часто используется как декоративное, красивоцветущее растение, во многих регионах, в том числе в Великобритании, Австралии, Новой Зеландии, Чехии, Словакии, Венгрии, Республике Крым, Узбекистане и других регионах отмечена натурализация вида (Randall, 2017; iNaturalist, 2025; GBIF, 2025; POWO, 2025) (рис. 1).
Натурализовавшиеся растения Clematis flammula на территории Крымского полуострова отмечаются с XIX в. (Никита, южный склон. 29.06.1885 г. Зеленецкий Н. М. Гербарий YALT), в настоящее время на Южном берегу Крыма (ЮБК) имеет статус инвазионного вида, проходит полный жизненный цикл, встречается в природных, полуестественных биотопах, а также в нарушенных местообитаниях (в хозяйственных и рекреационных зонах, вдоль дорог, на заброшенных виноградниках) в нижнем поясе на высоте от 5 до 240 м н.у.м. Наибольшее распространение имеет в сообществах с доминированием Quercus pubescens Willd., значительным участием Carpinus orientalis Mill., Juniperus excelsa M. Bieb., J. deltoides R.P. Adams., которые относятся к классу Quercetea pubescentis Doing-Kraft ex Scamoni et Passarge 1959. На антропогенно-нарушенных местообитаниях сообщества входят в класс Artemisietea vulgaris Lohmeyer et al. in Tx. ex von Rochow 1951 (Багрикова, Резников, 2014; Багрикова и др., 2020, 2021; Резников и др., 2017; Перминова и др., 2020).
Несмотря на то, что вид достаточно давно натурализовался в Крыму, изучение особенностей его распространения в разных типах растительных сообществ в условиях вторичного ареала с позиций теории экологической ниши не проводилось.
Цель данной работы – выявить особенности адаптации инвазионного вида Clematis flammula к условиям вторичного ареала на основе изучения соответствия фундаментальной ниши вида и реализованных ниш разных фитоценозов с использованием методов фитоиндикации.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследований являлись разные сообщества с участием Clematis flammula (клематиса жгучего) на ЮБК. Вид является полукустарниковой или кустарниковой полувечнозеленой лианой. Полевые исследования проводились в 2019–2021 гг. на особо охраняемой природной территории (ООПТ) – «Мыс Мартьян», а также в окрестностях поселка Отрадное, расположенного западнее Никитского ботанического сада в границах городского округа Ялта в естественных лесных фитоценозах, а также в составе антропогенно-нарушенных сообществ (вдоль дорог и на заброшенных виноградниках). При геоботаническом описании на площадках 100 м2 выявляли полный флористический состав, участие видов оценивали по шкале обилия-покрытия Ж. Браун-Бланке (Миркин и др., 2001).
 а
а
 б
б
 в
в
Рис. 1. Распространение Clematis flammula по данным информационных баз
а – GBIF, б – POWO, в – iNaturalist.
Зеленая заливка на рисунке б – природный ареал; фиолетовая заливка – вторичный ареал.
Экологические амплитуды сообществ приведены по шкалам В.В. Корженевского (Корженевский, 1990, 1999). Расчеты параметров фундаментальной (потенциальной) ниши вида и реализованной ниши фитоценозов выполнены по оригинальной программе «Power», унифицированная информация о размещении видов растений на градиентах факторов среды извлечена из базы данных «Экодата» (Корженевский, 1990, 1999). Рассмотрены 12 факторов, в том числе эдафические (увлажнение почвы (Hd), переменность увлажнения (fH), кислотность субстрата (Cr), солевой режим (анионный состав) (Tr), содержание карбонатов (Ca), содержание минерального азота (Nt), гранулометрический состав (аэрация) субстрата (Ae) и геоклиматические (освещенность ценозов (Lc), терморежим (Tm), омброрежим, аридность-гумидность (Om), криорежим (Cr), континентальность климата (Kn)). Лимитирующие факторы определялись по положению описанных ценопопуляций на градиентах отдельных факторов.
Ординационный и кластерный анализ выполнены с помощью пакета программы Past 3.26 (Hammer et al., 2001). Названия синтаксонов приводятся по классификационной схеме растительности Европы (EuroVegChecklist) (Mucina et al., 2016), названия видов растений – согласно международной базе данных Plants of the Words On-line (POWO, 2025).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Параметры реализованных ниш сообществ выявлены в семи ценопопуляциях (ЦП), пять из которых описаны на ООПТ «Мыс Мартьян», по одной в лесных фитоценозах и в синантропных местообитаниях, в том числе на заброшенных виноградниках в окрестностях пос. Отрадное. В изученных местообитаниях ценопопуляции Clematis flammula отличаются по типу, общему числу особей, количеству разновозрастных растений на 100 м2. Онтогенетическая структура изученных ЦП представлена согласно классификации А. А. Уранова, О. В. Смирновой двумя типами: левосторонние (ЦП 2, 4, 5 и 6) и бимодальные (ЦП 1, 3 и 7), а по классификации «дельта-омега» тремя типами: молодые (ЦП 4, 5 и 6), переходные (ЦП 2, 3, 7) и стареющая (ЦП 1) (Багрикова и др., 2020).
ЦП 1 (44.5077361 N, 34.2498581 E) на ООПТ «Мыс Мартьян» занимает приморские довольно крутые (до 50°) склоны юго-восточной и южной экспозиции, на высоте 5–30 м н.у.м. Растительность представлена разреженными можжевелово-земляничниково-дубовыми сообществами c сомкнутостью до 0,3, в которых в первом ярусе представлены Juniperus excelsa, Arbutus andrachne L., Quercus pubescens, единично встречается Pistacia atlantica Desf. Во втором ярусе присутствует Juniperus deltoides, в кустарниковом ярусе преобладает Cistus tauricus С.Presl. Общее проективное покрытие (ОПП) травяного и кустарничкового яруса – от 25 до 60 %. Характерна высокая каменистость почвы. Изученный вид распределен неравномерно, количество растений варьирует от 1 до 30, при средней плотности 7 особей, в большинстве случаев отмечается от 2 до 12 растений на 100 м2.
ЦП 2 (44.5074754 N, 34.2425566 E) также занимает довольно крутые склоны (25–35°), южной и юго-западной экспозиции, на высоте 20–100 м н.у.м. Древесный ярус отличается большей сомкнутостью (не менее 0,6) и в нем представлены те же виды, что и в ЦП 1, но доминантом в первом ярусе выступает Quercus pubescens. Хорошо выражен второй ярус и подлесок, в котором значительный процент участия приходится на Fraxinus ornus L., вечнозеленые виды натурализовавшихся интродуцентов – Quercus ilex L., Rhamnus alaternus L. В кустарниковом ярусе также преобладает Cistus tauricus, но с высоким постоянством и проективным покрытием до 30-40 % встречается Chrysojasminum fruticans (L.) Banfi, Ruscus aculeatus L., а также Bupleurum fruticosum L., который на заповедной территории является видом-трансформером. Клематис жгучий распределен по территории относительно равномерно, количество особей варьирует от 2 до 50, но по сравнению с другими описанными ЦП средняя плотность составляет 20 особей / 100 м2.
ЦП 3 (44.5094497 N, 34.2385647 E) расположена в самой западной части заповедной территории на высоте 100–120 м н.у. м., на наиболее крутых (45–55°) и очень каменистых склонах в основном юго-западной экспозиции. Растительность очень разреженная (сомкнутость до 0,2), в древесном ярусе представлены Arbutus andrachne, Quercus pubescens, Juniperus excelsa, единично встречаются Pinus nigra subsp. pallasiana (Lamb.) Holmboe, Juniperus deltoides, но достаточно хорошо выражен кустарниковый ярус из Cistus tauricus, ОПП травяного яруса 40–50 %. Плотность клематиса жгучего невысокая, чаще всего на площадках встречается 5–15 растений разных возрастных состояний, при средней плотности 10 особей / 100 м2. На открытых, очень крутых участках клематис жгучий отсутствует, тогда как изредка отмечаются растения аборигенного вида Clematis vitalba L.
ЦП 4 (44.5098566 N, 34.2403999 E) расположена в западной части изученной территории, вдоль границы заповедника, за которой расположены научно-производственные площади Никитского ботанического сада и жилой поселок, занимает относительно выровненные участки или некрутые склоны (5–25°) в основном юго-западной экспозиции, на высоте 120–170 м н.у.м. Растительность относится к дубово-можжевелово-сосновым сообществам, со значительным участием Pinus nigra subsp. pallasiana, Carpinus orientalis, Fraxinus ornus. Во втором ярусе и в подлеске отмечены Arbutus andrachne, единичные генеративные, а также достаточно часто имматурные и виргинильные растения Quercus ilex и Rhamnus alaternus. Сомкнутость древостоя – 0,4–0,6. В кустарниковом ярусе преобладает Ruscus aculeatus (до 40–60 %), мозаично отмечается Cistus tauricus, редко встречаются виргинильные растения Berberis aquifolium Pursh., ОПП травяного яруса составляет 30–60 %. Клематис жгучий распределен по территории относительно равномерно, количество растений на площадках варьирует от 2 до 50, плотность в ЦП составляет 19 особей / 100 м2. При увеличении сомкнутости древесного и кустарникового ярусов количество растений резко снижается.
ЦП 5 (44.5137892 N, 34.2470747 E) описана на высоте 180–210 м н.у.м., занимает относительно выровненные или не очень крутые участки (10–20°) юго-восточной экспозиции. Растительность представлена достаточно сомкнутыми (0,6–0,8) дубово-можжевелово-грабинниковыми сообществами. В первом ярусе часто встречается Pinus nigra subsp. pallasiana, во втором ярусе обычен Juniperus deltoides. В подлеске из аборигенных видов изредка отмечаются Cornus mas L., из натурализовавшихся интродуцентов – виргинильные растения Laurus nobilis L., Quercus ilex, Berberis aquifolium, единично встречается Rhamnus alaternus, в кустарниковом ярусе с покрытием до 40–60 % выделяются Ruscus aculeatus, как почвопокровное – Hedera helix L., ОПП кустарничкового и травяного яруса составляет 65–75 %. Клематис жгучий распределен неравномерно, количество растений варьирует от 1 до 20, при плотности 7 особей / 100 м2. Наибольшее число разновозрастных особей клематиса жгучего отмечено на площадках с более разреженным растительным покровом. В составе сообществ довольно часто встречается аборигенный вид – Clematis vitalba.
ЦП 6 расположена в окр. пос. Отрадное на высоте 115–120 м н.у.м., на шиферных склонах крутизной 10–20° юго-западной экспозиции. Растительность представлена пушистодубово-фисташковым редколесьем. В подлеске с незначительным покрытием отмечены Carpinus orientalis, Juniperus deltoides, в кустарниковом ярусе доминирует Cistus tauricus, отмечен также Ruscus aculeatus, ОПП кустарничкового и травяного яруса составляет 25–35%. Клематис жгучий распределен по территории относительно равномерно, количество растений на площадках варьирует от 5 до 20, плотность в ЦП составляет 15 особей / 100 м2.
ЦП 7 описана западнее пос. Отрадное на высоте 95 м н.у.м. на заброшенных виноградниках, на относительно выровненном участке до 5–10° юго-западной экспозиции. При ОПП 70–80% в составе залежной растительности преобладают травянистые растения, в том числе Cichorium intybus L., Chondrilla juncea L., Diplotaxis tenuifolia (L.) DC., Plantago lanceolata L., Bituminaria bituminosa (L.) C.H. Stirt., среди древесно-кустарниковых видов отмечены молодые особи Ailanthus altissima (Mill.) Swingle, Fraxinus angustifolia, Vahl., Rosa canina L. В составе сообществ довольно часто встречается аборигенный вид – Clematis vitalba. Клематис жгучий распределен неравномерно, количество растений варьирует от 1 до 20, при плотности 8 особей / 100 м2.
На рисунках 2 и 3 показаны значения параметров фундаментальной ниши Clematis flammula (F min, F max) и реализованных ниш описанных сообществ (R min, R opt, R max) по экологическим шкалам В.В. Корженевского (1999). На рисунке 3 на лепестковых диаграммах наглядно отражены объемы фундаментальной и реализованных экологических ниш, а также оптимальные показатели факторов-условий и факторов-ресурсов описанных сообществ.
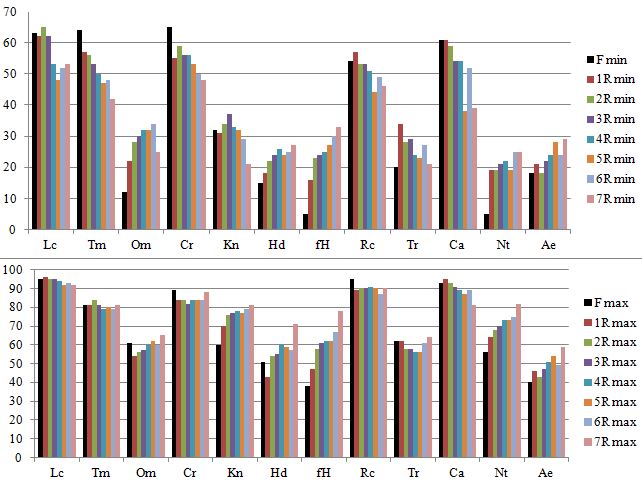
Рис. 2. Минимальные и максимальные значения параметров фундаментальной (F) ниши Clematis flammula и реализованных экологических ниш изученных сообществ, в которых описаны ценопопуляции
По оси Х – экологические факторы. Климатопа: Lc – освещенность-затенение, Tm – температура воздуха, Om – омброрежим (аридность-гумидность), Cr – криорежим, Kn – континентальность климата; Эдафотопа: Hd – увлажнение, fH – переменность увлажнения; Rc – кислотность субстрата, Tr – анионный состав (солевой режим), Ca – содержание карбонатов, Nt – содержание азота, Ae – механический (гранулометрический) состав субстрата. По оси Y – значения параметров экологических ниш по 100-балльной шкале.
В наибольшей степени описанные сообщества отличаются друг от друга по таким эдафическим факторам как режим увлажнения (Hd), переменность увлажнения (fH) и содержание азота в почве (Nt). По этим параметрам показатели реализованной ниши описанных сообществ в наименьшей степени соответствуют экологическим требованиям клематиса жгучего. При этом минимальные и максимальные значения этих показателей выявлены для синантропных сообществ, в которых описана ЦП 7 (рис. 2, 3). Нарушенные сообщества близки по этим и другим показателям к описанным в разреженных пушистодубово-фисташковых фитоценозах в окрестностях поселка Отрадное, в которых выделена ЦП 6.
Из рисунка 4, на котором представлены результаты кластерного анализа, видно, что эти сообщества близки по видовому составу и объединены в один кластер. Результаты ординационного анализа (рис. 5) позволили определить ведущие факторы дифференциации на градиентах факторов среды разных по составу и структуре сообществ, в которых описаны ценопопуляции. На ординационной диаграмме (рис. 5) видно, что ЦП 6 и ЦП 7
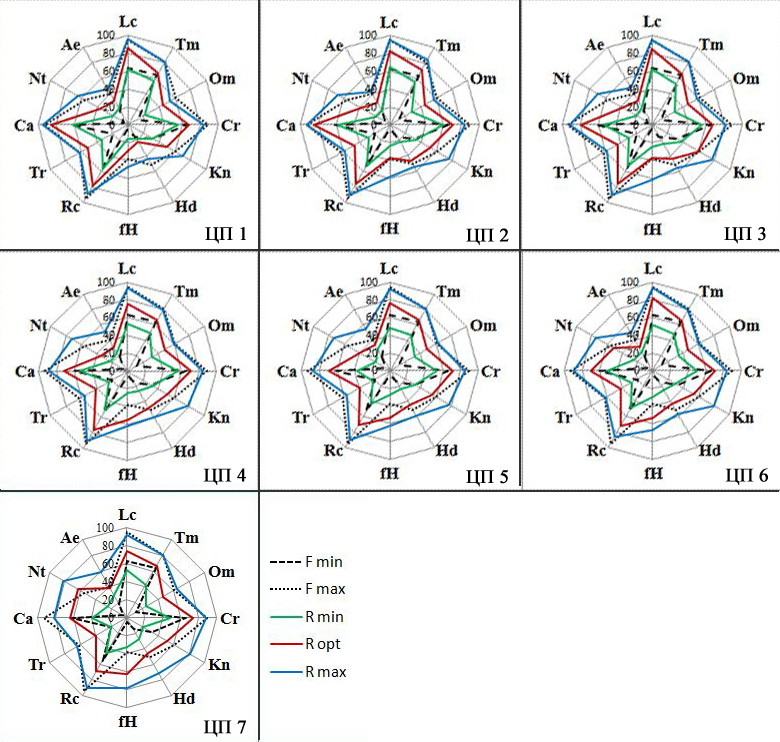
Рис. 3. Соотношение фундаментальной ниши Clematis flammula и реализованных ниш описанных фитоценозов
Обозначение климатических и эдафических факторов такие же, как на рисунке 2.
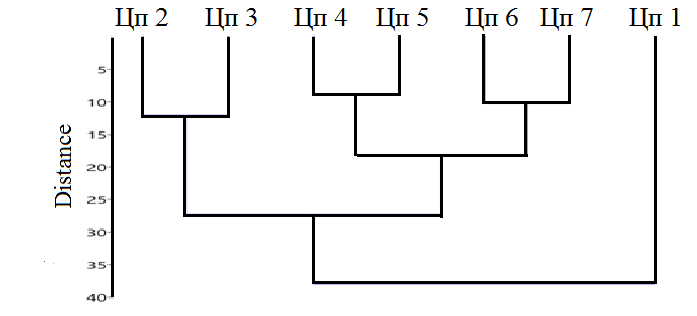
Рис. 4. Дендрограмма дифференциации сообществ с участием Clematis flammula (кластерный анализ, Past 3.26)
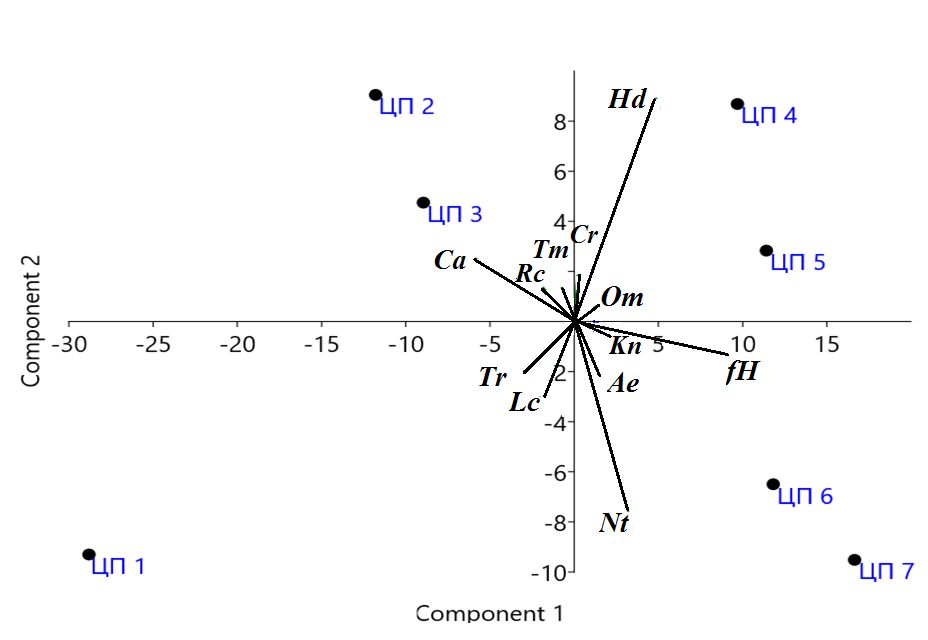
Рис. 5. Распределение ценопопуляций Clematis flammula на градиентах факторов среды в разных эколого-ценотических условиях (Past 3.26)
Обозначения осей климатических и эдафических факторов такие же, как на рисунке 2, ЦП 1–ЦП 7 – ценопопуляции. Описание сообществ, в которых они описаны, приведены в тексте.
расположились в правой нижней части и ведущими факторами дифференциации сообществ, в которых они описаны, являются содержание азота в почве (Nt) и переменность увлажнения (fH). Высокая каменистость почвы на шиферных склонах (ЦП 6) и в синантропных местообитаниях (ЦП 7) определяют также достаточно высокие значения такого показателя как аэрация (гранулометрический) состав субстрата (Ae).
Вторую группу сообществ, наиболее близких к ЦП 6 и ЦП 7 по показателям увлажнения почвы и аэрации субстрата (рис. 2, 3), а также по результатам кластерного анализа (рис. 4), составляют фитоценозы, в которых описаны ЦП 4 и ЦП 5. Поэтому сообщества ЦП 4–7 раcположились в правой части ординационной диаграммы (рис. 5). Но сообщества ЦП 4 и ЦП 5, выделенные на территории ООПТ «Мыс Мартьян» на относительно выровненных участках или по бортам балок, характеризуются достаточно высокой сомкнутостью древесного яруса (до 0,6–0,8), которая определяет наименьшие минимальные и максимальные значения параметров освещенность-затенение ценозов (Lc) и анионный состав почвы (Tr) по сравнению с другими описанными сообществами (рис. 2, 3). Таким образом, можно говорить о том, что режим увлажнения (Hd) является оптимальным для развития ЦП 4 и ЦП 5. Но как нами установлено ранее (Багрикова и др., 2020) именно в дубово-можжевелово-сосновых сообществах со средней сомкнутостью древостоя (до 0,4–0,6) и невысоком общем проективном покрытии травяно-кустарничкового яруса (до 30–60%) клематис жгучий в ЦП 4 распределен относительно равномерно и имеет наибольшую плотность на 100 м2, поэтому фактор освещенность-затенение ценозов (Lc) также можно отнести к ведущему для формирования нормальных по онтогенетическому спектру ценопопуляций. Следует отметить, что клематис жгучий относится к ксерофитным видам, поэтому минимальные и максимальные значения фундаментальной ниши вида по увлажнению почвы и переменности увлажнения намного ниже, чем в большинстве описанных фитоценозов. Но для южнобережных районов Крыма характерно выпадение осадков в основном в зимний период, тогда как летом осадки выпадают редко и чаще всего имеют ливневый характер. Вероятно, это объясняет тот факт, что условия в разреженных сообществах, в которых описана ЦП 4, при более высоких общих значениях параметра увлажнения по сравнению с показателями фундаментальной ниши изученного вида, в комплексе с другими эдафо-климатическими факторами отвечают требованиям инвазионного вида.
Ведущими факторами отдельного выделения ЦП 1 являются, прежде всего, анионный состав субстрата (Tr) и освещенность ценозов (Lc), эта ценопопуляция описана в прибрежных местообитаниях ООПТ «Мыс Мартьян» в составе разреженных можжевелово-земляничниково-дубовых сообществ, на приморских крутых склонах, в основном на высоте не более 30 м н.у.м. Для этих сообществ выявлены наименьшие минимальные и максимальные значения таких параметров как аридность-гумидность (Om), а также увлажнение почвы (Hd), переменность увлажнения (fH) (рис. 2, 3) и этому в значительной степени способствуют высокая крутизна склонов, имеющих южную или юго-восточную экспозицию. По результатам кластерного (рис. 4) и ординационного (рис. 5) анализа ЦП 1 также занимает обособленное положение и по большинству параметров реализованная ниша описанных сообществ не соответствует требованиям фундаментальной ниши Clematis flammula. По онтогенетическому спектру ЦП 1 также отличается от всех остальных описанных ценопопуляций, так как является стареющей при достаточно низкой плотности растений на 100 м2 (Багрикова и др., 2020).
Что касается сообществ, в которых описаны ЦП 2 и ЦП 3, то они объединены по сходству флористического состава и это отражено по результатам кластерного анализа на рисунке 3. Несмотря на то, что ценопопуляции описаны в сообществах с разной сомкнутостью древостоя, они характеризуются наибольшими минимальными и максимальными значениями таких параметров как термо- (Tm) и крио- (Cr) режимы, континентальность климата (Kn), освещенность-затенение ценоза (Lс), кислотность субстрата (Rc), содержание карбонатов в почве (Ca) (рис. 2, 3). Ведущими факторами дифференциации этих сообществ являются в наибольшей степени содержание карбонатов (Са) и терморежим (Tm), так как для данных ценопопуляций характерны хорошо прогреваемые достаточно крутые склоны южной или юго-западной экспозиции со скальными выходами и высокой каменистостью почв. При этом оптимальные условия для развития клематиса жгучего имеются в более сомкнутых сообществах, в которых описана ЦП 2. В них условия климатопа в наибольшей степени соответствуют требованиям инвазионного вида.
ЗАКЛЮЧЕНИЕ
Проведенный анализ показал, что наиболее подходящими для внедрения Clematis flammula в различные по степени сохранности или нарушенности фитоценозы во вторичном ареале на Южном берегу Крыма являются лесные сообщества c участием Quercus pubescens, Juniperus excelsa, J. deltoides, Pinus nigra subsp. pallasiana, а также натурализовавшихся вечнозеленых видов Quercus ilex, Rhamnus alaternus, относящихся к классу Quercetea pubescentis. По большинству климатических факторов описанные сообщества соответствуют экологическим требованиям изученного инвазионного вида, Установленное за последние десятилетия потепление климата может способствовать дальнейшему расселению вида в средиземноморских растительных сообществах, в нижнем лесном поясе пушистодубово-можжевеловых фитоценозов на южном макросклоне Главной гряды Крымских гор. Результаты ординационного и градиентного анализа методами фитоиндикации показали, что изменяющиеся в разных диапазонах эдафо-климатические условия неоднозначно влияют на дифференциацию сообществ. В большинстве из изученных сообществ эколого-ценотические условия являются благоприятными для распространения вида в естественные лесные сообщества в условиях вторичного ареала. По большинству параметров Clematis flammula имеет довольно широкую экологическую амплитуду, что обусловливает его высокую степень адаптации и 2-ой инвазионный статус в изученных сообществах Южного берега Крыма.
- Багрикова Н. А., Плугатарь Ю. В., Бондаренко З. Д., Резников О. Н. Наиболее опасные инвазионные виды растений на особо охраняемых природных территориях Горного Крыма // Научные записки природного заповедника «Мыс Мартьян». – 2021. – Вып. 12. – С. 114–148. DOI: 10.36305/2413-3019-2021-12-114-148
- Багрикова Н. А., Резников О. Н. Адвентивные растения в природном заповеднике «Мыс Мартьян»: история и перспективы их дальнейшего изучения // Научные записки природного заповедника «Мыс Мартьян». – 2014. – Вып. 5. – С. 48–87.
- Багрикова Н. А., Резников О. Н. Перминова Я. А. Возрастная структура и современное состояние ценопопуляций Clematis flammula (Ranunculaceae), натурализовавшегося на территории Крымского полуострова // Экосистемы. – 2020. – Вып 52 (23). – С. 152–165.
- Корженевский В. В. Новый способ графического выражения зависимости видового богатства и комплексных градиентов среды // Экология. – 1999. Т. 3. – С. 216–219.
- Корженевский В. В. Об одном простом способе интерпретации экологических шкал // Экология. – 1990. – Т. 6 – С. 60–63.
- Корженевский В. В. Современное состояние и уровни фитоиндикации // Журнал общей биологии. – 1992. – Т. 53, № 5. – С. 704–714.
- Миркин Б. М., Наумова Л. Г., Соломещ А. И. Современная наука о растительности. – М.: Логос, 2001. – 264 с.
- Павлов Д. С., Стриганова Б. Р., Букварева Е. Н., Дгебуадзе Ю. Ю. Сохранение биологического разнообразия как условие устойчивого развития // Вестник РАН. – 2010. – Т. 80, № 2. – 131-140.
- Перминова Я. А, Резников О. Н., Багрикова Н. А. Морфологические и морфометрические параметры Clematis flammula на особо охраняемых природных территориях Южного берега Крыма // Научные записки природного заповедника «Мыс Мартьян». – 2020. – Вып. 11. – С. 116–123. DOI: 10.36305/2413-3019-2020-11-116-123
- Петросян В. Г., Осипов Ф. А., Фенева И. Ю., Дергунова Н. Н., Хляп Л. А. Моделирование экологических ниш самых опасных инвазионных видов топ-100 России: проверка гипотезы консерватизма экологических ниш // Известия РАН. Сер биол. – 2023. Т. 7. – C. 70–92. DOI: 10.31857/S102634702360022X
- Плугатарь Ю. В., Корженевский В. В., Абраменков А. А. Шибляк или маквис? О внедрении Quercus ilex L. в фитоценозы южнобережного Крыма // Биология растений и садоводство: теория, инновации. – 2022. – № 3(164). – С. 6–19. DOI: 10.36305/2712-7788-2022-3-164-6-19
- Резников О. Н., Багрикова Н. А, Зубкова Н. В. Натурализация Clematis flammula L. в природных сообществах Государственного природного заповедника «Мыс Мартьян» // Вестник Тамбовского университета. Серия: естественные и технические науки. –2017. – Т. 22, вып. 5. – С. 979–883. DOI: 10.20310/1810-0198-2017-22-5-979-983.
- Селедец В. П. Типы экологических ниш видов растений и перспективы фитоиндикации на Дальнем Востоке России // Ботанический журнал. – 2013. Т. 98, № 1. – С. 25–40.
- Bagrikova N. A., Skurlatova M. V. The Materials to the “Black Book” of the Flora of the Crimean Peninsula // Russian Journal of Biological Invasions. – 2021. – Vol. 12, N 3. – P. 244–257. DOI: 10.1134/S2075111721030036
- Bello C., Cintra A. L. P., Barreto E., Vancine M. H., Sobral-Souza Th., Catherine H., Graham C. H., Galetti M. Environmental niche and functional role similarity between invasive and native palms in the Atlantic Forest // Biological Invasions. – 2021. – Vol. 23, N 3. – P. 741–54. DOI: 10.1007/s10530-020-02400-8
- Biondi E., Casavecchia S., Gigante D. Contribution to the syntaxonomic knowledge of the Quercus ilex L. woods of the Central European Mediterranean Basin // Fitosociologia. – 2003. – Vol. 40, N 1. – P. 129–156.
- Di Pietro R., Azzella M. M., Facioni L. The forest vegetation of the Tolfa-Ceriti mountains (northern latium – Central Italy) // Hacquetia. – 2010. – Vol. 9/1. – P. 91–150. DOI: 10.2478/v10028–010–0002–2
- GBIF. Global Biodiversity Information Facility. 2025. Available from: https://www.gbif.org/species/5420853 [accessed Juniary10, 2025]
- Hammer Ø., Harper D. A. T., Ryan P. D. PAST: paleontological statistics software package for education and data analysis // Palaeontologia Electronica. – 2001. – Vol. 4 (1). – 9 р.
- iNaturalist. 2025. Available from: https://www.inaturalist.org/search?q=Clematis%20flammula [accessed Juniary10, 2025]
- Liu C., Wolter C., Xian W., Jeschke J. M. Most invasive species largely conserve their climatic niche // Proceedings of the National Academy of Sciences of the USA. – 2020. – Vol. 117(38). – P. 23643–23651. DOI: 10.1073/pnas.2004289117
- Mack R. N. Biotic invasions: causes, epidemiology, global consequences and control // Ecological Applications. –2000.– N 10. – P. 689–710.
- Mucina L., Bültmann H., Dierßen K., Theurillat J.P., Raus T., Čarni A., Šumberová K., Willner W., Dengler J., García R. G., Chytrý M., Hájek M., Di Pietro R., Iakushenko D., Pallas J., Daniëls F J.A., Bergmeier E., Santos Guerra A., Ermakov N., Valachovič M., Schaminée J.H.J., Lysenko T., Didukh Ya.P., Pignatti S., Rodwell J.S., Capelo J., Weber H.E., Solomeshch A., Dimopoulos P., Aguiar C., Hennekens S.M., Tichý L. Vegetation of Europe: hierarchical floristic classification system of vascular plant, bryophyte, lichen, and algal communities // Applied Vegetation Science. – 2016. – Vol. 19 (1). – P. 3–264. doi: 10.1111/avsc.12257
- Pearman P. B., Guisan A., Broennimann O., Randin C. F. Niche dynamics in space and time // Trends in Ecology & Evolution. – 2008. – Vol. 23. – P. 149–158.
- Plant of the World On-line (POWO). 2025. Available from: http://www.plantsoftheworldonline.org (дата обращения 10.01.2025)
- Randall R. P. A Global Compendium of Weeds. – Perth, Western Australia. – 2017. – 3654 p.
- Rivas-Martínez S., Cantó P., Fernández-González F., Sánchez-Mata D. Revisión de la clase Quercetea ilicis en España y Portugal: 1. subalianza Quercenion ilicis // Folia Botanica Matritensis. – 1995. – Vol. 15. – P. 1–20.
- Santamarina S, Mateo R. G, Alfaro-Saiz E, Acedo C. On the importance of invasive species niche dynamics in plant conservation management at large and local scale // Frontiers in Ecology & Evolution. – 2023. – Vol. 10. – 049142. DOI: 10.3389/fevo.2022.1049142
- Stupar V., Milanović Đ., Brujić J., Čarni A. Formalized classification and nomenclatural revision of thermophilous deciduous forests (Quercetalia pubescentis) of Bosnia and Herzegovina // Tuexenia. – 2015. –Vol. 35. – P. 85–130. DOI: 10.14471/2015.35.016
- Tingley R., Vallinoto M., Sequeira F., Kearney M. R. Realized niche shift during a global biological invasion // Proceedings of the National Academy of Sciences of the USA. – 2014. – Vol. 111. – P. 10233–10238.
- Tsiourlis G., Konstantinidis P., Xofis P. Syntaxonomy and Synecology of Quercus coccifera Mediterranean Shrublands in Greece // Journal of. Plant Biology. – 2009. – Vol. – 52. – P. 433-447. DOI: 10.1007/s12374-009-9056-4
- Tutin T.G. The genus Clematis L. / [In: Tutin T. G. ed.]: Flora Europaea. London: Cambridge Univ. Press. 1964. – Vol. 1. – P. 221–222.
- Wiens J. J., Graham C. H. Niche conservatism: Integrating evolution, ecology, and conservation biology // Annual Review of Ecology, Evolution, Systematics. – 2005. – Vol. 36. – P. 519–539.

