Экосистемы, 30: 22–37 (2022) https://ekosystems.cfuv.ru
![]()
УДК 582.271/275:502.7(262.5)
Евстигнеева И. К.1, Танковская И. Н.1, Евстигнеев В. П.2
- Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
- Севастопольский государственный университет Севастополь, Россия ikevstigneeva@gmail.com
Изучен видовой и экологический состав, продукционный потенциал (фитомасса) и батиметрическая изменчивость фитоценозов гидрологического памятника природы – «Прибрежный аквальный комплекс у Херсонеса Таврического». На станциях восточного и западного разрезов обнаружены 58 видов 43 родов, 24 семейств, 17 порядков, 4 классов отделов Chlorophyta, Ochrophyta и Rhodophyta. 17 видов имеют природоохранный статус. В фитоценозах доминируют Rhodophyta и виды с высокой встречаемостью. Наибольшим числом видов представлены морская, ведущая, однолетняя и олигосапробная экогруппы. В системе продукционного доминирования превалируют виды с низкой относительной фитомассой, а ключевыми продуцентами являются Gongolaria barbata и Ericaria crinita. Сравнительный анализ выявил сходство и различие альгофлоры на разных участках акватории памятника. Показано, что таксономический состав альгофлоры на западном и восточном участках отличается незначительно, но в пределах каждого из них альгофлоре характерна батиметрическая неоднородность. Сходные черты свидетельствуют о принадлежности фитоценозов одной и той же ассоциации, различие обусловлено локальными особенностями среды на территориально разобщенных участках. Установлены статистически значимые различия средних числа видов и фитомассы в фитоценозе и у отделов.
Ключевые слова: особо охраняемые природные территории, макроводоросли, видовой состав, экологическая структура, встречаемость, фитомасса, доминанты, изменчивость, Черное море, Севастополь.
ВВЕДЕНИЕ
Морские экосистемы с их видовым и экологическим разнообразием имеют высокую ценность для человечества, однако в отдельных регионах они нуждаются в обеспечении эффективной сохранности и защиты (Birben, 2019; Coad et al, 2019). Одним из инструментов сохранения морских экосистем является выделение охраняемых районов Мирового океана. Такие территории помимо прямого назначения способны стать полигонами для мониторинга, результаты которого могут быть приняты во внимание при усовершенствовании природоохранных мероприятий (Fernández et al., 2016). В настоящее время на основе долгосрочных наблюдений разрабатываются новые системы критериев для выделения ключевых морских участков, обосновывается важность картирования местообитаний гидробионтов, находящихся под угрозой исчезновения, выявляются основные факторы стресса для морского биоразнообразия на местном, региональном и глобальном уровнях (Edgar et al., 2008; Heino, 2010; Darbyshire et al., 2017).
Памятники природы – одна из форм охраняемой природной территории (ООПТ), уникальные природные комплексы или объекты. К ним относится гидрологический памятник природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического», созданный 22.02.1979 года. Общая площадь ООПТ составляет 60,7 га, в том числе 59,7 га относятся к морской особо охраняемой акватории. Постановлениями правительства города Севастополя (от 29.04.2016 и от 01.02.2018 №56-ПП) был утвержден паспорт ООПТ, внесенной в перечень особо охраняемых территорий регионального значения (Прибрежный аквальный комплекс…, 2022). Памятник природы входит в состав
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
Каламитского приморского экокоридора экологического каркаса Крыма. Его основное назначение – охрана оригинальных прибрежных биоценозов и, прежде всего, сообществ, играющих важную роль в процессе самоочищения акватории, особенно мелководной зоны, которая еще недавно была местом пляжной рекреации. В настоящее время здесь запрещены все виды хозяйственной деятельности, различные формы природопользования, препятствующие сохранению или восстановлению охраняемого объекта. Одними из допустимых видов деятельности в границах памятника являются мониторинг состояния окружающей среды и изучение функционирования и развития природных экосистем и их компонентов. К сожалению, сведения об этой биоте отрывочные, не систематизированные, она недостаточно исследована в ботаническом отношении (Евстигнеева, 1983; Мильчакова, 2003; Evstigneeva, 2009). В 2003 году была опубликована монография, фрагментом одной из глав которой стали результаты обобщения оригинальных, архивных и литературных данных
- фитобентосе памятника в период с 1964 по 1998 год без указания протокола исследований (Мильчакова, 2003).
Целенаправленные гидроботанические исследования в акватории памятника были организованы спустя два десятилетия и их результаты представлены авторами в настоящей статье.
Цель работы – изучить состав, структуру, продукционный потенциал и батиметрическую изменчивость макрофитобентоса морской охраняемой акватории – «Прибрежный аквальный комплекс у Херсонеса Таврического» – в современных условиях.
МАТЕРИАЛ И МЕТОДЫ
Памятник природы находится на юго-западе Крыма, между бухтами Песочной и Карантинной. Для его береговой зоны характерны известняковые обрывистые склоны с волноприбойными нишами и висячими карнизами, единичными гротами и пещерами. Для нее характерен глыбовый бенч в виде отпрепарированного пласта известняка, перекрытого песчаными отложениями или ракушей.
Альгологические работы проводили методом вертикальных гидроботанических разрезов
- июле 2020 года. Разрез I (44º36″731′ N, 033º29″860′ E) был выполнен по восточной границе памятника со стороны бухты Карантинной, разрез II (44º36″739′ N, 033º29″319′ E) – по западной границе со стороны бухты Песочной (рис. 1). Бухта Карантинная – наиболее загрязненная среди Севастопольских бухт. В ее кутовой части находятся аварийные выпуски неочищенных бытовых стоков и вод ливневой канализации. Здесь же расположена база военных и гражданских транспортных средств. Свидетельством загрязнения вод бухты служат высокие концентрации нитратного (2–436 мкг/л) и органического (103–17000 мкг/л) азота, что обусловлено сбросами ливневой канализации (Pankeeva, Mironova, 2019). Отсутствие выраженной сезонной изменчивости концентраций обеих форм азота и некоторых других показателей указывает на превалирование антропогенного фактора над другими. Величина индекса эвтрофикации E-TRIX (3,66) позволила отнести качество вод бухты Карантинной к среднему трофическому уровню (Андреева, Копытина, 2018). Такие воды могут негативно сказываться на экологическом состоянии среды обитания макрофитов в восточной части охраняемой акватории. В бухте Песочной нет прямых источников загрязнения, здесь располагаются небольшие городские пляжи и курортно-оздоровительный комплекс «Песочная бухта».
Отбор проб проводили с помощью водолаза на глубинах 0,5; 1; 3; 5; 10 метров до границы фитали в четырехкратной повторности с применением учетных площадок размером 25х25 см (Калугина, 1969). Всего было собрано 40 количественных проб. Их первичная обработка проходила в лабораторных условиях, где определяли видовой состав водорослей с применением микроскопа «Армед XS-90» и сырую биомассу на лабораторных электронных весах «ВК-600». Определение видов проводили с учетом последних номенклатурных изменений (Зинова, 1967; Guiry et Guiry, 2022).
23
Евстигнеева И. К., Танковская И. Н., Евстигнеев В. П.

Рис. 1. Район исследования
a – гидроботанические разрезы I и II; b – восточная, c – западная границы заповедной территории.
При описании таксономической структуры учитывали сведения о пропорциях флоры, а данные по видовому составу применяли для оценки принадлежности морской флоры к той или иной географической зоне (коэффициент Фельдманна) и степени эвтрофирования водной среды в районе исследования (индекс Ченея) (Евстигнеева и др., 2020). Экологический состав идентифицировали в соответствии с классификацией макроводорослей, созданной на основе учета таких показателей, как сапробность, встречаемость видов в Черном море, сроки их вегетации и галобность (Калугина-Гутник, 1975). Для сравнения альгофлоры на разных участках охраняемой акватории применяли коэффициенты общности видового состава по Жаккару (Kj, %) и встречаемости видов (R, %). Рассчитывали индексы гомотонности фитоценоза (J1,2), видового разнообразия Шеннона в модификации Вильма (H) и выравненности сообщества по Пиелу (e) (Розенберг, 2010). На основе данных о встречаемости виды распределяли по группам постоянства (постоянные, добавочные, случайные) и фитоценотической активности (особо-, высоко-, средне-, мало- и неактивные) (Dajor, 2006; Савинов, Никитин, 2017). По индивидуальной фитомассе и с применением шкалы доминирования Е. Л. Любарского, базирующейся на сведениях об относительной фитомассе
24
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
видов, выделяли группы малозначимых и второстепенных видов, содоминантов и доминантов разных категорий (Баканов, 2005).
Для описания изменчивости характеристик ценоза определяли лимиты, размах их вариации и среднее значение с доверительным интервалом (Жукова, Минец, 2019). По величине коэффициента вариации (Cv, %) оценивали тип изменчивости признаков (верхне- и нижненормальный, значительный, большой, очень большой, аномально высокий) (Зайцев, 1990).
Для оценки отклонений характеристик фитоценоза на станциях двух разрезов выполняли проверку статистической гипотезы о значимости отличий выборочных значений анализируемой величины на основе стандартных критериев. При сравнении величины биомассы на разных разрезах применялся t-критерий Уэлча, который основан на распределении Стьюдента. Особенностью теста является его применение в случаях, когда распределение выборок случайных величин имеет необязательно равные известные дисперсии. В этом случае при справедливости нулевой гипотезы распределение t будет приблизительно распределением Стьюдента со степенями свободы d:
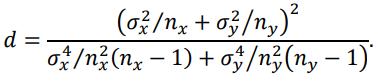
Из формулы следует, что число степеней свободы d необязательно является целым числом.
Сравнение числа видов макроводорослей на двух разрезах выполняли с применением χ2-критерия:
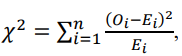
где: Ei и Oi – наблюдаемые и ожидаемые частоты, т.е. частоты в выборках для двух разрезов (Боровиков, 2013).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При выделении участков, важных для сохранения морского биоразнообразия, обычно руководствуются рядом критериев, среди которых степень изученности биоты и биотопа. Для многих регионов она недостаточна или требуется актуализация имеющихся сведений.
- таким регионам относится гидрологический памятник природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического». Результаты целенаправленных гидроботанических исследований его акватории в 2020 году легли в основу представления о составе, структуре и изменчивости бентосной альгофлоры памятника в современных условиях.
Общая характеристика бентосной флоры в районе исследований. В ходе исследований в составе альгофлоры памятника природы были обнаружены 58 видов, относящихся к 43 родам, 24 семействам, 17 порядкам, 4 классам отделов Chlorophyta (Ch), Ochrophyta (Och) и Rhodophyta (Rh). Видовая представленность отделов (12 видов Ch, 13 – Och, 33 – Rh) почти полностью соответствовала таковой в прибрежной зоне бухты Караджинской, примыкающей к южному кластеру особо охраняемой природной территории Национальный природный парк «Тарханкутский» (Черное море) (Sadogurskiy, 2018). Почти треть идентифицированных видов (2 вида Ch, 6 – Och, 9 – Rh) имели природоохранный статус. Большая часть их внесена в Красные книги Крыма (КкК) (4 вида Och, 5 – Rh) и Севастополя (КкС) (2 вида Och, 3 – Rh).
Два вида (Stilophora tenella (Esper) P. C. Silva и Phyllophora crispa (Huds.) P. S. Dixon)
зарегистрированы в Красной книге РФ (КкРФ), по семь видов– в Красной книге Украины
(КкУ) (1 – Ch, 3 – Och, 3 – Rh) и Black Sea Red Data List (RDL) (1 – Ch, 2 – Och, 4 – Rh). По два вида Och и Rh вошли в Black Sea Red Data Book (RDB) (Красная книга…, 2015; Красная книга…, 2008; Красная книга…, 2018; Червона книга…, 2009; Black Sea…, 1997; Black Sea…,
1999). Ниже приведен список видов водорослей, обнаруженных на охраняемой акватории летом 2020 года, с указанием глубин произрастания и природоохранного статуса.
25
Евстигнеева И. К., Танковская И. Н., Евстигнеев В. П.
![]()
CHLOROPHYTA Rchb.
Ulvophyceae Mattox et K. D. Stewart
Cladophorales Haeckel
Cladophoraceae Wille
Chaetomorpha Kütz.
Chaetomorpha aerea (Dillwyn) Kütz. Глубина 3 м, 10 м.
Chaetomorpha linum (O. F. Müll.) Kütz. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м.
Cladophora Kütz.
Cladophora albida (Nees) Kütz. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м.
Cladophora laetevirens (Dillwyn) Kütz. Глубина 0,5 м.
Cladophora liniformis Kütz. Глубина 3 м, 10 м.
Cladophora sericea (Huds.) Kütz. Глубина 0,5 м, 1 м, 3 м, 5 м.
Ulotrichales Borzi
Ulotrichaceae Kütz.
Ulothrix Kütz.
Ulothrix implexa (Kütz.) Kütz. Глубина 3 м, 10 м. Ulvales F. F. Blackman et Tansley Ulvaceae J. V. Lamour. ex Dumort. Ulva L.
Ulva intestinalis L. Глубина 0,5 м.
Ulva torta (Mertens) Trevisan . Глубина 0,5 м.
Ulva rigida C. Agardh. Глубина 0,5 м, 1 м, 3 м, 5 м.
Ulvellaceae Schmidle
Ulvella P. Crouan et H. Crouan
Ulvella viridis (Reinke) R. Nielsen, O’Kelly et B. Wysor. Глубина 5 м. RDL.
Cladophorales Haeckel
Boodleaceae Børgesen
Cladophoropsis Børgesen
Cladophoropsis membranacea (Hofm. Bang ex C. Agardh). Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. КкУ.
OCHROPHYTA Caval.-Sm.
Phaeophyceae Kjellm.
Ectocarpales Bessey
Acinetosporaceae G. Hamel ex Feldmann
Feldmannia Hamel
Feldmannia lebelii (Aresch. ex P. Crouan et H. Crouan) Hamel. Глубина 10 м.
Feldmannia irregularis (Kütz.) Hamel. Глубина 10 м.
Chordariaceae Grev.
Stilophora J. Agardh
Stilophora tenella (Esper) P. C. Silva. Глубина 3 м, 5 м, 10 м. КкРФ, КкК, КкС, КкУ.
Stilophora nodulosa (C. Agardh) P. C. Silva in P. C. Silva, Basson et Moe . Глубина 5 м.
Corynophlaea Kütz.
Corynophlaea umbellata (C. Agardh) Kütz. Глубина 1 м, 3 м, 5 м.
Ectocarpaceae C. Agardh
Ectocarpus Lyngb.
Ectocarpus siliculosus (Dillw.) Lyngb. Глубина 10 м. КкУ.
Fucales Bory
Sargassaceae Kütz.
Gongolaria Boehmer
Gongolaria barbata (Stackh.) Kuntze. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. КкК, RDL, RDB. Ericaria Stackhouse
Ericaria crinita (Duby) Molinari et Guiry. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. КкК, RDL, RDB.
Sphacelariales Mig.
Cladostephaceae Oltm.
Cladostephus C. Agardh
Cladostephus hirsutus (L.) Boudouresque et M. Perret-Boudouresque ex Heesch et al. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. КкУ.
Sphacelariaceae Decne.
Sphacelaria Lyngb.
26
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
Sphacelaria cirrosa (Roth) C. Agardh. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м.
Dictyotales Bory
Dictyotaceae J. V. Lamour. ex Dumortier
Dictyota J. V. Lamour.
Dictyota fasciola (Roth) J. V. Lamour. Глубина 5 м.
Cutleriaceae J. W. Griffith et A. Henfrey
Zanardinia Nardo ex Zanard.
Zanardinia typus (Nardo) P. C. Silva in Greuter. Глубина 10 м.
Nereia Zanard.
Nereia filiformis (J. Agardh) Zanard. Глубина 5 м, 10 м. КкК, КкС.
RHODOPHYTA Wettst.
Florideophyceae Cronquist
Acrochaetiales Feldmann
Acrochaetiaceae Fritsch ex W. R. Taylor
Acrochaetium Nägeli
Acrochaetium secundatum (Lyngb.) Nägeli. Глубина 0,5 м, 3 м, 5 м.
Rhodochorton Nägeli
Rhodochorton purpurem (Light.) Rosenv. Глубина 1 м. КкУ.
Corallinales P. C. Silva et H. W. Johans.
Corallinaceae J. V. Lamour.
Corallina L.
Corallina officinalis L. Глубина 3 м.
Hydrolithon (Foslie) Foslie
Hydrolithon farinosum (J. V. Lamour.) Penrose et Y. M. Chamb. . Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. Ellisolandia K. R. Hind et G. W. Saunders
Ellisolandia elongata (J. Ellis et Solander) K. R. Hind et G. W. Saunders. Глубина 0,5 м, 1 м, 3 м, 5 м,
- м.
Gigartinales F. Schmitz
Phyllophoraceae Willk.
Phyllophora Grev.
Phyllophora crispa (Huds.) P. S. Dixon. Глубина 5 м, 10 м. КкРФ, КкК, КкС, RDL, RDB.
Coccotylus Kütz.
Coccotylus brodiei (Turner) Kütz. Глубина 10 м. RDL, RDB.
Ceramiales Nägeli
Callithamniaceae Kütz.
Callithamnion Lyngb.
Callithamnion corymbosum (J. E. Smith.) Lyngb. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м.
Ceramiaceae Dumort.
Ceramium Roth
Ceramium diaphanum (Lightf.) Roth. Глубина 0,5 м; 3 м, 5 м.
Ceramium virgatum Roth. Глубина 0,5 м, 3 м, 10 м.
Ceramium ciliatum (Ell.) Ducl. Глубина 0,5 м.
Ceramium secundatum Lyngb. . Глубина 3 м. Antithamnion Nägeli
Antithamnion cruciatum (Agardh) Nägeli Глубина 3 м, 5 м, 10 м.
Pterothamnion Nägeli
Pterothamnion plumula (J. Ellis) Nägeli. Глубина 0,5 м, 3 м.
Apoglossum (J. Agardh) J. Agardh
Apoglossum ruscifolium (Turn.) J. Agardh. Глубина 1 м, 3 м, 5 м, 10 м.
Nitophyllum Grev.
Nitophyllum punctatum (Stackh.) Grev. Глубина 10 м.
Rhodomelaceae Horan.
Chondria С. Agardh
27
Евстигнеева И. К., Танковская И. Н., Евстигнеев В. П.
![]()
Chondria capillaris (Huds.) M. J. Wynne. Глубина 1 м, 10 м.
Chondria dasyphylla (Woodw.) С. Agardh. . Глубина 0,5 м, 3 м, 5 м, 10 м.
Laurencia J. V. Lamour.
Laurencia coronopus J. Agardh. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. КкК, КкУ.
Laurencia obtusa (Huds.) J. V. Lamour. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. RDL.
Osmundea Stackhouse
Osmundea pinnatifida (Huds.) Stackhouse . Глубина 10 м. КкК.
Palisada K. W. Nam
Palisada perforata (Bory) K. W. Nam . Глубина 0,5 м. Carradoriella P. C. Silva
Carradoriella denudata (Dillwyn) Savoie et G. W. Saunders . Глубина 0,5 м, 3 м, 5 м, 10 м.
Carradoriella elongata (Huds.) Savoie et G. W. Saunders. Глубина 3 м, 5 м.
Vertebrata Gray
Vertebrata subulifera (C. Agardh) Kuntze. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м.
Leptosiphonia Kylin
Leptosiphonia brodiei (Dillw.) Savoie et G. W. Saunders . Глубина 3 м.
Wrangeliaceae J. Agardh
Spermothamnion Aresch.
Spermothamnion strictum (C. Agardh). Глубина 1 м, 3 м, 5 м, 10 м.
Gelidiales Kylin
Gelidiaceae Kütz.
Gelidium J. V. Lamour.
Gelidium crinale (Hare ex Turner). Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м.
Gelidium spinosum (S. G. Gmel.) P. C. Silva. Глубина 0,5 м, 1 м, 3 м, 5 м, 10 м. RDL.
Dasyaceae Kütz.
Dasya C. Agardh
Dasya apiculata (C. Agardh) J. Agardh . Глубина 3 м. КкК, КкС, КкУ.
Halymeniales G. W. Saunders et Kraft
Dermocorynus P. Crouan et H. Crouan
Dermocorynus dichotomus (J. Agardh) Gargiulo, M. Morabito et Manghisi. Глубина 0,5 м. КкС.
Lomentaria Lyngb.
Lomentaria clavellosa (Turn.) Gail. Глубина 1 м, 3 м, 5 м.
Compsopogonophyceae G. W. Saunders et Hommersand
Erythropeltales Garbary, G. I. Hansen et Scagel
Erythrotrichiaceae G. M. Smith
Erythrotrichia Aresch.
Erythrotrichia carnea (Dillw.) J. Agardh. Глубина 5 м, 10 м.
Опубликованный в 2003 году список для района исследований за период с 1964 по 1998 год включал 80 видов (Мильчакова, 2003). Отсутствие в работе сведений о координатах гидроботанических съемок, времени (сезон), частоте их проведения и др. не позволило корректно провести сравнительный анализ данных за указанный период и спустя два десятилетия. Однако результаты наших исследований способны расширить этот список за счет дополнительно обнаруженных 2 видов Ch, 1 вида Och и 10 видов Rh (в предлагаемом в статье списке обозначены символом « »). Число видов, собранных авторами только во время летней альгосъемки 2020 года, составило 62 % этого показателя, обобщенного для двух периодов исследований, что явилось доказательством достаточно высокого фиторазнообразия биоты гидрологического памятника природы. Видовое соотношение отделов осталось неизменным и свидетельствовало о равном вкладе Ch и Och во флористический состав бентоса района исследований, втрое меньшем, чем у Rh. Численная пропорция Rh : Och (коэффициент Фельдманна), как и ранее, указывала на субтропический характер флоры. Основу таксономического разнообразия формировали Rh. Достаточно высоким видовым разнообразием (по 3 или 4 вида) отличались роды Ulva, Cladophora и
28
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
Ceramium. Большинство родов (77 %) было представлено одним видом, что говорило о таксономической «пестроте» исследованной альгофлоры. Спектр порядков и семейств, ведущих по числу видов и родов, включал Cladophoraceae, Ceramiaceae, Rhodomelaceae, Cladophorales, Ceramiales. Пропорция таксонов всей альгофлоры (1 порядок : 1 семейство : 3 рода : 3 вида) и у отделов совпадала только в надродовой части.
Летняя альгофлора состояла из видов 12 экологических групп из 13 известных для фитобентоса Черного моря. Среди них отсутствовали виды пресноводно-солоноватоводного комплекса. Наибольшим числом видов были представлены морская, ведущая, однолетняя и олигосапробная группы (по 45–71 % всех видов), а каждый третий вид был многолетним.
Разрез I (восточный участок). Основу альгофлоры этой части охраняемой акватории составили 46 видов (79 % идентифицированных видов) (рис. 2). Пропорция таксонов выглядела как 1 порядок : 1 семейство : 2 рода : 3 вида, а видовое соотношение отделов (1 Ch : 1 Och : 3 Rh) свидетельствовало о превосходстве Rh.
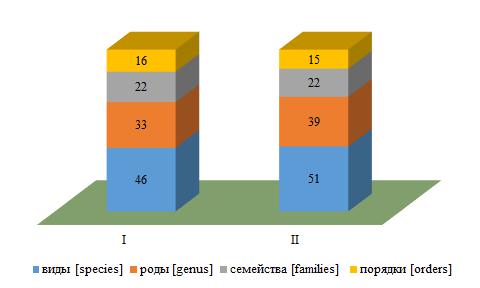
Рис. 2. Таксономический состав макроводорослей на I и II разрезах
Цифрами обозначено абсолютное число таксонов.
Среди донных водорослей у восточной границы охраняемой акватории преобладали постоянные виды со встречаемостью выше 50 % (табл. 1). Треть видового состава относилась
- случайной категории (R менее 25 %). Случайных видов было больше среди Ch, постоянных
– среди Rh, у Och обе группы были представлены поровну. Константное ядро (R=100 %) состояло из 7 видов, большая часть которых по своим экологическим предпочтениям были представителями морской, ведущей, многолетней, олиго- и мезосапробной групп
(Chaetomorpha linum (O. F. Müll.) Kütz., Cladophora albida (Nees) Kütz., Gongolaria barbata (Stackh.) Kuntze, Sphacelaria cirrosa (Roth) C. Agardh., Gelidium crinale (Hare ex Turner), Gelidium spinosum (S. G. Gmel.) P. C. Silva, Laurencia obtusа (Huds.) J. V. Lamour.).
Среди групп фитоценотической активности лидировала малоактивная и отсутствовала неактивная группа с R менее 5 %. В фитоценозе было немало видов особо- и высокоактивной категорий, общая доля которых составляла 46 % (табл. 1). Значения индексов J1 и J2 (0,6 и 2,6) свидетельствовали о видовой однородности сообщества.
Альгофлора на станциях разреза I состояла из видов 12 экогрупп. Наибольшим разнообразием отличались морская, ведущая, однолетняя и олигосапробная группы (по 52– 67 % видового состава на восточном участке) (рис. 3). Высокий суммарный вклад ключевых групп указывал на гомотонный характер экологического состава исследованного ценоза. Вторую позицию занимали многолетние, солоноватоводно-морские и мезосапробные виды (26–35 %). Такой уровень развития групп-индикаторов средней степени распреснения и загрязнения среды соответствовал условиям, сложившимся на границе с эвтрофированными водами бухты Карантинной.
29
Евстигнеева И. К., Танковская И. Н., Евстигнеев В. П.
![]()
Таблица 1
Группы постоянства, фитоценотической активности и продукционного доминирования в
альгофлоре памятника природы
| Группа | Разрезы | ||||||
| I | II | ||||||
| Группы постоянства | |||||||
| Постоянная | 21 (46 %)* | 24 | (47 %) | ||||
| Добавочная | 8 (17 %) | 8 (17 %) | |||||
| Случайная | 17 | (37 %) | 19 | (37 %) | |||
| Группы фитоценотической активности | |||||||
| Особоактивная | 11 | (24 %) | 17 | (33 %) | |||
| Высокоактивная | 10 | (22 %) | 7 (14 %) | ||||
| Среднеактивная | 8 (17 %) | 8 (16 %) | |||||
| Малоактивная | 17 | (37 %) | 19 | (37 %) | |||
| Группы продукционного доминирования | |||||||
| Малозначимая | 37 (81%) | 41 (80%) | |||||
| Второстепенная | 6 (13 %) | 6 (12 %) | |||||
| Содоминантная | 2 | (4 %) | 3 | (6 %) | |||
| Доминантная | – | 1 | (2 %) | ||||
| Абсолютно доминантная | 1 | (2 %) | – | ||||
Примечание к таблице. * Перед скобками – абсолютное число видов, в скобках – относительное.
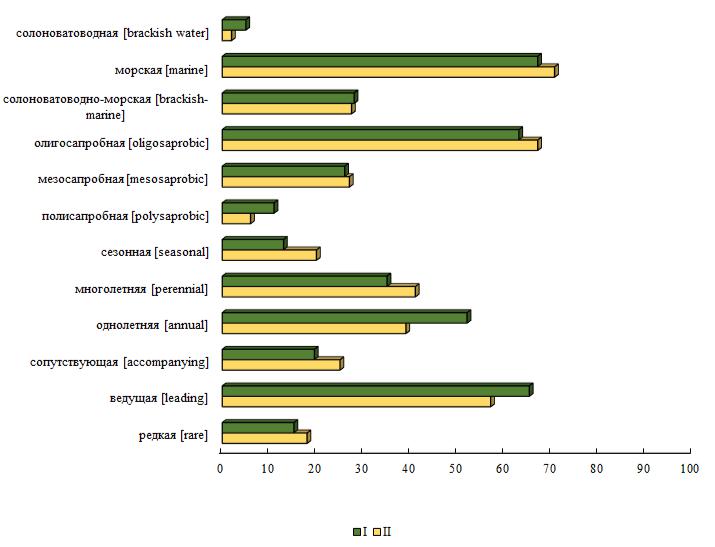
Рис. 3. Доля (%) видов экологических групп макроводорослей на I и II разрезах
30
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
Особенностью пространственного распределения водорослей на станциях разреза I было то, что большая часть видов (32 вида) обитала на первом этаже горизонта фотофильной растительности и среди них преобладали Rh. На втором этаже состав был в 1,5 раза беднее, а лидерство Rh – менее существенным. Общее число видов по глубинам варьировало незначительно с максимумом на 5 м (рис. 4). Его среднее значение составляло 23±2 вида, а изменчивость находилась в пределах «нижней» нормы (Cv=12 %).
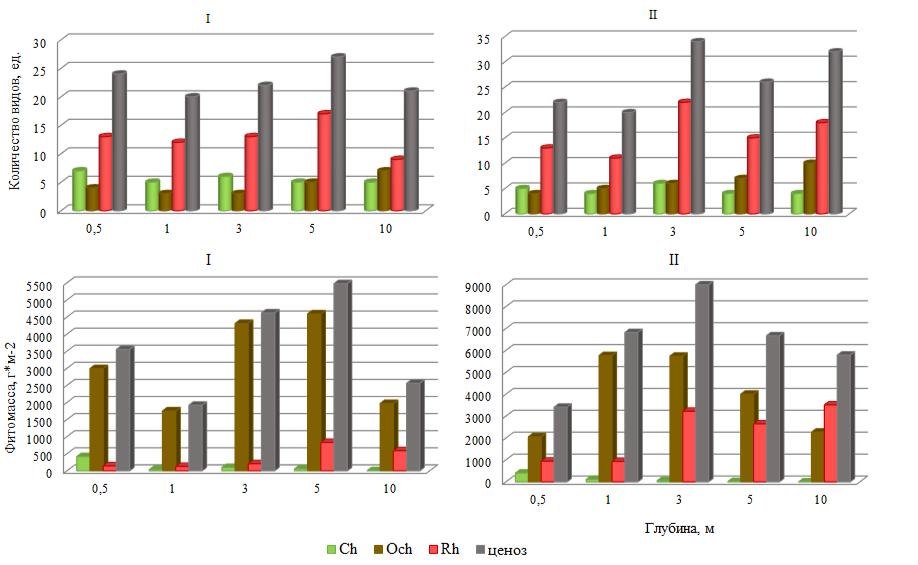
Рис. 4. Батиметрическая изменчивость числа видов и фитомассы
макроводорослей (I, II разрезы)
Размах вариации числа видов у Ch был незначительным (2 вида), что предопределяло низкое значение Сv. Среднее для обследованных глубин число видов Ch составляло 5,6±0,8 (рис. 5). Пределы изменений числа видов Och были примерно как у Ch, но его среднее значение было ниже, а вертикальная изменчивость соответствовала «верхненормальному» типу. Красные водоросли доминировали повсеместно, число их видов колебалось по глубинам сильнее, чем у других отделов.
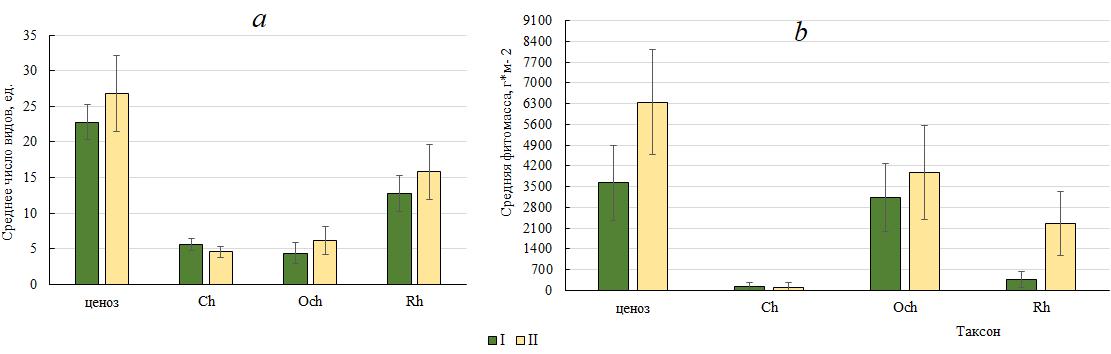
Рис. 5. Среднее число видов (a) и фитомасса (b) макроводорослей
31
Евстигнеева И. К., Танковская И. Н., Евстигнеев В. П.
![]()
Сравнение видового состава на разных горизонтах выявило 41 % одинаковых видов. Половина или чуть больше их приходилось на глубины 1 и 3 м, 3 и 5 м. Очень мало общих видов обитало на 0,5 и 10 м, на 3 и 10 м, что, по-видимому, свидетельствовало о контрастности условий обитания на этих горизонтах.
Биомасса водорослей трех отделов была в разной степени пространственно изменчивой.
- Ch она варьировала широко с максимумом на крайних для данного разреза горизонтах (рис. 4). Ее изменчивость можно было оценить как «аномально» высокую (Cv=137 %). У остальных отделов и особенно у Och вариабельность фитомассы была ниже. Таксономическое лидерство отдела не всегда сопровождалось его продукционным господством. Так, среди отделов на всех горизонтах в роли ключевого продуцента выступал Och, а не Rh. На его долю приходилось 78–93 % фитомассы ценоза. Rh с большим отрывом от Och занимал второе место. Фитомасса ценоза изменялась в пределах «нормы» и в среднем составляла 3627±1275 г×м-2.
Среди видов наибольшим вкладом в продукционный процесс отличалась G. barbata (43– 82 %). Минимум ее относительной фитомассы был отмечен на 10 м, где индекс Шеннона достигал своего максимума. Максимум относительного показателя ключевого продуцента был логично сопряжен с минимумом индекса Н, что было зафиксировано на глубине 3 м. Пределы изменений и среднее значение этого индекса отражены в таблице 2. Его изменчивость по станциям носила «верхненормальный» характер (Cv=34 %).
| Таблица 2 | ||||||||||
| Пространственные изменения индексов Шеннона (Н) и Пиелу (е) | ||||||||||
| Номер разреза | Индекс | Глубина, м | Среднее значение индексов | |||||||
| 0,5 | 1 | 3 | 5 | 10 | ||||||
| I | H | 1,53 | 1,38 | 1,08 | 2,09 | 2,55 | 1,70±0,50 | |||
| e | 0,60 | 0,50 | 0,40 | 0,80 | 1,00 | 0,70±0,20 | ||||
| II | H | 2,82 | 1,42 | 2,67 | 2,33 | 1,97 | 2,20±0,50 | |||
| e | 1,00 | 0,50 | 0,95 | 0,83 | 0,70 | 0,80±0,20 | ||||
-
- границах разреза I фитомасса таких важных ценозообразующих компонентов черноморского фитобентоса как Ericaria crinita (Duby) Molinari et Guiry и Ph. crispa была во много раз ниже, чем у G. barbata. Высокие значения индекса Пиелу соответствовали степени выравненности ценоза по относительному обилию видов на 5 и 10 м (табл. 2).
По шкале Е. Л. Любарского, учитывающей величину относительной фитомассы, виды были распределены на четыре группы доминирования (табл. 1). Самой многочисленной среди них была группа малозначимых видов с невысокой относительной фитомассой. Каждый десятый вид относился к второстепенной группе, а Vertebrata subulifera (C. Agardh) Kuntze, E. crinita и S. cirrosa – к субдоминантной. У восточной границы памятника природы доминанты, выделенные на основе шкалы доминирования, отсутствовали, а их место занимал абсолютный доминант G. barbata.
Разрез II (западный участок). У западной границы охраняемой акватории обитали 88 % всех идентифицированных видов (рис. 2). Общая таксономическая пропорция выглядела как 1 порядок : 1 семейство : 2 рода : 3 вида. Видовое соотношение отделов свидетельствовало о четырехкратном преимуществе Rh. Наибольшим разнообразием видов отличалось ограниченное количество родов (Ceramium, Cladophora), семейств (Cladophoraceae, Ceramiaceae, Rhodomelaceae) и порядков (Cladophorales, Ceramiales). Подавляющее большинство родов и 40 % порядков были представлены одним видом. Пропорция соподчиненных таксонов в ценозе и у Ch совпадала с таковой на разрезе I. У Och и сообщества сходство проявлялось в надвидовой части пропорции, а у всех отделов – в надродовой.
Основу альгофлоры на западном участке составляли виды постоянной группы, вторую позицию занимали случайные виды, третью – добавочные (табл. 1). Среди Ch было больше постоянных видов, среди Rh – постоянных и случайных. Отличительными особенностями
32
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
Och стали отсутствие добавочных видов и равная доля остальных групп. Величины индексов J1 (1,1) и J2 (3,0) свидетельствовали о выраженной однородности видовой структуры фитобентоса на станциях разреза II.
Водоросли у западной границы охраняемой акватории принадлежали к 12 экогруппам (рис. 3). Наибольшим разнообразием видов выделялись одно- и многолетняя, морская, ведущая и олигосапробная группы (по 40–71 % обнаруженных на разрезе видов). Среди видов присутствовал представитель солоноватоводной группы (Cladophora liniformis Kütz.).
Константная группа состояла из 1 вида Ch, 4 – Och и 5 – Rh. Среди них присутствовали ценообразующие виды G. barbata и E. crinita. Доминирующий в филлофоровых фитоценозах вид Ph. crispa был зафиксирован только на глубине 10 м. Большая часть константных видов относились к морским, олигосапробным, чаще многолетним организмам. Среди бентосных водорослей лидировали особо- (33 %) и малоактивные (37 %) виды. Неактивные виды отсутствовали, а остальные категории фитоценотической активности были представлены поровну (табл. 1).
-
- применением коэффициента Жаккара было выявлено высокое сходство видового состава в районе разреза II между такими парами глубин, как 0,5 и 1 м, 3 и 5 м (Kj=62 %). Половина общих видов была характерна для фитобентоса на 0,5 и 5 м, 0,5 и 3 м, 1 и 5 м. Очень низкий уровень взаимного подобия проявлял видовой состав на 10 м при сопоставлении его с таковым на остальных горизонтах (30–37 %). Средний коэффициент Жаккара для всего разреза не достигал 50 % и тем самым свидетельствовал о наличии батиметрической неоднородности альгофлоры, во многом детерминированной закономерностями распространения света в водной среде.
Анализ распределения видов в пределах этажей фотофильной растительности показал, что на первом из них было сосредоточено в 1,3 раза больше видов, чем на втором. На каждом горизонте и этажах доминировали красные водоросли. Особенно существенной их структурная роль была на глубинах 3 (65 %) и 10 (56 %) м. К этим же глубинам был приурочен максимум разнообразия всего ценоза, Ch (на 3 м) и Och (на 10 м). Среди отделов только у Och прослеживалась прямая зависимость между числом видов и глубиной. Среднее для разреза число видов Rh (15,8±3,8) было вдвое выше, чем у Ch и Och (рис. 5). Вертикальная изменчивость анализируемого показателя у всех отделов находилась в пределах биологической «нормы».
На каждой глубине в продукционном процессе лидировал Och. На долю суммарной фитомассы его видов приходилось 77–93 %, а средней – 86 %. Ch на глубине 0,5 м занимал вторую позицию, на остальных горизонтах здесь располагался Rh (рис. 4). У Rh, Och и всего ценоза вертикальная изменчивость фитомассы носила умеренный характер. Большой размах
- существенная разница в крайних значениях показателя у Ch позволили причислить его фитомассу по шкале Г.Н. Зайцева к «аномально» изменчивым признакам. Локацией максимума фитомассы ценоза и входящих в его состав Rh и Och были глубины 3 и 10 м, минимума – чаще 1 м. Наиболее благоприятными для произрастания Ch оказались условия на глубине 0,5 м. Среди отделов их средняя фитомасса была наименьшей, а Och – наибольшей. В отличие от ситуации на станциях разреза I роль доминанта здесь выполняла E. crinita, а
G. barbata, V. subulifera и Ph. crispa перешли в ранг содоминантов.
Сравнительная характеристика фитобентоса на двух разрезах. Полученные в ходе исследований данные были подвергнуты сравнительной процедуре с целью выявления сходства и различия растительности на обследованных участках охраняемой акватории. Сходство фитоценоза прежде всего свидетельствовало о принадлежности его одной и той же растительной ассоциации, где главную структурную роль играют E. crinita и G. barbata. Различие могло быть обусловлено локальными особенностями морской среды на территориально разобщенных участках, описанными выше. Установлено, что на любом из них фитобентос обладал одной и той же таксономической пропорцией в сообществе в целом
- у каждого отдела. Видовое соотношение свидетельствовало о равном участии Ch и Och в формировании ценоза и количественном доминировании Rh. Величина коэффициента Жаккара иллюстрировала высокое сходство общего видового состава на двух разрезах и более
33
Евстигнеева И. К., Танковская И. Н., Евстигнеев В. П.
![]()
низкое – на станциях каждого разреза в отдельности. Одинаковым было и видовое соотношение групп постоянства (3 постоянных вида : 1 добавочный : 2 случайных). Величины индекса гомотонности, большое количество одинаковых и константных видов отражали незначительность варьирования таксономического состава фитобентоса на исследованных участках заповедной акватории.
Экологический состав фитобентоса на станциях двух разрезов характеризовался одинаковым числом ведущих и солоноватоводно-морских видов, одними и теми же базовыми (по числу видов) экогруппами. В системе продукционного доминирования преобладали малозначимые виды с небольшой относительной фитомассой, а вторую позицию занимали второстепенные виды одной и той же систематической принадлежности. Пространственная изменчивость числа видов в отделах, фитомассы ценоза и входящих в него Rh и Och соответствовала биологической «норме». Средняя фитомасса Ch и Och на двух разрезах была близка к совпадению. Максимум и минимум фитомассы Ch в пределах каждого разреза был приурочен к одним и тем же глубинам (0,5 м и 10 м). На малых глубинах проявлялся минимум данного показателя у Rh. У Och он был зафиксирован как на мелководье, так и на максимальной для данных разрезов глубине. Территориальная приуроченность крайних значений фитомассы разных отделов скорее соответствовала особенностям распространения света в водной среде.
Индивидуальное отличие фитоценоза на западной границе охраняемой акватории проявлялось в его более высоком видовом и родовом разнообразии, в большем количестве видов красных и бурых водорослей. Среднее число видов в фитоценозе и у его Rh и Och, средняя фитомасса ценоза и Rh превышали подобные на восточном участке. Вклад группы особо активных видов с высоким показателем встречаемости и малозначимых с небольшой относительной фитомассой на станциях западного разреза был гораздо выше, чем восточного. Система продукционного доминирования включала E. crinita. Большое количество малозначимых видов и отсутствие абсолютного доминанта среди водорослей западной части охраняемой акватории отразилось на величине индекса Шеннона, вдвое меньшей, чем на восточном участке. Экологический состав альгофлоры отличался более весомым развитием морской и олигосапробной экогрупп, сопутствующих, многолетних и сезонных видов.
- восточной границы памятника уровень индекс Ченея был выше, чем у западной, что соответствовало качеству среды обитания, граничащей с более эвтрофными водами бухты Карантинной. В таких условиях активнее развивались однолетние виды, максимума достигало среднее число видов Ch, среди которых были представители, предпочитающие загрязненные участки и даже избегающие чистые без подтока загрязняющих веществ. Фитоценоз в условиях превалирования антропогенного фактора содержал в своем составе абсолютный доминант G. barbata. Территориальная локация крайних значений фитомассы ценоза, видов Rh и Och на двух разрезах не всегда совпадала.
При сравнении данных для восточного и западного разрезов применили два способа проверки статистических гипотез: t-тест Уэлча и χ2-тест Пирсона (табл. 3).
Таблица 3
Статистическая оценка различий в выборке данных альгосъемки на двух разрезах
| Фитомасса | Число видов | |||||||||
| Таксон | Доверительный | Число | Число | |||||||
| |x̅- y̅| | интервал (95%) | t | степеней | p | χ2 | степеней | p | |||
| нижний | верхний | свободы | свободы | |||||||
| Ch | 5,25 | -240 | 250 | 0,05 | 8,00 | 0,96 | 0,34 | 4 | 0,98 | |
| Och | 846 | -1480 | 3170 | 0,85 | 7,30 | 0,42 | 1,3 | 4 | 0,86 | |
| Rh | 1874 | 355 | 3390 | 3,28* | 4,51 | 0,03 | 9,7* | 4 | 0,04 | |
| Ценоз | 2715 | 100 | 5330 | 2,43* | 7,26 | 0,04 | 7,7* | 4 | 0,10 | |
Примечание к таблице. * значимая величина критериев на уровне 10 %.
34
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
Первый тест был привлечен для непрерывной случайной величины фитомассы, второй – для дискретной случайной величины числа видов. В обоих случаях значимые различия были выявлены для интегральной характеристики фитоценоза («Ценоз») и Rh. Для Ch и Och такие различия не обнаружены.
ВЫВОДЫ
-
- Фитобентос гидрологического памятника природы летом 2020 года состоял из 58 видов 43 родов, 24 семейств, 17 порядков, 4 классов, 3 отделов. 17 видов имели природоохранный статус. Основа таксономического разнообразия сформирована Rhodophyta. С учетом современных и ранее полученных данных фитобентос памятника природы включает 93 вида.
- Значения коэффициента сходства видов, индексов гомотонности и Пиелу, большое число константных видов свидетельствовали о незначительности различия таксономического состава флоры на разных участках охраняемой акватории. Однако среднее значение коэффициента Жаккара для каждого из них в отдельности указывало на наличие батиметрической неоднородности бентосной флоры.
- В составе летней альгофлоры лидировали виды морской, ведущей, однолетней и олигосапробной групп, а в системе продукционного доминирования – представители малозначимой группы с низкой относительной фитомассой. Ключевыми продуцентами анализируемого сообщества являлись черноморские ценозообразующие бурые водоросли
Gongolaria barbata и Ericaria crinita.
-
- Пространственная изменчивость видового состава отделов, фитомассы ценоза, Ochrophyta и Rhodophyta носила умеренный характер. Фитомасса Chlorophyta по шкале изменчивости биологических объектов была отнесена к высоко вариабельным признакам.
- Сравнительная процедура выявила сходство и различие альгофлоры исследованной акватории. Наличие сходных черт свидетельствовало о принадлежности фитоценоза к одной
- той же ассоциации. Различие было обусловлено локальными особенностями морской среды на территориально разобщенных участках.
- Проверка гипотезы о значимости установленных различий показала, что среднее число видов Chlorophyta и Ochrophyta, средняя фитомасса Rhodophyta и всего ценоза на двух разрезах достоверно отличались. В отношении среднего числа видов в ценозе и у его флористического лидера Rhodophyta, а также средней фитомассы Chlorophyta и Ochrophyta сохраняется нулевая гипотеза.
Полученные в ходе исследований данные послужили расширению представления о фиторазнообразии гидрологического памятника природы регионального значения и способны стать частью научной базы для оценки его трансформации под воздействием природных и антропогенных факторов.
Благодарности. Авторы выражают искреннюю благодарность сотрудникам отдела биотехнологий и фиторесурсов канд. географ. наук, с. н. с. Т. В Панкеевой., канд. биол. наук, с. н. с. Н. В. Мироновой за совместную работу по сбору и обработке первичного материала, а также водолазу-дайверу А. М. Щербачу за отбор альгологических проб.
Работа выполнена в рамках государственного задания Института биологии южных морей им. А. О. Ковалевского РАН (проект № 121030300149-0).
Список литературы
Андреева Н. А., Копытина Н. И. Сукцессия таксоценов морских микроводорослей при длительном лабораторном культивировании // Системы контроля окружающей среды – 2018. – Вып. 11 (31). – С. 95–100.
Баканов А. И. Количественная оценка доминирования в экологических сообществах / [Ред. чл.-корр. РАН Г. С. Розенберг]. – Сборник научных трудов Количественные методы экологии и гидробиологии. – Тольятти: СамНЦ РАН, 2005. – С. 37–68.
35
Евстигнеева И. К., Танковская И. Н., Евстигнеев В. П.
![]()
Боровиков В. П. Популярное введение в современный анализ данных в системе STATISTICA. Учебное пособие для вузов. – М.: Горячая линия, Телеком, 2013. – 288 с.
Евстигнеева И. К. Структура цистозирово- и зостерово-лауренциевых фитоценозов в некоторых районах Крымского побережья Черного моря // Экология моря. – 1983. – Т. 12. – С. 35–41.
Евстигнеева И. К., Евстигнеев В. П., Танковская И. Н. Пространственная изменчивость макрофлоры обрастания гидротехнических сооружений в различных районах Крымского прибрежья Черного моря // Вода и экология: проблемы и решения. – 2020. – № 2 (82). – С. 67–78. DOI: 10.23968/2305-3488.2020.25.2.67-78
Жукова А. А., Минец М. Л. Биометрия. Описательная статистика. – Минск: БГУ. Ч. 1., 2019. – 100 с.
Зайцев Г. Н. Математика в экспериментальной ботанике. – М.: Наука, 1990. – 96 с.
Зинова А. Д. Определитель зеленых, бурых и красных водорослей южных морей СССР. – М.–Л.: Наука,
1967. – 397 с.
Калугина А. А. Исследование донной растительности Черного моря с применением легководолазной техники // Морские подводные исследования. – 1969. – М. – С. 105–113.
Калугина-Гутник А. А. Фитобентос Черного моря. – Киев: Наукова думка, 1975. – 248 с.
Красная книга Республики Крым. Растения, водоросли и грибы. – Симферополь, 2015. – 480 с.
Красная книга Российской Федерации (растения и грибы). – М., 2008. – 885 с.
Красная книга города Севастополя. – Калининград, Севастополь. 2018. – 432 с.
Мильчакова Н.А. Макрофитобентос // Современное состояние биоразнообразия прибрежных вод Крыма (черноморский сектор) / [Ред. Еремеев В. Н., Гаевская А. В.]. – Севастополь: ЭКОСИ-Гидрофизика. 2003. – С. 152– 208.
Прибрежный аквальный комплекс у Херсонеса Таврического. URL: http://oopt.aari.ru/oopt/Прибрежный-аквальный-комплекс-у-Херсонеса-Таврического.
Розенберг Г. С. Информационный индекс и разнообразие: Больцман, Котельников, Шеннон, Уивер … //
Самарская Лука: проблемы региональной и глобальной экологии. – 2010. – Т. 19 (2). – С. 4–25.
Савинов А.Б., Никитин Ю. Д. Развитие представлений об активности растений, ее экологической роли и способах оценки в экосистемах // Принципы экологии. – 2017. – № 3. – С. 20–39. DOI: 10.15393/j1.art.2017.6224
Червона книга України. Рослинний світ. – Київ: Глобалконсалтінг, 2009. – 912 с.
Birben Ü. The effectiveness of protected areas in biodiversity conservation: the case of Turkey // Cerne. – 2019. – Vol. 25 (4). – Р. 424–438. https://doi.org/10.1590/01047760201925042644
Coad L., Watson J. E., Geldmann J., Burgess N. D., Leverington F., Hockings M., Knights K., Marco M. Widespread shortfalls in protected area resourcing undermine efforts to conserve biodiversity // Frontiers in Ecology and the Environment. – 2019. – Vol. 17 (5). – Р. 259–264.
Black Sea Red Data Book. – New York: United Nations Office for Project Services. – 1999. – 413 p.
Black Sea Red Data List. – 1997. [online] Available at: http:// www.grid.unep.ch/bsein/redbook/about/datalist.htm [Дата обращения 22.06.2022]
Dajor R. Precis d’ecologie. – Paris: 8-ème edition (Français), 2006. – 415 p.
Darbyshire I., Anderson S., Asatryan A., Byfield A., Cheek M., Clubbe C., Ghrabi Z., Harris T., Heatubun C. D., Kalema J., Magassouba S., McCarthy B., Milliken W., de Montmollin B., Lughadha E. N., Onana J-M., Saïdou D., Sârbu A., Shrestha K., Radford E.A. Important Plant Areas: revised selection criteria for a global approach to plant conservation // Biodiversity and Conservation. – 2017. – Vol. 26 (8). – P. 1767–1800.
Edgar G. J., Langhammer1 P. F., Allen G., Thomas M., Brooks T. M., Brodie J., Crosse W., De Silva N., Fishpool L. D., Foster M. N., Knox D. H., Mccosker J. E., Roger Mcmanus R., Alan J. K., Millar F. J.K., Robinson Mugo R. Key biodiversity areas as globally significant target sites for the conservation of marine biological diversity // Aquatic concervation. – 2008. – Vol. 18 (6). – P. 969–983.
Evstigneeva I. K. Dynamics of phytocenoses in littoral ecotone of the Black Sea bays // International Journal on Algae. – 2009. – Vol. 11 (1). – P. 1–15.
Fernández C. G., Paulo D., Serrão E. A, Engelen A. H. Limited differences in fish and benthic communities and possible cascading effects inside and outside a protected marine area in Sagres (SW Portugal) // Journal Marine Environmental Research. – 2016. – Vol. 114. – P. 12–23.
Guiry M. D., Guiry G. M. AlgaeBase. Worldwide electronic publication. Galway: Nat. Univ. Ireland. 2022. URL:
http://www.algaebase.org (accessed 22.06.2022).
Heino J. Are indicator groups and cross-taxon congruence useful for predicting biodiversity in aquatic ecosystems? // Ecological Indicators. – 2010. – Vol. 10 (2). – P. 112–117.
Pankeeva T. V., Mironova N. V. Spatiotemporal сhanges in the macrophytobenthos of Laspi bay (Crimea, Black sea) // Oceanology. – 2019. – Vol. 59 (1). – P. 86–98. DOI: 10.1134/S0001437019010168
Sadogurskiy S. Ye. Macrophytobenthos in the coastal waters near Cape Tarkhankut (Crimean Peninsula, the Black sea) // International Journal on Algae. – 2018. – Vol. 20 (1). – P. 69–84.
36
Макрофитобентос памятника природы регионального значения «Прибрежный аквальный комплекс у Херсонеса Таврического»
![]()
Evstigneeva I. K., Tankovskaya I. N., Evstigneev V. P. Macrophytobenthos of the regional natural monument “Coastal aquatic complex near Tauric Chersoneses” // Ekosistemy. 2022. Iss. 30. P. 22–37.
The research studied the species and ecological composition, productive potential (phytomass) and bathymetric variability of phytocenoses of the hydrological natural monument “Coastal aquatic complex near Tauric Chersoneses”. At the stations of the eastern and western transects 58 species of 43 genera, 24 families, 17 orders, 4 classes of the phyla Chlorophyta, Ochrophyta and Rhodophyta were found. Seventeen species have a conservation status. Rhodophyta and species with high occurrence dominate in the phytocenoses. Marine, leading, annual and oligosaprobic ecogroups are represented by the highest number of species. Species with low relative phytomass predominate in the production system, therefore, and Gongolaria barbata and Ericaria crinita are the key producers. Сomparative analysis revealed similarities and differences in the algoflora in different parts of the water area of the natural monument. The study proves that taxonomic composition of algoflora at the western and eastern sites differ insignificantly, but within each site the algoflora is characterized by bathymetric heterogeneity. The similarities indicate that the phytocenoses belong to the same association; the difference is due to local environmental features at the territorially separated sites. Statistically significant differences in the average number of species and phytomass in the phytocenosis and in the phylum were obtained.
Key words: protected areas, macroalgae, species composition, ecological structure, occurrence, phytomass, dominants, variability, the Black Sea, Sevastopol.
Поступила в редакцию 24.06.22
Принята к печати 27.07.22
37

