ДЕЙСТВИТЕЛЬНО ЛИ ТАК ОПАСЕН НЕДАВНИЙ ВСЕЛЕНЕЦ В АЗОВО-ЧЕРНОМОРСКИЙ БАССЕЙН ДВУСТВОРЧАТЫЙ МОЛЛЮСК ANADARA KAGOSHIMENSIS?
IS THE INVASION OF THE AZOV-BLACK SEA BASIN BY THE ARK CLAM ANADARA KAGOSHIMENSIS DANGEROUS?
JOURNAL: «EKOSISTEMY», Issue 39, 2024
Publication text (PDF): Download
UDK: [574.5.047:594.1](262.5+262.54)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Revkov N. K.
A. O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2024-39-127-147
PAGES: from 127 to 147
STATUS: Published
LANGUAGE: Russian
KEYWORDS: Anadara kagoshimensis, alien mollusk, macrozoobenthos, biological invasion, Black Sea, Crimea.
ABSTRACT (ENGLISH):
The bivalve Anadara kagoshimensis (Tokunaga, 1906), a recent invader of the Azov-Black Sea basin, is classified as one of the most dangerous invasive species in Russia. The main objective of this research was to test the hypothesis about the difference in zoobenthos structure assessed by Shannon, Simpson, Pielou and Margalef ecological indices (otherwise – by indexed «outer contour» of macrozoobenthos condition) in the presence and absence of A. kagoshimensis.
Additionally, the possibility of A. kagoshimensis to enter direct competitive relationships with some native species was considered. The obtained results indicate that the emergence of A. kagoshimensis as an invasive species near the Black Sea coast of Crimea did not result in a modification of the indexed ‘outer contour’ of the structural organisation of the native zoobenthos complex. At the same time, this ‘external’ stability was achieved against a background of internal restructuring of the benthic ecosystem, associated with natural changes in the degree of dominance of individual species. The mere presence of intrasystem changes in the presence of A. kagoshimensis does not prove the determining role of A. kagoshimensis itself in these intrasystem processes. The researchers have no sufficient evidence of direct competition between A. kagoshimensis and native species for substrate and food in areas where they share a habitat. More obvious may be a positive or negative correlation in the dynamics of the development of individual species, mediated by changes in the conditions of their habitat – climatic, edaphic and trophic. An example of this is the substitution (not direct replacement) of the psammophilic bivalve Chamelea gallina by the pelophilic A. kagoshimensis under conditions of biotope siltation. In light of the current state of knowledge regarding the results of the invasion of A. kagoshimensis into the Azov-Black Sea basin, it is not yet possible to conclude that the results are negative or dangerous, given the lack of sufficient evidence.
ВВЕДЕНИЕ
Вслед за отнесением в 2006 году недавнего вселенца в Азово-Черноморский бассейн двустворчатого моллюска Anadara kagoshimensis (Tokunaga, 1906) (в дальнейшем анадара) к группе наиболее опасных инвазионных видов (100 ‘worst invasives’) Средиземного моря (Streftaris, Zenetos, 2006), в 2018 году – этот вид был включен в аналогичную группу (ТОП – 100) России (Солдатов и др., 2018). Данное решение было основано на общем подходе, согласно которому «виды-мишени» включались в группу инвазионных видов (ИВ) при условиях:
1) ИВ могут существенно изменить структуру и функции аборигенных экосистем, включая местообитания аборигенных видов (особенно в случаях, когда ИВ являются «ключевыми видами» – видами-эдификаторами);
2) ИВ могут стать конкурентами аборигенных видов и способствовать их вытеснению;
3) ИВ могут стать хищниками по отношению к аборигенным видам и также способствовать их вытеснению;
4) ИВ могут стать возбудителями, резервуарами или переносчиками заболеваний (включая паразитарные) аборигенных видов и человека» (Самые опасные, 2018).
В отношении анадары, являющейся по способу добывания пищи фильтратором, третья форма воздействия исключается. В отношении четвёртой – мы пока ничего сказать не можем, ввиду отсутствия соответствующей информации, хотя вероятность её есть. Оставшиеся две формы воздействия – первая и вторая – являлись базовыми к признанию анадары в качестве одного из инвазивных видов, которые в современных условиях могут проникать разными путями в Азово-Черноморский бассейн и оказывать влияние на видовой состав и структуру локальных бентосных сообществ (Arvanitidis et al., 2009). Основой для этого стали работы, в которых высказывались предположения о конкурентном вытеснении анадарой аборигенных видов двустворчатых моллюсков из совместных зон обитания (Чикина и др., 2003; Анистратенко, Халиман, 2006; Милютин, Вилкова, 2006), оценивалась её экспансия, степень доминирования и связанные с этим структурные изменения в донных сообществах (Маринов и др., 1983; Gomoiu, 1984; Золотарев, Золотарев, 1987; Маринов, 1990; Zaitsev, Mamaev, 1997; Фроленко, Двинянинова, 1998; Фроленко и др., 2000; Синегуб, 2006; Фомичёва, Фроленко, 2007; Иванов, Синегуб, 2008; Стадниченко, Золотарев, 2009; Чикина, 2009; Терентьев, 2009; Sahin et al., 2009; Болтачева и др., 2011; Ревков, 2015; Trayanova et al., 2011; Фроленко, Мальцева, 2017; Колючкина и др., 2018; Шаловенков, 2023).
Общим итогом развития популяции анадары в новых условиях стало её превращение в ценозообразующий вид с соответствующей трансформацией донных экосистем на больших участках черноморского шельфа в диапазоне глубин до 49 м (Солдатов и др., 2018) и в акватории Азовского моря (Фроленко, Двинянинова, 1998; Ревков, Болтачева, 2021).
Однако, при всём многообразии информации об анадаре как виде, занявшем одно из ведущих мест в донной фауне Азово-Черноморского бассейна, до сих пор открытым остаётся вопрос о самом характере изменений в структуре аборигенных биоценозов под влиянием вида-вселенца. Эти изменения могут регистрироваться на уровне обобщённых (индексированных) показателей развития зообентоса в целом (назовём это внешним контуром общего состояния зообентоса) и уровне его внутренних перестроек, связанных с изменением степени доминирования отдельных видов. Весьма показательными в этом отношении стали результаты, полученные в Таманском заливе Азовского моря, где было показано отсутствие влияния анадары на таксономический состав, численность и значение индекса ES100 макрозообентоса (Kolyuchkina et al., 2019). Есть данные, указывающие на отсутствие изменений в видовой структуре донных сообществ в период освоения моллюском-вселенцем акваторий у южных берегов Крыма (Шаловенков, 2023).
Основной целью данной работы была проверка гипотезы о различии в структуре зообентоса, оцениваемой по экологическим индексам (Шеннона, Симпсона, Пиелоу, Маргалефа), в условиях присутствия анадары и без неё, и рассмотрение возможности вступления анадары в прямые конкурентные отношения с некоторыми аборигенными видами бентоса у черноморских берегов Крыма.
МАТЕРИАЛ И МЕТОДИКА
Реализация поставленной цели выполнена на архивных материалах, хранящихся в базе данных отдела Экологии бентоса ФИЦ ИнБЮМ РАН. В расчётах использованы 1016 бентосных станций (от одной до трёх дночерпательных проб на каждой станции), выполненных в диапазоне глубин 0–50 м в 1950–2013 годы у открытых берегов Крыма (всего 753 станции без учёта района Керченского пролива) и в его бухтовых акваториях (263 станции) (табл. 1). Открытое побережье представлено станциями на северо-западном (Каркинитский залив, поднятия Межводное, Голицына), западном (южный участок мыса Тарханкут, Каламитский залив, районы побережья у п. Учкуевка и вблизи устьев бухт Казачья, Камышовая и Севастопольская), южном (районы мыса Фиолент, бухт Балаклавская, Ласпи, побережье у Ялты, Алушты и мыса Плака) и юго-восточном участках (районы Судака, мыса Меганом, Карадага и Феодосийского залива) крымского побережья. Акватории «бухтового» типа представлены собственно бухтами Артиллерийской, Севастопольской, Балаклавской, Круглой, Стрелецкой и заливом Донузлав.
Сбор материала выполнен дночерпателями Петерсена и Океан с площадью захвата 0,1 и 0,25 м2; в акваториях бухт – ручным водолазным дночерпателем с площадью захвата 0,04 м2.
При описании донной фауны использованы два интегральных параметра её количественного развития – индекс функционального обилия таксонов (ИФОi) и индекс плотности таксонов (ИПi) в выражениях:
ИФОi = Bi0,75×Ni0,25; ИПi = ИФОi×pi
где: Ni и Bi – соответственно численность (экз./м2) и биомасса (г/м2) «i»-го таксона; pi – встречаемость таксона «i» (от 0 до 1).
Значение индекса ИФО на станции рассчитывали, как сумму ИФО встреченных на станции видов. При анализе многолетних изменений использовано осреднение данных по десятилетиям: 1950–1959, 1960–1969 … 2000–2009, 2010–2013 годы. Для каждого десятилетия рассчитывали средние значения ИФО каждого таксона только с учётом станций, где таксон присутствовал. Далее, шло определение средних для десятилетия значений ИП отдельных таксонов, с учётом их встречаемость на всех станциях в пределах десятилетий. Значения ИП макрозообентоса для десятилетий рассчитывали, как суммы значений ИП отдельных таксонов.
Индексы ИПi и ИФОi являются продолжением линейки показателей количественного учёта таксонов с использованием различных комбинаций параметров: встречаемости (pi), удельных численности (Ni) и биомассы (Bi) (Зенкевич, Броцкая, 1937; Арнольди, 1941, 1949; Воробьев, 1949; Старк, 1960; Киселёва, 1981), известных в 1930–1980 годы под общим названием «индексов плотности». Современное звучание и возможность использования ИФОi в исследованиях структурной организации зообентоса (Ревков, Николаенко, 2002; Denisenko
Таблица 1
Объём материала, использованного для анализа положения анадары в общей структуре макрозообентоса у черноморских берегов Крыма (без Керченского пролива)
| Годы | Глубины, м | Число станций | Годы | Глубины, м | Число станций | ||
| открытый берег | бухты | открытый берег | бухты | ||||
| 1950–1959 | <10 | 7 | – | 1990–1999 | <10 | 51 | 47 |
| 10–19 | 25 | – | 10–19 | 64 | 6 | ||
| 20–29 | 24 | – | 20–29 | 48 | 1 | ||
| 30–39 | 5 | – | 30–39 | 11 | 1 | ||
| 40–49 | 6 | – | 40–49 | 15 | – | ||
| 1960–1969 | 10–19 | 9 | – | 2000–2009 | <10 | 78 | 93 |
| 20–29 | 9 | – | 10–19 | 39 | 92 | ||
| 30–39 | 9 | – | 20–29 | 17 | 4 | ||
| 40–49 | 9 | – | 30–39 | 9 | 3 | ||
| 1970–1979 | <10 | 52 | – | 2010–2013 | <10 | 1 | 5 |
| 10–19 | 20 | – | 10–19 | 22 | 7 | ||
| 20–29 | 13 | – | 20–29 | 9 | |||
| 30–39 | 12 | – | 30–39 | 9 | |||
| 40–49 | 14 | – | 40–49 | 5 | 2 | ||
| 1980–1989 | <10 | 33 | – | Все годы | <50 | 753 | 263 |
| 10–19 | 53 | 1 | |||||
| 20–29 | 38 | 1 | |||||
| 30–39 | 27 | – | |||||
| 40–49 | 10 | – | |||||
et al., 2003; Revkov et al., 2008b; Ревков и др., 2014; Ревков, Болтачева, 2022 и др.) дала его биологическая интерпретация, пришедшая из работ по энергетике гидробионтов (Кучерук, Савилова, 1985; Мальцев, 1990), как оценочного эквивалента энергетической роли гидробионтов.
Для оценки структурной организации макрозообентоса использованы алгоритмы многомерной статистики – программы Cluster, MDS пакета PRIMER-6 (Clarke, 1993; Clarke, Gorley, 2001). В расчётах использована «log(x+1)» трансформированная матрица ИФО видов по станциям. Для минимизации стресс-фактора в матрицу включены станции с 3 и более видами макрозообентоса, и виды, встреченные на 10 и более станциях. Мерой сходства станций являлась статистика Брэя-Куртиса. Оценка внутрикомплексного сходства, а также определение вклада отдельных видов в это сходство выполнена на исходной матрице ИФО видов по станциям (программа SIMPER, пакет PRIMER-6) (Clarke, Gorley, 2001). В этом же пакете выполнен расчёт индексов разнообразия Шеннона (H’), выровненности Пиелоу (J´), доминирования Симпсона (1–λ), видового богатства Маргалефа (d) (программа Diversity). Расчёт всех экологических индексов выполнен на основе станционной матрицы ИФОi таксонов. Достоверность различия средних значений массивов данных оценивали с помощью однофакторного дисперсионного анализа в программе ANOVA (пакет STATISTICA-10) с уровнем значимости p=0,05. Все построения выполнены в графических редакторах пакетов STATISTICA-10 и PRIMER-6. В тексте приведены названия биоценотических комплексов, сокращенные до родовых имен доминирующих в них видов.
Анализ развития поселений анадары у берегов Крыма выполнен поэтапно, в рамках детализации акваторий её обнаружения и фаунистических комплексов, в которых шло её развитие. В ходе анализа использовано условное подразделение акваторий на открытые к волновому воздействию участки побережья и бухты.
РЕЗУЛЬТАТЫ
Предварительно выполненное подразделение обширного спектра районов исследования на две группы – акватории открытого побережья и бухты – оказалось оправданным. Было отмечено более высокое (в 2,8 раза) количественное развитие и достоверное различие (ANOVA, p<0,000001) зообентоса по ИФО в районах открытого побережья в сравнении с акваториями бухтового типа (табл. 2).
Основными комплексообразующими видами бентоса соответствующих акваторий являются двустворчатые моллюски Chamelea gallina (открытое побережье), гастропода Tritia reticulata и полихета Heteromastus filiformis (бухтовые акватории) (табл. 3). Эти же виды имеют и наиболее стабильные (см. βi/SD) показатели развития в каждом из выделенных комплексов, что усиливает их индикаторную значимость.
Таблица 2
Основные параметры количественного развития зообентоса в акваториях разного типа у берегов Крыма
| Тип акватории | Кол-во станций | Годы | Общее кол-во видов | Значения параметра ИФО | ||||
| mean | min. | max. | Std. Dev. | Std. Err. | ||||
| Открытое побережье | 753 | 1950-е – 2013 | 192 | 302,24 | 0,11 | 7592,62 | 532,93 | 19,45 |
| Бухты | 263 | 1980-е – 2013 | 182 | 107,65 | 0,41 | 1898,56 | 206,76 | 12,87 |
Примечание к таблице: Std. Dev. – стандартное отклонение; Std. Err. – стандартная ошибка среднего.
Таблица 3
Ранжированный (по вкладу во внутрикомплексное сходство) список основных видов зообентоса в различных биотопических комплексах у берегов Крыма
Примечание к таблице: ИФОср. – среднее значение Индекса функционального обилия;
βi – абсолютный и βi % – относительный (%) вклад вида «i» в среднее сходство (Брея-Куртиса) внутри комплекса; SD – стандартное отклонение; Cum. – накопленный процент вклада видов в среднее сходство внутри комплекса.
Полученные результаты дают общее представление о доминирующих видах зообентоса в обозначенных типах акваторий в пределах временных рамок выполненных исследований (см. табл. 2). По понятным причинам появления анадары у берегов Крыма только в конце 1990-х годов (Ревков и др., 2002), среди данных, обобщённых за период с 1950-х по 2013 год (открытое побережье) и 1980-е–2013 год (бухты), в группе наиболее значимых видов зообентоса мы её не находим. Дальнейший анализ двух основных типов акваторий с подразделением временного ряда на десятилетние периоды исследований позволил оценить динамику завоевания анадарой своего места в общей структуре зообентоса у берегов Крыма.
Анадара у открытых берегов Крыма. При рассмотрении показателя многолетней динамики ИП всего макрозообентоса в биотопе рыхлых грунтов в диапазоне глубин до 50 м у открытых берегов Крыма, следует обратить внимание на один важный момент – его последовательное увеличение в период с 1970-х по 1990-е годы и снижение в 2000-е–2010-е годы (рис. 1). Данная этапность общего поведения ИП в целом хорошо согласуется с этапностью эвтрофирования черноморского шельфа во второй половине 20 века (Юнев и др., 2019): увеличение ИП с 236 (1970-е гг.) до 511 (1980-е гг.) и 864 (1990-е гг.) в первую и вторую фазах эвтрофирования, и его снижение до 418 (2000-е гг.) и 266 (2010–2013 гг.) – в постэвтрофикационный период. Основной вклад в обозначенную динамику суммарного показателя ИП на шельфе Крыма внесли двустворчатые моллюски из группы фильтраторов-сестонофагов. Это Ch. gallina (с максимумом ИП=76,19 в 1990–1999 гг.), Mytilus galloprovincialis (ИПmax=68,76 в 1990–1999 гг.), Modiolus adriaticus (ИПmax=16,8 в 1980–1989 гг.), Gouldia minima (ИПmax=49,2 в 1980–1989), P. rudis (ИПmax=50,31 в 1980–1989 гг.), Spisula subtruncata (ИПmax=40,97 в 1990–1999 гг.), Mytilaster lineatus (ИПmax=38,23 в 1990–1999 гг.), Lucinella divaricata (ИПmax=34,63 в 1970–1979 гг.), а также гастропода T. reticulata (ИПmax=19,48 в 1980–1989 гг.) (рис. 1).
Анализ временного ряда показал, что наиболее активно процесс освоения анадарой открытого побережья Крыма начал происходить только в начале 2000-х годов. Из мало заметного в 1990–1999 годы вселенца (ИП=0,01 и 150 место в ранжированном по данному показателю списке видов), анадара к 2013 году вошла в список 20 наиболее массовых форм бентоса на глубине до 50 м. Значение её ИП в 2000–2009 годы составляло 3,38 (33 позиция в ранжированном списке видов), в 2010–2013 годы – соответственно 5,23 (19 позиция).
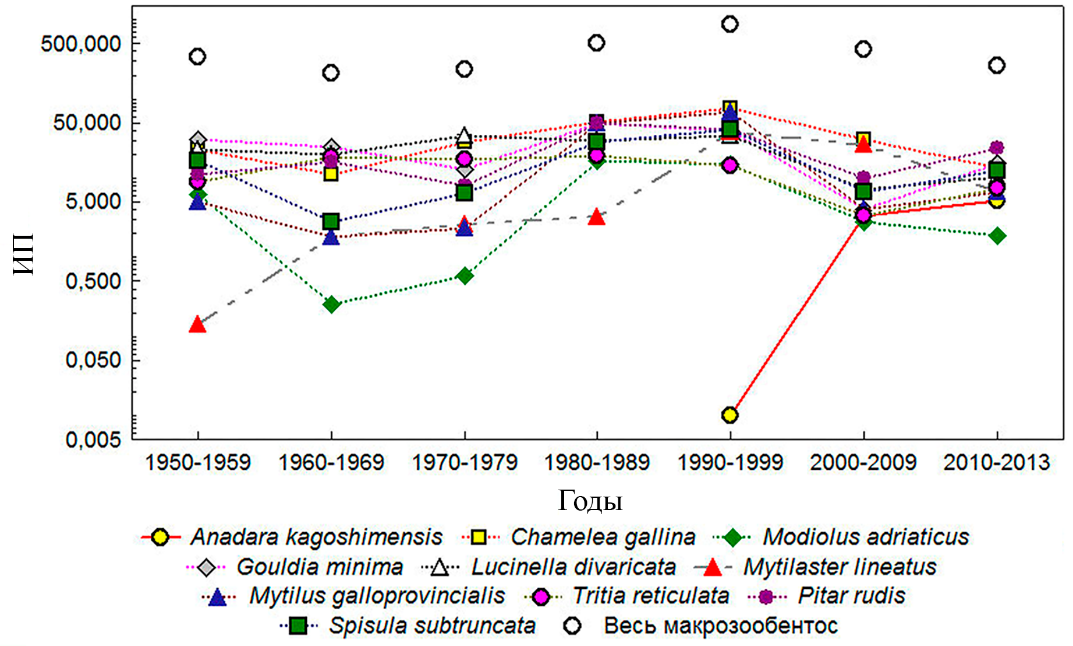
Рис. 1. Многолетняя динамика индекса плотности (ИП) основных видов макрозообентоса в биотопе рыхлых грунтов в диапазоне глубины от 1 до 50 м у открытых берегов Крыма
(без Керченского пролива). Шкала ординат представлена в log-масштабе
Наличие хорошо «наполненного измерениями» многолетнего ряда наблюдений на юго-восточном участке шельфа Крыма (всего 167 станции), позволило детализировать процесс освоения анадарой данного региона. Здесь, в отличие от обобщённых характеристик для всего Крыма, и в связи с близостью района кавказского шельфа, являющегося одним из центров иррадиации анадары в Чёрном море, отмечен более высокий уровень её количественного развития. ИП анадары с 0,00001 в 1990–1999 годы возрос в 2000–2009 и 2010–2013 годы соответственно до 1,740 и 9,213 (рис. 2). Из недавнего вселенца анадара превратилась в вид, претендующий на общее лидерство в фауне региона. По величине ИП она расположилась на 2–4 месте после аборигенных массовых видов двустворчатых моллюсков P. rudis, Ch. gallina и G. minima.
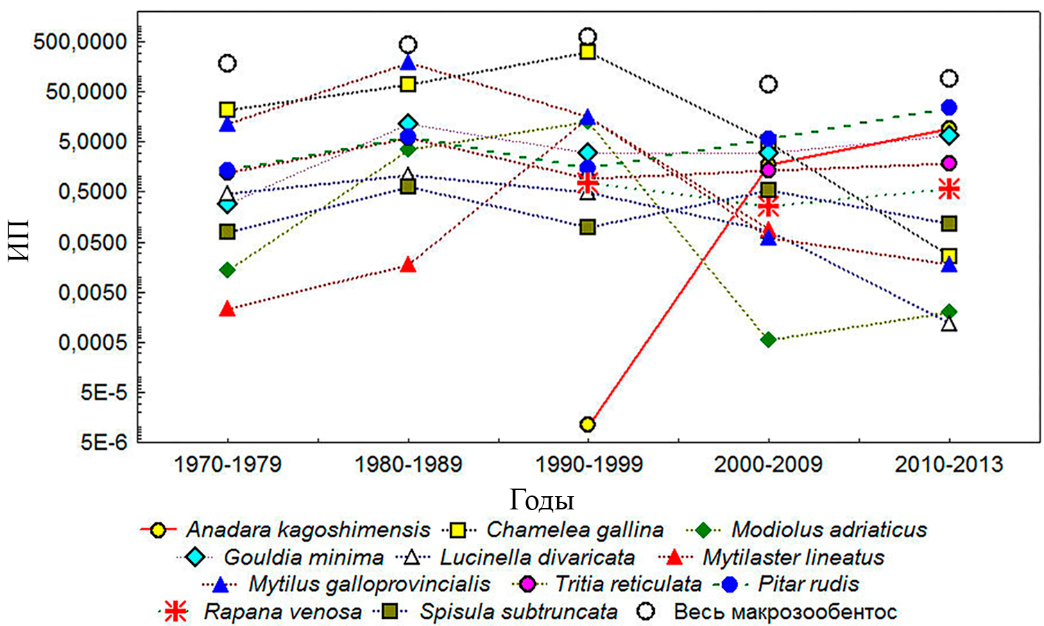
Рис. 2. Многолетняя динамика индекса плотности (ИП) основных видов макрозообентоса в биотопе рыхлых грунтов в диапазоне глубин до 50 м у открытых берегов
юго-восточного Крыма. Шкала ординат представлена в log-масштабе
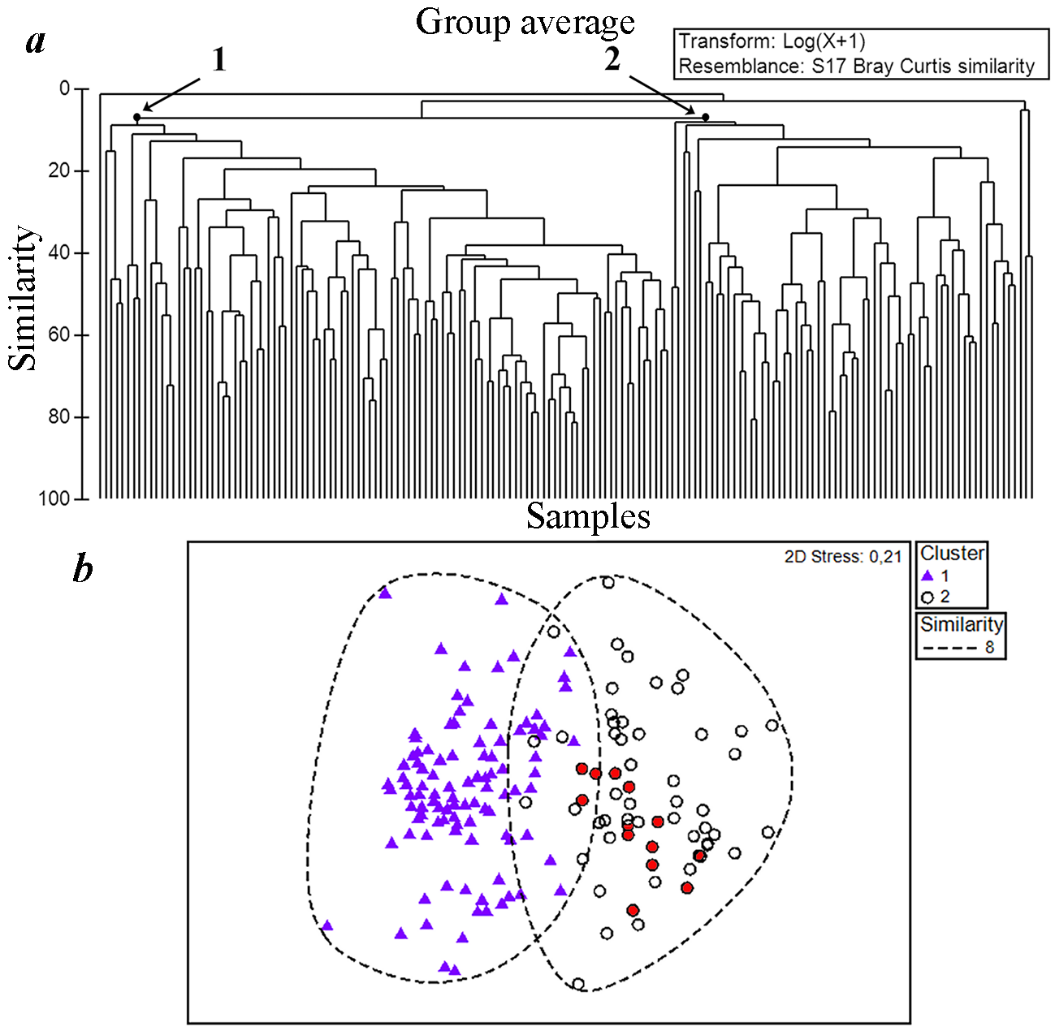
Рис. 3. Иерархическая кластеризация (a) и ординация (b) станций, выполненных на основе log(x+1) трансформированной матрицы ИФО видов в биотопе рыхлых грунтов открытого побережья юго-восточного Крыма на глубине до 50 м (1957–2013 годы) (красными метками обозначены позиции станций с анадарой в кластере 2 (комплекс Pitar))
В фаунистическом плане макрозообентос рыхлых грунтов юго-восточного Крыма на глубине до 50 м подразделяется на два основных биоценотических комплекса (кластеры станций 1 и 2 (рис. 3а). В кластер 1 вошли 101 станция, расположенные на глубине 1–25 м (10±1 м, Mean±St. Err.), в кластер 2 – соответственно 62 станции на глубине 7–49 м (28±1 м). Четыре краевые станциями, не вошедшие в два основных кластера, отнесены к «выбросам» из анализируемого массива данных и дальнейший анализ проведён без их учёта.
Основными комплексообразующими видами выделенных группировок зообентоса являются двустворчатый моллюски Ch. gallina (кластер 1; относительный вклад во внутрикомплексное сходство 69,51 %) и P. rudis (кластер 2; 29,92 %) (табл. 4). Соответственно этому, и руководствуясь принципами биотической классификации бентоса по доминирующим видам, выделенные группировки в бентосе рыхлых грунтов юго-восточного Крыма на глубине до 50 м могут быть отнесены к биоценотическим комплексам Chamelea и Pitar.
Несмотря на довольно близкие значения исследованных параметров (табл. 5), достоверные различия между комплексами Pitar и Chamelea не отмечены только в отношении среднего числа видов на станции (ANOVA, ps=0,099), ИФО (pИФО=0,185) и видового богатства Маргалефа (pd=0,975). По индексам разнообразия Шеннона (pH’=0,008), выровненности Пиелоу (pJ’=0,0002) и доминирования Симпсона (p1–λ=0,002) различия между донными комплексами достоверны.
Основные комплексообразующие виды биоценотических комплексов в биотопе рыхлых грунтов открытого побережья юго-восточного Крыма в 1957–2013 годы
Примечание к таблице: ИФОср. – среднее значение Индекса функционального обилия;
βi – абсолютный и βi % – относительный (%) вклад вида «i» в среднее сходство (Брея-Куртиса) внутри комплекса; SD – стандартное отклонение; Cum. – накопленный процент вклада видов в среднее сходство внутри комплекса.
Основные характеристики развития зообентоса в биоценотических комплексах с доминированием Pitar rudis и Chamelea gallina в 1957–2013 годы
| Комплекс | Значения параметров (mean±st.err.) | |||||
| S | ИФОср | d | J’ | H’ | 1–λ | |
| Pitar | 16±1 | 391,85±92,51 | 3,24±0,20 | 0,41±0,02 | 1,52±0,09 | 0,47±0,03 |
| Chamelea | 13±1 | 220,65±65,16 | 3,25±0,26 | 0,54±0,03 | 1,91±0,11 | 0,62±0,04 |
Примечание к таблице: S – число видов на станции; индексы: ИФО – функционального обилия, d – видового богатства Маргалефа, J’ – выровненности Пиелоу, H’ – видового разнообразия Шеннона, 1–λ – доминирования Симпсона.
При сопоставлении принадлежности станций с анадарой к выделенным биоценотическим комплексам оказалось, что все 13 из них расположены в комплексе Pitar (рис. 3b). В отношении позиции анадары в ранжированном списке наиболее значимых видов макрозообентоса данного комплекса (см. табл. 4) следует понимать, что этот результат получен по усреднённым данным для региона (Меганом – 1957 год (1 станция), 1986 (1), 1989 (5); Судак – 2013 (1); Карадаг – 1976 (11), 1990 (6), 1999 (2), 2008 (6), 2010 (2), 2013 (2); Феодосийский залив – 2008 (21), 2010 (2), 2011 (1)), включающим станции, выполненные и до 1990 года, когда анадара в пробах не регистрировалась. В данном случае важной являлась информация как о подразделении зообентоса юго-восточного шельфа Крыма в пределах глубины до 50 м на два биоценотических комплекса Pitar и Chamelea, так и приоритетность в развитии анадары именно в биоценотическом комплексе Pitar. Дальнейшая (после 1990 года) динамика развития поселений анадары у открытых берегов Крыма указывает на возрастание её комплексообразующей роли и превращение во второй по значимости (после P. rudis) вид данного биоценотического комплекса. Значения её ИП имели тенденцию прогрессирующих изменений с 0,0005 (1990–1999 годы) до 4,297 (2000–2009 годы) и 11,660 (2010–2013 годы) (рис. 4).
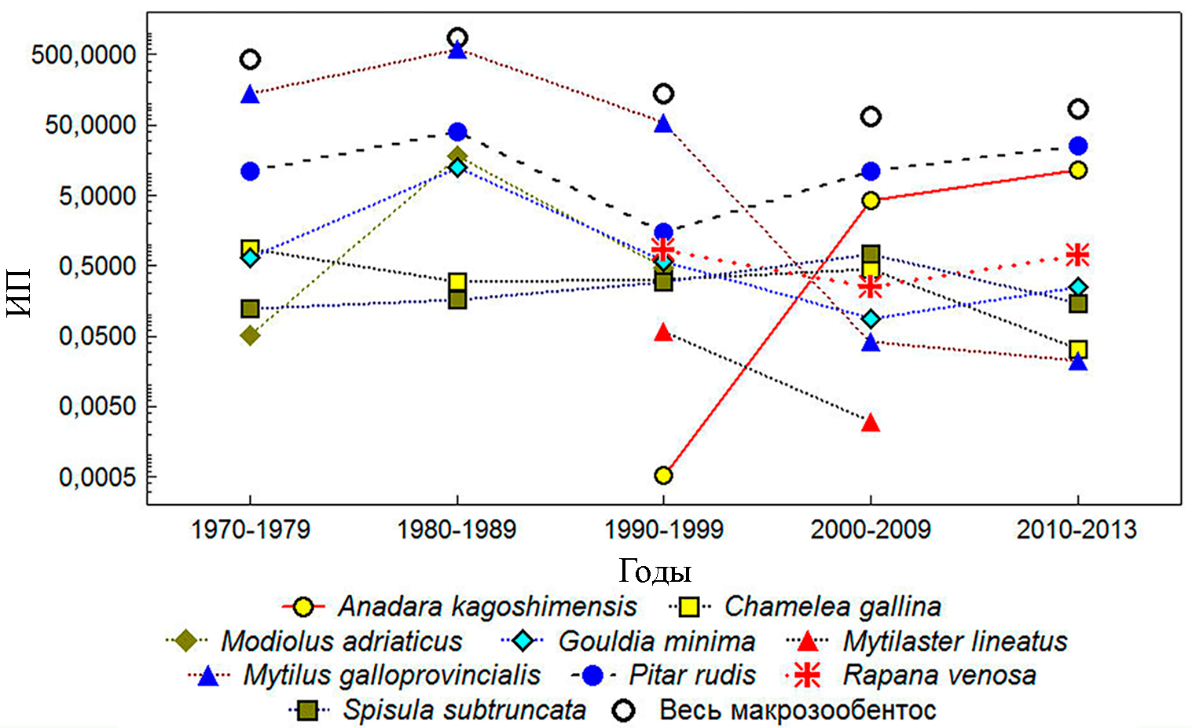
Рис. 4. Многолетняя динамика индекса плотности (ИП) основных видов макрозообентоса в биоценотическом комплексе Pitar у берегов юго-восточного Крыма
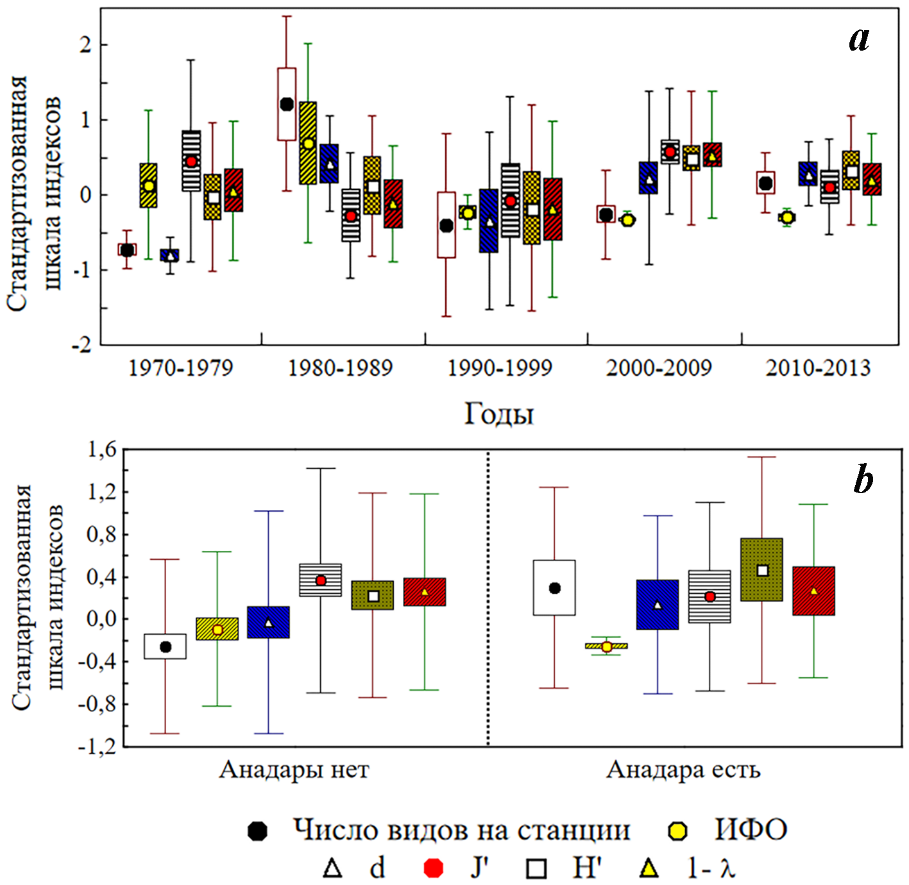
В многолетнем ряду наблюдений появление и массовое развитие анадары (2000–2013 годы) в биоценотическом комплексе Pitar на юго-восточном участке крымского шельфа происходило на фоне отсутствия достоверных изменений значений ряда экологических индексов зообентоса: выровненности Пиелоу (ANOVA, pJ’=0,330), разнообразия Шеннона (pH’=0,347) и доминирования Симпсона (p1–λ=0,239), при достоверных изменениях ИФО (pИФО=0,008), индекса видового богатства Маргалефа (pd=0,032) и среднего числа видов на станции (pS=0,0004) (рис. 5a).
В тоже время, при вневременном сравнении станций, где анадара присутствует (13 станций), со станциями, где анадары нет (49 станций), различия всех сравниваемых индексов оказались не достоверными (pИФО=0,435, pH’=0,439, pd=0,597, pJ’=0,635, p1-λ=0,969), за исключением среднестанционного числа видов (pS=0,040) (рис. 5 b). В присутствии анадары отмечено достоверно большее число видов: в среднем 17±2 против 12±1.
Анадара в акваториях бухтового типа. У черноморских берегов Крыма в акваториях бухтового типа, в сравнении с открытым побережьем, до 2013 года поселения анадары были менее развиты. После 2000 года основные полигоны наших работ располагались в бухтах Севастопольская – 117 станций (анадара встречена на 6-ти из них), Балаклавская – 60 станций (5) и Круглая – 24 станции (анадара не обнаружена).
В фаунистическом плане зообентос бухт Севастопольская и Балаклавская представлен биоценотическими комплексами соответственно моллюсков T. reticulata и Bittium reticulatum (табл. 6), имеющими сходные (во всех случаях p>0,6) параметры оцениваемого количественного развития (табл. 7).
В Севастопольской бухте первое появление анадары зарегистрировано в 2006 году, и дальнейшее развитие её поселений здесь пока не отмечено (рис. 6). На фоне общего сокращения количественного развития донной макрофауны бухты значение ИП анадары снизилось с 0,0011 в 2000–2009 годы до 0,0003 в 2010–2013 годы.
Рис. 5. Многолетняя динамика индексов состояния макрозообентоса (a) и индексы состояния макрозообентоса в условиях присутствия/отсутствия анадары (b) в биоценотическом комплексе Pitar у берегов юго-восточного Крыма
Использована стандартизованная матрица данных ИФО видов по станциям. Здесь и далее на аналогичных рисунках показаны: среднее (в соответствии с подрисуночным обозначением параметров); стандартная ошибка (прямоугольная область); стандартное отклонение (выносные линии)
Основные комплексообразующие виды зообентоса рыхлых грунтов бухт Севастопольская и Балаклавская
Примечание к таблице: ИФОср. – среднее значение Индекса функционального обилия;
βi – абсолютный и βi % – относительный (%) вклад вида «i» в среднее сходство (Брея-Куртиса) внутри комплекса; SD – стандартное отклонение; Cum. – накопленный процент вклада видов в среднее сходство внутри комплекса.
Основные характеристики развития зообентоса рыхлых грунтов Севастопольской (комплекс Tritia) и Балаклавской (комплекс Bittium) бухт
| Комплекс | Значения параметров (mean±st.err.) | |||||
| S | ИФО | d | J’ | H’ | 1–λ | |
| Tritia | 15±1 | 76,33±13,57 | 4,24±0,15 | 0,60±0,02 | 2,21±0,06 | 0,73±0,02 |
| Bittium | 15±1 | 75,78±25,10 | 4,20±0,23 | 0,60±0,02 | 2,23±0,11 | 0,72±0,04 |
Примечание к таблице: S – число видов на станции; индексы: ИФО – функционального обилия, d – видового богатства Маргалефа, J’ – выровненности Пиелоу, H’ – видового разнообразия Шеннона, 1–λ – доминирования Симпсона.
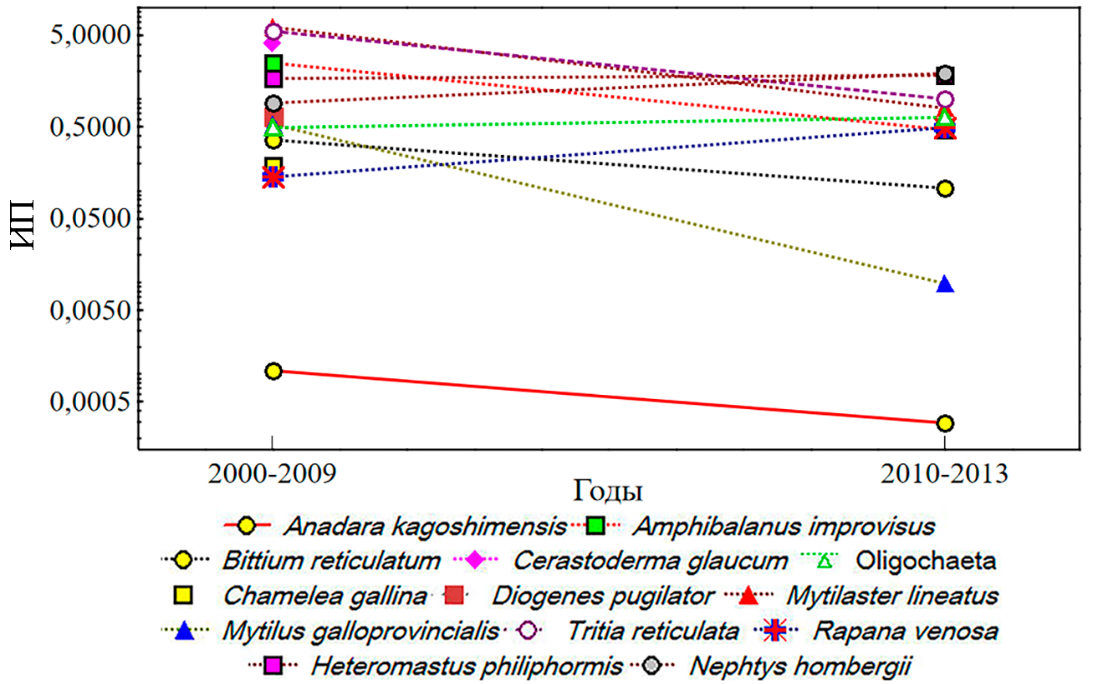
Рис. 6. Многолетние изменения индекса плотности (ИП) основных видов макрозообентоса Севастопольской бухты
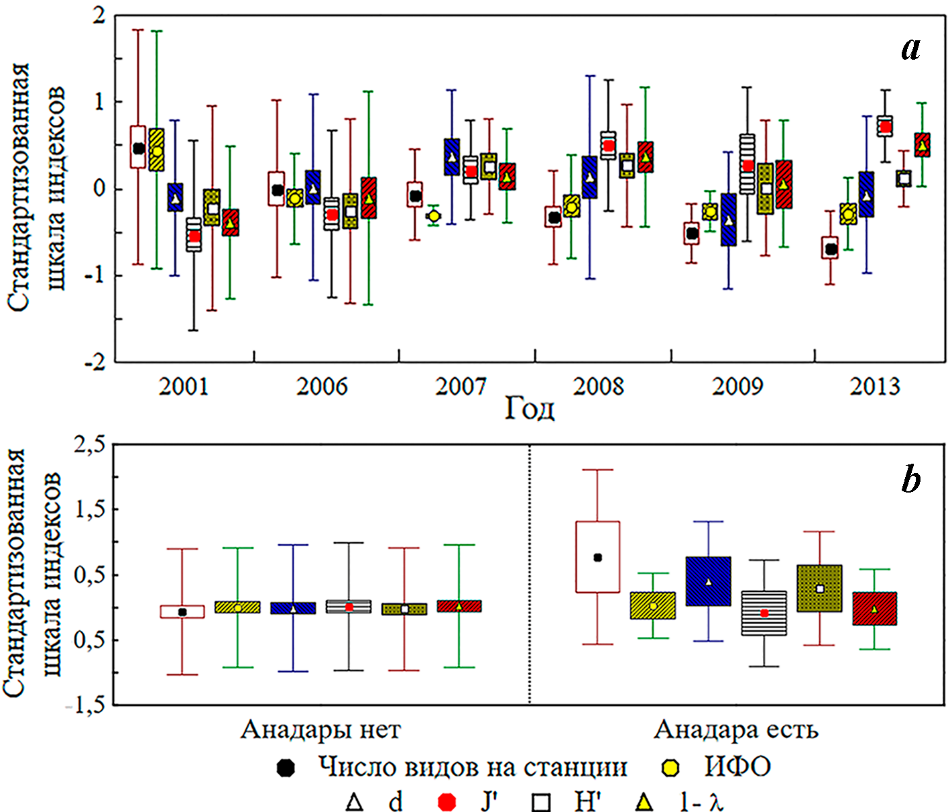
В многолетнем ряду данных 2001–2013 годов (рис. 7 а) по параметрам индексов видового богатства Маргалефа (ANOVA, pd=0,614) и разнообразия Шеннона (pH’=0,229) различия в бентосе бухты не отмечены, по параметрам ИФО (pИФО=0,013), выровненности Пиелоу (pJ’=0,0003), числу видов на станции (pS=0,003) и доминирования Симпсона (p1–λ=0,017) – различия достоверны. При вневременном сравнении данных периода 2000–2013 годов, на станциях с анадарой и в её отсутствии (рис. 7 b) значения экологических индексов не отличались (pИФО=0,94, pd=0,32, pJ’=0,81, pH’=0,43, p1-λ=0,91), за исключение различий по числу видов (pS=0,04). В присутствии анадары отмечено достоверно большее число видов: 21±4 против 14±1.
В бентосе Балаклавской бухты, как и в Севастопольской, анадара впервые зарегистрирована в 2006 году. За период 2005–2008 годов (всего 60 станций) отмечены межгодовые достоверные изменения числа видов на станции (pS<0,000001), видового богатства Маргалефа (pd<0,000001) и разнообразия Шеннона (pH’=0,00002) при отсутствии различий по параметрам ИФО (pИФО=0,786), выровненности Пиелоу (pJ’=0,201) и доминирования Симпсона (p1–λ=0,455) (рис. 8 a). При этом достоверные различия в индексах состояния макрозообентоса на станциях с анадарой и без анадары – не зарегистрированы (для всех сравниваемых параметров p>0,39) (рис. 8 b). В ранжированном по ИП списке видов анадара здесь занимала всего 51 место (ИП=0,0038).
Рис. 7. Многолетние изменения индексов состояния макрозообентоса (a) и индексы состояния макрозообентоса в условиях станционного присутствия/отсутствия анадары (b) в Севастопольской бухте. Использована стандартизованная матрица ИФО видов макрозообентоса по станциям съёмок 2001–2013 годов
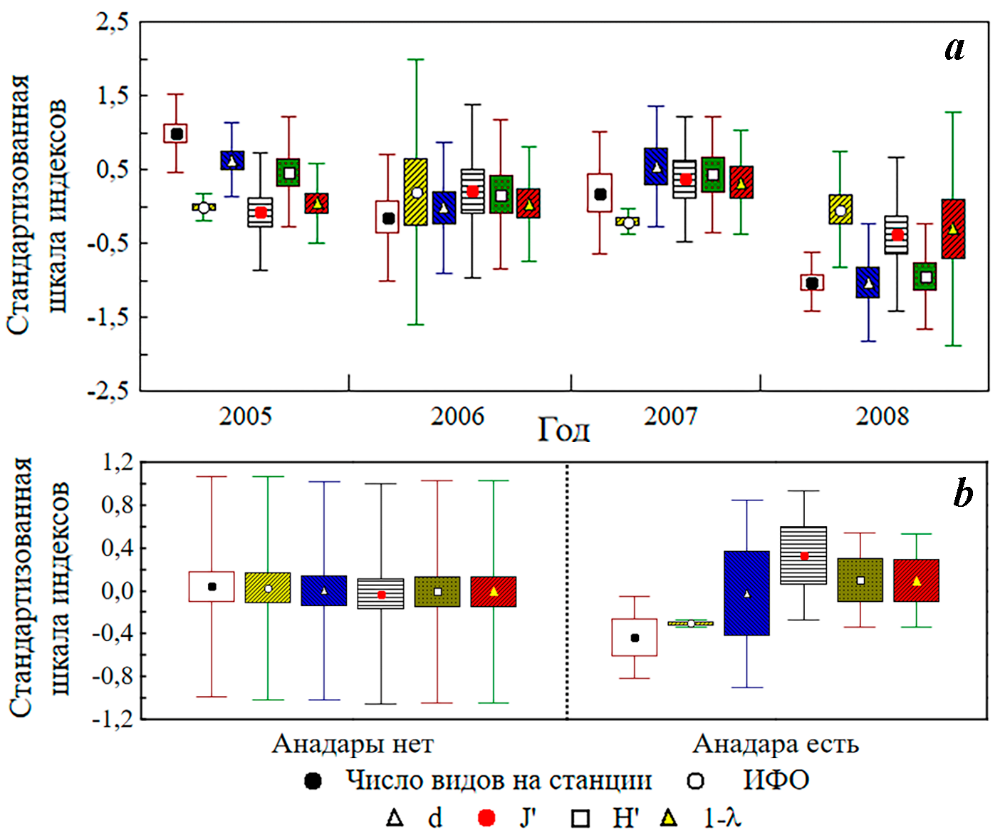
Рис. 8. Многолетние изменения индексов состояния макрозообентоса (a) и индексы состояния макрозообентоса в условиях присутствия/отсутствия анадары (b) в Балаклавской бухте (использована стандартизованная матрица ИФО видов макрозообентоса по станциям съёмок 2005–2008 годов)
ОБСУЖДЕНИЕ
Полученные результаты указывают на то, что появление анадары у черноморских берегов Крыма не привело к изменениям «внешнего контура» структурной организации аборигенного комплекса зообентоса. Единственным из исследованных параметров по которому отмечено «влияние» анадары в случае её присутствия в пробах – более высокое среднестанционное число видов. По-видимому, здесь речь может идти об уже известной для A. kagoshimensis способности к формированию комплекса альго- и зооконсортов (Бондарев, 2020), что важно в условиях дефицита твёрдого субстрата. Все представители подсемейства Anadarinae имеют плохо развитые сифоны, не выходящие за пределы заднего края раковины; в результате большинство видов этого подсемейства не зарываются в грунт (Broom, 1985). Anadara kagoshimensis не является исключением, и моллюски часто располагается на дне так, что задний конец раковины слегка, или на 1/3–2/3 длины раковины выступает над поверхностью грунта (Бондарев, 2020). В других случаях сифональный край раковины может находиться ниже уровня окружающей поверхности в небольшом углублении. Подобное расположение моллюсков на грунте в условиях дефицита твёрдого субстрата является привлекательным для многих гидробионтов в качестве дополнительного временного или постоянного местообитания.
На фоне обозначенной «внешней» индексированной стабильности донной экосистемы, выразившейся в отсутствии достоверных различий сравниваемых индексов в присутствии анадары и без неё, в период прогрессирующего развития поселений анадары происходили и внутренние экосистемные перестройки, которые по своей сути можно назвать компенсаторными. Такие компенсаторные многолетние изменения в зообентосе были отмечены, например, в биоценотическом комплексе Pitar у юго-восточных берегов Крыма, когда появление анадары в 1990–1999 годы и укрепление её позиций в качестве одного из видов-доминантов в 2000–2013 годы шло на фоне снижения показателей количественного развития двустворчатых моллюсков Mytilus galloprivincialis и Ch. gallina (см. рис. 2), являющихся одними из ключевых ценозообразующих видов черноморской бентали. Но были ли эти изменения для последних обусловлены появлением анадары и возникновением межвидовых конкурентных отношений за субстрат, пищу? Мы склонны к отрицательному ответу на данный вопрос.
Многолетняя тенденция снижения показателей развития иловой мидии у берегов Крыма стала прослеживаться задолго до появления анадары – с 1930-х годов (Ревков, 2003). Снижение её весовой доли в общей структуре мидийного пояса бентали с 95 % (1960–1970-е гг.) до 78 % (1980–1990-е гг.) (Ревков, 2011) сопровождалась снижением средних размеров моллюсков (Ревков и др., 2015) и распространялась, что также важно, за пределы зоны обитания анадары (глубина более 50 м).
Отсутствие прямых конкурентных отношений между анадарой и хамелеей, ввиду принадлежности их к разным биоценотическим комплексам (см. табл. 4), также очевидно. Многолетние же изменения в развитии поселений Ch. gallina в Чёрном море связывают с её положительной реакцией на трофический статус акваторий (Ревков и др., 1999; Ревков, 2011; Болтачева, Заика, 2018) и отрицательной – на заилённость донного субстрата (Киселёва, 1981; Chikina, Kucheruk, 2004; Колючкина и др., 2020, Петров, 2022).
Так по данным прямых наблюдений на одном из морских прибрежных участков западного Крыма Ch. gallina входила в α-мезосапробную экологическую группировку бентоса и имела максимум количественного развития в непосредственной близости от источника эвтрофирования (Ревков и др., 1999). Аналогичная положительная реакция хамелеи на органическое обогащение вод была найдена при сопоставлении многолетних рядов данных. Пик количественного развития зообентоса у открытых берегов Крыма (см. рис. 1, 2), с одной из основных долей в этом пике у Ch. gallina, как собственно и максимум её количественного развития (Ревков, 2003; Revkov et al., 2008a), совпали по времени с пиком эвтрофирования черноморского бассейна в конце 1980-х – начале 1990-х (Кукушкин и др., 2008; Маньковский и др., 1996; Юнев и др., 2019). В Севастопольской бухте аналогичным «индикатором» эвтрофирования стал другой представителя группы фильтраторов-сестонофагов – Cerastoderma glaucum (Revkov et al., 2008b). Снижение в 2000-е и последующие годы количественного развития Ch. gallina у открытых берегов Крыма (см. рис. 1, 2) стало следствием современного процесса де-эвтрофикации бассейна, определившего понижение верхнего порога концентрации взвешенного в толще воды органического вещества, являющегося пищевым материалом для моллюска. Наблюдаемая же у берегов Крыма в 2000–2013 годы количественная динамика анадары в противофазе изменений аборигенной группы фильтраторов-сестонофагов необычна, и может объясняться ещё не достигнутым анадарой собственным пороговым уровнем развития в существующих условиях трофности акваторий.
Отрицательная же реакция псаммофильной хамелеи на заиление донного субстрата, на нижнем краевом участке её обитания определила, как это было отмечено в начале 2000-х годов у берегов Кавказа, смещение нижней границы её обитания на меньшие глубины, и замещение (но не прямое конкурентное вытеснение) на заилённых участка в качестве доминирующего вида биотопа – на пелофильную анадару (Chikina, Kucheruk, 2004; Колючкина и др., 2020).
Согласно полученным результатам, у открытых берегов юго-восточного Крыма анадара входит в состав биоценотического комплекса Pitar, располагающегося в диапазоне глубин 7–49 м в биотопе илисто-песчаных грунтов (см. табл. 4). В биотоп песка (комплекс Chamelea), располагающегося на меньшей глубине – от 1 до 25 м – анадара фактически не проникает. Причину этого, по-видимому, следует искать в её недостаточной устойчивости к штормовым нагрузкам по сравнению с хамелеей (Петров, 2022) в связи с отсутствием соответствующих адаптационных механизмов.
В относительно мелководной прибрежной зоне в штормовых условиях нестабильности поверхностного слоя грунта, являющегося зоной обитания анадары, есть два возможных варианта её поведения. Первый – изоляция от неблагоприятных внешних условий путём простого смыкания створок раковины. В этом случае, при определённой силе шторма, возникает вероятность для моллюсков быть выброшенными на берег. Второй вариант – предштормовая вертикальная миграция моллюсков для пережидания неблагоприятных условий в подповерхностных слоях грунта. В любом из вариантов возможность длительной самоизоляции от внешней среды обеспечивается способностью анадары к анаэробиозу благодаря наличию в тканях моллюсков высокоэффективного анаэробного ферментативного комплекса (Солдатов и др., 2008, 2010; Андреенко и др., 2014). Вопрос же о способностях анадары к предштормовой миграции в более глубокие слои грунта, как и к обратному её возвращению на поверхность – пока остаётся открытым.
В этой связи обратимся к результатам экспериментов по вертикальной миграции через слой грунта двух руководящих видов (по терминологии М. И. Киселёвой (1981)) обозначенных выше биоценотических комплексов – P. rudis и Ch. gallina. В лабораторных и полевых экспериментах питар показал достоверно более слабую способность к вертикальной миграции и выживанию, чем хамелея, после засыпания 35-ти сантиметровым слоем грунта (Просвиров, 1989, 1990). Следовательно, питар менее приспособлен к жизни в условиях штормового перемешивания донных осадков, чем хамелея (Петров, 2022). Подобная, к сожалению, пока отсутствующая информация о вертикальной миграции анадары (формирующей поселения только в самом поверхностном слое грунта (Broom, 1985) и отдающей предпочтение заилённым грунтам (Cahn, 1951; Kusukabe, 1959; Ting et al., 1972; Zaitsev, Mamaev, 1997; Park et al., 2011)) была бы полезна для более полного раскрытия причин её слабого проникновения в зону развития псаммофильного комплекса хамелеи у открытых берегов юго-восточного Крыма. Обнаружение же анадары в более глубоководном комплексе питара даёт основание предположить, её сходную с питаром реакцию в выборе биотопа – в менее гидродинамически активной зоне заилённых грунтов.
На некоторых открытых волновому воздействию участка крымского и кавказского шельфов, а также в условиях относительной защищённости от интенсивного волнового воздействия – в акваториях бухтового типа (например, Севастопольская, Балаклавская, Казачья), а также в Азовском море, Керченском проливе и Таманском заливе, других аналогичных акваториях Чёрного моря – анадара может формировать поселения на различных типах рыхлых грунтов на глубинах и менее 10–15 м (Маринов и др., 1983; Фроленко, Двинянинова, 1998; Фроленко и др., 2000; Фомичёва, Фроленко, 2007; Иванов, Синегуб, 2008; Терентьев, 2009; Чикина, 2009; Trayanova et al., 2011; Фроленко, Мальцева, 2017; Колючкина и др., 2018; Бондарева, 2020; Ревков, Болтачева, 2021; Живоглядова и др., 2021; Шаловенков, 2023). Не факт, что все эти поселения, особенно в прибрежной гидродинамически активной зоне, в том числе и обнаруживаемые в пелофильном сообществе Chamelea (Шаловенков, 2023), являются стабильными. Их относительно длительное существование может быть связано со способностью моллюсков противостоять существующей на период формирования поселений штормовой нагрузке, не являющейся критической для выживания. Нам не известен этот критический уровень штормовой нагрузки. Однако, если предположить наличие такового, например, при высоте волны от 3 до 5,3 м, то фактическая повторяемость таких штормов на открытых участках шельфа Крыма от Балаклавы до Феодосия, равная 1 раз в 10 лет (Горячкин, Долотов, 2019), позволяет анадаре в промежутке между этими волновыми нагрузками формировать зрелые квазистабильные поселения. Более низкий уровень штормовой нагрузки с высотой волны от 2 до 4,4 м, повторяющийся на южном побережье Крыма 1 раз в 5 лет также может рассматриваться в качестве критического.
Говоря о конкурентных отношениях, нельзя не отметить наличие у анадары определённых преимуществ, основанных на морфотипе её раковины. При известной уязвимости, в силу ещё недостаточной прочности створок раковины, в первые два года жизни анадара является доступным кормовым объектом рыб-бентофагов (в том числе осетровых) (Чихачев и др., 1994). Крупные же особи анадары в зонах совместного обитания с другими двустворчатыми моллюсками – M. galloprovincialis, P. rudis – ввиду массивности створок и наличии рёбер, ещё более увеличивающих прочность раковины, в меньшей степени потребляются хищной рапаной (Золотарев, Терентьев, 2012; Savini, Occhipinti-Ambrogi, 2006) и рыбами (Zaitsev, Mamaev, 1997), в большей степени защищены от сверлильщиков (Klompmaker, Kelley 2015), получая при этом определенные конкурентные преимущества.
Анадара в структуре аборигенных биоценозов. Освоение анадарой Азово-Черноморского бассейна, с момента её первого обнаружения в Чёрном море у берегов Кавказа в 1968 году (Киселёва, 1992) до появления в наиболее осолонённых участках Таганрогского залива (Живоглядова и др., 2021), заняло около 50 лет. Её экспансия в Чёрном море происходила из двух центров иррадиации, сформировавшихся в 1970-е годы на западном и восточном участках шельфа и в 1990-е – 2000-е годы охватывала уже его северный (крымский) и южный (анатолийский) участки (Ревков, 2016).
Уже в начале 2000-х годов в бентосе рыхлых грунтов Азово-Черноморского бассейна в диапазоне глубин до 40 метров анадара стала широко распространённым видом, входящим в состав различных сообществ. В Чёрном море, на его северо-западном участке (Филлофорное поле Зернова) она вошла в сообщество Mytilus (Revkov et al., 2018), у берегов Крыма (на южном участке шельфа) – в сообщества Chamelea, Gouldia и Gouldia–Pitar (Шаловенков, 2023) и (в Феодосийском заливе на глубинах 28–34 м) в качестве содоминанта – в смешанное сообщество Anadara–Pitar (Болтачева и др., 2011), у берегов Кавказа на глубине 20–30 м – формировала собственный биоценоз и входила в состав биоценоза Chamelea–Gouldia (Киселёва, 1992; Чикина, 2009), в Керченском проливе – формировала собственный биоценоз, выступала содоминантом в сообществах Mytilaster и Cerastoderma и являлась характерным видом в сообществе Mytilus (Головкина, Набоженко, 2012; Иванов, Синегуб, 2008), у берегов Болгарии в Бургасском заливе – формировала собственный биоценоз (Marinov, 1990), а в Варненском заливе на заиленных песках на глубине 7 м – выступала содоминантом в сообществе Upogebia–Tellina (Trayanova et al., 2011). Одним из результатов успешного освоения черноморской акватории Крыма, стало появление анадары, с формированием собственного биоценоза, в Казачьей бухте (севастопольский регион) (Бондарев, 2020). В наших исследованиях у открытых берегов юго-восточного Крыма анадара отмечена в рамках биоценотического комплекса (=сообщества) Pitar, в Севастопольской и Балаклавской бухтах – соответственно в комплексах Tritia и Bittium. Таким образом, в качестве доминанта, кодоминанта, характерного или второстепенного вида анадара отмечена в составе почти всех основных биоценозов Чёрного моря, расположенных в диапазоне глубин её обитания.
Вплоть до конца 2000-х годов, в Азовском море сохранялся единый «моллюско-балянусовый биоценоз» (по Воробьеву) или «биоценоз Cardium» (по Старк) (Ревков, Болтачева, 2021). Появление здесь в 1989 году мигрировавшей из Чёрного моря анадары – нарушило эту «стабильность». Уже к 1997 году на южном участке Азовского моря было отмечено формирование собственного биоценоза анадары (Фроленко, Двинянинова, 1998), который в 2000 году занимал уже практически всю прибрежную часть Крыма до середины Арабатской косы (Литвиненко, Евченко, 2006). В настоящее время её поселения отмечены уже по всему Азовскому морю, включая отдельные участки наиболее распреснённой зоны Таганрогского залива (Живоглядова и др., 2021). К 2016–2017 годам в бентосе юго-западного участка Азовского моря было отмечено формирование единого биоценоза Anadara, который «поглотил» ранее существовавшие в данном регионе биоценозы аборигенных видов (Abra и Cerastoderma) с сохранением «ядра» видов прежних биоценозов (Ревков, Болтачева, 2021; Болтачева и др., 2022). Ранее доминировавшие аборигенные виды Abra segmentum и Cerastoderma glaucum остались представленными в биоценозе Anadara субдоминантами в соответствующих биоценотических комплексах. Выполненный анализ показал, что в многолетнем ряду наблюдений, включающем периоды последовательного повышения солёности вод Азовского моря – 1930-е (9,3–11,1 ‰) и 1950-е годы (11,6–12,1 ‰) без анадары, и 2016–2017 годы (13,5–14 ‰) с анадарой – на фоне снижения количественного развития основных аборигенных ценозообразующих видов Cerastoderma glaucum и Abra segmentum, в 2016–2017 годы за счёт A. kagoshimensis зарегистрировано «компенсаторное» увеличение суммарной биомассы зообентоса, превышающей таковую 1930-х годов (Ревков, Болтачева, 2021).
ЗАКЛЮЧЕНИЕ
Данные, полученные на основе использованных в работе экологических индексов состояния зообентоса (индексы функционального обилия, видового богатства Маргалефа, разнообразия Шеннона, выровненности Пиелоу, доминирования Симпсона) указывают на то, что появление анадары, как вселенца, у черноморских берегов Крыма не привело к изменениям «внешнего контура» структурной организации аборигенного комплекса зообентоса. При этом, данная «внешняя» стабильность реализовывалась на фоне некоторых внутренних (для донной экосистемы) перестроек, связанных с изменением степени доминирования отдельных видов. Отмечая наличие естественной динамики развития различных видов, мы понимаем, что само наличие внутрисистемных перестроек в присутствии анадары не является доказательством определяющей роли самой анадары в этих процессах. У нас пока нет достаточных оснований говорить о том, что какой-то определённый круг этих изменений обусловлен появлением анадары и возникающими при этом межвидовыми конкурентными отношениями за субстрат, пищу. Более явной оказывается положительная или отрицательная корреляция в динамике развитии отдельных видов, опосредованная изменением условий среды их обитания – климатическими, эдафическими и трофическими. Обозначенный в работе случай с псаммофильной хамелеей, является хорошим примером её «не прямого вытеснения» (замещения) пелофильной анадарой при заилении биотопа. Внешне это выглядит как «компенсаторная» перестройка внутренних элементов динамически развивающейся экосистем. На данном этапе наших знаний о результатах инвазии анадары в Азово-Черноморский бассейн говорить о негативных и тем более опасных результатах этой инвазии пока нет достаточных оснований.
Работа выполнена в рамках госзадания ФИЦ ИнБЮМ по теме «Биоразнообразие как основа устойчивого функционирования морских экосистем, критерии и научные принципы его сохранения» №124022400148-4.
- Андреенко Т. И., Солдатов А. А., Головина И. В. Особенности организации тканевого метаболизма у Anadara inaequivalvis (заключительные аспекты) // Черноморские моллюски: элементы сравнительной и экологической биохимии. – Севастополь: ЭКОСИ-Гидрофизика, 2014. – C. 207–216. https://repository.marine-research.ru/handle/299011/1360
- Анистратенко В. В., Халиман И. А. Двустворчатый моллюск Anadara inaequivalvis (Bivalvia, Arcidae) в северной части Азовского моря: завершение колонизации Азово-Черноморского бассейна // Вестник зоологии. – 2006. – Т. 40, № 6. – С. 505–511.
- Арнольди Л. В. Материалы по количественному изучению зообентоса в Чёрном море // Труды зоологического института. – Т. 7. – 1941. – С. 94–113. http://www.e-heritage.ru/Book/10083501
- Арнольди Л. В. Материалы по количественному изучению зообентоса Чёрного моря. II. Каркинитский залив // Труды зоологического института. – 1949. – Т. 7. – C. 127–192.
- Болтачева Н. А., Колесникова Е. А., Мазлумян С. А. Макрозообентос Феодосийского залива // Промысловые биоресурсы Чёрного и Азовского морей. – 2011. – С. 163–169. https://www.elibrary.ru/download/elibrary_26839203_34033639.pdf
- Болтачева Н. А., Заика В. Е. Моллюски Chamelea gallina и Mytilus galloprovincialis верхней сублиторали: многолетние изменения // Биология Черного моря у берегов юго-восточного Крыма. – 2018. – С. 87–96. https://www.elibrary.ru/download/elibrary_37525348_84898965.pdf
- Болтачева Н. А., Ревков Н. К., Надольный А. А., Аннинская И. Н. Донная фауна юго-западной части Азовского моря. Таксономический состав и биоценотическая организация макрозообентоса в 2016–2017 годах // Морской биологический журнал. – 2022. – Т. 7, № 2. – С. 3–22. https://www.elibrary.ru/download/elibrary_48618610_54567086.pdf
- Бондарев И. П. Особенности биоценотических связей Anadara kagoshimensis (Bivalvia, Arcidae) в бухте Казачьей Чёрного моря // Российский журнал биологических инвазий. – 2020. – Т. 13, № 2. – С. 9–22. http://www.sevin.ru/invasjour/issues/2020_2/Bondarev_20_2.pdf
- Воробьев В. П. Бентос Азовского моря. Труды АзЧерНИРО. – Симферополь: Крымиздат, 1949. – Вып. 13. – 193 с.
- Головкина Е. М., Набоженко М. В. Современное состояние донных сообществ Керченского пролива (Российский сектор) и заливов Таманского полуострова // Вестник южного научного центра РАН. 2012. – Т. 8, №2. – С. 53–61. https://www.elibrary.ru/download/elibrary_17842321_79898812.pdf
- Горячкин Ю. Н., Долотов В. В. Морские берега Крыма. – Севастополь: Колорит, 2019. – 256 с.
- Живоглядова Л. А., Ревков Н. К., Фроленко Л. Н., Афанасьев Д. Ф. Экспансия двустворчатого моллюска Anadara kagoshimensis (Tokunaga, 1906) в Азовском море // Российский журнал биологических инвазий. – 2021. – Т. 14, № 1. – С. 83–94. https://doi.org/10.35885/1996-1499-2021-14-1-83-94
- Зенкевич Л. А., Броцкая В. А. Материалы по экологии руководящих форм бентоса Баренцева моря // Ученые записки МГУ. – 1937. – Вып. 13, № 3. – С. 203–236.
- Золотарев В. Н., Золотарев П. Н. Двустворчатый моллюск Cunearca cornea – новый элемент фауны Черного моря // Доклады АН СССР. – 1987. – Т. 297, № 2. – С.501–503.
- Золотарёв П. Н., Терентьев А. С. Изменения в сообществах макробентоса Гудаутской устричной банки // Океанология. – 2012. – Т. 52, № 2. – С. 251–257. https://elibrary.ru/download/elibrary_17679731_99464089.pdf
- Иванов Д. А., Синегуб И. А. Трансформация биоценозов Керченского пролива после вселения хищного моллюска Rapana thomasiana и двустворчатых Mya arenaria и Сunearca cornea // Современные проблемы экологии Азово-Черноморского региона: Материалы III Международной конференции (10–11 октября 2007 г.) – Керчь. – 2008. – С. 45–51.
- Киселёва М. И. Бентос рыхлых грунтов Чёрного моря. – Киев: Наук. думка, 1981. – 165 с. https://repository.marine-research.ru/handle/299011/8133
- Киселёва М. И. Сравнительная характеристика донных сообществ у побережья Кавказа // Многолетние изменения зообентоса Черного моря. – Киев: Наукова думка, 1992. – С. 84–99. https://repository.marine-research.ru/handle/299011/5644
- Колючкина Г. А., Чикина М. В., Бирюкова С. В., Булышева Н. И., Басин А. Б., Любимов И. В., Коваленко Е. П. Долговременные изменения популяции двустворчатого моллюска-вселенца Anadara kagoshimensis на северо-восточном побережье Чёрного моря // Труды ВНИРО. – 2018. – Т. 170. – С. 7–25. https://elibrary.ru/download/elibrary_35257559_68832833.pdf
- Колючкина Г. А., Семин В. Л., Григоренко К. С., Басин А. Б., Любимов И. В. Роль абиотических факторов в вертикальном распределении макрозообентоса северо-восточного побережья Черного моря // Зоологический журнал. – 2020. – Т. 99, № 7. – С. 784–800. https://doi.org/10.31857/S0044513420070053
- Кукушкин А. С., Бурлакова З. П., Еремеева Л. В. Особенности распределения прозрачности и содержания взвешенного вещества в поверхностном слое северо-западной части Чѐрного моря в осенний период // Океанология. – 2008. – Т. 48, № 3. – С. 333–344. https://www.elibrary.ru/download/elibrary_10008345_67022836.pdf
- Кучерук Н. В., Савилова Т. А. Количественная и экологическая характеристики донной фауны шельфа и верхнего склона района Североперуанского апвеллинга // Бюллетень Московского общества испытателей природы. Отделение биологическое. – 1985. – Т. 90, вып. 6. – С. 70–79.
- Литвиненко Н. М., Евченко О. В. Изменение качественного и количественного состава зообентоса Азовского моря после зарегулирования реки Дон // Материалы II междунар. конф. Современные проблемы экологии Азово-Черноморского бассейна. – 2006. – С. 36–41.
- Мальцев В. И. О возможности применения показателя функционального обилия для структурных исследований зооценозов // Гидробиологический журнал. – 1990. – Т. 26, № 1. – С. 87–89.
- Маньковский В. И., Владимиров В. Л., Афонин Е. И., Мишонов А. В., Соловьев М. В., Аннинский Б. Е., Георгиева Л. В., Юнев О. А. Многолетняя изменчивость прозрачности воды в Чѐрном море и факторы, обусловившие ее сильное снижение в конце 80-х начале 90-х годов. – Севастополь, 1996. – 32 с. (Препр./НАН Украины. МГИ, ИнБЮМ).
- Маринов Т., Стойков Ст., Барек М. Зообентосът от сублиторальното пясъчно и тинесто дъно на Варненския залив // Известия на института по рибни ресурси. Варна. – 1983. – Т. 20. – С. 109–133.
- Маринов T. M. Зообентос Болгарского сектора Чёрного моря. – София: Изд-во Болгарской академии наук, 1990. – 195 с.
- Милютин Д. М., Вилкова О. Ю. Черноморские моллюски-вселенцы рапана и анадара: современное состояние популяций и динамика запасов // Рыбное хозяйство. – 2006. – Т. 4. – С. 50–53.
- Петров А. Н. Закономерности батиметрического распределения массовых видов моллюсков в зависимости от свойств рыхлых субстратов у побережья западного Крыма // Водные биоресурсы и среда обитания. – 2022. – Т. 5, № 3. – С. 69–81.
- Просвиров Ю. В. Влияние высоты слоя насыпного грунта на вертикальную миграцию и смертность бентосных животных // Тезисы докладов IV Всесоюзной научно-технической конференции «Вклад молодых ученых и специалистов в решение современных проблем океанологии и гидробиологии». – Ч. 2. – Севастополь, 1989. – С. 70. https://repository.marine-research.ru/handle/299011/8616
- Просвиров Ю. В. Формирование донных сообществ песчаных грунтов в районе Севастополя (полевой эксперимент): автореф. … дис. канд. биол. наук: спец. 03.00.18 Гидробиология. – Севастополь: Институт биологии южных морей им. А. О. Ковалевского, 1990. – 24 с. https://repository.marine-research.ru/handle/299011/5254
- Ревков Н. К. Таксономический состав донной фауны Крымского побережья Черного моря. Региональные особенности зообентоса. Вертикальное распределние зообентоса. Многолетние изменения зообентоса рыхлых грунтов в районе юго-западного Крыма // Современное состояние биоразнообразия прибрежных вод Крыма (Черноморский сектор). – Севастополь: ЭКОСИ-Гидрофизика, 2003. – С. 209–228, 326–338. https://www.elibrary.ru/download/elibrary_26825093_82196328.pdf
- Ревков Н. К. Современное состояние зооресурсов бентали Азово-Черноморского бассейна. Макрозообентос украинского шельфа Чёрного моря // Промысловые биоресурсы Чёрного и Азовского морей / [Pед. В. Н. Еремеев, А. В. Гаевская, Г. Е. Шульман, Ю. А. Загородняя]. – НАН Украины, Институт биологии южных морей НАН Украины. – Севастополь: ЭКОСИ-Гидрофизика, 2011. – С. 140–162. https://www.elibrary.ru/download/elibrary_26839195_36633279.pdf
- Ревков Н. К. Недавний вселенец и перспективный объект аквакультуры в Черном море двустворчатый моллюск Anadara kagoshimensis (Tokunaga, 1906): особенности развития поселений у берегов Крыма // Материалы VIII Всес. конф. по пром. беспозвоночным (Калиниград, 2–5 сент. 2015 г.). – Калининград. – 2015. – С. 254–257. https://doi.org/10.13140/rg.2.1.1438.0001
- Ревков Н. К. Особенности колонизации Чёрного моря недавним вселенцем – двустворчатым моллюском Anadara kagoshimensis (Bivalvia: Arcidae) // Морской биологический журнал. – 2016. – Т. 1, № 2. – С. 3–17. http://dx.doi.org/10.21072/mbj.2016.01.2.01
- Ревков Н. К., Валовая Н. А., Колесникова Е. А., Николаенко Т. В., Шаляпин В. К. К вопросу о реакции Черноморского макрозообентоса на эвтрофирование // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа: Сб. науч. тр. – Севастополь, 1999. – С. 199–212. https://www.researchgate.net/publication/265397117
- Ревков Н. К., Болтачева Н. А., Николаенко Т. В., Колесникова Е. А. Биоразнообразие зообентоса рыхлых грунтов Крымского побережья Чёрного моря // Океанология. – 2002. – Т. 42, № 4. – С. 561–571. https://www.researchgate.net/publication/265161600
- Ревков Н. К., Николаенко Т. В. Биоразнообразие зообентоса прибрежной зоны южного берега Крыма (район бухты Ласпи) // Биология моря. – 2002. – Т. 28, № 3. – С. 170–180. https://www.researchgate.net/publication/265249544
- Ревков Н. К., Болтачева Н. А., Бондаренко Л. В. Многолетние изменения зообентоса в акватории Ялтинского залива (южный берег Крыма, Чёрное море) // Морской экологический журнал. – 2014. – Т. 13, № 2. – С. 49–62. https://repository.marine-research.ru/handle/299011/1343
- Ревков Н. К., Болтачева Н. А., Бондарев И. П., Бондаренко Л. В., Тимофеев В. А. Состояние зооресурсов бентали глубоководной зоны шельфа Крыма после кризиса черноморской экосистемы второй половины XX века (по данным экспедиционных исследований 2010 г. на НИС «Профессор Водяницкий» // 100 лет Карадагской научной станции им. Т. И. Вяземского: сб. науч. трудов / [Ред. А. В.Гаевская, А. Л.Морозова]. – Симферополь: Н. Орiанда, 2015. – С. 549–571. https://repository.marine-research.ru/handle/299011/550
- Ревков Н. К., Болтачева Н. А. Донная фауна юго-западной части Азовского моря: трансформация биоценоза макрозообентоса в начале XXI века // Экосистемы. – 2021. – № 26. – С. 51–66. https://doi.org/10.37279/2414-4738-2021-26-51-66
- Ревков Н. К., Болтачева Н. А. Восстановление биоценоза черноморского гребешка Flexopecten glaber (Bivalvia: Pectinidae) у берегов Крыма (район Ласпи) // Экологическая безопасность прибрежной и шельфовой зон моря. – 2022. – № 4. – С. 90–103. https://www.elibrary.ru/download/elibrary_50136958_41562020.pdf
- Самые опасные инвазионные виды России (ТОП-100) / [Ред. Ю. Ю. Дгебуадзе, В. Г. Петросяна, Л. А. Хляп]. – М.: Товарищество научных изданий КМК, 2018. – 688 с.
- Синегуб И. А. Макрозообентос. Доные сообщества. 1984–2002 гг. // Северо-Западная часть Чёрного моря: биология и экология. – Киев: Наукова думка, 2006. – С. 276–286. https://www.researchgate.net/publication/324248290
- Солдатов А. А., Андреенко Т. И., Головина И. В. Особенности организации тканевого метаболизма у двустворчатого моллюска-вселенца Anadara inaequivalvis Bruguiere // Доповидi НАН України. – 2008. – № 4. – С. 161–165.
- Солдатов А. А., Андреенко Т. И., Головина И. В., Столбов А. Я. Особенности организации тканевого метаболизма у моллюсков с различной толерантностью к внешней гипоксии // Журнал эволюционной биохимии и физиологии. – 2010. – Т. 46, № 4. – С. 284–290.
- Солдатов А. А., Ревков Н. К., Петросян В. Г. Моллюски. Anadara kagoshimensis (Tokunaga, 1906) // Самые опасные инвазионные виды России (ТОП-100) / [Ред. Ю. Ю. Дгебуадзе, В. Г. Петросяна, Л. А. Хляп]. – М.: Товарищество научных изданий КМК, 2018. – С. 260–266. https://www.researchgate.net/publication/332158449
- Стадниченко С. В., Золотарев В. Н. Популяционная структура морских двустворчатых моллюсков в районе дельты Дуная в 2007–2008 гг. // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. – Севастополь: ЭКОСИ-Гидрофизика, 2009. – Вып. 20. – C. 248–261.
- Старк И. Н. Годовая и сезонная динамика бентоса в Азовском море // Труды АзНИИРХ. – 1960. – Т. 1, вып. 1. – С. 167–229.
- Терентьев А. С. Макрозообентос юго-западной части Азовского моря в условиях эксплуатации газоконденсатных месторождений // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа: Сб. науч. тр. Вып. 17. – Севастополь, 2009. – С. 327–348. https://www.researchgate.net/publication/269096674
- Фомичёва А. И., Фроленко Л. Н. Состояние биоценоза моллюска-вселенца Cunearca cornea (Scapharca inaequivalvis) в Азовском море // Эколого-биологические проблемы вод и биоресурсов: пути решения. Сборник научных трудов Всероссийской конференции. – Ульяновск, 2007. – С. 2003–2004.
- Фроленко Л. Н., Двинянинова О. В. Формирование биоценоза вселенца кунеарки Cunearca cornea в Азовском море // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна. – Ростов-на-Дону: Изд-во АзНИИРХ, 1998. – С. 115–118.
- Фроленко Л. Н., Бирюкова А. А., Саенко Е. М. Биологическая и биохимическая характеристика популяции кунеарки (Cunearca cornea) в Азовском море // Тез. докл. по биологич. ресурсам окраинных и внутренних морей России. – M., ВНИРО, 2000. – С. 159–160.
- Фроленко Л. Н., Мальцева О. С. О сообществе Аnadara в Азовском море // Современные рыбохозяйственные и экологические проблемы азово-черноморского региона. – 2017. – C. 99–103.
- Чикина М. В. Макрозообентос рыхлых грунтов северо-кавказского побережья Черного моря: пространственная структура и многолетняя динамика: автореф. дис…. канд. биол. наук: спец. 03.00.18 Гидробиология. – Москва, Институт океанологии им. П. П. Ширшова РАН, 2009. – 25 с. https://new-disser.ru/_avtoreferats/01004257753.pdf
- Чикина М. В., Колючкина Г. А., Кучерук Н. В. Аспекты биологии размножения Scapharca inaequivalvis (Bruguière) (Bivalvia, Arcidae) в Черном море // Экология моря. – 2003. – Вып. 64. – С. 72–77. https://elibrary.ru/download/elibrary_25457232_72732980.pdf
- Чихачев А. С., Фроленко Л. Н., Реков Ю. И. Новый вселенец в Азовское море // Рыбное хозяйство. – 1994. – Т. 3. – С. 40–45.
- Шаловенков Н. Н. Моллюск-вселенец Anadara kagoshimensis в структуре донных сообществ шельфа Крыма // Биология внутренних вод. – 2023. – № 4. – С. 491–500. https://doi.org/10.31857/S0320965223040198
- Юнев О. А., Коновалов С.К., Великова В. Антропогенная эвтрофикация в пелагической зоне Черного моря: долговременные тренды, механизмы, последствия. Москва, Изд-во ГЕОС. – 2019. – 164 с. https://core.ac.uk/reader/304111950
- Arvanitidis C., Somerfield P. J., Rumohr H., Faulwetter S., … Nevrova E. L., Petrov A. N., Revkov N. K., … Speybroeck J., Van Hoey G., Vincx M., Whomersley P., Willems W., Zenetos A. Biological geography of the european seas: results from the Macroben database // Marine Ecology – Progress Series. – 2009. – Vol. 382. – P. 265–278. https://elibrary.ru/item.asp?id=31528236.
- Broom M. J. The Biology and Culture of Marine Bivalve Molluscs of the Genus Anadara. ICLARM Studies and Reviews 12. Manila, Philippines. – 1985. – 37 p. https://core.ac.uk/download/pdf/6515039.pdf
- Cahn A. R. Clam Culture in Japan. Washington DC, US Fish and Wildlife Service. – 1951. – Leaflet FL-399. – 103 p. https://spo.nmfs.noaa.gov/sites/default/files/legacy-pdfs/leaflet399.pdf
- Clarke K. R. Non-parametric multivariate analyses of changes in community structure // Australian Journal of Ecology. – 1993. – Vol. 18. – Р. 117–143. https://doi.org/10.1111/j.1442-9993.1993.tb00438.x
- Clarke K. R., Gorley R. M. PRIMER v5: User Manual / Tutorial. Primer – E: Plymouth. – 2001. – 92 p.
- Denisenko S. G., Denisenko N. V., Lehtonen K. K., Andersin A.-B., Laine A. O. Macrozoobenthos of the Pechora Sea (SE Barents Sea): community structure and spatial distribution in relation to environmental conditions // Marine ecology progress series. – 2003. – Vol. 258. – P. 109–123. https://www.int-res.com/articles/meps2003/258/m258p109.pdf
- Gomoiu M.-T. Scapharca inaequivalvis (Bruguière) – a new species in the Black Sea // Cercetări marine – Recherches marines. – 1984. – Vol. 17. – P. 131–141.
- Klompmaker A. A., Kelley P. H. Shell ornamentation as a likely exaptation: evidence from predatory drilling on Cenozoic bivalves // Paleobiology. – 2015. – Vol. 41. – P. 187–201. https://doi.org/10.1017/pab.2014.12
- Kolyuchkina G. A., Syomin V. L., Spiridonov V. A., Zalota A. K., Biryukova S. V., Basin A. B., Simakova U. V., Nabozhenko M. V. The resilience of macrozoobenthos of boreal coastal lagoons to non-indigenous species invasion: A case study of Taman Bay (the Sea of Azov) // Regional studies in marine science. – 2019. – Vol. 28, article 100573. https://doi.org/10.1016/j.rsma.2019.100573
- Kusukabe D. Studies on the artificial seeds of the ark shell Anadara subcrenata (Lischke) // Journal of the Faculty of Fisheries and Animal Husbandry Hiroshima University. – 1959. – Vol. 2, N 2. – P. 183–239.
- Marinov T. M. The Zoobenthos from the Bulgarian sector of the Black Sea. – Sofia: Bulg. Academy of Sci. Publ., 1990. – 194 p.
- Park H. J., Lee W. C., Choy E. J., Choi K.-S., Kang C.-K. Reproductive cycle and gross biochemical composition of the ark shell Scapharca subcrenata (Lischke, 1869) reared on subtidal mudflats in a temperate bay of Korea // Aquaculture. – 2011. – Vol. 322–323. – P. 149–157. https://doi.org/10.1016/j.aquaculture.2011.10.015
- Revkov N. K., Abaza V., Dumitrache C., Todorova V., Konsulova T., Mickashavidze E., Varshanidze M., Sezgin M., Ozturk B., Chikina M. V., Kucheruk N. V. The state of zoobenthos // State of the Environment of the Black Sea (2001–2006/7) / Edited by Temel Oguz. Publications of the Comission on the Protection of the Black Sea Against Pollution (BSC) 2008–3. – Istanbul Turkey, 2008a. – P. 273–320. https://repository.marine-research.ru/handle/299011/6659
- Revkov N. K., Petrov A. N., Kolesnikova E. A., Dobrotina G. A. Comparative analysis of long-term alterations in structural organization of zoobenthos under permanent anthropogenic impact (сase study: Sevastopol bay, Crimea) // Marine Ecological Journal. – 2008b. – Vol. 7, N 3. – P. 37–49.
- Revkov N. K., Boltacheva N. A., Timofeev V. A., Bondarev I. P., Bondarenko L. V. Macrozoobenthos of the Zernov’s Phyllophora Field, northwestern Black Sea: species richness, quantitative representation and long-term variations // Nature Conservation Research. – 2018. – Vol. 3, N 4. – P. 32–43. https://repository.marine-research.ru/handle/299011/972
- Savini D., Occhipinti-Ambrogi A. Consumption rates and prey preference of the invasive gastropod Rapana venosa in the Northern Adriatic Sea // Helgoland Marine Research. – 2006. – Vol. 60. – P. 153–159. https://doi.org/10.1007/s10152-006-0029-4
- Sahin C., Emiral H., Okumus I., Mutlu Gozler A. The Benthic Exotic Species of the Black Sea: Blood Cockle (Anadara inaequivalvis, Bruguiere, 1789: Bivalve) and Rapa Whelk (Rapana thomasiana, Crosse, 1861: Mollusc) // Journal of Animal and Veterinary Advances. – 2009. – Vol. 8, N 2. – P. 240–245. https://www.researchgate.net/publication/344489800
- Streftaris N., Zenetos A. Alien marine species in the Mediterranean – the 100 ‘worst invasives’ and their impact // Mediterranean Marine Science. – 2006. – Vol. 7, N 1. – P. 87–118. https://doi.org/10.12681/mms.180
- Ting Y. Y., Kasahara S. and Nakamura N. An ecological study of the so-called Mogai (Anadara subcrenata (Lischke)) cultured in Kasaoka Bay // Journal of the Faculty of Fisheries and Animal Husbandry, Hiroshima University. – 1972. – Vol. 11. – P. 91–110.
- Trayanova A. T., Todorova V. R., Konsulova Ts. H., Shtereva G. P., Hristova O. D., Dzhurova B. S. Ecological State of Varna Bay in Summer 2009 according to Benthic Invertebrate Fauna // Acta Zoologica Bulgarica. – 2011. – Vol. 63, iss. 3. – P. 277–288. https://www.researchgate.net/publication/290523567
- Zaitzev Yu., Mamaev V. Biodiversity in the Black Sea: A study of Change and Decline. In: New York Black Sea Envir. Ser. – 1997. – Vol. 3. – 208 p. https://fishermenassociation.wordpress.com/wp-content/uploads/2014/10