| Экосистемы, 37: 73–81 (2024) | https://ekosystems.cfuv.ru |
| УДК 598.2(477.75) | DOI: 10.29039/2413-1733-2024-37-73-81 |
Действие бурового раствора на эмбрионы и предличинок русского осетра Acipenser gueldenstaedtii
Руднева И. И. 1, Шайда В. Г. 2, Медянкина М. В. 3
- Морской гидрофизический институт Севастополь, Россия svg-41@mail.ru
- Общество с ограниченной ответственностью «ЭкоСервис-А» Москва, Россия
- Московский государственный университет технологий и управления имени К. Г. Разумовского (Первый казачий университет имени К. Г. Разумовского)
Москва, Россия mediankina@mail.ru
Активное развитие нефте- и газодобычи на морском шельфе негативно влияет на гидробионтов, что выражается в ухудшении условий их существования и снижении жизнеспособности. Ранние стадии развития морских обитателей наиболее чувствительны к действию загрязнителей, наличие которых в среде приводит к нарушению их выживаемости, роста и развития. Исследовали влияние бурового компонента (водный раствор гемицеллюлазы) в концентрации 0,1; 0,5; 1; 5 и 10 мг/л на выживаемость эмбрионов и предличинок осетра Acipenser gueldenstaedtii (Brandt & Ratzeberg, 1833) в среде соленостью 5 ‰. Не обнаружено различий в выживаемости эмбрионов в растворах с токсикантом в концентрации 0,1–1 мг/л, но при увеличении его концентрации до 5 мг/л и выше происходило достоверное (р<0,01) снижение этого показателя и задержка вылупления предличинок. Установлена средняя корреляция (r=0,53) между выживаемостью эмбрионов и концентрацией вещества. Вылупление личинок в контрольных группах было наибольшим и не имело существенных различий в пресной и соленой воде. Не действующая на выживаемость эмбрионов рыб концентрация вещества составила 1 мг/л. Рассмотрены разные механизмы негативного влияния бурового раствора на развивающихся эмбрионов рыб: ухудшение условий обитания, оседание твердых частиц на поверхности икринки и тем самым задержка выклева, прямые токсические эффекты, обусловленные наличием токсикантов, особенно тяжелых металлов в составе бурового раствора. Обсуждается возможность использования икры рыб для оценки экологического состояния прибрежных морских акваторий в районах интенсивной нефте- и газодобычи.
Ключевые слова: буровой раствор, загрязнение, токсичность, эмбрионы и предличинки рыб, выживаемость.
ВВЕДЕНИЕ
Добыча нефти и газа на шельфе морей и океанов и их последующая транспортировка приобретают все большие масштабы, что сопряжено с неизбежным загрязнением морской среды нефтью и нанесением существенного вреда прибрежным экосистемам и их обитателям, включая человека (Khalturin et al., 2023). Токсические эффекты нефти и ее производных достаточно полно исследованы на гидробионтах на разных уровнях их биологической организации (Pereira et al., 2018; Samuelsen et al., 2019; Руднева, 2022; Rudneva, 2023). Однако, при бурении нефтяных и газовых скважин используют специальные химические компоненты – буровые растворы, информация о биологических эффектах и токсичности которых крайне ограничена (Antia et al., 2022; Yalman et al., 2022).
Буровые растворы необходимы для разработки скважин как в наземных условиях, так и в шельфовой зоне морей и океанов. Это сложные многокомпонентные дисперсные смеси, состоящие из воды, суспензионных, эмульсионных и аэрированных жидкостей, органических растворителей, тяжелых металлов, глины, которые используются для промывки скважин в процессе их бурения (Neff, 2003). Существует три группы буровых растворов в зависимости от жидкой фазы: в первой группе применяется вода, во второй группе – масло, в третьей группе – синтетические компоненты, в частности, эфир (Holdway, 2002; Deka, 2023). Наиболее часто используются буровые растворы на основе воды, в которой растворены разные компоненты, более 90 % которых составляют барит, бентонит, лигнит и лигносульфонат, а также тяжелые металлы (Ejileughaa et al., 2022). Число остальных компонентов может варьировать в пределах от 8 до 12. После их использования буровые растворы относятся к отходам производства и подлежат утилизации, так как многие из них являются токсичными и обладают мутагенной и канцерогенной активностью (Antia et al., 2022, Pereira et al., 2022; Xiong, Han, 2023). Вместе с тем имеются сведения о том, что эти вещества могут проявлять положительные эффекты, которые проявляются в стимуляции роста растений (Седых и др., 2004). В связи с этим анализ токсичности буровых растворов, их влияния на гидробионтов и установление допустимых концентраций в водной среде имеет важное практическое и теоретическое значение. Для этих целей применяются разные токсикологические тесты, позволяющие по откликам тест-организмов выявить токсичность этих веществ, возможные изменения в водных экосистемах и оценить экологический риск (Beyer et al., 2016).
Важное значение имеет выбор тест-объектов и их реакций, которые позволяют оценить степень токсичности загрязнителей. Эмбрионы и личинки рыб чувствительны к действию разных неблагоприятных факторов и поэтому являются признанными и широко используемыми организмами в токсикологических исследованиях для оценки качества водной среды. Тест на эмбриотоксичность рыб обязателен при определении предельно допустимых концентраций загрязнителей (ПДК) как для рыбохозяйственных водоемов, так и для морских акваторий в районе активной хозяйственной деятельности (Beyer et al., 2016). Учитывая все возрастающие масштабы нефте- и газодобычи на шельфе морей и океанов, и риски, сопряженные с этой деятельностью, попадание буровых растворов в морскую среду может привести к тяжелым последствиям для экосистемы и ее обитателей. Поскольку биологические эффекты буровых растворов слабо изучены, исследование их токсичности для гидробионтов представляет несомненный интерес, имеющий теоретическое и практическое значения.
Русский осетр Acipenser gueldenstaedtii (Brandt & Ratzeberg, 1833) является типичным бентофагом, спектр питания молодых рыб включает дафний, хирономид, бокоплавов и других мелких беспозвоночных, тогда как взрослые особи поедают моллюсков, олигохет, ракообразных, мелких рыб. Весной и в летнее время осетр обитает на шельфе моря (Переварюха, 2010). Осетры воспроизводятся в пресной воде, затем совершают миграции в море для нагула и возвращаются для нереста в места своего воспроизводства. Они относятся к условно анадромным видам, так как в основном они нагуливаются в солоноватоводных водоёмах – Каспийском, Азовском, Чёрном морях, в которых вода имеет более низкую соленость, чем в океане. По времени миграции делится на яровую и озимую расы. Яровая раса нерестится ранней весной с апреля по июнь. Рыбы озимой расы, составляющие основную часть популяции, мигрируют на нерест в летнее время при температуре воды +22–27 °С. Максимальный нерест озимого осетра происходит в июле–августе со спадом в сентябре – октябре. При понижении температуры воды до +8–4 °С нерестовый ход озимой расы практически прекращается. Озимая раса осетра зимует в зимовальных ямах с последующим нерестом на следующий год. Икру откладывает в реках на глубине от 3 до 10 м, в основном на участках, временно затопляемых весенним паводком. Плодовитость 80–890 тысяч икринок. Развитие оплодотворенной икры происходит в течение 8–10 суток. Личинки сносятся вниз по течению нерестовых рек. Половой зрелости достигает в 10–12 лет (Вилкова, 2022).
Цель настоящей работы – оценить токсичность бурового раствора на основе гемицеллюлазы в концентрациях 0,1; 0,5; 1; 5 и 10 мг/л для эмбрионов и предличинок русского осетра – Acipenser gueldenstaedtii, обитающего в морях, на шельфе которых производится интенсивная нефте- и газодобыча.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Иcследуемый буровой раствор представляет собой жидкость коричневого цвета с легким запахом ферментации, pH 3,8–8,0, растворим в воде и стабилен в нормальных условиях.
Применяется в нефтегазовой промышленности для разрушения химических связей в рабочем растворе.
В качестве тест-объекта использовали развивающихся эмбрионов русского осетра Acipenser gueldenstaedtii, полученных в результате искусственного оплодотворения на Темрюкском рыбоводном заводе в мае 2021 года. Эксперименты проводили в соответствие с методами, изложенными в (Методические указания…, 2009). Продолжительность опытов составила 5 суток, повторность – трехкратная. Контрольной и фоновой средой в экспериментах служила природная пресная вода из реки Кубань, прошедшая специальную водоподготовку на предприятии, а также искусственная морская вода, приготовленная на той же пресной воде с добавлением морской соли до концентрации 5 ‰, что соответствует средней солености воды в Азовском море, где обитает осетр.
Икринки на стадии 31–35, на которой хорошо просматривается эмбрион и его глаза, помещали в стеклянные емкости по 10 экземпляров в каждую из расчета 1 икринка в 15 мл соответствующей среды. Икринки инкубировали при температуре окружающей среды от 16,3 до 18,0 ℃ в течение эмбрионального периода. Воду меняли 1 раз в 2 дня. Анализировали процент живых эмбрионов, динамику вылупления предличинок и их выживаемость.
Результаты исследований обрабатывали статистически общепринятыми методами, вычисляли среднее арифметическое и ошибку средней. Рассчитывали индекс выживаемости как отношение процента живых эмбрионов и предличинок в опытных вариантах к контрольным значениям. Достоверность различий определяли по критерию Стьюдента, и различия считали достоверными при p<0,05. Корреляционный анализ между исследуемыми показателями и концентрацией вещества проводили с помощью компьютерной программы CURFVIT (версия L2).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Продолжительность интоксикации эмбрионов осетра составила 5 суток в диапазоне концентраций 0,1–10 мг/л. Как можно видеть из таблицы 1, достоверных различий между значениями выживаемости эмбрионов рыб в пресной воде и в воде с соленостью 5‰ не установлено.
| Таблица 1 | |||||
| Влияние вещества на выживаемость эмбрионов осетра | |||||
| Концентрация, | Доля выживаемости эмбрионов рыб, % | ||||
| мг/л | n | ||||
| М±m | Fстат. | ||||
| Контроль 1 | 30 | 26,67±5,44 | 0/1,1 | ||
| Контроль 2 | 30 | 33,33±2,72 | 1,1/0 | ||
| 0,1 мг/л | 30 | 16,67±7,2 | 1,1/2,2 | ||
| 0,5 мг/л | 30 | 16,67±9,81 | 0,89/1,64 | ||
| 1 мг/л | 30 | 23,33±10,89 | 0,27/0,89 | ||
| 5 мг/л | 30 | 3,33±2,72* | 3,83/7,79 | ||
| 10 мг/л | 30 | 3,33±2,72* | 3,83/7,79 | ||
Примечание к таблице: M±m – средняя ± ошибка репрезентативности; n – величина выборки;
- – достоверное отличие от контроля (Fкрит.=3,80); Fстат. – отличие: числитель – отличие от контроля в пресной воде; знаменатель – отличие от контроля в 5 ‰ соленой воде.
Не обнаружено различий по данному показателю при инкубации икры осетра в растворах
- веществом в концентрации 0,1–1 мг/л. Однако, при увеличении концентрации вещества до
5 мг/л и выше наблюдали достоверное (р<0,01) сокращение выживаемости эмбрионов осетра. Таким образом, не действующая на выживаемость эмбрионов рыб концентрация вещества составила 1 мг/л. Установлена умеренная корреляция между выживаемостью эмбрионов осетра и концентрацией вещества (r=0,53).
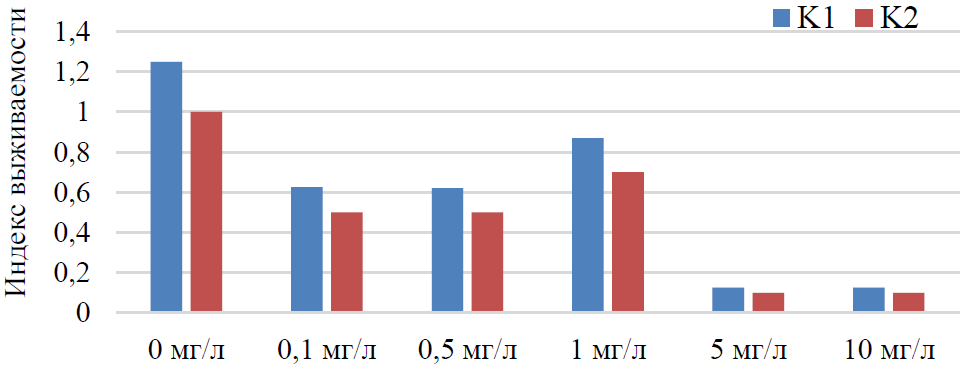
Индекс выживаемости эмбрионов рыб при разных концентрациях вещества по отношению к контролю в пресной и в соленой воде показал сходную тенденцию. Его значения мало различались в двух контрольных группах, имели тенденцию к снижению по мере увеличения концентрации токсиканта и резко падали при содержании его в среде 5–10 мг/л (рис. 1).
Начало вылупления предличинок рыб в диапазоне концентраций 0,1–1,0 мг/л произошло одновременно с контролем в течение первых суток (рис. 2). Однако, следует отметить, что самый высокий показатель (13,3 %) был отмечен в контрольной группе в пресной воде, тогда как в группе, развивающейся в соленой воде и при добавлении токсиканта в концентрациях 0,1–1 мг/л, он был ниже. При концентрации вещества в воде 5–10 мг/л в первые сутки вылупления не было, оно началось только на вторые сутки.
Рис. 1. Индекс выживаемости эмбрионов рыб по отношению к контролю в пресной воде (К1) и в 5 ‰ соленой воде (К2)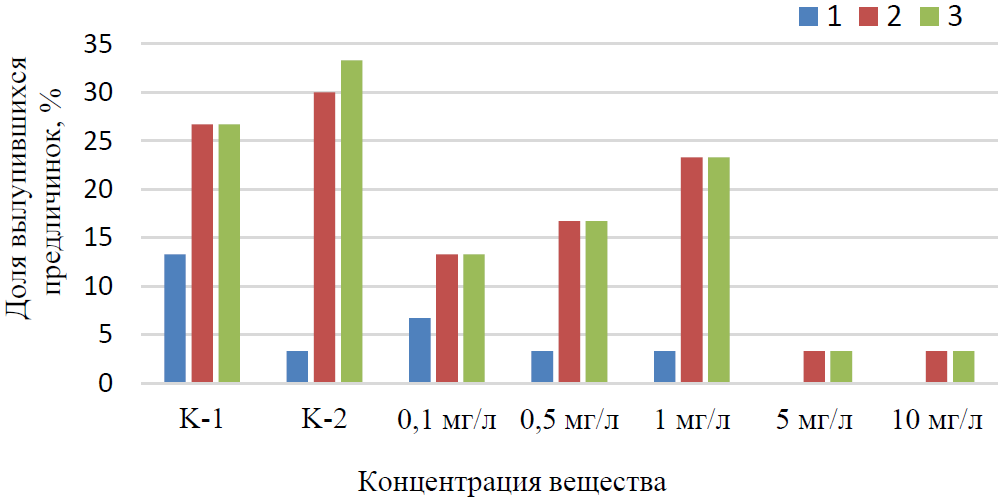
Рис. 2. Динамика вылупления предличинок из икринок осетра при действии вещества в концентрации 0,1–10 мг/л
1–3 – дни вылупления; К1 и К2 – контроль в пресной воде и в воде соленостью 5 ‰ соответственно.
На вторые и третьи сутки вылупление личинок в контрольных группах было наибольшим и не имело существенных различий. В опытных вариантах при концентрации 0,1–1 мг/л этот показатель составил 13,3–23,3%, причем он возрастал последовательно с увеличением концентрации вещества от 0,1 до 1 мг/л. При концентрации токсиканта 5 и 10 мг/л вылупление было минимальным и составило 3,3 % в обоих случаях. Таким образом, не действующая на динамику вылупления концентрация реагента равна 1 мг/л.
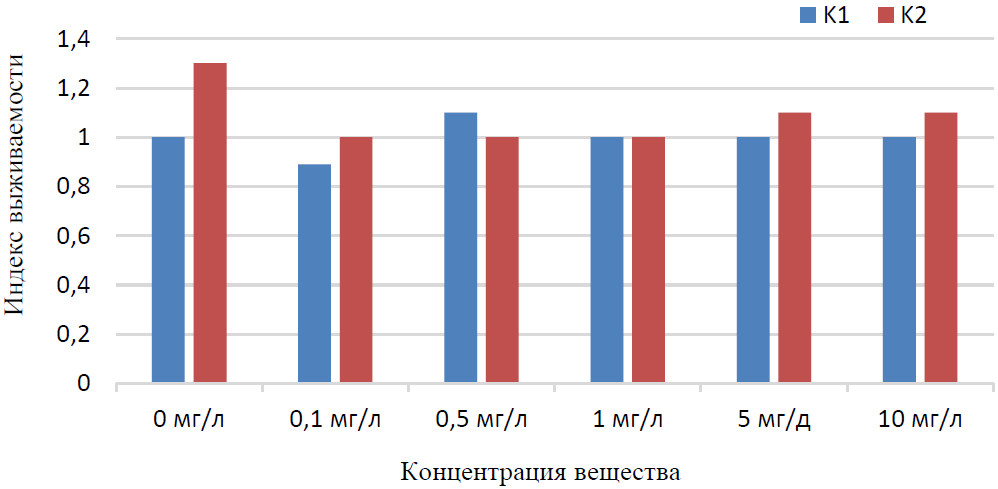
Выживаемость предличинок осетра на третьи сутки после вылупления не отличалась в обоих контрольных вариантах (табл. 2). Индекс выживаемости предличинок рыб по отношению к контролю в пресной воде (К1) и в 5‰ соленой воде (К2) также имел близкие значения (рис. 3)
| Таблица 2 | ||||
| Влияние концентрации вещества на выживаемость личинок осетра | ||||
| Концентрация, мг/л | Выживаемость личинок, % | |||
| М±m | Fстат. | |||
| Контроль 1 | 75,0±11,8 | 0/0,6 | ||
| Контроль 2 | 66,7±6,8 | 0,6/0 | ||
| 0,1 мг/л | 83,3±13,6 | 0,5/1,1 | ||
| 0,5 мг/л | 80,1±10,5 | 0,3/1,1 | ||
| 1 мг/л | 75,1±10,5 | 0/0,6 | ||
| 5 мг/л | 75,0±17,7 | 0/0,4 | ||
| 10 мг/л | 75,0±17,7 | 0/0,4 | ||
Примечание к таблице. M±m – средняя ± ошибка репрезентативности; n – величина выборки; числитель – отличие от контроля в пресной воде; знаменатель – отличие от M±m; Fстат.: числитель – отличие от контроля в пресной воде, знаменатель – отличие от контроля в 5 ‰ соленой воде. Уровень достоверности отличий – Fкрит.=3,8.
Рис. 3. Индекс выживаемости предличинок рыб по отношению к контролю в пресной воде (К1) и в 5 ‰ соленой воде (К2)
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ
Результаты проведенных исследований позволили выявить неоднозначные эффекты действия вещества на ранние онтогенетические стадии развития осетра. Установленные эффекты зависели от времени экспозиции и концентрации бурового раствора. Следует отметить, что анадромные рыбы, к которым относится осетр, воспроизводящиеся в пресных водоемах и затем возвращающиеся в море для нагула, представляют особый интерес для экотоксикологических исследований, так как позволяют сравнить действие токсикантов на одном и том же виде в пресных и соленых водах (Foley et al., 2022). В связи с этим в наших исследованиях было использовано два контрольных варианта развития икры в пресной воде и в воде соленостью 5 ‰.
Действие вещества при концентрации 5–10 мг/л приводило к снижению выживаемости эмбрионов рыб и снижению индекса выживаемости по отношению к обоим контрольным вариантам. Не действующая на выживаемость эмбрионов рыб концентрация вещества составила 1 мг/л. Результаты были достоверны по отношению к контролю в пресной и в соленой воде, что свидетельствует о токсичности исследуемого бурового раствора в обеих средах.
Вторым информативным тестом, характеризующим токсичность вещества, явился показатель вылупления предличинок из икринок. В этом случае как в обоих контрольных вариантах, так и в опытных группах при концентрации 0,1–1 мг/л максимальный показатель вылупления происходил на 2–3 день, а при инкубации предличинок в растворах с большей концентрацией вещества вылупление началось на день позже и составило всего 3 %. Это свидетельствовало о токсичном влиянии бурового раствора на процесс выхода предличинки из оболочек икринки. Однако, на выживаемость предличинок вещество в исследованных концентрациях не оказало существенного влияния. Таким образом, результаты исследований показали, что тестируемый буровой раствор по-разному влияет на разные ранние онтогенетические стадии осетра, что согласуется с данными других исследователей.
Токсичность различных видов буровых растворов и шламов была установлена для разных видов рыб на разных этапах онтогенеза. Так, было показано в экспериментальных условиях, что различные компоненты буровых смесей могут негативно действовать на рыб и проявлять при этом различную токсичность, отличную от комплексного вещества (Sil et al., 2012). Авторы предположили, что это может быть обусловлено как синергическими эффектами, так и антагонистическими взаимодействиями между компонентами бурового раствора. Было продемонстрировано также, что в наибольшей степени от попадающих в водную среду веществ страдают бентосные рыбы и беспозвоночные, которые непосредственно контактируют с этими токсикантами. Так, например, в экспериментальных условиях было показано, что у трех видов литорин при действии возрастающих концентраций бурового раствора хромлигносульфоната от 100 до 2000 мг/л смертность моллюсков возрастала до 40– 80 % в зависимости от вида. При этом отмечена высокая корреляция между содержанием хрома в веществе и выживаемостью литорин (Ekpo et al., 2004). Экспериментальные исследования влияния буровых растворов на основе масла и воды на диатомовые одноклеточные водоросли Pheodsactilum tricornutum установили, что максимальный летальный эффект через 96 час проявился при концентрации 20 мг/л, а для дафний этот показатель составил 1 мг/л. Было отмечено снижение продуктивности, воспроизводства, замедление роста и созревания ракообразных. Моллюски мидии и дрейссены оказались более устойчивыми к действию токсикантов (Mazlova et al., 2019). Эксперименты, проведенные на тиляпии Tilapia mossambica, кефали Mugil persia и бентосном моллюске Boleopthalmus boddarti показали, что нерастворимые в воде компоненты влияют в меньшей степени на эти тест-организмы, чем водорастворимые буровые вещества (Sil et al., 2012). В то же время водная вытяжка утилизированного бурового шлама не оказывала острого токсического действия на дафнию Daphnia magna Straus и одноклеточную водоросль Chlorella vulgaris Beijer (Тарасова, Гаевая, 2021). Токсические эффекты бурового раствора, выражающиеся в повреждении жабр, были выявлены у тигровой креветки Penaeus monodon, для которой ЛК50 варьировала через 96 час инкубации в пределах 30,740–78,271 мг/л (Soegianto et al., 2008).
Такие же эффекты были отмечены и в природной среде, когда даже на расстоянии 5 км от нефтяной платформы бентосные организмы, в основном двустворчатые моллюски, были существенно повреждены. Наиболее сильные отклонения от нормы наблюдали у мидий на расстоянии 0,5–1 км от нефтяной скважины (Bakke et al., 2013). Донные беспозвоночные мидии и полихеты наиболее пострадали от загрязнения при функционировании скважины в радиусе 250 м, но отдельные случаи аномалий были отмечены у гидробионтов на расстоянии 500 м. Исследования, проведенные на рыбах (пикше и сельди) из природных популяций, обитающих в районах интенсивной нефтедобычи, показали значительную активацию защитных систем организма, прежде всего возрастание активности ферментов семейства цитохрома Р-450 в печени, повреждение ДНК и изменения в составе жирных кислот, что свидетельствовало о комплексном негативном влиянии нефти и сопутствующих компонентов, используемых на нефтепромыслах (Balk et al., 2011). При этом основной риск создают значительные объемы, высокие концентрации и выпуски водорастворимых буровых растворов, но их быстрое распространение на больших акваториях существенно снижает ожидаемый вред, также как и осаждение твердого компонента на глубине 80 м. Было отмечено действие этих компонентов на бентосные фильтрующие организмы, но не выявлено негативных последствий для эпибентосной фауны и рыб около мезотрофного рифа (Jones et al., 2021).
Существует три возможных механизма токсического действия буровых растворов на водные экосистемы (Ismail еt al., 2017): a – прямые токсические эффекты буровых растворов проявляются при попадании их в воду и изменении ее физико-химических свойств; б – происходит образование пленки на поверхности воды и создание тем самым гипо-и аноксических условий, вызывающих гибель гидробионтов и в – развивается аноксия вод, вызванная деградацией органических компонентов микробными сообществами (Rasti1 et al., 2021).
Таким образом, результаты проведенных исследований по изучению влияния вещества на эмбриональный период развития осетра показали, что его пороговая концентрация составляет 5,0 мг/л, максимально допустимая концентрация равна 1,0 мг/л. Лимитирующий показатель – выживаемость эмбрионов и динамика выклева личинок.
Важнейшей задачей проведения тестирования буровых растворов на ранних онтогенетических стадиях рыб является оценка риска для гидробионтов, а также для здоровья человека (Adams et al., 2021). Вторая цель подобных исследований – оценить качество воды и разработать критерии для их анализа (Martínez-Gómez et al., 2017). В данном исследовании ранние онтогенетические стадии осетра – эмбрионы и предличинки – были экспонированы в среде с разной концентрацией бурового раствора от 0,5 до 10 мг/л. Было установлено, что пороговая концентрация составляет 5 мг/л, а максимально допустимая 1 мг/л. Буровой раствор обладает определенной токсичностью и, попадая в морскую среду, может негативно влиять на развитие ранних онтогенетических стадий рыб, и тем самым нанести ущерб воспроизводству рыб, их росту и развитию. а также численности популяций. При этом возможны разные механизмы негативного влияния бурового раствора на развивающихся эмбрионов рыб, а именно:
– ухудшение условий обитания;
– оседание твердых частиц на поверхности икринки и тем самым задержка выклева;
– прямые токсические эффекты, обусловленные наличием токсикантов, особенно тяжелых металлов в составе бурового раствора, развитие окислительного стресса, о чем мы писали ранее (Rudneva, 2019);
– вся совокупность синергетических и антагонистических эффектов.
ЗАКЛЮЧЕНИЕ
Результаты проведенных исследований свидетельствуют о токсичности тестируемого бурового раствора. Наиболее чувствительным тестами явились показатели смертности эмбрионов рыб и динамика вылупления предличинок из икринок. Попадая в морскую среду, буровой раствор может негативно влиять на развитие ранних онтогенетических стадий рыб, и тем самым нанести ущерб воспроизводству рыб, их росту и развитию, а также численности популяций
Благодарности. Авторы выражают благодарность ООО «Экосервис-А» за финансовую поддержку исследований, а также сотрудникам Темрюкского рыбоводного завода и лично Емельянову А.В. за помощь в выполнении экспериментальных работ.
Список литературы
Вилкова О. Ю. Анадромные осетры России: перспективы промысла // Труды ВНИРО. – 2022. – Т. 190. – С. 14–21.
Методические указания по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов ПДК вредных веществ в водах водных объектов рыбохозяйственного значения, утв. приказом Росрыболовства № 695 от 04.08.2009 г.
Патин С. А. Морской нефтегазовый комплекс: факторы экологического риска // Защита окружающей среды в нефтегазовом комплексе. – 2015. – № 4. – С. 5–14.
Переварюха Т. Ю. Некоторые правовые и биологические аспекты сохранения биологического разнообразия при искусственном воспроизводстве рыб // Вестник АГТУ. Сер.: Рыбное хозяйство. – 2010. – № 1. – С. 107–111.
Седых В. Н., Игнатьев Л. А., Семенюк М. В. Реакции растений на воздействие отходов бурения. – Новосибирск: Наука, 2004. – 104 с.
Тарасова С. С., Гаевая Е. В. Исследования токсичности буровых шламов и возможности их утилизации // Проблемы региональной экономики. – 2021. – Т. 3. – С. 75–79.
Adams R. H., Ojeda-Castillo V., Guzmán-Osorio F. J., Álvarez-Coronel G., Domínguez-Rodríguez V. I. Human health risks from fish consumption following a catastrophic gas oil spill in the Chiquito River, Veracruz, Mexico // Environmental Monitoring. Assessment. – 2020. – Vol. 192, N 12. – 783. – Р. 2–15.
Antia M, Ndidiamaka A., Ezejiofor A., Cecilia Nwadiuto Obasi C. N., Orisakwe O. E. Environmental and public health effects of spent drilling fluid: an updated systematic review // Journal of Hazardous Materials Advances. – 2022. – 100120.
Bakke T., Klungsøyr J., Sanni S. Environmental impacts of produced water and drilling waste discharges from the Norwegian offshore petroleum industry // Marine Environmental Research. – 2013. – Vol. 92. – P. 154–169.
Balk L., Hylland K., Hansson T., Berntssen M. H. G., Beyer J., Jonsson G., Melbye A., Grung M., Torstensen B. E., Borseth J. F., Skarphedinsdottir H., Klungsoyr J. Biomarkers in natural fish populations indicate adverse biological effects of offshore oil production // PLОS ONE. – 2011. – Vol. 6, iss. 5. https;//doi.org/10.1371/journal.pone.0019735
Beyer J., Trannum H. C. , Bakke T., Hodson P. V., Tracy K. Collier T. K. Environmental effects of the Deepwater Horizon oil spill: A review // Marine Pollution. Bulletin. – 2016. – Vol. 110, N 1. – P. 28–51.
Deka B. Drilling fluids and their types. // In: Basics of Drilling Fluid. Chapter 2. (ed. Mech D.). Noida: CIIR Scientific Publications, India. – 2023. – P. 4–7.
Ejileughaa Ch., Ezejiofor A. N., Ezealisiji K. M., Orisakwe O. E. Metal oxide nanoparticles in oil drilling: Aquatic toxicological concerns // Journal Hazardous Materials Advances. – 2022. – Vol. 7. – 100116.
Ekpo A. E., Uzebu M. L. The effect of the petroleum drilling mud additive (Chrome lignosulphonate) on the microbiology and survival of periwinkle (Pachymelania spp. and Tympanotonus spp.) // World Journal Microbiological. Biotechnology. – 2004. – Vol. 20. – P. 559–562.
Foley M., Askin N., Belanger M. P., Wittnich C. Anadromous fish as biomarkers for the combined impact of marine and freshwater heavy metal pollution // Ecotoxicology and Environmental Safety. – 2022. – Vol. 230. – 113153. – Р. 00– 00.
Holdway D. A. The acute and chronic effects of wastes associated with offshore oil and gas production on temperate and tropical marine ecological processes // Marine Pollution Bulletin. – 2002. – Vol. 44. – P. 185–203
Ismail A. R., Alias A. H., Sulaiman W. R. W., Jaafar M. Z., Ismail I. Drilling fluid waste management in drilling for oil and gas wells // Chemistry. Engineering Transactions. – 2017. – Vol. 56. – P. 1351–1356.
Jones R., Wakeford M., Currey-Randall L., Miller K., Tonin H. Drill cuttings and drilling fluids (muds) transport, fate and effects near a coral reef mesophotic zone // Marine Pollution Bulletin. – 2021. – Vol. 72. – 112717.
Khalturin A. A., Parfenchik K. D., Shpenst V. A. Features of oil spills monitoring on the water surface by the Russian Federation in the Arctic Region // Journal of Marine Science and Engineering. – 2023. – Vol. 11 (1). – 111. https://doi.org/10.3390/jmse11010111
Martínez-Gómez C., Vethaak A. D., Hylland K., Burgeot T., Köhler A., Lyons B. P., Thain J., Gubbins M. J., Davies I. M. A guide to toxicity assessment and monitoring effects at lower levels of biological organization following marine oil spills in European Waters // ICES Journal of Marine Science. – 2010. – Vol. 67, N 6. – P. 1105–1118.
Mazlova E. A., Malina N., Semenycher V. G. Study of influence of drilling wastes on Black Sea planktonic and benthic organisms // Chemistry and Technology of Fuels and Oils. – 2019. – Vol 55, N 5. – P. 70–84.
Neff J. M. Composition, environmental fates, and biological effects of water based drilling muds and cuttings discharged to the marine environment: A synthesis and annotated bibliography // Prepared for Petroleum Environmental Research Forum (PERF) and American Petroleum Institute. – 2003. – 83 p.
Pereira B., Sad Eustáquio C. M. S., Castro V. R., Filgueiras P. R., Lacerda V. Environmental impacts related to drilling fluid waste and treatment methods: A critical review // Fuel. – 2022. – Vol. 310, Part B. – 122301.
Rasti1 A., Ameri A., Riahi M. A. Aerobic degradation of oil-based mud drilling fluid by in situ bacteria in the Hawizeh Marshes // Journal Petroleum Exploration and Production Technology. – 2021. – Vol. 11. – P. 3775–3783.
Rudneva I.I. Use of fish embryo biomarkers for the evaluation of mazut toxicity in marine environment // International Aquatic Research. – 2019. – Vol. 11. – P. 147–157.
Rudneva I.I. Assessment of mazut toxicity for embryos of two sea fish species // Ecological Safety of the Coastal and Shelf Zones of Sea. – 2022. – N 2. – P. 118–127.
Rudneva I.I. Interspecies peculiarities of biomarkers response of marine fish embryos to oil pollution // Pollution. – 2023. – Vol. 9 (1). – P. 243–253.
Samuelsen A., Daewe U., Wettre C. Risk of oil contamination of fish eggs and larvae under different oceanic and weather conditions ICES // Journal of Marine Science. – 2019. – Vol. 76, N 6. – P. 1902–1916.
Sil A., Wakadikar K., Kumar S., Babu S., Sivagami S., Tandon S., Hettiaratchi P. Toxicity characteristics of drilling mud and its effect on aquatic fish populations // Journal Hazardous, Toxic and Radioactive Waste. – 2012. – Vol. 12, N 16. – P. 51–57
Soegianto A., Irawan B., Affandi M. Toxicity of drilling waste and its impact on gill structure of post larvae of tiger prawn. (Penaeus monodon) // Global Journal Environmental Research. – 2008. – Vol. 2. – P. 36–41.
Xiong D., Xu Han X. Particular pollutants, human health risk and ecological risk of oil — based drilling fluid: a case study of Fuling shale gas field // Environmental Geochemistry Health. – 2023. – Vol. 45. – P. 981–995
Yalman E., Federer-Kovacs G., Depci T., Al Khalaf H., Aylikci V., Aydin M. G. Development of novel inhibitive water-based drilling muds for oil and gas field applications // Journal Petroleum Science and Engineering. – 2022. – Vol. 210. – 109907.
Rudneva I.I., Shaida V.G., Medaynkina M.V. Toxic effects of drilling fluid on the embryos and prelarvae of Ruissian sturgeon Acipenser guelenstaedtii // Ekosistemy. 2024. Iss. 37. P. 73–81.
The active development of oil and gas production on the sea shelf negatively affects aquatic organisms, leading to deterioration of their existence and reduced viability. The early stages of development of marine organisms are particularly sensitive to pollutants, which disrupt their survival rate, growth, and development. The researchers studied the impact of a drilling fluid component (an aqueous solution of hemicellulase) at concentrations of 0.1, 0.5, 1, 5, and 10 mg/L on the survival of embryos and prelarvae of the Russian sturgeon, Acipenser gueldenstaedtii (Brandt & Ratzeberg, 1833), in a saline environment (salinity 5 ‰). No differences were observed in the survival of embryos in solutions containing a toxicant at a concentration of 0.1–1 mg/l. However, when the concentration increased to 5 mg/l and higher, there was a significant (p<0.01) decrease in survival rate and delayed hatching of prelarvae. An average correlation (r=0.53) between embryo survival and substance concentration was found. The hatching of larvae in the control groups was the highest and it did not differ significantly in fresh and salty water. A concentration of 1 mg/L of the substance had no effect on fish embryos survival. Various mechanisms of the negative impact of drilling fluid on developing fish embryos are considered, including habitat deterioration, sedimentation of solid particles on the surface of eggs leading to delayed hatching, and direct toxic effects caused by the presence of toxicants, especially heavy metals, in the composition of the drilling fluid. The potential use of fish eggs to assess the ecological status of coastal marine areas in the regions of intensive oil and gas production is discussed.
Key words: drilling fluid, pollution, toxicity, fish embryos and prelarvae, survival rate.
Поступила в редакцию 26.11.23
Принята к печати 12.01.24