ВЕСЕННЯЯ МИГРАЦИЯ ПТИЦ НА ЮГЕ КРЫМА
SPRING MIGRATION OF BIRDS IN THE SOUTH OF CRIMEA
JOURNAL: «EKOSISTEMY», Issue 38, 2024
Publication text (PDF):Download
UDK: 598.2/.9:574.91(477.75-12)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Beskaravayny M. M.
T.I. Vyazemsky Karadag scientific station — Nature Reserve of the Russian Academy of Sciences, branch of A. O. Kovalevsky Institute of Biology of the Southern Seas of the Russian Academy of Sciences, Feodosiya, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2024-38-17-34
PAGES: from 17 to 34
STATUS: Published
LANGUAGE: Russian
KEYWORDS: pring migration, southern Crimea, species composition, biotopes, timing of migration, direction of migration, long-term changes in the ornithocomplex.
ABSTRACT (ENGLISH):
Data on the taxonomic and ecological composition, biotopic distribution, number and duration of stay of spring-migratory birds in the south of Crimea, intra-seasonal dynamics and long-term changes in the migration complex are presented. 193 species of birds from 18 orders were registered: Passeriformes (67 species) and Charadriiformes (48) are in the lead, significant proportions belong to Anseriformes, Ciconiiformes, Falconiformes and Gruiformes (10–18). The presence of species from four ecological groups are established: limnophiles (103), dendrophiles (51), campophiles (25) and sclerophiles (14). The marine and coastal migration complex includes about 85 limnophilic species: Gavia arctica, Podiceps cristatus, Phalacrocorax carbo, Thalasseus sandvicensis, some gulls and ducks are numerous. Significant accumulations of Anatidae, Rallidae, Ardeidae, Charadrii and some Passeriformes are noted in inland reservoirs. 97 species are associated with terrestrial habitats, mainly dendrophiles (49 species), a considerable part of the migration complex of open habitats are campophiles and sclerophiles. The duration of the migration period is about 4 months (mid–February – early June), the predominant direction of flight is north–east, according to the orientation of the coastline. The increase in the diversity of avifauna in Crimea during the second half of the 20th and early 21st centuries, as a consequence of increased water availability in the region and the expansion of some species’ ranges, resulted in the emergence and/or increase in numbers of at least 23 species of spring migrants in the southern part of the peninsula.
ВВЕДЕНИЕ
Небольшой по площади Крымский полуостров, через который проходит одна из ветвей Понтийского или Черноморского пролетного пути (Мензбир, 1934), является регионом массовой миграции птиц, а его территория и прибрежная акватория моря – местами формирования крупных миграционных скоплений. В составе авифауны Крымского полуострова группа весенних мигрантов составляет более половины зарегистрированных здесь видов.
Общие описания хода миграционного процесса в Крыму и южной его части содержатся в капитальных работах конца 19 – начала 20 века (Никольский, 1891; Pusanow, 1933); разрозненные данные, касающиеся главным образом отдельных видов и субрегионов, приводятся в ряде публикаций последних десятилетий (Костин Ю., 1983; Бескаравайный, 2008; Бескаравайный и др., 1999; Гирагосов, Бескаравайный, 2016 и др.). Однако в целом этот вопрос остается недостаточно изученным.
Целью настоящей работы является выяснение таких вопросов, как таксономический и экологический состав весеннемигрирующих птиц на юге Крыма, распределение по биотопам, численность, сроки и направление пролета, анализ внутрисезонной динамики весенней миграции и многолетних изменений в составе миграционного орнитокомплекса.
МАТЕРИАЛ И МЕТОДЫ
Район исследований охватывает нижнюю часть южного макросклона Главной Гряды Крымских гор с прилегающей полосой побережья и прибрежной акватории Черного моря от Севастополя до Феодосии (около 200 км) (рис. 1). Обобщены литературные данные, а также собственные материалы, полученные в 1976–2023 годах.
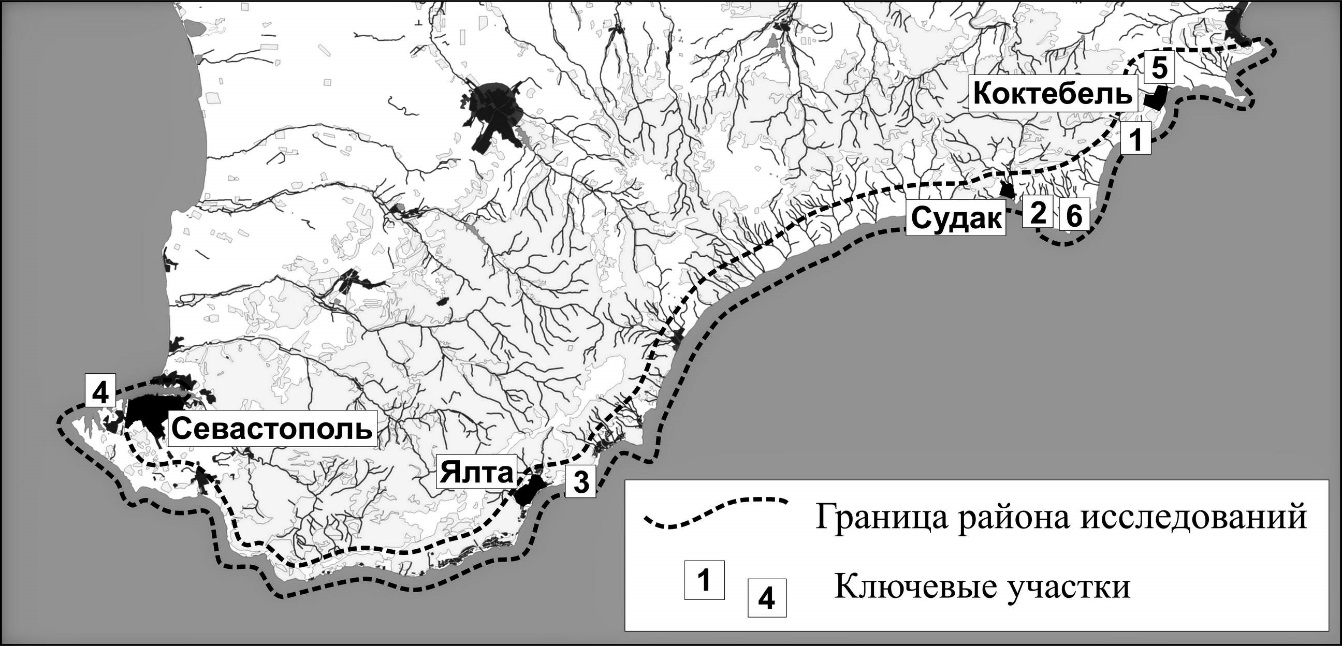
Рис. 1. Район исследований и расположение ключевых участков
Наблюдения велись ежегодно с февраля до июня. В их сфере находилась лишь визуально-доступная часть миграционного процесса: птицы регистрировались в основном в светлое время суток (за исключением некоторых видов, определяемых по голосу), на сравнительно небольшой высоте (1–1,5 км) и удаленности от береговой линии в сторону моря примерно на 1 км.
Определенные трудности в процессе установления видового состава весенних мигрантов вызваны одновременным присутствием в этот период года птиц одного вида – еще не отлетевших с мест зимовки, мигрирующих и прилетевших на места гнездования. О принадлежности птиц к мигрирующим судили по таким визуально фиксируемым явлениям, как направленное и регулярное их перемещение над сушей и морем, появление и (или) временные скопления в позднезимнее и весеннее время в негнездовых биотопах; для видов, одноименных с зимующими – также по заметному росту численности по сравнению с зимней.
Регистрировались первая и последующие даты встреч, биотоп, количество птиц в стаях и скоплениях, по возможности (в основном для крупных видов) – направление пролета. Для характеристики сроков миграции, наряду с собственными данными, использованы материалы из литературных источников последних четырех десятилетий (Костин Ю., 1983; Костин С., 1999, 2004; Цвелых, Аппак, 2012).
Наиболее полные данные о численности мигрирующих водных и околоводных птиц на местах кормежки и отдыха получены на следующих шести регулярно обследуемых ключевых участках (рис. 1).
1. 2,5-километровый прибрежный участок на востоке Южного берега Крыма у поселка Курортное (бухта Карадагская – мыс Крабий): включает две небольшие бухты (Карадагская и Актинометрическая) и прибрежную акваторию (2,5 кв. км).
2. Двухкилометровый участок берега с прилегающей морской акваторией в бухте Капсель восточнее города Судак (2 кв. км).
3. Двухкилометровый участок берега с прилегающей акваторией в центральной части Южного берега Крыма (заповедник «Мыс Мартьян») у Ялты (2 кв. км).
4. Акватория и береговая зона южной части бухты Круглая в Севастополе (0,4 кв. км).
5. Мелководное озеро Бараколь с прилегающими степными территориями в 4 км к северу от поселка Коктебель (100 га).
6. Водохранилище Бугаз с прилегающими степными территориями в 10 км восточнее города Судак (3 кв. км).
Полученные на этих участках данные дополнены материалами нерегулярных наблюдений, фиксирующих миграционные скопления птиц в других районах прибрежной морской акватории и на внутренних водоемах исследуемого региона.
В суходольных биотопах численность некоторых фоновых видов оценивалась на маршрутах 1–7 км, проложенных на относительно хорошо просматриваемых участках суши (открытые биотопы, редколесья: 90 учетов).
Такие базовые характеристики миграции, как направление и интенсивность, оценивались посредством наблюдений за видами, пролет которых хорошо заметен (пролетающими вдоль берегов или высоко над сушей). При наличии направленной миграции вдоль морских берегов, учитывали количество птиц, пролетевших за определенный период времени (15 мин. – 1 час).
В связи с тем, что в миграционные периоды имеют место значительные колебания численности птиц, для количественных оценок использовались максимальные (в некоторых случаях также экстремальные) значения, полученные на обследуемых ключевых участках и маршрутах.
Номенклатура и порядок расположения отрядов и видов соответствуют списку птиц стран Северной Евразии (Коблик, Архипов, 2014). Принадлежность видов к экологическим группам дана по работам В. П. Белика (2000) с отдельными поправками для некоторых видов, учитывающими особенности их экологии в Крыму.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Южный Крым как регион временного обитания мигрирующих птиц
По своему ландшафтно-биотопическому облику, южная часть Крыма отличается от северной отсутствием таких высокопродуктивных кормовых стаций, как обширные мелководья, аккумулятивные острова и косы, а также слабым развитием тростниковых биотопов.
Регулярно используемой мигрирующими птицами стацией является прибрежная морская акватория, в меньшей степени – некоторые элементы рельефа береговой зоны (пляжи с прибойной зоной, скальные островки). Береговая линия на значительном протяжении ориентирована в субширотном направлении. Берега абразионного типа: наиболее мелководные участки морской акватории приурочены к бухтам, где 10-метровая изобата проходит на удалении до 1 км от берега (в бухте Коктебельская).
Пресноводные биотопы представлены водоемами антропогенного происхождения (поливные пруды, водохранилища): наиболее крупные – Изобильненское у Алушты, Бугаз у Судака, «Хрущевский Фонтан» у Коктебеля. Единственный крупный естественный водоем – мелководное озеро Бараколь на востоке региона.
Естественный растительный покров образуют редколесья и леса из дуба пушистого, грабинника, местами – можжевельника высокого. Широко представлены искусственные древесно-кустарниковые насаждения – парки, сады, виноградники. В восточной части региона значительные площади занимают степи.
Климатические особенности весеннего сезона следующие (Павлова,1964; Климат и опасные…, 1982; Боков и др., 1989; Клюкин, Костенко, 1997). Характерен широкий диапазон температур (в апреле – от –5 до +27 °C). В марте иногда бывают метели, сильные ветры и снегопады, но к концу этого месяца морозы обычно прекращаются. В апреле и мае возрастает облачность, часты туманы, надвигающиеся с моря. Преобладают южные ветра.
Таксономический и экологический состав весенних мигрантов
Весеннемиграционный орнитокомплекс южного Крыма включает не менее 193 видов птиц из 18 отрядов (табл. 1). Основу этого списка составляют виды, отвечающие принятым здесь критериям принадлежности к весеннемигрирующим. Еще 6 видов, не отмеченных нами согласно этим критериям, включены в список на основании литературных и коллекционных данных: это черный аист – Ciconia nigra (Костин С., 2004), степной лунь – Circus macrourus (Пекло, 1997), хохлатая чернеть – Aythya fuligula, канюк – Buteo buteo и погоныш-крошка – Porzana pusilla (Костин Ю., 1983), серый сорокопут – Lanius excubitor (Цвелых, Аппак, 2012).
Видовой состав и некоторые основные характеристики весеннемигрирующих птиц на юге Крыма
| Вид | Экогруппа | Сроки пролета: месяц (декада) | Оценка численности |
| 1 | 2 | 3 | 4 |
|---|---|---|---|
| Coturnix coturnix | К | 3(2)–5 | ++ |
| Cygnus cygnus | Л | 3–4(3) | + |
| Anser albifrons | Л | 3(1?)–4(1) | ++ |
| Anser anser | Л | 3(1–3) | + |
| Tadorna ferruginea | Л | 3(1)–4(2) | + |
| Tadorna tadorna | Л | 2(3)–4(2) | ++ |
| Anas penelope | Л | 2?–5(1) | ++ |
| Anas strepera | Л | 3(1–3) | + |
| Anas crecca | Л | 2(3)–5(2) | ++ |
| Anas platyrhynchos | Л | 2(3?)–4(?) | +++ |
| Anas acuta | Л | 3(1)–5(1) | ++ |
| Anas querquedula | Л | 2(3)–5(?) | +++ |
| Anas clypeata | Л | 3(1)–5(3) | ++ |
| Netta rufina | Л | 2(3)–3(3) | ++ |
| Aythya ferina | Л | 2(3)–4(1?) | +++ |
| Aythya nyroca | Л | 2(3)–4? | + |
| Aythya fuligula | Л | 3(1?)–5(1)? | ++ |
| Mergus serrator | Л | 3–5(1) | ++ |
| Mergus merganser | Л | 2(3)–4(2) | + |
| Gavia stellata | Л | 4(1)–5(2) | + |
| Gavia arctica | Л | 2(3)–5(1?) | +++ |
| Phalacrocorax pygmeus | Л | 3(2)–4(3) | + |
| Phalacrocorax carbo | Л | 2(2)–4(3?) | +++ |
| Botaurus stellaris | Л | 3(1)–4(3) | + |
| Ixobrychus minutus | Л | 3(3)–5(3) | ++ |
| Nycticorax nycticorax | Л | 3(1)–5(3) | ++ |
| Ardeola ralloides | Л | 4(2)–6(1) | ++ |
| Egretta garzetta | Л | 3(3)–6(1) | +++ |
| Casmerodius albus | Л | 2–5(3) | ++ |
| Ardea cinerea | Л | 2(3)–5(3?) | +++ |
| Ardea purpurea | Л | 3(2)–6(1?) | ++ |
| Ciconia nigra | Д | 3(3)–5(1) | + |
| Ciconia ciconia | Д | 4(1)–5(1) | + |
| Plegadis falcinellus | Л | 3(2)–5(3) | ++ |
| Platalea leucorodia | Л | 4(3)–5(2) | + |
| Tachybaptus ruficollis | Л | 3–4(2) | + |
| Podiceps grisegena | Л | 2(3)–5(2) | ++ |
| Podiceps cristatus | Л | 2(2)–5(1?) | +++ |
| Podiceps nigricollis | Л | 3–5(2) | ++ |
| Podiceps auritus | Л | 3(2)–5(1) | + |
| Falco tinnunculus | С | 3–4(3) | ++ |
| Falco vespertinus | Д | 4(2)–5(3) | ++ |
| Falco columbarius | Д | 3(2)–4(1) | + |
| Falco subbuteo | Д | 4(1)–6(1) | ++ |
| Pandion haliaetus | Л | 4(1–3) | + |
| Pernis apivorus | Д | 4(2)?–5(3) | ++? |
| Milvus migrans | Д | 4(2)–5(3?) | + |
| Circus aeruginosus | Л | 3(1?)–5 | ++ |
| Circus cyaneus | К | 3(1)–4(2) | ++ |
| 1 | 2 | 3 | 4 |
| Circus macrourus | К | 4(1–2) | + |
| Circus pygargus | К | 4(3)–5(2) | + |
| Buteo buteo | Д | 3–4 | + |
| Buteo lagopus | К | 2?–4(2) | + |
| Anthropoides virgo | К | 3(3)–5(2) | + |
| Grus grus | Л | 2(2)–4(3) | +++ |
| Rallus aquaticus | Л | 2(3)–5(1) | ++? |
| Crex crex | К | 3(3)–5(3) | ++ |
| Porzana parva | Л | 4(1)–5(1) | ++ |
| Porzana pusilla | Л | 4(2) | +? |
| Porzana porzana | Л | 4(3) | ++? |
| Gallinula chloropus | Л | 3(2)–5(2) | ++ |
| Fulica atra | Л | 3(1)–5(2?) | ++ |
| Otis tarda | К | 3(1–3) | + |
| Burhinus oedicnemus | К | 3(3)–5(3) | ++ |
| Haematopus ostralegus | Л | 3(2)–5(1) | ++ |
| Himantopus himantopus | Л | 3(3)–5(3) | ++ |
| Recurvirostra avosetta | Л | 3(3)–6(1) | ++ |
| Vanellus vanellus | Л | 2(3)–5(2?) | ++ |
| Vanellochettusia leucura | Л | 4(3) | + |
| Pluvialis apricaria | Л | 2(3) | + |
| Pluvialis squatarola | Л | 2(2)–5(1) | + |
| Charadrius hiaticula | Л | 5(1–3) | + |
| Charadrius dubius | Л | 3(2)–5(1) | ++? |
| Charadrius alexandrinus | Л | 3(2)–5(2) | + |
| Eudromias morinellus | К | 4(2–3) | + |
| Scolopax rusticola | Д | 3?–4(3) | ++? |
| Lymnocryptes minimus | Л | 3(3) | + |
| Gallinago gallinago | Л | 2(3)–5(2) | ++ |
| Gallinago media | Л | 5(2) | + |
| Limosa limosa | Л | 3(3)–5(1) | ++ |
| Numenius phaeopus | Л | 4(3) | + |
| Numenius arquata | Л | 3(3) | + |
| Tringa erythropus | Л | 5(1) | + |
| Tringa totanus | Л | 3(2)–5(1) | ++ |
| Tringa stagnatilis | Л | 4(2–3) | + |
| Tringa nebularia | Л | 4(1)–6(1) | ++ |
| Tringa ochropus | Л | 3(1)–5? | ++ |
| Tringa glareola | Л | 3(3)–5(3) | +++ |
| Actitis hypoleucos | Л | 3(3)–6(1?) | +++ |
| Arenaria interpres | Л | 4(2)–5(3) | ++ |
| Calidris minuta | Л | 4(3)–6(1) | ++ |
| Calidris temminckii | Л | 5(1) | + |
| Calidris ferruginea | Л | 4(3)–5(3) | ++ |
| Calidris alpina | Л | 2(3)–5(2) | ++ |
| Philomachus pugnax | Л | 2(3)–6(1) | +++ |
| Limicola falcinellus | Л | 5(1) | + |
| Glareola pratincola | Л | 5(3) | + |
| Larus canus | Л | 2–4(3) | +++ |
| Larus fuscus | Л | 3(1)–5(3?) | ++ |
| Larus ichthyaetus | Л | 2(3)–3(1) | + |
| Larus melanocephalus | Л | 2(3)–5(2) | +++ |
| Larus ridibundus | Л | 2–5(2?) | +++ |
| Larus genei | Л | 2(3)–5(1) | +++ |
| 1 | 2 | 3 | 4 |
| Larus minutus | Л | 3(1?)–5(2) | ++ |
| Gelochelidon nilotica | Л | 4(1)–5(3) | ++ |
| Thalasseus sandvicensis | Л | 3(1)–5(3) | +++ |
| Sterna hirundo | Л | 4(2)–6(1) | ++ |
| Sterna albifrons | Л | 5(1)–6(1) | + |
| Chlidonias hybrida | Л | 5(1–2) | + |
| Chlidonias leucopterus | Л | 4(3)–5(2) | ++ |
| Chlidonias niger | Л | 4(2) | + |
| Columba oenas | Д | 3(3)–4(3) | + |
| Columba palumbus | Д | 3(1)–4(2) | +++ |
| Streptopelia turtur | Д | 4(2)–5(2) | ++ |
| Streptopelia decaocto | Д | 3(2)–5(1) | + |
| Cuculus canorus | д/л | 4(1)–5(3) | ++ |
| Asio otus | Д | 3(2)–4(1?) | + |
| Asio flammeus | К | 3(2) | + |
| Caprimulgus europaeus | Д | 4(2)–6(1) | ++ |
| Apus melba | С | 3(3)–6(1?) | +++ |
| Apus apus | С | 3(3)–6(1) | +++ |
| Coracias garrulus | С | 4(3)–6(1) | ++ |
| Alcedo atthis | Л | 3(3)–6(1) | ++ |
| Merops apiaster | С | 4(3)–6(2?) | +++ |
| Upupa epops | С | 3(1)–5(3) | ++ |
| Jynx torquilla | Д | 3(3)–5(2) | ++ |
| Melanocorypha calandra | К | 3(1)–4? | + |
| Calandrella brachydactyla | К | 4(2) | + |
| Alauda arvensis | К | 3(1)–4(2) | +++ |
| Riparia riparia | С | 4(1)–6(1) | +++ |
| Hirundo rustica | С | 3(3)–6(1) | +++ |
| Cecropis daurica | С | 4(2)–6(1) | + |
| Delichon urbicum | С | 3(3)–6(1) | +++ |
| Anthus campestris | К | 4(2–3) | + |
| Anthus trivialis | Д | 3(3)–5(1) | +++ |
| Anthus cervinus | К | 4(1)–5(1) | + |
| Motacilla flava | К | 3(3)–5(2) | +++ |
| Motacilla feldegg | К | 4(1)–5(3) | +++ |
| Motacilla werae | Л | 3(2)–4(3) | + |
| Motacilla cinerea | Л | 3?–5(1) | ++ |
| Motacilla alba | Л | 2(3)–5(1) | +++ |
| Turdus pilaris | Д | 2(3?)–4(1) | +++ |
| Turdus iliacus | Д | 2(3)–4(1) | + |
| Turdus philomelos | Д | 3(2)–5(1) | +++ |
| Turdus viscivorus | Д | 3–4(2?) | ++ |
| Phoenicurus ph. phoenicurus | Д | 3(2)–5(1) | +++ |
| Phoenicurus ochruros | С | 3(2)–4(3) | +++ |
| Erithacus r. rubecula | Д | 3(2)–4(2) | +++ |
| Luscinia luscinia | Д | 5(1–2) | + |
| Luscinia svecica | Л | 3(3)–4(3) | ++ |
| Saxicola rubetra | К | 3(2)–6(1) | +++ |
| Saxicola rubicola | К | 3(1)–5(2) | +++ |
| Oenanthe oenanthe | К | 3(2)–6(1) | +++ |
| Oenanthe pleschanka | К | 4(1)–5(1?) | ++ |
| Oenanthe melanoleuca | К | 4(3)–5(2) | + |
| Oenanthe isabellina | К | 4(1–3) | + |
| Muscicapa striata | Д | 4(2)–6(1) | +++ |
| Ficedula hypoleuca | Д | 4(1)–5(1) | ++ |
| Ficedula albicollis | Д | 3(3)–5(2) | +++ |
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 |
| Ficedula semitorquata | Д | 4(1) | + |
| Ficedula parva | Д | 4(3)–5(3) | +++ |
| Locustella luscinioides | Л | 4(1)–6(1) | ++ |
| Locustella fluviatilis | Л | 5(1–3) | ++ |
| Acrocephalus schoenobaenus | Л | 4(2)–5(1) | ++ |
| Acrocephalus palustris | Л | 5(2) | ++? |
| Acrocephalus arundinaceus | Л | 4(3)–6(3?) | +++ |
| Hippolais icterina | Д | 4(3)–5(3) | + |
| Phylloscopus trochilus | Д | 4(1)–6(2) | +++ |
| Phylloscopus collybita | Д | 3(1)– 5(3) | +++ |
| Phylloscopus sibilatrix | Д | 4(1)–5(2) | ++ |
| Phylloscopus trochiloides | Д | 5(3) | + |
| Sylvia atricapilla | Д | 4(1)–5(3?) | + |
| Sylvia borin | Д | 4(3)–5(3) | ++? |
| Sylvia communis | Д | 4(2)–5(3) | ++ |
| Sylvia curruca | Д | 4(2)–5(3) | + |
| Remiz pendulinus | Л | 3?–4(2?) | + |
| Lanius collurio | Д | 4(2)–5(2) | ++? |
| Lanius minor | Д | 4(3)–6(1) | +++ |
| Lanius excubitor | Д | 4(3)–6(1) | + |
| Lanius senator | Д | 4(3)–6(1?) | + |
| Oriolus oriolus | Д | 4(2)–6(1) | +++ |
| Corvus monedula | С | 2(2)–4(2) | ++ |
| Corvus frugilegus | Д | 2(2)–5(1) | +++ |
| Pastor roseus | С | 5(1)–6(1) | ++ |
| Sturnus vulgaris | С | 2(3)–4 | +++ |
| Passer hispaniolensis | Д | 4(3) | + |
| Fringilla coelebs coelebs | Д | 3(1)–4(2) | +++ |
| Spinus spinus | Д | 3?–5(1) | ++ |
| Carpodacus erythrinus | Д | 4(3)–5(2) | + |
| Emberiza citrinella | Д | 3(1)– 4(1) | ++ |
| Emberiza hortulana | Д | 4(1–3) | ++ |
| Granativora melanocephala | К | 5(1–2) | + |
| Schoeniclus schoeniclus | Л | 3?–5(1) | ++ |
Примечание к таблице. Экогруппа:
Л – лимнофилы, Д – дендрофилы, К – кампофилы, С – склерофилы. Сроки пролета: приводятся на основании наиболее ранних и поздних за весь период исследований дат регистраций. Оценка численности: +++ – вид наблюдался ежегодно, многочислен (в скоплениях до сотен, иногда тысяч особей); ++ – не ежегодно, численность умеренная (в скоплениях до нескольких десятков особей), иногда высокая; + – редок, наблюдался в некоторые годы и в незначительном количестве (менее 10 раз за сезон).
С большой вероятностью мигрирующими являются еще некоторые виды, отмеченные в апреле и мае в негнездовых биотопах и известные как весеннепролетные для других регионов Крыма (Костин Ю., 1983), но заметного возрастания численности которых, по сравнению с одноименными зимующими и (или) гнездящимися, не наблюдали. Это перепелятник – Accipiter nisus, лесной жаворонок – Lullula arborea, луговой конек – Anthus pratensis, крапивник – Troglodytes troglodytes, лесная завирушка – Prunella modularis, ястребиная славка – Sylvia nisoria, красноголовый королек – Regulus ignicapilla, юрок – Fringilla montifringilla, дубонос – Coccothraustes coccothraustes. Таким образом, реальный видовой состав весенних мигрантов на юге Крыма может включать более 200 видов.
Согласно приведенному списку (табл. 1), среди рассматриваемой группы видов доминируют воробьеобразные – Passeriformes (не менее 67 видов, или 34,7 % видового состава) и ржанкообразные – Charadriiformes (48 видов, 24,9 %). Далее со значительным отрывом следуют гусеобразные – Anseriformes (18 видов, 9,3 %), соколообразные – Falconiformes (13 видов, 6,7 %), аистообразные – Ciconiiformes (12 видов, 6,2 %), журавлеобразные – Gruiformes (10 видов, 5,2 %); на долю остальных отрядов приходится по 1–5 видов (0,5–2,6 %).
Степень ландшафтно-биотопической дифференциации региона является достаточной для временного пребывания здесь мигрирующих птиц из четырех экологических групп (табл. 1). Лидирующее положение (103 вида, или 53,4 %) принадлежит лимнофилам из отрядов гусеобразных, гагарообразных, пеликанообразных, аистообразных, поганкообразных, большинства журавлеобразных и ржанкообразных, некоторых соколообразных, ракшеобразных и воробьеобразных. Значительно меньшую долю занимают дендрофилы (51 вид, 26,4 %), кампофилы (25 видов, 13,0 %) и склерофилы (14 видов, 7,3 %).
Биотопическое распределение весенних мигрантов
По признаку биотопического предпочтения выделяются две основные группы мигрантов: связанные с водными и суходольными биотопами.
Представление о численности некоторых обычных и регулярно мигрирующих видов, отмеченных в береговой зоне моря и на внутренних водоемах, дают результаты учетов на ключевых участках, дополненные нерегулярными локальными наблюдениями в других районах (табл. 2).
Лимнофильный весеннемиграционный комплекс морской акватории и прилегающей береговой зоны включает около 85 видов, более или менее регулярно в его составе
присутствуют около 50. Количественную основу составляют чернозобая гагара – Gavia arctica, чомга – Podiceps cristatus, большой баклан – Phalacrocorax carbo, пестроносая крачка – Thalasseus sandvicensis – ихтиофаги, для которых данный кормовой биотоп является предпочитаемым или единственным на юге Крыма. Крупные кратковременные концентрации у морских берегов, особенно при ухудшении погодных условий, образуют чайки (сизая – Larus canus, черноголовая – Larus melanocephalus и озерная – Larus ridibundus) и некоторые утки (кряква – Anas platyrhynchos, чирок-трескунок – Anas querquedula) (табл. 2).
Для видов тростникового комплекса, а также добывающих корм на мелководьях и отмелях (большинство уток и пастушковых, цаплевые, кулики, некоторые воробьеобразные), отмечаются лишь непродолжительные остановки в береговой и прибрежной зонах одиночек и небольших мигрирующих групп; редко, при резком ухудшении погодных условий, формируются значительные скопления лысухи – Fulica atra. Регулярные и наиболее крупные миграционные концентроации этих видов (более 100, иногда до тысячи особей) существуют только на внутренних водоемах. Разнообразный и многочисленный миграционный комплекс складывается на озере Бараколь (не менее 60 видов), основу которого составляют 12: пеганка – Tadorna tadorna, кряква, чирок-трескунок, широконоска – Anas clypeata, красноголовый нырок – Aythya ferina, серая цапля – Ardea cinerea, лысуха, ходулочник – Himantopus himantopus, фифи – Tringa glareola, кулик-воробей – Calidris minuta, турухтан –
Таблица 2
Численность обычных и регулярно мигрирующих видов в береговой зоне и на внутренних водоемах по данным учетов на ключевых участках и в некоторых других районах южного Крыма
| Вид | Численность на ключевых участках (max) | Данные нерегулярных учетов в других районах | |||||||
| 1 М | 2 М | 3 М | 4 Б | 5 В | 6 В | Место наблюдения | N птиц | Биотоп | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Anser albifrons | 1 | – | – | – | 39 | – | Коктебель | 70 | о |
| Anser anser | 1 | – | – | – | 21 | – | Коктебель | 1 | в |
| Tadorna tadorna | 2 | – | – | – | ~200 | 6 | СевастопольОрджоникидзе | 365 | мм |
| Anas penelope | 7 | – | 1 | 2 | 20 | 3 | Ялта | 2 | м |
| Anas crecca | 25 | 4 | – | – | 30 | 5 | ЯлтаКоктебель | 145 | мм |
| Anas platyrhynchos | 235 | 10 | 48 | – | 240 | 6 | КоктебельКоктебель | 8050 | вм |
| Anas acuta | 4 | – | – | 1 | 115 | 7 | Ялта | 2 | в |
| Anas querquedula | 90 | ~300 | 16 | 1 | ~500 (1200) | 40 (800) | ЯлтаМорскоеКоктебель | 404050 | ммв |
| Anas clypeata | 2 | – | – | 2 | 270 | 40 | Коктебель | 50 | в |
| Netta rufina | 59 | – | – | – | 10 | – | БалаклаваКоктебель | 2198 | мм |
| Aythya ferina | 20 | – | 11 | – | ~200 | 6 | ЯлтаСудакКоктебель | 46095 | ббв |
| Mergus serrator | 13 | – | 6 | – | – | – | СудакБухта ЛисьяКоктебель | 2136 | вмм |
| Gavia arctica | 200(430) | 200 | 30 | 2 | – | – | ПартенитСудак | ~2002 | мв |
| Phalacrocorax carbo | ~350(2000) | – | ~200 | 1 | – | 14 | СевастопольСудакКоктебель | >10002229 | мвв |
| Nycticorax nycticorax | 5 | 5 | 11 | 2 | – | 7 | Мыс АйяКоктебель | 14 | бв |
| Ardeola ralloides | 12 | 1 | 15 | – | 5 | 5 | СудакБухта ЛисьяКоктебель | 61310 | ббв |
| Egretta garzetta | 10 | 41 | 5 | 2 | 27 | 10 | ПартенитКоктебель | 213 | бв |
| Casmerodius albus | 8 | 2 | – | – | 16 | 2 | Коктебель | 3 | в |
| Ardea cinerea | 9 | 8 | 1 | 1 | 7 | 17(156) | СевастопольКоктебель | 1142 | бв |
| Ardea purpurea | 3 | 18 | – | – | 3 | 12 | СудакКоктебель | 1616 | вв |
| Podiceps grisegena | 21 | 5 | 5 | – | 8 | 2 | Мыс АйяСудакОрджоникидзе | 262 | ммм |
| Podiceps cristatus | ~600(2000) | 8(920) | 285(640) | 105 | – | 1 | СевастопольЯлтаОрджоникидзе | 470750~1000 | ммм |
Таблица 2 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Podiceps nigricollis | 20 | 25 | 10 | 19 | 30 | 3 | СевастопольКоктебель | 744 | мм |
| Grus grus | 12 | – | – | – | 18(200) | – | Бухта ЛисьяКоктебель | 130 | оо |
| Fulica atra | 100(3000) | – | 1 | – | 570 | 102 | ПартенитКоктебельОрджоникидзе | 340020 | мвм |
| Himantopus himantopus | 10 | 16 | 3 | 25 | 120 | 25 | АлуштаКоктебель | 2027 | бб |
| Tringa ochropus | 3 | – | 1 | 1 | 2 | 3 | СевастопольЯлтаПриветное | 1856 | ввв |
| Tringa glareola | 7 | – | – | – | 140 | 23 | СудакКоктебель | 1117 | вв |
| Actitis hypoleucos | 19 | 13 | 20 | 2 | 7 | 8 | СудакОрджоникидзе | 84 | вм |
| Calidris minuta | – | 1 | – | – | ~50(200) | 10 | СевастопольПриветное | 21 | вб |
| Philomachus pugnax | 3 | 3 | – | 1 | ~200 | 12 | СевастопольЯлта | 72 | вб |
| Larus canus | 120 | 15 | – | 9 | – | – | БалаклаваЯлта | 115 | бм |
| Larus fuscus | 6 | – | 15 | 1 | 2 | – | СевастопольЯлта | ОбМн | м,бм |
| Larus melanocephalus | 44(200) | 400 | 5 | 10 | – | 2 | СевастопольФеодосия | Мн20 | м,бм |
| Larus ridibundus | ~300(800) | 610 | ~300 | 460 | 50 | ~200 | КоктебельФеодосия | 20100 | мм |
| Larus genei | 54 | 35 | – | 4 | – | 52 | Ялта | 9 | м |
| Larus minutus | 5 | 6 | – | – | 30 | – | ЯлтаКоктебель | 11 | мм |
| Thalasseus sandvicensis | 190 | 100 | 10 | 5 | – | – | Мыс АйяКоктебель | 1760 | мм |
| Chlidonias leucopterus | 1 | ~80 | – | 1 | 40 | 22 | Ялта | 3 | м |
| Alcedo atthis | 2 | – | 1 | 4 | – | 1 | МорскоеКоктебельОрджоникидзе | 211 | бвб |
| Motacilla flava | 20 | – | 1 | 1 | 25 | 85 | СевастопольКоктебель | Мн12 | оо |
| Motacilla feldegg | 15 | 2 | – | 1 | 5 | 4 | ЯлтаКоктебель | 820 | вв |
| Motacilla alba | 25 | Об | 2 | 7 | 17 | 10 | ПартенитБухта Лисья | 420 | бб |
| Acrocephalus arundinaceus | – | – | – | – | Об | Об | ПриветноеКоктебель | 1Об | вв |
| Schoeniclus schoeniclus | 3 | – | – | – | Об | Об | КоктебельОрджоникидзе | Об1 | вв |
Примечание к таблице. Ключевые участки – нумерация как в тексте и на рис. 1: М – открытая морская акватория, Б – закрытая бухта, В – внутренний водоем. Численность: приводится максимальное значение (для некоторых видов дополнительно в скобках – при кратковременном резком возрастании в отдельные дни); Об, Мн – обычный, многочисленный. Биотоп: м – морская акватория, б – морской берег, в – водоемы и водотоки, о – открытые прибрежные биотопы.
Philomachus pugnax, озерная чайка. Здесь же обычны виды тростниковых сообществ – дроздовидная камышевка – Acrocephalus arundinaceus, камышовая овсянка – Schoeniclus schoeniclus, возможно соловьиный сверчок – Locustella luscinioides. На прилегающих к берегам водоемов открытых участках суши регистрировали кратковременные скопления гусей белолобого – Anser albifrons и серого – Anser anser, а также серого журавля – Grus grus (табл. 2).
Регулярный характер имеет присутствие в околоводных биотопах некоторых видов из других экогрупп, главным образом кампофильной и склерофильной. Так, на морском берегу отмечали перепела – Coturnix coturnix (до 3 ос./км), авдотку – Burhinus oedicnemus, козодоя – Caprimulgus europaeus (до 2 ос./км), удода – Upupa epops (до 2–3 ос./км, локально до 16 особей), трясогузок желтую – Motacilla flava и черноголовую – Motacilla feldegg (табл. 2), каменку – Oenanthe oenanthe (локально до 9 особей).
Топическая и трофическая связь с суходольными местообитаниями установлена для 97 видов из разных экогрупп, в том числе некоторых лимнофилов (волчок – Ixobrychus minutus, кваква – Nycticorax nycticorax, цапли серая и рыжая – Ardea purpurea, варакушка – Luscinia svecica, сверчки, камышевки, камышовая овсянка). Результаты маршрутных учетов некоторых обычных и регулярно встречающихся видов приводятся в таблице 3..
Таблица 3
Результаты маршрутных учетов некоторых обычных видов суходольных биотопов
| Вид | N, ос./км | В скоплениях |
| Columba palumbus | 9 | ~4000 |
| Upupa epops | 2 | 30 |
| Alauda arvensis | 29 | ~600 |
| Motacilla alba | 6 | 25 |
| Lanius minor | 10 | 14 |
| Sturnus vulgaris | ~30 | ~1000 |
| Corvus frugilegus | 40 | ~1600 |
| Phylloscopus trochilus | 20* | – |
| Phylloscopus collybita | 7* | – |
| Saxicola rubetra | 3 | 18 |
| Oenanthe oenanthe | 20 | 30 |
| Muscicapa striata | 3 | 6 |
| Turdus pilaris | 59 | ~100 |
| Fringilla coelebs | 19 | 50 |
Примечание к таблице. * – учет по поющим самцам.
Доминирующее положение занимает здесь дендрофильная экогруппа (49 видов, 50,5 %), что обусловлено широким распространением в регионе и разнообразием типов древесно-кустарниковых сообществ. Количественную основу образуют вяхирь – Columba palumbus, лесной конек – Anthus trivialis, рябинник – Turdus pilaris, певчий дрозд – Turdus philomelos, горихвостка-лысушка – Phoenicurus phoenicurus, зарянка – Erithacus rubecula, мухоловки серая – Muscicapa striata и белошейка – Ficedula albicollis, пеночки весничка – Phylloscopus trochilus и теньковка – Phylloscopus collybita, чернолобый сорокопут – Lanius minor, иволга – Oriolus oriolus, скворец – Sturnus vulgaris, зяблик – Fringilla coelebs.
Представители относительно небольших экогрупп кампофилов и склерофилов составляют значительную часть миграционного комплекса открытых местообитаний: его основу образуют перепел, полевой лунь – Circus cyaneus, удод, полевой жаворонок – Alauda arvensis, трясогузки желтая и черноголовая, горихвостка-чернушка – Phoenicurus ochruros, чеканы луговой – Saxicola rubetra и западный черноголовый – Saxicola rubicola, каменка, грач – Corvus frugilegus.
Внутрисезонная динамика весенней миграции
Общая продолжительность весеннемиграционного периода составляет около 4 месяцев – приблизительно с середины (возможно с 1 декады) февраля до начала, иногда до третьей декады июня.
В таблице 4 конкретизированы основные временны́е параметры весеннего пролета некоторых регулярно мигрирующих видов, для которых была возможной точная фиксация его сроков (появление при отсутствии на зимовке, или хорошо заметное начало подъема численности в конце зимы и весной).
Таблица 4
Даты начала и продолжительность весеннего пролета некоторых обычных и регулярно мигрирующих птиц
| Вид | N наблюдений | Даты начала пролета | Продолжительность (max), сут. | |
| Средняя | Lim | |||
| 1 | 2 | 3 | 4 | 5 |
| Coturnix coturnix | 14 | 06.04±3,5 | 11.03–26.04 | 78 |
| Anas querquedula | 27 | 16.03±1,5 | 28.02–29.03 | ~80 |
| Nycticorax nycticorax | 25 | 31.03±1,7 | 03.03–09.04 | 86 |
| Ardeola ralloides | 23 | 26.04±1,3 | 13.04–04.05 | 37 |
| Egretta garzetta | 16 | 12.04±1,6 | 30.03–20.04 | 52 |
| Ardea cinerea | 25 | 14.03±1,9 | 23.02–31.03 | 78 |
| Ardea purpurea | 20 | 04.04±1,8 | 20.03–15.04 | 49 |
| Falco subbuteo | 15 | 30.04±3,3 | 05.04–15.05 | ~48 |
| Grus grus | 39 | 09.03±1,4 | 20.02–28.03 | 60 |
| Actitis hypoleucos | 27 | 11.04±1,9 | 10.03–20.04 | 54 |
| Larus fuscus | 16 | 31.03±2,5 | 09.03–12.04 | 71 |
| Larus melanocephalus | 32 | 14.03±2,0 | 21.02–01.04 | 70 |
| Larus genei | 26 | 16.03±1,7 | 25.02–01.04 | 54 |
| Thalasseus sandvicensis | 24 | 30.03±3,2 | 24.02–20.04 | 67 |
| Sterna hirundo | 13 | 01.05±2,7 | 16.04–14.05 | 47 |
| Streptopelia turtur | 32 | 25.04±1,0 | 14.04–07.05 | 27 |
| Cuculus canorus | 33 | 19.04±1,5 | 02.04–05.05 | ~38 |
| Caprimulgus europaeus | 11 | 23.04±2,2 | 11.04–05.05 | 56 |
| Apus apus | 25 | 15.04±1,2 | 01.04–24.04 | 70 |
| Apus melba | 36 | 10.04±1,0 | 28.03–20.04 | 57 |
| Alcedo atthis | 32 | 11.04±1,1 | 28.03–20.04 | 62 |
| Merops apiaster | 44 | 06.05±1,0 | 21.04–21.05 | 50 |
| Upupa epops | 43 | 25.03±1,1 | 10.03–07.04 | 63 |
| Jynx torquilla | 24 | 12.04±1,0 | 31.03–20.04 | 37 |
| Riparia riparia | 18 | 27.04±2,6 | 07.04–12.05 | 48 |
| Hirundo rustica | 34 | 07.04±1,0 | 25.03–19.04 | 54 |
| Delichon urbicum | 29 | 07.04±1,6 | 25.03–28.04 | 50 |
| Anthus trivialis | 17 | 06.04±1,8 | 19.03–17.04 | ~21 |
| Motacilla flava | 22 | 14.04±2,1 | 30.03–28.04 | 48 |
| Motacilla feldegg | 15 | 08.04±2,1 | 24.03–22.04 | 43 |
| Motacilla alba | 39 | 10.03±1,1 | 27.02–20.03 | 63 |
| Turdus philomelos | 20 | 20.03±1,8 | 03.03–30.03 | 60 |
| Phoenicurus phoenicurus | 20 | 30.03±1,2 | 18.03–05.04 | ≥35 |
| Phoenicurus ochruros | 26 | 17.03±1,5 | 03.03–05.04 | 40 |
| Luscinia svecica | 12 | 03.04±1,9 | 24.03–12.04 | 29 |
| Saxicola rubetra | 20 | 17.04±2,6 | 19.03–28.04 | 32 |
| Saxicola rubicola | 25 | 17.03±1,8 | 04.03–29.03 | 22 |
| Oenanthe oenanthe | 34 | 31.03±1,0 | 20.03–17.04 | 61 |
| Muscicapa striata | 21 | 01.05±1,2 | 18.04–10.05 | 42 |
Таблица 4 (продолжение)
| 1 | 2 | 3 | 4 | 5 |
| Ficedula hypoleuca | 15 | 16.04±1,7 | 04.04–26.04 | 28 |
| Ficedula albicollis | 30 | 16.04±1,7 | 31.03–03.05 | 30 |
| Ficedula parva | 24 | 02.05±1,0 | 22.04–09.05 | 20 |
| Acrocephalus arundinaceus | 19 | 02.05±1,0 | 26.04–09.05 | 45 |
| Phylloscopus trochilus | 45 | 15.04±1,0 | 03.04–28.04 | 70 |
| Phylloscopus collybita | 43 | 24.03±1,2 | 06.03–09.04 | 58 |
| Phylloscopus sibilatrix | 18 | 14.04±2,0 | 01.04–28.04 | 32 |
| Lanius minor | 36 | 03.05±0,7 | 22.04–10.05 | 35 |
| Oriolus oriolus | 42 | 05.05±1,1 | 17.04–18.05 | 42 |
| Corvus frugilegus | 35 | 01.03±1,2 | 17.02–14.03 | 67 |
| Sturnus roseus | 27 | 21.05±1,3 | 08.05–31.05 | 19 |
Анализ сроков и продолжительности периодов миграции главным образом обычных и регулярно пролетающих видов позволяет дать общую характеристику внутрисезонной последовательности весеннемиграционного процесса.
Вторая половина февраля. Признаки пролета некоторых видов становятся заметными в середине этого месяца, на фоне еще существующих полночленных зимних орнитокомплексов. Во второй декаде активизируются вдольбереговые перемещения лимнофильных птиц, на морской акватории растет численность и формируются миграционные скопления большого баклана и чомги, к концу месяца – чернозобой гагары, чаек черноголовой и озерной, у берегов и на водоемах – красноносого нырка – Netta rufina. В некоторые годы во второй половине февраля регистрировали начало пролета чирка-трескунка, чибиса – Vanellus vanellus (22.02.1990[1]), бекаса – Gallinago gallinago (17.02.2006), турухтана (22.02.1978), морского голубка – Larus genei, над территорией и береговой зоной – серого журавля и галки – Corvus monedula (18.02.2014). В суходольных биотопах, вследствие подлета мигрантов, растет численность белой трясогузки – Motacilla alba, рябинника и грача. К концу февраля количество мигрирующих видов достигает 35 (рис. 2).
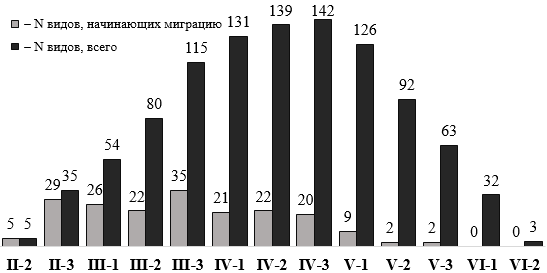
Рис. 2. Подекадное распределение количества видов, начинающих миграцию (по датам первых регистраций) и общего количества мигрирующих видов (римская цифра – месяц, арабская – декада)
Март. Начинается интенсивный рост видового разнообразия мигрантов, со второй декады марта количество видов возрастает более, чем вдвое (рис. 2). Всего в этом месяце мигрирует не менее 116 видов.
На водоемах становятся обычными кряква и красноголовый нырок; заметно увеличивается численность пеганки, свиязи – Anas penelope, чирка-свистунка – Anas crecca, шилохвости – Anas acuta, широконоски, цапель большой белой – Casmerodius albus и серой. На море обычны чернозобая гагара, черношейная поганка – Podiceps nigricollis, вышеуказанные виды чаек; достигает максимума численность большого баклана, чомги, озерной чайки, в отдельные годы при ухудшении погоды наблюдаются значительные скопления лысухи (табл. 2). В начале месяца начинается активная миграция чирка-трескунка, у морских берегов – клуши – Larus fuscus, морского голубка и пестроносой крачки; на вторую декаду приходятся самые ранние регистрации рыжей цапли, каравайки – Plegadis falcinellus (13.03.2002) и травника – Tringa totanus (12.03.2011), на третью – волчка (21.03.1979), малой белой цапли – Egretta garzetta, авдотки (23.03.1965) (Костин Ю., 1983), ходулочника, перевозчика – Actitis hypoleucos, зимородка – Alcedo atthis; за редким исключением, в этой декаде начинается миграция кваквы.
В суходольных биотопах увеличивается, по сравнению с зимней, численность полевого луня, вяхиря, полевого жаворонка, горихвостки-чернушки, зарянки, грача, скворца, зяблика. В первой декаде регулярной становится миграция белой трясогузки, появляются удод, западный черноголовый чекан, в отдельные годы – пеночка-теньковка; во второй декаде – горихвостка-лысушка и луговой чекан, редко – каменка; в третьей – варакушка (24.03.1985), редко – вертишейка – Jynx torquilla, желтая трясогузка, мухоловка-белошейка. В некоторые годы в конце месяца появляются стрижи белобрюхий – Apus melba и черный – Apus apus, ласточки деревенская – Hirundo rustica и воронок – Delichon urbicum. Над территорией и береговой зоной в первой половине марта идет пролет белолобого гуся, на середину и вторую его половину приходится активный пролет серого журавля.
Апрель. Рост видового разнообразия мигрантов в этом месяце замедляется, а к третьей декаде их количество достигает максимума (рис. 2). Общее число пролетающих в продолжение апреля составляет не менее 190 видов.
К лимнофилам в первой декаде апреля добавляются малый погоныш – Porzana parva (10.04.1978), соловьиный сверчок (05.04.2012), во второй декаде – желтая цапля – Ardeola ralloides и речная крачка – Sterna hirundo (16.04.2005), в третьей – белокрылая крачка – Chlidonias leucopterus (25.04.2000), дроздовидная камышевка, иногда кулик-воробей (27.04.2008) и краснозобик – Calidris ferruginea (30.04.1978). Обычными становятся малая белая цапля, каравайка, фифи, перевозчик и зимородок, достигает максимума численность пестроносой крачки. Во второй половине апреля падает численность большого баклана, чомги, кряквы, красноголового нырка, заканчивается пролет сизой чайки – Larus canus (самая поздняя дата 22.04.1996).
В суходольных биотопах на первую декаду месяца приходятся первые регистрации чеглока – Falco subbuteo (05.04.1992), кукушки – Cuculus canorus, береговушки – Riparia riparia, черноголовой трясогузки (01.04.2001), мухоловки-пеструшки – Ficedula hypoleuca (04.04.2011), пеночки-веснички, садовой овсянки – Emberiza hortulana (01.04.1992); регулярность приобретает миграция белобрюхого и черного стрижей, ласточек деревенской и воронка, желтой трясогузки и мухоловки-белошейки. Во второй декаде появляются кобчик – Falco vespertinus (15.04.1985), горлица – Streptopelia turtur (16.04.1995), козодой (11.04.1989), серая мухоловка, серая славка – Sylvia communis (18.04.2003), иволга, обычным становится перепел. В третьей декаде начинается пролет сизоворонки – Coracias garrulus (25.04.1988), золотистой щурки – Merops apiaster, малой мухоловки – Ficedula parva, садовой славки – Sylvia borin (29.04.2003), чернолобого сорокопута. На вторую и третью декады этого месяца приходятся последние встречи полевого луня (последняя дата – 16.04.1996), горихвостки-чернушки (27.04.2007) и галки (14.04.2000).
Май. С первой декады происходит обеднение видового состава. Общее количество видов составляет в этом месяце не менее 129, а к его концу падает, по сравнению с позднеапрельским, более чем вдвое (рис. 2). Более 90 видов заканчивают пролет.
В околоводных биотопах только на май приходятся редкие наблюдения 6 лимнофильных видов: малой крачки – Sterna albifrons, белохвостого песочника – Calidris temminckii, луговой тиркушки – Glareola pratincola и других. Обычными остаются чирок-трескунок, кваква, цапли серая и рыжая, каравайка, турухтан, пестроносая крачка, возрастает численность волчка, цапель желтой и малой белой, ходулочника, фифи, перевозчика, кулика-воробья, краснозобика, крачек речной и белокрылой. В первой декаде месяца регистрировались последние свиязи (последняя дата – 04.05.1997) и шилохвости (01.05.1996), в третьей – большая белая цапля (25.05.1994).
В суходольных биотопах исключительно в мае отмечены 7 видов: появляются, в частности, обыкновенный соловей – Luscinia luscinia (06.05.1997), речной сверчок – Locustella fluviatilis (10.05.1996), розовый скворец – Pastor roseus, черноголовая овсянка – Granativora melanocephala (04.05.2001). Пика миграционной активности достигают чеглок, кобчик, коростель – Crex crex, луговой чекан, серая и малая мухоловки, дроздовидная камышевка, пеночка-весничка, чернолобый сорокопут, иволга; до середины месяца обычен перепел. Над сушей продолжается массовый пролет стрижей, золотистой щурки и ласточек.
Июнь. Регулярная вдольбереговая миграция лимнофильных птиц заканчивается. В первой половине месяца относительно обычной остается пестроносая крачка, резко снижается численность чернозобой гагары, серой цапли, перевозчика, зимородка. В отдельные годы до третьей декады регистрируются возможно уже летнекочующие кваква, цапли желтая, малая белая и рыжая.
В суходольных местообитаниях до первой декады месяца еще относительно регулярно встречается иволга; заканчивается миграция белобрюхого и черного стрижей, золотистой щурки, ласточек, зафиксированы самые поздние даты встреч сизоворонки (последняя дата – 08.06.1983), серой мухоловки (01.06.2012), соловьиного сверчка (02.06.1999), дроздовидной камышевки (27.06.1991), пеночки-веснички (14.06.1996), чернолобого сорокопута (10.06.1999).
Направление и интенсивность миграции
Согласно визуальным наблюдениям, значительная часть мигрирующих птиц на юге Крыма пролетает в восточном и северо-восточном направлениях, что соответствует ориентации береговой линии Черного моря в изучаемом регионе. Преимущественно этого направления придерживается большинство лимнофилов (чернозобая гагара, поганки, большой баклан, аистообразные, гусеобразные, кулики и чайки); чаще отклоняются от него виды, трофически не связанные с морскими кормовыми стациями – серый журавль, золотистая щурка, стрижи, ласточки, грач. Соотношения направлений пролета некоторых регулярно мигрирующих видов показаны для восточной части региона, где береговая линия ориентирована в направлении с юго-запада на северо-восток (рис. 3). Таким образом, для значительной части мигрантов береговая зона представляет собой экологический барьер, а для некоторых лимнофилов – также комплекс кормовых биотопов, выполняя функцию экологического коридора.
Периоды интенсивной миграции часто совпадают по времени с похолоданиями и туманом и могут продолжаться до нескольких дней. Длительность таких «волн» достигает 3–4 дней у большого баклана и золотистой щурки, 5–6 дней у ласточек деревенской и воронка, 7 дней у пестроносой крачки. Установлены следующие максимальные значения интенсивности вдольбереговой миграции для некоторых регулярно мигрирующих видов (особей в час): чирка-трескунка – 70, чернозобой гагары – около 100, большого баклана – 238, серого журавля – 453, черноголовой чайки – 110, озерной чайки – 231, сизой чайки – около 800, пестроносой крачки – около 200, полевого жаворонка – 100, грача – 914, ласточек деревенской и воронка – несколько сотен.
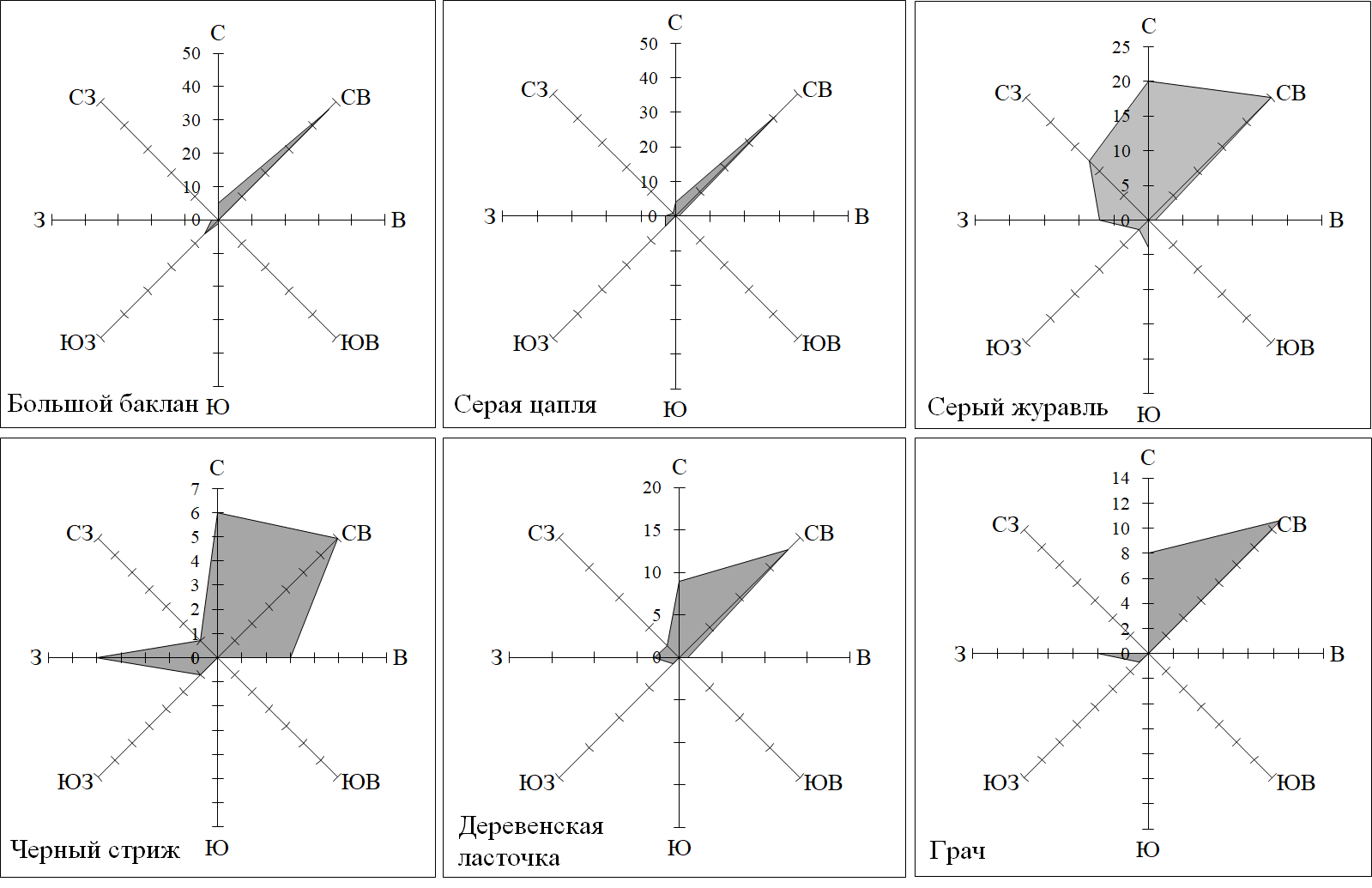
Рис. 3. Соотношение направлений пролета некоторых фоновых мигрирующих видов птиц по наблюдениям в восточной части южного Крыма
Многолетние изменения в составе весеннемиграционных орнитокомплексов
В последние десятилетия 20 века и первые десятилетия 21 века авифауна Крыма претерпела существенные изменения, выразившиеся в появлении новых и росте численности некоторых ранее обитавших здесь видов. Эти тенденции отразились на видовом составе и численности весеннемигрирующих птиц в южных районах полуострова.
Изменения в составе лимнофильного миграционного комплекса. Обводнение Северного Крыма в 60–70-х годах 20 века, как результат ввода в эксплуатацию Северо-Крымского канала, привело к значительному обогащению лимнофильного комплекса Крымского полуострова. Не менее 20 новых для региона видов появилось на гнездовании (Костин Ю., 1983; Бузун, Гринченко, 1991; Гармаш, 1998; Гринченко, 2004, 2009 и др.), для некоторых установлено возрастание численности в миграционные периоды. Эти изменения можно рассматривать, как вероятную причину появления или роста численности некоторых видов на юге Крыма во время весенней миграции (табл. 5).
Изменения в составе миграционного комплекса суходольных биотопов. Расширение границ ареалов некоторых «сухопутных» видов птиц во второй половине 20 века и первых десятилетиях 21 века стало причиной появления на гнездовании в Крыму не менее 15 новых видов (Костин Ю., 1983; Абакумов и др.,1995; Бескаравайный и др., 2001; Кинда и др., 2003; Петрович и др., 2015 и др.). Для некоторых гнездящихся в Крыму, например, черноголовой овсянки (Кинда, Гринченко, 2002), отмечен существенный рост гнездовой численности. В последние десятилетия (приблизительно с начала 1980-х годов) не менее 7 из этих видов стали встречаться, или увеличили свою численность во время весеннего пролета на юге полуострова.
Рыжепоясничная ласточка. До начала 1970-х годов весной на юге Крыма наблюдалась дважды – в 1957 и 1972 годах (Костин Ю., 1983). Остается редкой и в настоящее время, но регистрации весеннепролетных птиц участились, что можно объяснить расширением ареала в Европе и появлением на гнездовании в Крыму в конце 20 века (Дулицкий, 2000; Кинда и др., 2003; Прокопенко и др., 2012). С 2002 до 2021 года во время весеннего пролета в южных районах полуострова встречена нами 6 раз.
Таблица 5
Изменение статуса или численности в Крыму некоторых лимнофильных видов и первые регистрации на весеннем пролете в южных районах
| Вид | Изменение статуса или численности | Год (источник информации) | Первые регистрации на весеннем пролете на юге Крыма, год |
| Netta rufina | Появление на гнездовании | 1974 (Костин Ю., 1983) | 1982 |
| Aythya ferina | То же | 1973–1974 (Костин Ю., 1983) | 1978 |
| Phalacrocorax pygmeus | То же | Конец 1970-х гг. (Бузун, Гринченко, 1991) | 2006 |
| Botaurus stellaris | То же | 1973 (Костин Ю., 1983) | 1987 |
| Casmerodius albus | То же | 1970 (Костин Ю., 1983) | Регулярно с начала 1980-х гг. |
| Plegadis falcinellus | То же | 1967 (Костин Ю., 1983) | Регулярно с 1982 |
| Platalea leucorodia | То же | 1976 (Костин Ю., 1983) | 1997 |
| Himantopus himantopus | Рост гнездовой численности | Конец 1970 – начало 1980-х гг. (Сиохин и др., 1988; Кинда, 1998) | 1965 (Костин Ю., 1983); регулярно с середины 1980-х гг. |
| Vanellochettusia leucura | Появление на гнездовании | 1997 (Гармаш, 1998) | 1997 |
| Numenius arquata | То же | 1987 (Андрющенко и др., 1991) | 1991 |
| Tringa stagnatiis | Рост численности на пролете | «С приходом… днепровской воды» (Костин Ю., 1983) | 2007 |
| Calidris ferruginea | То же | «С обводнением северного Крыма» (Костин Ю., 19983) | 1976 |
| Larus melanocephalus | Появление на гнездовании | 1973 (Костин Ю., 1983) | 1977 |
| Sterna hirundo | Рост гнездовой численности | Конец 1980 – начало 1990-х гг. (Сиохин и др., 2000) | 1992 |
| Chlidonias hybrida | Появление на гнездовании | 1989 (Кинда, Потапов, 1998) | 1994 |
| Remiz pendulinus | То же | 1992 (Кинда и др., 2003) | Начало 2000-х гг. (?) |
Горихвостка-чернушка. Расселение вида на территории европейской части России идет с конца 1960-х годов (Мосолова, Табачишин, 2016), в Крыму отмечается на гнездовании с 2001 года (Бескаравайный и др., 2001). По данным Ю. В. Костина (1983), в 1960–1970-х годах была редкой на пролете в Крыму и наблюдалась только в равнинной его части. С начала 1980-х годов на юге полуострова встречи весеннепролетных птиц участились, а с середины 1990-х годов одиночки и группы до 8–10 особей регистрируются ежегодно.
Западный черноголовый чекан. Во второй половине 20 века встречался на весеннем пролете почти исключительно в равнинной части Крыма и был охарактеризован, как редкий вид (Костин Ю., 1983). В последние десятилетия происходит расширение его ареала на Украине и в России (Баник, 2006), первая достоверная регистрация на гнездовании в Крыму датируется 1989 годом (Абакумов и др., 1995). На юге полуострова с 1981 года преимущественно одиночные птицы стали встречаться на весеннем пролете, а с начала 2000-х годов – регулярно, группами до 5 (в отдельных случаях до 15) особей.
Каменка-плясунья. Впервые на гнездовании в Крыму (Присивашье) обнаружена в 1973 году (Костин Ю., 1983), а в середине 1980-х – начале 2000-х годов стала обычной в ряде районов равнинной и предгорной частей Крыма (Кинда и др., 2003). С 2003 года одиночные особи отмечаются во время весеннего пролета в южных районах полуострова.
Красноголовый сорокопут. Две встречи этого вида в равнинном Крыму были известны в 1950-х годах (Кинда и др., 2003), первая – в 1952 году (Аверин, Вшивков, 1955). С конца 1980‑х годов наблюдения весеннепролетных птиц (большинство – в равнинном Крыму) участились, а во второй половине 1990-х годов получены данные, свидетельствующие о гнездовании (Кинда и др., 2003). С 1980 до 2002 года вид регистрировался на юге Крыма в период весенней миграции 8 раз.
Черногрудый воробей. Впервые в Крыму (Керченский полуостров) отмечен в 2013 году, гнездование установлено в 2015 году (Петрович и др., 2015). Первое и пока единственное наблюдение в горной части Крыма (Севастополь) сделано во время весеннего пролета 24.04.2022 (Бескаравайный, Гирагосов, 2023).
Черноголовая овсянка. Начало роста гнездовой численности на Керченском полуострове зафиксировано в первой половине 1970-х годов; в последующие годы стала встречаться в других районах равнинного Крыма (Кинда, Гринченко, 2002) и предгорьях. В восточной части южного Крыма одиночки и группы до 3 особей не ежегодно наблюдаются во время весенней миграции с 1981 года.
ЗАКЛЮЧЕНИЕ
Весеннепролетные птицы составляют наиболее разнообразную и многочисленную часть авифауны южного Крыма (не менее 75 % видового состава). Высокое разнообразие весенних мигрантов обусловлено расположением региона на одном из основных миграционных путей Евразии и достаточно широким диапазоном присутствующих здесь кормовых биотопов. Основу миграционного компонента авифауны образуют виды лимнофильной и дендрофильной экологических групп.
Продолжительность весеннего миграционного периода составляет около 4 месяцев (середина февраля – начало июня), пик миграционной активности приходится на вторую половину апреля. Преобладающее направление миграции значительного числа видов – восточное и северо-восточное, что соответствует ориентации береговой линии, играющей роль экологического барьера и одновременно экологического коридора. Чаще отклоняются от этого направления виды, трофически не связанные с морскими кормовыми стациями.
Обогащение гнездовой авифауны Крыма и увеличение численности на полуострове некоторых видов во второй половине 20 – начале 21 века стали вероятной причиной появления и (или) роста численности на весеннем пролете в южных районах не менее 16 лимнофильных видов и не менее 7, населяющих суходольные местообитания.
Работа подготовлена по теме госзадания КНС–ПЗ РАН – филиал ФИЦ ИнБЮМ «Изучение биотических и абиотических компонентов наземных экосистем, особенности их структурно-временной организации в различных климатических условиях среды», № 124030100098-0.
Андрющенко Ю. А., Гринченко А. Б., Винтер С. В. О численности журавля-красавки, дрофы, стрепета и большого кроншнепа на Керченском полуострове // Материалы Всесоюзного научно-методического совещания зоологов педвузов. Ч. 2. – Махачкала, 1991. – С. 5–7.
Абакумов В. Г., Бескаравайный М. М., Кинда В. В., Костин С. Ю., Стадниченко И. С., Цвелых А. Н. Современное состояние черноголового чекана (Saxicola torquata) в Крыму // Русский орнитологический журнал. – 1995. – Т. 4, вып. 3/4. – С. 143–144.
Аверин Ю. В., Вшивков Ф. Н. Залет красноголового сорокопута (Lanius senator senator L.) в Крым // Труды Крымского филиала АН СССР. –1955. – Т. 9, вып. 3. – С. 155.
Баник М. В. Расширение ареала черноголового чекана на Украине и в соседних регионах: этапы экспансии и ее возможные причины // Орнитология. – 2006. – Вып. 33. – С. 1–22.
Белик В. П. Птицы степного Придонья: Формирование фауны, ее антропогенная трансформация и вопросы охраны. – Ростов-на-Дону: Изд-во РГПУ, 2000. – 376 с.
Бескаравайный М. М. Птицы морских берегов Южного Крыма. – Симферополь: Сонат, 2008. – 160 с.
Бескаравайный М. М., Гирагосов В. Е. Птицы Севастополя. – М.: Товарищество научных изданий КМК, 2023. – 180 с.
Бескаравайный М. М., Костин С. Ю., Аппак Б. А. Пролет серого журавля на юге Крыма // Журавли Украины. – Мелитополь, 1999. – С. 54–57.
Бескаравайный М. М., Костин С. Ю., Спиваков О. Б., Розенберг О. Г. Новые данные о некоторых редких и малоизученных птицах Крыма // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 2001. – Вып. 4. – С. 123–124.
Боков В. А., Будашкин Ю. И., Костенко Н. С. Климат // Природа Карадага. – Киев: Наукова Думка, 1989. – С. 29–40.
Бузун В. А., Гринченко А. Б. О гнездящихся птицах Ойсульских плавней, малом баклане, огаре и пеганке в Крыму // Редкие птицы Причерноморья. – Киев – Одесса: Лыбидь, 1991. – С. 182–193.
Гармаш Б. А. Гнездование белохвостой пигалицы (Vanellochettusia leucura L.) в Крыму // Вестник зоологии. – 1998. – № 4. – С. 120.
Гирагосов В. Е., Бескаравайный М. М. Сезонная динамика гидрофильного орнитокомплекса бухты Круглая (Севастополь) // Морской биологический журнал. – 2016. – Т. 1, № 4. – С. 12–21.
Гринченко А. Б. История и динамика колониальных поселений аистообразных птиц в восточных районах Крыма в связи с антропогенной сукцессией Восточного Сиваша и Присивашья // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 2004. – Вып. 7. – С. 61–81.
Гринченко А. Б. Изменения гнездовой фауны гусеобразных Крыма, связанные с антропогенной сукцессией Сиваша и степной части полуострова // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 2009. – Вып. 12. – С. 59–69.
Дулицкий А. И. Рыжепоясничная ласточка (Cecropis daurica L.) в Крыму: Красная книга Крыма 2000 // Природа. – 2000. – № 2. – С. 13.
Кинда В. В. Современное состояние гнездящихся куликов семейства ржанковых в Крыму и Присивашье // Гнездящиеся кулики восточной Европы – 2000. Том 1. – М., 1998. – С. 115–120.
Кинда В. В., Гринченко А. Б. Черноголовая овсянка в Крыму: современный ареал, численность и черты биологии // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 2002. – Вып. 5. – С. 7–13.
Кинда В. В., Бескаравайный М. М., Дядичева Е. А., Костин С. Ю., Попенко В. М. Ревизия редких, малоизученных и залетных видов воробьинообразных (Passeriformes) птиц в Крыму // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 2003. – Вып. 6. – С. 25–58.
Кинда В. В., Потапов О. В. Белощекая крачка в Украине: история расселения, численность и размещение // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 1998. – Вып. 1. – С. 37–51.
Климат и опасные гидрометеорологические явления Крыма / [Pед. К. Т. Логвинова, М. Б. Барабаш]. – Л.: Гидрометеоиздат, 1982. – 319 с.
Клюкин А. А., Костенко Н. С. Курортологические ресурсы // Курорт Коктебель. – Киев: Наукова думка, 1997. – С. 69–75.
Коблик Е. А., Архипов В. Ю. Фауна птиц стран Северной Европы в границах бывшего СССР. Списки видов // Зоологические исследования. 2014.№ 14. – М.: Товарищество научных изданий КМК. –171 с.
Костин С. Ю. Журавль-красавка на Южном берегу Крыма // Журавли Украины. – Мелитополь, 1999. – С. 95–96.
Костин С. Ю. Черный аист (Ciconia nigra) в Крыму // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 2004. – Вып. 7. – С. 208–214.
Костин Ю. В. Птицы Крыма. – М.: Наука, 1983. – 240 с.
Мензбир М. А. Миграции птиц с зоогеографической точки зрения. – М.-Л.: Биомедгиз, 1934. – 112 с.
Мосолова Е. Ю., Табачишин В. Г. Динамика и темпы расселения горихвостки-чернушки (Phoenicurus ochruros) в европейской части России // Байкальский зоологический журнал. – 2016. – № 1(18). – С. 33–37.
Никольский А. М. Позвоночные животные Крыма // Записки императорской Академии наук: Приложение № 4 к 68-му тому. – СПб, 1891/1892. – 484 с.
Павлова Н. Н. Физическая география Крыма. – Изд-во Ленинградского университета, 1964. – 106 с.
Пекло А. М. Каталог коллекций зоологического музея ННПМ НАН Украины. Птицы. Вып. 1. Неворобьиные Non-Passeriformes (Пингвинообразные Sphenisciformes – Журавлеобразные Gruiformes). – Киев: Зоомузей ННПМ НАН Украины, 1997. – 156 с.
Петрович З. О., Грінченко О. Б., Щеголев І. В. Гніздування чорногрудого горобця (Passer hispaniolensis) на Кримському півострові // Птахи Азово-Чорноморського регіону. Матеріали 34 наради Азово-Чорноморської орнітологічної робочої групи 16–18 жовтня 2015 р., м. Одеса. – Одеса, 2015. – С. 64–67.
Прокопенко С. П., Бескаравайный М. М., Кучеренко В. Н. О гнездовании рыжепоясничной ласточки (Hirundo daurica) в Крыму // Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – 2012. – Вып. 15. – С. 163–165.
Сиохин В. Д., Черничко И. И., Андрющенко Ю. А. и др. Численность и размещение гнездящихся околоводных птиц в водно-болотных угодьях Азово-Черноморского побережья Украины. – Бранта: Мелитополь – Киев, 2000. – 476 с.
Сиохин В. Д., Черничко И. И., Ардамацкая Т. Б. и др. Колониальные гидрофильные птицы юга Украины: Ржанкообразны. – Киев: Наукова думка, 1988. – 176 с.
Цвелых А. Н., Аппак Б. А., 2012. Миграции сорокопутов в Горном Крыму. Бранта: Сборник научных трудов Азово-Черноморской орнитологической станции. – Вып. 15. – С. 134–139.
Pusanow J. Versuch einer Revision der Taurischen Ornis // Бюллетень Московского общества испытателей природы, отдел биологии. – 1933. – Т. 42, № 1. – С. 3–41.
- В скобках – даты самых ранних регистраций: приводятся для тех видов, которые не указаны в таблице 4. ↑
