БИОЦЕНОЗ MYA ARENARIA (LINNAEUS, 1758) В КЕРЧЕНСКОМ ПРОЛИВЕ (АЗОВО-ЧЕРНОМОРСКИЙ БАССЕЙН)
BIOCOENOSIS OF MYA ARENARIA (LINNAEUS, 1758) IN THE KERCH STRAIT (AZOV AND BLACK SEA BASIN)
JOURNAL: «EKOSISTEMY», Issue 38, 2024
Publication text (PDF): Download
UDK: 574.58+594(262.5)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Terentev A. S.
Azov-Black Sea Branch of Russian Research Institute of Fisheries and Oceanography
(Kerch Department), Kerch, Republic of Crimea, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2024-38-101-112
PAGES: from 101 to 112
STATUS: Published
LANGUAGE: Russian
KEYWORDS: Mya arenaria, Kerch Strait, Azov and Black Sea Basin, biocoenosis, zoobenthos, succession.
ABSTRACT (ENGLISH):
The bivalve mollusk Mya arenaria is a species recently introduced to the Azov and Black Sea Basin. Presently, it has become one of the dominant species in the Kerch Strait. Its biocoenosis keeps to silt and silty shell bottoms and comprises 13 animal species. The species density varies from 1 to 10 species/0.1m2 with 5.0±0.3 species/0.1m2 being the average value. In terms of species richness, bivalve mollusks are the most prevalent. The abundance is in the range from 40 to 2620 ind./m2 with 590±130 ind./m2, on average. The biomass ranges from 58 to 1599 g/m2; it is 770±67 g/m2 on average. The bivalve mollusks are the most prevalent in terms of abundance and biomass. A sizable part of the abundance belongs to crustaceans. The dominant species account for an average of 6 to 11 % of the total abundance and 78 to 85 % of the overall biomass. In general, the species composition of the biocoenosis on various substrates is characterized by a rather high degree of similarity. When the biocenosis dominated by Cerastoderma glaucum transformed into a M. arenaria one, the species richness decreased by 3.5 times, while the species density was relatively unchanged. The total abundance of the biocoenosis remained constant. The total biomass increased by 3.8–5.9 times due to the soft-shell clam (sand gaper) biomass. Then, upon the transformation of M. arenaria biocoenosis into Anadara kagoshimensis one, the species richness increased by 3.8 times and the species density increased by 1.5–2.0 times. Along with that, the total abundance and total biomass of the biocoenosis remained statistically the same. In terms of species richness, all three biocoenoses had the same core species. The changes in the species composition mainly resulted from the changes in rare species. Transformation of the biocoenoses occurred mostly due to the introduction of invasive species which took the leading position within the biocenotic community. In fact, there was a successive replacement of dominant species. The biocoenosis of M. arenaria in the central part of the Kerch Strait is an intermediate one between the biocoenoses of lagoon cockle and half-crenated ark.
Введение
В прошлом столетии, в результате повышения активности судоходства, в Азово-Черноморский бассейн проник двустворчатый моллюск мия (Mya arenaria Linnaeus, 1758). В настоящее время этот вид распространился в обоих частях северного полушария, как на обоих побережьях Атлантического океана, так и на восточном побережье Тихого океана, а также в Черном море (Strasser, 1999). Первоначально мия вселилась в Азовское море (Савчук, 1980; Булышева и др., 2020) и колонизировала его вплоть до Таганрогского залива (Савикин, 2020). В Азовском море мия сформировала собственный биоценоз (Фроленко, 1999; Фроленко, Студеникина, 1999; Терентьев, 2009; Terentijev, Litvinenko, 2000). В настоящее время биоценоз M. arenaria сформировался и в Керченском проливе. Также этот биоценоз сформировался в районе Одессы (Воробьева, Синегуб, 2014).
Этот биоценоз представляет особый интерес, так как он оказался достаточно новым образованием для Азово-Черноморского бассейна.
Цель настоящих исследований – изучить видовое богатство, оценить численность и биомассу биоценоза M. arenaria в Керченском проливе.
МАТЕРИАЛ И МЕТОДЫ
В работе использовались материалы, собранные в Керченском проливе с 1986 по 2016 год. Пробы отбирались дночерпателем Петерсена, площадью охвата 0,1 м2. Всего выполнено 352 станций (рис. 1).
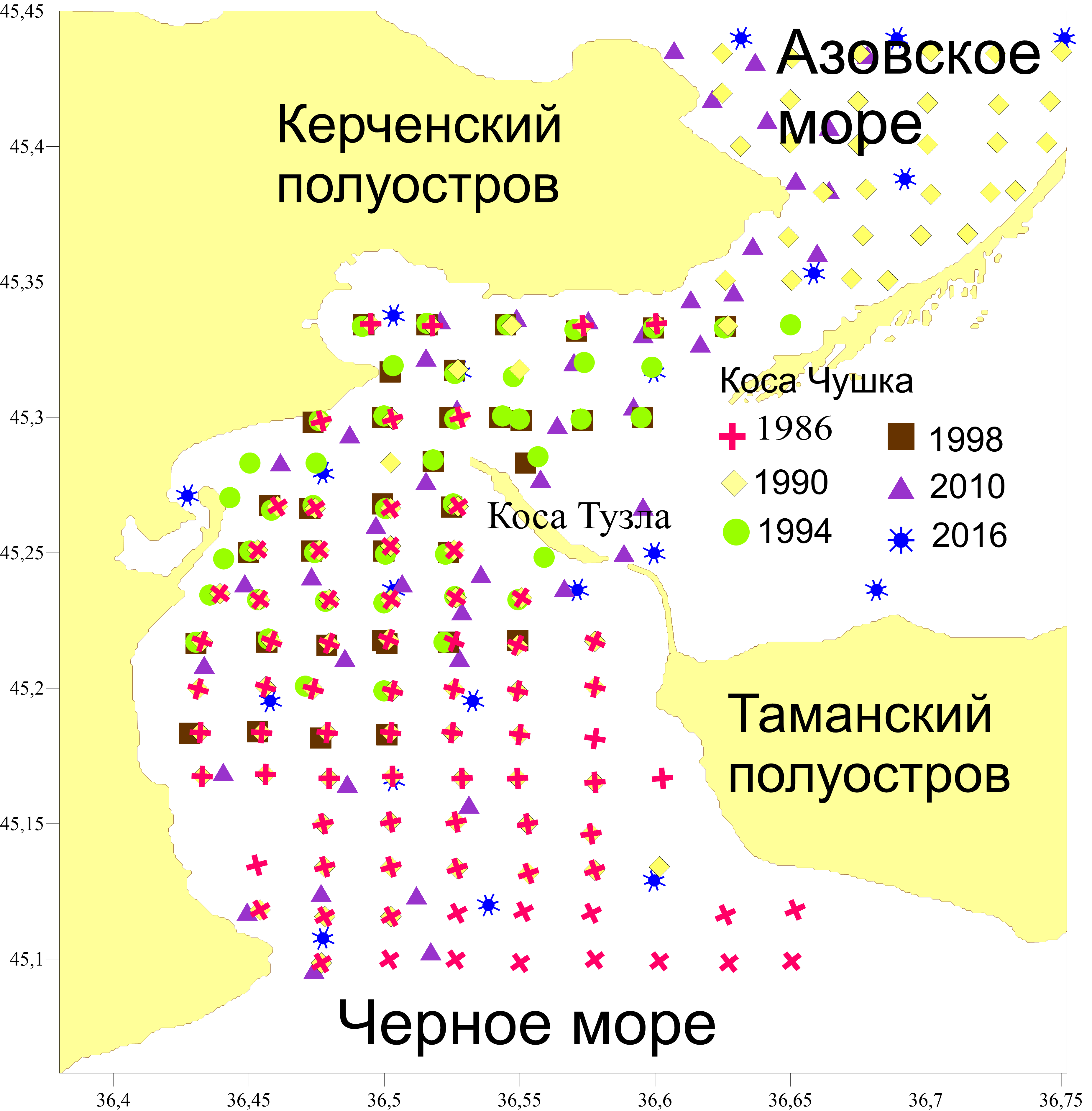
Рис. 1. Карта-схема гидробиологических станций в Керченском проливе (1986–2016 гг.)
Сбор материала осуществлялся по общепринятым методикам (Жадин, 1960). На каждой станции оценивалось количество видов, их численность и биомасса. Крупные животные взвешивались с точностью до 0,1 г, мелкие – до 0,001 г. Список видов приведен по Определителю фауны Черного и Азовского морей (1968, 1969, 1972), с уточнениями по номенклатурным изменениям (Pilombo, 2004; Wesselingh at al, 2019; WoRMS, 2024). Биоценоз выделялся по виду, имеющему наиболее высокую биомассу, с учетом его численности (Воробьев, 1949). Такой способ выделения биоценоза является традиционным для Азовского и Черного морей. В зависимости от встречаемости виды разделялись на руководящие более 50 %, характерные – 25–50 %, менее 25 % – редкие (Броцкая, Зенкевич, 1939; Лейбсон, 1939; Bodenheimer, 1955; Balogh, 1958). Виды, представленные одной особью, относились в категорию очень редких видов.
Поскольку выявление количества видов (видовое богатство) недостаточно для описания видового разнообразия (Hurlbert, 1971; Песенко, 1982). Для оценки выравненности видового состава использовался индекс полидоминантности Симпсона (Simpson, 1949) в его обратной форме (Песенко, 1982; Розенберг, 2007).
где: ni – численность i-го вида; N – общая численность.
По мнению Г.С. Розенберга (2007) индекс полидоминантности является весьма чувствительным индикатором доминирования одного или нескольких видов.
В качестве меры сходства использовался индекс Чекановского-Сёренса
и Синкевича-Симпсона
где: a и b – количество видов в первом и втором списке; c – количество общих видов.
Степень влияния различных факторов оценивался с помощью дисперсионного анализа (Любищев, 1986).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В Керченском проливе биоценоз M. arenaria был обнаружен в 1994 г в центральной части пролива (рис. 2). Он был сильно фрагментирован. Отдельные участки располагались между косами Чушка и Тузла, а также вдоль берега Крыма.
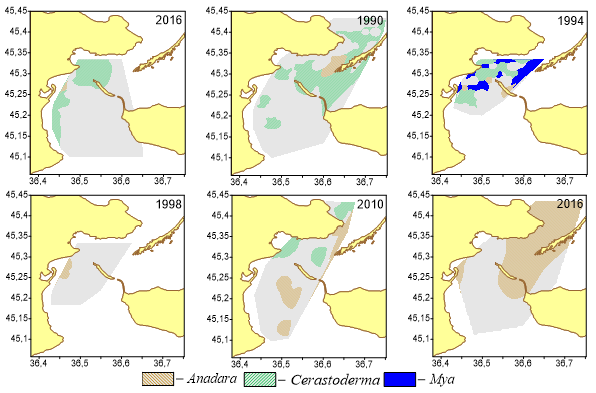
Рис. 2. Биоценоы Anadara kagoshimensis, Cerastoderma glaucum и Mya arenaria в Керченском проливе (1986–2016 гг.)
Биоценоз мии в Керченском проливе оказался неустойчивым. Неустойчивость биоценоза мии в Черном море отмечалась также в Одесском районе (Воробьева, Синегуб, 2014). В тоже время в Белом и Баренцовом морях этот биоценоз достаточно устойчив (Смольникова, 2009; Смольникова, Мещеряков, 2022; Филиппова и др., 2023).
Его видовое богатство в проливе насчитывало 13 видов животных или 9 % всех видов макрозообентоса Керченского пролива обнаруженных в дночерпательных пробах (табл. 1).
Таблица 1
Видовой состав и средний уровень развития биоценоза Mya arenaria
в Керченском проливе (1986–2016 гг.)
| Вид | Численность, экз./м2 | Биомасса, г/м2 | Встречаемость, % |
| Полихеты: | |||
| Alitta succinea | 6,40±1,20 | 1,460±0,350 | 30–61 |
| Melinna palmata | 2,73±0,62 | 0,055±0,014 | 13–41 |
| Nephtys hombergii | 11,80±1,70 | 1,280±0,290 | 39–70 |
| Сумма | 20,90±2,20 | 2,800±0,460 | |
| Ракообразные: | |||
| Ampelisca diadema | 1,82±0,54 | 0,027±0,009 | 6–30 |
| Amphibalanus improvisus | 241,00±90,00 | 6,400±2,000 | 21–52 |
| Rhithropanopeus harrisii | 14,50±2,90 | 8,000±2,400 | 30–61 |
| Сумма | 257,00±90,00 | 14,400±3,100 | |
| Брюхоногие моллюски: | |||
| Tritia neritea | 0,91±0,40 | 0,027±0,012 | 1–18 |
| Сумма | 0,91±0,40 | 0,027±0,012 | |
| Двустворчатые моллюски: | |||
| Anadara kagoshimensis | 7,30±1,20 | 66,000±20,000 | 39–70 |
| Cerastoderma glaucum | 251,00±90,00 | 58,000±17,000 | 59–87 |
| Lentidium mediterraneum | 2,70±1,20 | 0,091±0,040 | 1–18 |
| Mya arenaria | 50,90±3,80 | 628,000±64,000 | 100 |
| Mytilaster lineatus | 0,91±0,40 | 0,970±0,430 | 1–18 |
| Сумма | 313,00±90,00 | 753,000±69,000 | |
| Асцидии: | |||
| Molgula appendiculata | 1,82±0,54 | 0,095±0,037 | 6–30 |
| Сумма | 1,82±0,54 | 0,095±0,037 | |
| Общая сумма | 590,00±130,00 | 770,000±67,000 |
Плотность видов колебалась от 1 до 10 вид/0,1м2, а в среднем равнялась 5,0±0,3 вид/0,1м2.
В видовом богатстве преобладали двустворчатые моллюски, далее шли ракообразные и полихеты (рис. 3). Общая численность биоценоза колебалась от 40 до 2620 экз./м2, биомасса – от 58 до 1599 г/м2.
Как по численности, так и по биомассе доминировали двустворчатые моллюски, включая и доминантный вид. Их плотность видов в среднем равнялась 2,09±0,07 вид/0,1м2, а доля в видовом богатстве биоценоза была 38 %. Плотность видов могла доходить до 3 вид/0,1м2.
| Видовое богатство | Численность | Биомасса |
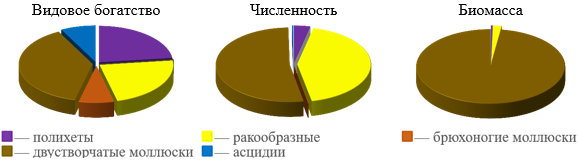
Рис. 3. Доля различных таксономических групп в видовом богатстве, численности и биомассе биоценоза Mya arenaria в Керченском проливе (1986–2016 гг.)
Численность двустворчатых моллюсков колебалась от 30 до 2340 экз./м2, биомасса от 58 до 1598 г/м2. На их долю приходилось не менее 2 %, в среднем 49–56 % численности и не менее 55 %, в среднем 96–99 % биомассы биоценоза. Важную роль среди двустворчатых моллюсков играла C. glaucum. Ее доля в общей численности была даже выше, чем у доминантного вида 38–46 % против 4–13 %. Но по биомассе она сильно уступала ему 6–9 % против 78–85 %. В основном церастодерма была представлена мелкими, недавно осевшими особями.
На втором месте по численности стояли ракообразные. Их встречаемость была высокой – 48–79 %. Плотность видов в среднем равнялась 0,82±0,13 вид/0,1м2 и не превышала 3 вид/0,1м2. На их долю приходилось 23 % видового богатства биоценоза. Численность ракообразных могла доходить до 2280 экз./м2, биомасса – до 65 г/м2. На их долю в среднем приходилось 39–47 % общей численности и 1–3 % общей биомассы биоценоза. По численности они немногим уступали двустворчатым моллюскам. Среди ракообразных доминировал морской желудь A. improvisus. На его долю в среднем приходилось 87–99 % общей численности и 35–53 % общей биомассы ракообразных. Этот вид в качестве субстрата очень часто используют живые и мертвые раковины двустворчатых моллюсков. Высокой биомассой также отличался голландский крабик R. harrisii. Однако, он встречался реже и отличался довольно низкой численностью. Хотя на отдельных участках биоценоза она доходила до 60 экз./м2. Его высокая доля в биомассе ракообразных объясняется только крупными размерами самого животного.
На долю полихет приходилось 23 % видового богатства биоценоза. их встречаемость была очень высокой – 79–94 %. На их долю приходилось в среднем 2–5 % численности и 0,3–0,4 % биомассы биоценоза. На отдельных участках биоценоза их численность могла доходить до 25 экз./м2, а биомасса до 1,93 г/м2.
Брюхоногие и асцидии встречались довольно редко. На их долю в среднем приходилось 0,2–0,7 % численности и 0,01–0,02 % биомассы биоценоза. Причем эта доля нигде не превышала 12 % по численности и 0,25 % по биомассе.
Таким образом, основная часть видового богатства биоценоза приходилась на долю двустворчатых моллюсков, полихет и ракообразных. По численности также, как и по биомассе, доминировали двустворчатые моллюски. На втором месте по численности после двустворчатых моллюсков стояли ракообразные.
Руководящие, характерные, редкие и очень редкие виды играли разную роль в видовом богатстве, численности и биомассе биоценоза. На долю доминантного вида приходилось 8 % видового богатства, в среднем 6–11 % численности и 78–85 % биомассы биоценоза (рис. 4). Причем по биомассе доля доминанта в биоценозе не опускалась ниже 42 %.
К руководящим видам кроме доминантного относились: A. kagoshimensis, C. glaucum и N. hombergii. На их долю, без учета доминантного вида, приходилось 23 % видового богатства, 43–48 % общей численности и 14–19 % общей биомассы биоценоза. На отдельных
| Видовое богатство | Численность | Биомасса |
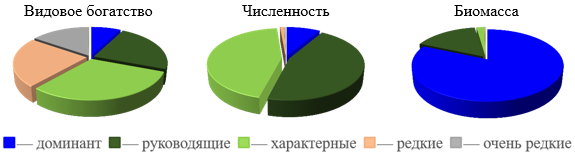
Рис. 4. Доля доминанта, руководящих, характерных, редких и очень редких видов в видовом богатстве, численности и биомассе биоценоза Mya arenaria в Керченском проливе (1986–2016 гг.)
участках биоценоза их доля по численности доходила до 88 %, а по биомассе до 43 %. Плотность видов в среднем равнялась 1,82±0,12 вид/0,1м2. Средняя численность руководящих видов равнялась 270±91 экз./м2, при биомассе 125±25 г/м2. На отдельных участках она доходила до 2300 экз./м2, при биомассе 445 г/м2. Доминантом второго порядка была C. glaucum. На ее долю приходилось 90–95 % общей численности руководящих видов и 41–51 % их биомассы. Анадара имела практически такую же биомассу, как и церастодерма. На ее долю в среднем приходилось 43–63 % от общей биомассы руководящих видов. Но сильно уступала ей по численности. Ее доля была всего 2–3 %.
К характерным видам относились: морской желудь A. improvisus, A. succinea, M. palmata и R. harrisii. Их плотность видов в среднем равнялась 1,54±0,17 вид/0,1м2, а на отдельных участках доходила до 4 вид/0,1м2. Средняя численность равнялась 265±91 экз./м2, при биомассе 15,9±3,3 г/м2. На отдельных участках их численность доходила до 2290 экз./м2, при биомассе 73 г/м2. На их долю приходилось 31 % видового богатства биоценоза, 6–9 % численности и 0,2–0,4 % биомассы. На отдельных участках биоценоза их доля в численности доходила до 97 %, а в биомассе до 44 %. Среди характерных видов доминировал A. improvisus. На его долю в среднем приходилось 88–94 % численности и 30–50 % биомассы характерных видов.
На долю редких видов приходилось 23 % видового богатства биоценоза. К ним относились: A. diadema, L. mediterraneum и M. appendiculata. Их плотность видов в среднем равнялось 0,36±0,07 вид/0,1м2 и, как правило, не превышало 1вид/0,1м2. Средняя численность редких видов равнялась 6,4±1,4 экз./м2, при биомассе 0,214±0,053 г/м2 и не превышала 30 экз./м2, при биомассе 1 г/м2. На их долю в среднем приходилось 0,8–1,3 % численности и 0,02-0,03 % биомассы биоценоза и не превышала 9 % по численности и 0,24 % по биомассе.
Очень редко встречались: M. lineatus и T. neritea. Их встречаемость в целом была невысокой – 6–30 %. Плотность видов в среднем равнялась 0,18±0,05 вид/0,1м2 и не превышала 1 вид/0,1м2. Численность в среднем равнялась 1,82±0,54 экз./м2, а биомасса 1,00±0,43 г/м2. При этом их численность не превышала 10 экз./м2, а биомасса 11 г/м2. На их долю в среднем приходилось 15 % видового богатства, 0,26–0,35 % численности и 0,07–0,19 % биомассы биоценоза. При этом, их численность не превышала 3 %, а биомасса 9 %.
Главную роль в видовом богатстве играли характерные виды. По численности доминировали руководящие и характерные виды. Основная часть биомассы биоценоза приходилась на долю доминантного вида.
Большая часть (59–86 % от общей площади) биоценоза располагалась на иле. Заиленная ракуша занимала 14–41 % общей площади. На других типах грунтов он обнаружен не был.
Различия основных показателей уровня развития биоценоза довольно сильно зависело от типа грунта (табл. 2). Сильнее всего это сказывалось на плотности видов, выровненности видовой структуры биоценоза, доли недоминантных видов по численности. Сильное влияние тип грунта оказывал также на общую биомассу биоценоза, численность и биомассу доминантного вида, и долю недоминантных видов в общей биомассе биоценоза. Менее всего от типа грунта зависели общая численность биоценоза и численность недоминантных видов. В пределах этих двух типов грунта его уровень развития зависел в основном от не организованных факторов.
Видовое богатство биоценоза на заиленной ракуше и иле было одинаковым. Как на ракуше, так и на иле было обнаружено по 11 видов животных. При этом, плотность видов на заиленной ракуше в среднем была выше, чем на иле (табл. 3). Плотность видов на заиленной ракуше колебалась от 1 до 10 вид/0,1м2, а на иле от 3 до 6 вид/0,1м2. В целом плотность видов на иле отличалась большей стабильностью.
На заиленной ракуше численность биоценоза колебалась от 60 до 2340 экз./м2 на иле – от 40 до 2620 экз./м2. Биомасса биоценоза на иле была напротив, выше чем на заиленной ракуше, где она изменялась от 119 до 1081 г/м2. На иле она колебалась от 58 до 1599 г/м2. При этом индекс полидоминантности как на заиленной ракуше, так и на иле имел близкие значения, но на заиленной ракуше отличался большим разбросом значений.
Таблица 2
Влияние типа грунта уровень развития биоценоза Mya arenaria в Керченском проливе (1986–2016 гг.)
| Организованный фактор | Влияние фактора (%) | |
| Организованного | Не организованного | |
| Плотность видов | 74–76 | 24–26 |
| Численность | 21–26 | 74–79 |
| Биомасса | 57–60 | 40–43 |
| Значения индекса полидоминантности Симпсона | 71–72 | 28–29 |
| Доминантный вид | ||
| Численность | 64–65 | 35–36 |
| Биомасса | 52–53 | 47–48 |
| Недоминантные виды | ||
| Численность | 18–23 | 77–82 |
| Биомасса | 22–27 | 73–78 |
| Доля недоминантных видов | ||
| Численность | 75–77 | 23–25 |
| Биомасса | 41–54 | 46–59 |
Таблица 3
Уровень развития биоценоза Mya arenaria на разных грунтах в Керченском проливе (1986–2016 гг.)
| Характеристики биоценоза | Тип грунта | |
| Заиленная ракуша | Ил | |
| Общие характеристики биоценоза | ||
| Видовое богатство | 11 | 11 |
| Плотность видов, вид/0,1м2 | 5,7±0,6 | 4,8±0,1 |
| Численность, экз./м2 | 950±160 | 460±120 |
| Биомасса, г/м2 | 640±65 | 819±70 |
| Индекс полидоминантности Симпсона | 2,30±1,30 | 2,46±0,24 |
| Доминантный вид | ||
| Численность | 46,70±3,10 | 52,50±4,2 |
| Биомасса | 444±47 | 697±69 |
| Недоминантные виды | ||
| Численность | 900±170 | 410±120 |
| Биомасса | 196±38 | 122±25 |
| Доля в общей численности, % | 91–98 | 84–93 |
| Доля в общей биомассе, % | 27–31 | 13–17 |
Численность доминантного вида на заиленной ракуше изменялась от 20 до 60 экз./м2, а на иле от 10 до 90 экз./м2. Статистически достоверной разницы между численностью доминантного вида на этих грунтах не обнаружено. Его биомасса на заиленной ракуше колебалась от 50 до 719 г/м2. На иле она была в среднем выше и находилась в пределах от 34 до 1597 г/м2.
В среднем по всему биоценозу на долю недоминантных видов приходилось 87–96 % численности и 16–21 % биомассы. При этом, она никогда не превышала 58 % от общей биомассы биоценоза.
Часть биоценоза мии, лежащая на иле отличается более высокой плотностью видов и общей численностью, но имеет более низкую биомассу (рис. 5).

Рис. 5. Зависимость, плотности вида, численности и биомассы биоценоза Mya arenaria от типа грунта в Керченском проливе (1986–2016 гг.)
Видовое богатство обоих частей биоценоза было одинаковым. При этом, его часть, лежащая на заиленной ракуше, отличалась более высокой плотностью видов, она была в 1,1–1,3 раза выше, чем на иле. Также в этой части численность биоценоза была в 1,6–2,5 раза выше. В тоже время часть биоценоза, лежащая на иле, отличалась более высокой биомассой. В среднем она была в 1,2–1,4 раза выше, чем на заиленной ракуше.
Видовой состав биоценоза M. arenaria на заиленной ракуше и иле отличается очень высоким уровнем сходством (табл. 4).
Таблица 4
Уровень сходства биоценоза Mya arenaria на разных грунтах в Керченском проливе (1986–2016 гг.)
| Индекс сходства Чекановского-Сёренса | ||
| Тип грунта | Заиленная ракуша | Ил |
| Заиленная ракуша | 0,82 | |
| Ил | 0,82 | |
| Индекс сходства Синкевича-Симпсона | ||
На иле не были отмечены M. lineatus и T. neritea, а на заиленной ракуше – L. mediterraneum и N. hombergii. Первые три вида в целом были достаточно редкими для этого биоценоза.
Биоценоз мии образовался на месте, ранее существовавшего там биоценоза C. glaucum. Биоценоз церастодермы широко распространен и в Азовском море (Воробьев, 1949; Экологический атлас…, 2011; Ревков, Болтачева, 2021; Болтачева и др., 2022). По сравнению с исходным биоценозов видовое богатство уменьшилось в 3,5 раза, при этом плотность видов практически не изменилась. Из видового богатства полностью исчезли книдарии и иглокожие. Видовое богатство брюхоногих моллюсков уменьшилось в 8 раз, полихет в 4, двустворчатых моллюсков в 3, ракообразных и асцидий в 2 раза (рис. 7).
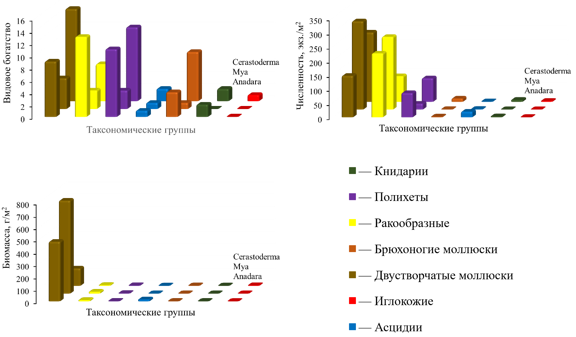
Рис. 7. Динамика видового богатства, численности и биомассы при трансформации биоценоза Cerastoderma glaucum в биоценоз Mya arenaria, а его в биоценоз Anadara kagoshimensis в Керченском проливе (1986–2016 гг.)
Реже стали встречаться M. palmata и M. lineatus. Чаще – A. improvisus, A. kagoshimensis и R. harrisii. Сокращение видового богатства произошло в основном за счет редких видов. При этом, видовое богатство биоценозов оказалось достаточно высоким. Индекс Чекановского-Сёренса равнялся 0,51. Но из-за резкого сокращения видового богатства индекс Синкевича-Симпсона был довольно низким (0,28). Следует отметить, что все виды животных, входящие в состав биоценоза M. arenaria, встречались и в биоценозе C. glaucum.
Статистически значимого изменения в общей численности биоценоза также, как и численности, ранее доминировавшей C. glaucum, не произошло. Однако, ее доля в общей численности биоценоза уменьшилась в среднем до 5,4–9,6 %. Численность M. arenaria увеличилась в 21–57 раза. В 1,4–4,3 раза увеличилась численность ракообразных. В 2,1–5,9 раза уменьшилась численность полихет.
Общая биомасса биоценоза в среднем выросла в 3,8–5,9 раза. Биомасса, ранее доминировавшей C. glaucum уменьшилась в 1,2–2,8 раза, а биомасса M. arenaria наоборот выросла в 542–707 раз. На долю C. glaucum в биоценозе мии приходилось 0,2–0,3 % от общей биомассы. Биомасса ракообразны увеличилась в 1,2–3,5 раза, биомасса полихет в 1,2–1,9 раз.
При трансформации биоценоза M. arenaria в биоценоз A. kagoshimensis видовое богатство увеличилось в 3,8 раза. Плотность видов выросла в 1,5–2,0 раза. Более чем 4 раза увеличилось видовое богатство ракообразных. В 4 раза выросло видовое богатство брюхоногих моллюсков, в 3,7 – полихет, в 1,8 двустворчатых моллюсков. Чаще стали встречаться A. equina, A. improvisus, M. palmata, M. appendiculata, M. lineatus и P. exiguum, реже – N. hombergii. Встречаемость, ранее доминировавшей мии, снизилась до 4–20 %. При этом, видовое богатство биоценоза M. arenaria и A. kagoshimensis также имели довольно сходное видовое богатство. Индекс Чекановского-Сёренса равнялся 0,48. Но так как видовое богатство при этом сильно увеличилось, индекс Синкевича-Симпсона был невысоким (0,32). Также все виды животных, входящие в состав биоценоза M. arenaria, встречались и в биоценозе A. kagoshimensis.
Общая численность при этом зообентоса осталась практически на прежнем уровне. Численность мии уменьшилась в 20–22 раза. Ее доля в общей численности не превышала 1 %. Численность A. kagoshimensis выросла в 3–7 раза. Ранее, в Балтийском море у берегов Швеции, была установлена обратная отрицательная зависимость между плотностью взрослого населения мии и церастодермы и недавно осевшими личинками двустворчатых моллюсков (Andre, Rosenberg, 1991). Препятствие к оседанию молоди двустворчатых, вероятно является одной из причин, препятствующих восстановлению этих биоценозов. Также поселения мии неустойчиво к заилению, вызванному антропогенными причинами (Baker, Mann, 1990). В Керченском проливе это переосаждение илов при дноуглубительных работах при очистке и углублению судоходного канала. Численность C. glaucum уменьшилась в 5–18 раз. Общая численность двустворчатых моллюсков уменьшилась в 1,4–2,8 раза. Численность ракообразных осталась практически на прежнем уровне. В 6–16 раз увеличилась численность асцидий, в 1,8–6,4 полихет. Статистически достоверного изменения численности брюхоногих моллюсков не произошло.
Общая биомасса зообентоса, при трансформации биоценоза M. arenaria в биоценоз A. kagoshimensis статистически значимо не изменилась. При этом, биомасса мии уменьшилась в 37–60 раз. Ее доля в общей биомассе биоценоза в среднем не превышала 6 %. Биомасса A. kagoshimensis также, как и численность, выросла в 3–7 раза. Статистически достоверного увеличения биомассы C. glaucum не произошло. Однако, их средняя масса увеличилась с 0,1–0,3 г в биоценозе M. arenaria до 0,2–1,9 г в биоценозе A. kagoshimensis, что еще раз подтверждает предположение о том, что препятствием к восстановлению биоценоза C. glaucum может служить препятствие к осаждению ее молоди. Общая биомасса двустворчатых моллюсков уменьшилась в 1,2–1,9 раза. Статистически значимого изменения биомассы полихет и ракообразных не произошло. Несмотря на то, что биомасса асцидий и брюхоногих моллюсков сильно выросла, они по-прежнему играют небольшую роль в общей биомассе биоценоза A. kagoshimensis, где на их долю в среднем приходится 0,7–3,7 % от общей биомассы этого биоценоза. В основном трансформация биоценоза M. arenaria в биоценоз A. kagoshimensis произошла за счет смены доминантных видов.
ЗАКЛЮЧЕНИЕ
Биоценоз Mya arenaria в Керченском проливе располагался на иле и заиленной ракуше. На других типах грунта отсутствовал. Образовался на месте биоценозов Cerastoderma glaucum. В его составе насчитывается 13 видов животных. Плотность видов колеблется от 1 до 10 и в среднем равняется 5,0±0,3 вид/0,1м2. В видовом богатстве преобладают двустворчатые моллюски. Численность находится в пределах от 40 до 2620, в среднем 590±130 экз./м2. Биомасса изменяется от 58 до 1599 в среднем 770±67 г/м2. Главную роль в численности и биомассе биоценоза играют двустворчатые моллюски. Огромную роль в численности биоценоза также играют ракообразными. На долю доминантного вида в среднем приходится 6–11 % численности и 78–85 % биомассы биоценоза. При трансформации биоценоза C. glaucum в биоценоз M. arenaria видовое богатство уменьшилось в 3,5 раза, при этом практически не изменилась плотность видов. Общая численность биоценоза осталась на прежнем уровне. Общая биомасса, за счет биомассы мии, увеличилась в 3,8–5,9 раза. В дальнейшем при трансформации биоценоза мии в биоценоз Anadara kagoshimensis видовое богатство увеличилось в 3,8 раза, а плотность видов в 1,5–2,0 раза. При этом общая численность и общая биомасса биоценоза статистически не изменились. Для всех трех биоценозов в видовом богатстве сохраняется ядро, состоящее из одних и тех же видов. Изменение видового состава происходило в основном за счет редких видов. Трансформация биоценозов происходила в основном за счет внедрения видов-вселенцев, которые занимали лидирующее положение в биценозе. Фактически происходила последовательная смена доминантов. Биоценоз мии центральной части Керченского пролива оказался промежуточным между биоценозами церастодермы и анадары.
Болтачева Н. А., Ревков Н. К., Надольный А. А., Аннинская И. Н. Донная фауна юго-западной части Азовского моря. Таксономический состав и биоценотическая организация макрозообентоса в 2016–2017 гг. // Морской биологический журнал. – 2022. – Т. 1, № 2. – С. 3–22.
Броцкая В. А., Зенкевич Л. А. Количественный учет донной фауны Баренцева моря // Труды ВНИРО. – 1939. – Т. IV. – С. 5–126.
Булышева Н. И., Сёмин В. Л., Шохин И. В., Савикин А. И., Коваленко Е. П., Бирюкова С. В. Чужеродные виды зообентоса в экосистемах Нижнего Дона и Азовского моря на рубеже XX–XXI вв. // Труды Южного научного центра РАН. – 2020. – Т. 8. – С. 256–273.
Воробьев В. П. Бентос Азовского моря // Труды АзЧерНИРО. – 1949. – Вып. 13. – 193 с.
Воробьева Л. В., Синегуб И. А. Зообентос биоценозов Одесского морского региона Черного моря // Экосистемы, их оптимизация и охрана. – 2014. – Вып. 11. – С. 198–206.
Жадин В. И. Методы гидробиологических исследований. – М.: Высшая школа. – 1960. – 191 с.
Лейбсон Р. Г. Количественный учет донной фауны Мотовского залива // Труды ВНИРО. – 1939. – Т. IV. – С. 127–198.
Любищев А. А. Дисперсионный анализ в биологии. – Москва: МГУ. – 1986. – 200 с.
Определитель фауны Черного и Азовского морей. Т. 1. Свободноживущие беспозвоночные. Простейшие, губки, кишечнополостные, черви, щупальцевые. – Киев: Наукова думка. – 1968. – 437 с.
Определитель фауны Черного и Азовского морей. Т. 2. Свободноживущие беспозвоночные. Ракообразные. – Киев: Наукова думка. – 1969. – 536 с.
Определитель фауны Черного и Азовского морей. Т. 3. Свободноживущие беспозвоночные. Членистоногие (кроме ракообразных), моллюски, иглокожие, щетинкочелюстные, хордовые. – Киев: Наукова думка. – 1972. – 340 с.
Песенко Ю. А. Принципы и методы количественного анализа в фаунистических исследованиях. – Москва: Наука. 1982. – 287 с.
Ревков Н. К., Болтачева Н. А. Донная фауна юго-западной части Азовского моря: трансформация биоценоза макрозообентоса в начале XXI века // Экосистемы. – 2021. – Вып. 26 (56). – С. 51–66.
Розенберг Г. С. Несколько слов об индексе разнообразия Симпсона // Самарская Лука. – 2007. – Т. 16, № 3 (21). – С. 581–584.
Савикин А. И. Новые данные о распространении Mya arenaria Linnaeus, 1758 в Таганрогском заливе Азовского моря // Наука юга России. – 2020. – Т. 16, № 4. – С. 84–87.
Савчук М. Я. Mya arenaria L. – новый элемент в фауне Азовского моря // Вестник зоологии. – 1980. – № 5. – С. 11–15.
Смольникова О. В., Биоценоз Mya arenaria на литорали Кандалашского залива Булого моря // Сохранение биологического разнообразия наземных и морских экосистем в условиях высоких широт: Материалы Международной научно-практической конференции. Мурманск: МГПУ. – 2009. – С. 257–259.
Смольникова О. В., Мещеряков Н.И. Биология двустворчатого моллюска Mya arenaria (Linnaeus, 1758) губы Хлебная Кольского залива Баренцева моря // Труды Кольского научного центра РАН. Вып. 10 (Океанология. Вып. 4/2022(3)). – Аппатиты. – 2022. – С. 86–99.
Терентьев А. С. Макрозообентос юго-западной части Азовского моря в условиях эксплуатации газоконденсатных месторождений // Экологическая безопасность прибрежной и шельфовой зоны и комплексное использование ресурсов шельфа: Сборник научных трудов. – 2009. – Вып. 17. – С. 327–348.
Филиппова Н. А., Герасимова А. В., Козин В. В., Кайров А. И., Максимова Н. В. Организация сообщества макрозообентоса мягких грунтов литорали губы Чупа Белого моря: многолетнии аспекты // Труды Зоологического института РАН. – 2023. – Том 327, № 2. – С. 350–376.
Фроленко Л. Н. Особенности формирования донных биоценозов Азовского моря в современный период // XI Всероссийская конференция по промысловой океанологии. Тезисы докладов. – 1999. – С. 136.
Фроленко Л. Н., Студеникина Е.И. Роль вселенцев в донных сообществах Азовского моря в современный период // XI Всероссийская конференция по промысловой океанологии. Тезисы докладов. – 1999. – С. 136–137.
Экологический атлас Азовского моря / [Гл. ред. акад. Г. Г. Матишов; отв. ред. Н. И. Голубева, В. В. Сорокина]. – Ростов-на-Дону: ЮНЦ РАН. – 2011. – 328 с.
Andre, C., Rosenberg, R. Adult-larval interactions in the suspension-feeding bivalves Cerastoderma edule and Mya arenaria // Marine Ecology Progress Series. – 1991. – Vol. 71. – P. 227–234
Baker, P., Mann, R. L. Habitat Requirements for the Softshell Clam, Mya arenaria in the Chesapeake Bay. Special Scientific Report – 1990. – N 125. Virginia Institute of Marine Science, William & Mary. https://dx.doi.org/doi:10.25773/v5-jc3f-tk19
Balogh J. Lebensgemeinschaften der Landtiere. – Berlin, 1958. – 560 р.
Bodenheimer F. S. Precisd’ecologieanimal. – Paris, 1955. – 315 р.
Wesselingh F. P., Neubauer T. A., Anistratenko V. V., Vinarski M. V., Yanina T., ter Poorten J. J., Kijashko P., Albrecht C., Anistratenko O. Yu., D’Hont A., Frolov P., Gándara A. M., Gittenberger A., Gogaladze A., Karpinsky M., Lattuada M., Popa L., Sands A. F., van de Velde S., Vandendorpe J., Wilke T. Mollusc species from the Pontocaspian region – an expert opinion list // ZooKeys 827. – 2019 – Р. 31–124.
Hurlbert S. H. The nonconcept of species diversity: A critique and alternative parameters // Ecology. – Vol. 52, N 4. – 1971. – P. 577–586.
Pilombo F. B. Phylogenetic analysis of the Balanidae (Cirripedia, Ballanomorpha) // Zoologica Scripta. – Vol. 33, N 3. – 2004. – P. 261–276.
Simpson E. H. Measurement of diversity // Nature. – 1949. – Vol. 163. N 688. – 688 p.
Strasser M. Mya arenaria on ancient invader of the North Sea coast // Helgoländer Meeresuntersuchunden. – 1999. – Vol. 52. – P. 309–324.
Terentijev A. S., Litvinenko N. M. Biocenosis of intruders Mya arenaria and Cunearca cornea (Scapharca) in the north-western Azov Sea // The Black Sea ecological problems / International symposium «Black Sea Strategic Action Plan Implementations (1996-2000)». – Odessa: SCSEIO. – 2000. – P. 315–317.
World Register of Marine Species (WoRMS). URLhttps://www.marinespecies.org/index.php (дата обращения 29.03.2024)

