Экосистемы, 36: 87–101 (2023) https://ekosystems.cfuv.ru
УДК 574.58+594(262.5) DOI 10.5281/zenodo.10374274
Биоценоз Anadara kagoshimensis (Tokunaga, 1906) в Керченском проливе (Азово-Черноморский бассейн)
Всероссийский институт рыбного хозяйства и океанографии Керчь, Россия
iskander65@bk.ru
Двустворчатый моллюск Anadara kagoshimensis является недавним вселенцем в Азово-Черноморский бассейн из умеренных вод Тихого океана. К настоящему времени A. kagoshimensis стал одним из доминантных видов в Керченском проливе. В составе биоценоза A. kagoshimensis насчитывается 49 видов животных. Плотность видов колеблется от 1 до 24 и в среднем равняется 8,9±1,2 вид/0,1 м2. В видовом отношении преобладают ракообразные. Число их видов находится в пределах от 10 до 1320, в среднем 380±100 экз./м2. Численно преобладают двустворчатые моллюски и ракообразные. Биомасса изменяется от 8 до 1526 в среднем 400±100 г/м2. По биомассе доминируют двустворчатые моллюски. На долю доминантного вида в среднем приходится 6–13 % общей численности особей в биоценозе и 75–85 % биомасы особей биоценоза. Наиболее высокого уровня развития этот биоценоз достигает на ракуше, а наиболее низкого на песке. В целом, видовой состав биоценоза на разных грунтах отличается довольно высоким сходством. Наиболее сильные различия в видовом отношении наблюдаются между частями биоценоза, сформированными на песке и на ракуше. К 2016 году биоценоз распространился на всю северную часть пролива, но не дошел до Черного моря. Биоценоз A. kagoshimensis в Черном и Азовских морях образовался на местах, характерных для биоценозов Cerastoderma glaucum и Chamelea gallina. При трансформации биоценоза C. glaucum видовое богатство уменьшилось в 1,2 раза, при этом плотность видов увеличилась в 2,0–2,4 раза. Общая численность особей биоценоза осталась на прежнем уровне. Общая биомасса, за счет биомассы анадары, увеличилась в 1,9–4,5 раза. При трансформации биоценоза Ch. gallina видовое богатство уменьшилось в 3,6 раза. Плотность видов практически не изменилась. Общая численность особей биоценоза уменьшилась в 2,6– 4,2 раза, общая биомасса – в 1,2–1,7 раза. При образовании биоценоза A. kagoshimensis на месте биоценоза C. glaucum произошло внедрение вселенца в ранее существовавшее сообщество, в котором он занял лидирующее место. В то время как его образование на месте биоценоза C. gallina сопровождалось существенной перестройкой предшествующего сообщества.
Ключевые слова: Anadara kagoshimensis, Керченский пролив, Азово-Черноморский бассейн, биоценоз, зообентос, сукцессия.
ВВЕДЕНИЕ
-
- прошлом столетии, в результате повышения активности судоходства, в Азово-Черноморский бассейн проникло большое количество видов-вселенцев. Этому также способствовала хозяйственная деятельность по интродукции некоторых видов. В настоящее время этот процесс продолжается.
Одним из таких видов стал недавний вселенец Anadara kagoshimensis (Tokunaga, 1906), попавшая в Черное море из умеренных широт Тихого океана (Zaitzev, Mamaev, 1997). Впервые она была отмечена в 1968 году на Кавказском побережье в районе Туапсе – Шеспи (Ревков, 2016) и была определена М.И. Киселевой (1992) как Cunearca cornea (Reeve, 1844).
- результате генетического анализа этот вид отнесен к A. kagoshimensis (Krapal еt al., 2014).
- настоящее время она полностью колонизировала Азовское море (Живоглядова и др., 2021), где сформировала собственный биоценоз (Terentijev, Litvinenko, 2000; Фомичёва, Фроленко, 2007; Терентьев, 2009; Фроленко, Мальцева, 2017; Ревков, Болтачева, 2021; Болтачева и др., 2022). В настоящее время ее биоценоз сформировался и в Керченском проливе.
Этот биоценоз представляет особый интерес, так как он оказался достаточно новым образованием для Азово-Черноморского бассейна.
Цель работы – изучить видовое богатство, оценить численность и биомассу особей биоценоза A. kagoshimensis в Керченском проливе.
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Терентьев А. С.
![]()
МАТЕРИАЛ И МЕТОДЫ
- работе использовались материалы, собранные в Керченском проливе с 1986 по 2016 год. Пробы отбирались дночерпателем Петерсена, площадью охвата 0,1 м2. Всего выполнено 352 станций (рис. 1).
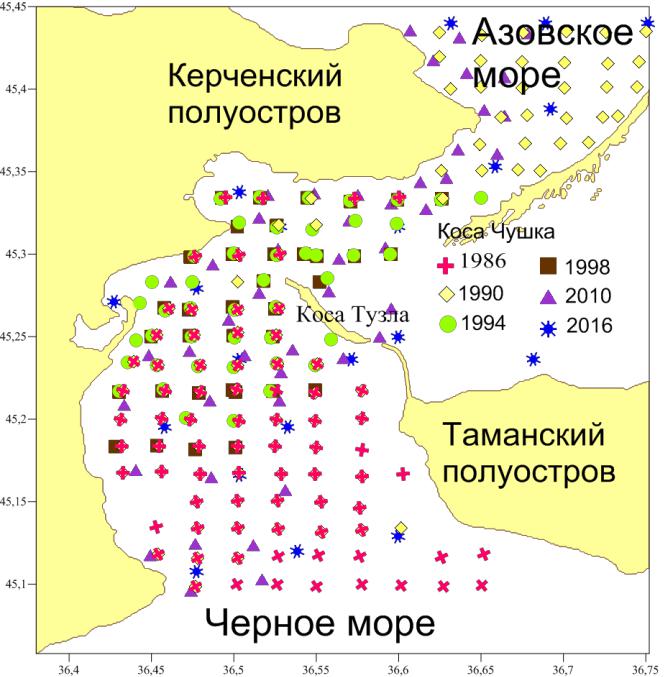
Рис. 1. Карта-схема гидробиологических станций в Керченском проливе (1986–2016 гг.)
Сбор материала осуществлялся по общепринятым методикам (Жадин, 1960). На каждой станции оценивалось количество видов, численность особей и биомасса. Крупные животные взвешивались с точностью до 0,1 г, мелкие – до 0,001 г. Список видов приведен по Определителю фауны Черного и Азовского морей (1968, 1969, 1972), с уточнениями по номенклатурным изменениям (Pilombo, 2004; Krapal еt al., 2014; Wesselingh еt al., 2019; WoRMS, 2022). Биоценоз выделялся по виду, имеющему наиболее высокую биомассу, с учетом его численности (Воробьев, 1949). Такой способ выделения биоценоза является традиционным для Азовского и Черного морей. В зависимости от встречаемости виды разделялись на руководящие более 50 %, характерные – 25–50 %, менее 25 % – редкие (Броцкая, Зенкевич, 1939; Лейбсон, 1939; Bodenheimer, 1955 Balogh, 1958). Виды, представленные одной особью, относились в категорию очень редких видов.
Поскольку выявление количества видов (видовое богатство) недостаточно для описания видового разнообразия (Hurlbert, 1971; Песенко, 1982), для оценки выравненности видового состава использовался индекс полидоминантности Симпсона (Simpson, 1949):
( − 1)
= ,
где: ni – численность i-го вида; N – общая численность особей.
По мнению Г. С. Розенберга (2007) индекс полидоминантности Симпсона является весьма чувствительным индикатором доминирования одного или нескольких видов.
- качестве меры сходства использовался индекс Чекановского-Сёренсена, вычисляемый по формуле:
88
Биоценоз Anadara kagoshimensis (Tokunaga, 1906)
в Керченском проливе (Азово-Черноморский бассейн)
![]()
2
= +
и Синкевича-Симпсона – по формуле:
= ,при ≥ ,
где: a и b – количество видов в первом и втором списке; c – количество общих видов. Степень влияния различных факторов оценивался с помощью дисперсионного анализа (Любищев, 1986).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
- Керченском проливе биоценоз A. kagoshimensis (Tokunaga, 1906) располагается на глубинах от 3 до 10 м. Впервые был обнаружен в 1986 году в средней части пролива возле Керченского полуострова (рис. 2).
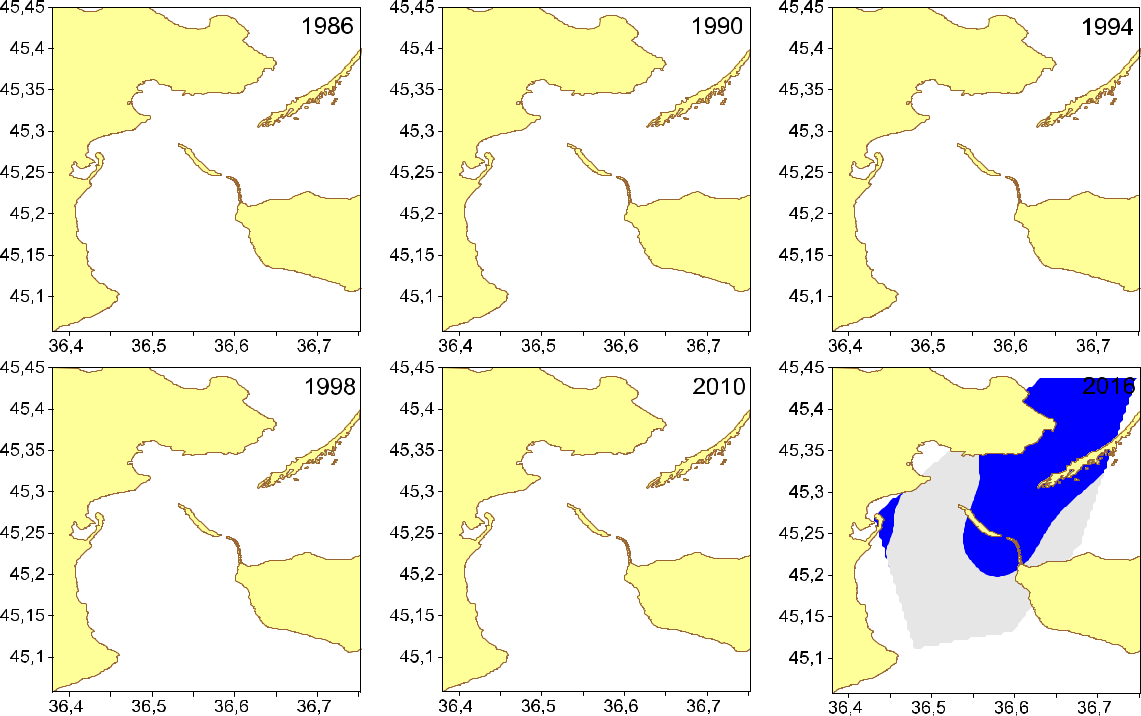
Рис. 2. Биоценоз Anadara kagoshimensis в Керченском проливе (1986–2016 гг.)
- 1990 году этот биоценоз был обнаружен возле оконечности косы Чушка. Еще через четыре года он фрагментарно располагался в центральной части залива. Еще через четыре года он занимает значительный участок дна возле Керченского полуострова. В 2010 году он располагался между северной частью Керченского полуострова и косой Чушка, и доходил до косы Тузла. К 2016 году этот биоценоз распространился на всю северную часть пролива. На юге он заходит за косу Тузла, но не доходит до Черного моря. Также его фрагмент располагается возле Керченского полуострова.
Его видовое богатство насчитывало 49 видов животных или 39 % всех видов макрозообентоса Керченского пролива обнаруженных в дночерпательных пробах (табл. 1).
89
Терентьев А. С.
![]()
Таблица 1
Видовой состав и средний уровень развития биоценоза Anadara kagoshimensis
в Керченском проливе (1986–2016 гг.)
| Вид | Численность, | Биомасса, г/м2 | Встречаемость, | ||
| экз./м2 | % | ||||
| 1 | 2 | 3 | 4 | ||
| Книдарии | |||||
| Actinia equina | 2,40±1,30 | 0,800±0,440 | 18–40 | ||
| Cylista undata | 0,39±0,10 | 0,004±0,001 | 1–12 | ||
| Сумма | 2,80±1,30 | 0,810±0,440 | |||
| Полихеты | |||||
| Alitta succinea | 5,50±1,90 | 0,280±0,120 | 35–59 | ||
| Genetyllis tuberculata | 0,39±0,27 | 0,001±0,001 | 4–20 | ||
| Hediste diversicolor | 0,78±0,45 | 0,008±0,005 | 8–27 | ||
| Heteromastus filiformis | 0,20±0,05 | менее 0,001 | 1–12 | ||
| Lagis koreni | 0,20±0,05 | 0,002±0,001 | 1–12 | ||
| Leiochone leiopygos | 0,78±0,19 | 0,003±0,001 | 1–12 | ||
| Melinna palmata | 65,00±34,00 | 1,730±0,840 | 53–76 | ||
| Mysta picta | 0,20±0,05 | 0,002±0,001 | 1–12 | ||
| Nephtys cirrosa | 0,20±0,05 | менее 0,001 | 1–12 | ||
| Nephtys hombergii | 4,20±1,70 | 0,124±0,067 | 29–53 | ||
| Perinereis cultrifera | 0,20±0,05 | 0,001±0,001 | 1–12 | ||
| Petaloproctus terricolus | 0,39±0,27 | менее 0,001 | 4–20 | ||
| Scolelepis (Parascolelepis) tridentata | 0,24±0,06 | 0,047±0,011 | 1–12 | ||
| Spirobranchus triqueter | 0,39±0,10 | 0,002±0,001 | 1–12 | ||
| Сумма | 79,00±33,00 | 2,190±0,870 | |||
| Ракообразные | |||||
| Ampelisca diadema | 0,78±0,61 | 0,001±0,001 | 4–20 | ||
| Amphibalanus improvisus | 120,00±41,00 | 4,300±1,600 | 66–87 | ||
| Ampithoe ramondi | 3,10±2,70 | 0,002±0,001 | 4–20 | ||
| Corophium volutator | 0,39±0,10 | менее 0,001 | 1–12 | ||
| Cymadusa crassicornis | 0,20±0,05 | менее 0,001 | 1–12 | ||
| Diogenes pugilator | 0,20±0,05 | 0,019±0,005 | 1–12 | ||
| Ericthonius difformis | 0,20±0,05 | менее 0,001 | 1–12 | ||
| Gammarus subtypicus | 0,20±0,05 | менее 0,001 | 1–12 | ||
| Jassa ocia | 0,20±0,05 | менее 0,001 | 1–12 | ||
| Melita palmata | 2,20±1,60 | 0,003±0,002 | 4–20 | ||
| Microdeutopus damnoniensis | 0,59±0,14 | менее 0,001 | 1–12 | ||
| Microdeutopus gryllotalpa | 0,78±0,61 | 0,001±0,001 | 4–20 | ||
| Rhithropanopeus harrisii | 3,10±1,90 | 2,000±1,300 | 13–34 | ||
| Stenosoma capito | 0,59±0,14 | 0,051±0,012 | 1–12 | ||
| Сумма | 132,00±42,00 | 6,400±2,300 | |||
| Брюхоногие моллюски | |||||
| Bittium reticulatum | 0,20±0,05 | 0,002±0,001 | 1–12 | ||
| Calyptraea chinensis | 0,20±0,05 | 0,005±0,001 | 1–12 | ||
| Hydrobia acuta | 0,78±0,61 | 0,001±0,001 | 4–20 | ||
| Retusa truncatula | 1,18±0,64 | 0,036±0,022 | 13–34 | ||
| Tritia neritea | 0,20±0,05 | 0,059±0,014 | 1–12 | ||
| Tritia pellucida | 0,24±0,06 | 0,028±0,007 | 1–12 | ||
90
Биоценоз Anadara kagoshimensis (Tokunaga, 1906)
в Керченском проливе (Азово-Черноморский бассейн)
![]()
Таблица 1 (продолжение)
| Tritia reticulata | 0,20±0,05 | 0,149±0,036 | 1–12 | |
| Сумма | 2,98±0,99 | 0,280±0,160 | ||
| Двустворчатые моллюски | ||||
| Abra nitida milachewichi | 2,60±1,80 | 0,530±0,380 | 4–20 | |
| Abra segmentum | 15,00±14,00 | 2,300±2,000 | 8–27 | |
| Anadara kagoshimensis | 36,00±11,00 | 320,000±93,000 | 100 | |
| Cerastoderma glaucum | 21,60±9,30 | 23,000±15,000 | 66–87 | |
| Chamelea gallina | 3,00±2,50 | 1,030±0,920 | 8–27 | |
| Gastrana fragilis | 0,59±0,14 | 1,180±0,290 | 1–12 | |
| Lentidium mediterraneum | 0,20±0,05 | 0,009±0,002 | 1–12 | |
| Mya arenaria | 2,40±1,60 | 13,000±12,000 | 4–20 | |
| Mytilaster lineatus | 61,00±36,00 | 21,000±13,000 | 29–53 | |
| Mytilus galloprovincialis | 1,40±1,20 | 0,230±0,220 | 4–20 | |
| Parvicardium exiguum | 2,20±1,30 | 0,500±0,410 | 13–34 | |
| Сумма | 147,00±50,00 | 380,000±100,000 | ||
| Асцидии | ||||
| Molgula appendiculata | 10,80±6,30 | 8,400±6,000 | 18–40 | |
| Сумма | 10,80±6,30 | 8,400±6,00 | ||
| Общая сумма | 380,00±100,00 | 400,000±100,000 | ||
Плотность видов колебалась от 1 до 24 вид/0,1 м2, а в среднем равнялась 8,9±1,2 вид/0,1 м2. В видовом богатстве преобладали полихеты и ракообразные, за ними шли двустворчатые моллюски (рис. 3).
Видовое богатство Численность особей Биомасса
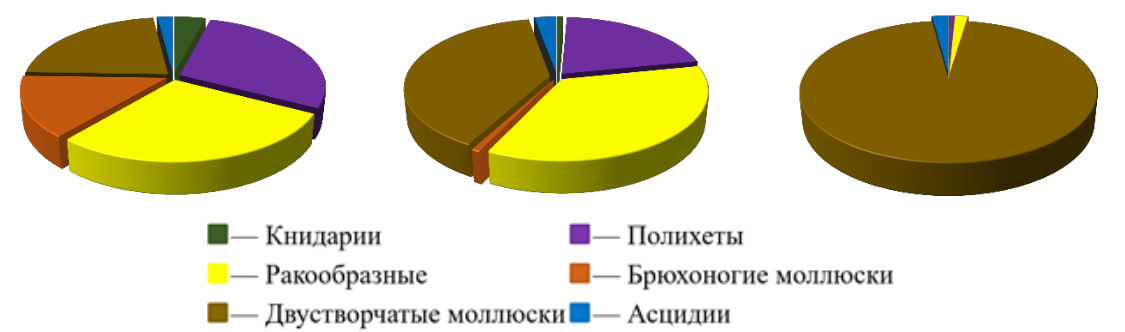
Рис. 3. Доля различных таксономических групп в видовом богатстве, численности особей и биомассе биоценоза Anadara kagoshimensis в Керченском проливе (1986–2016 гг.)
Численность особей в биоценозе колебалась от 10 до 1320 экз./м2, биомасса – от 8 до 1526 г/м2. Как по численности, так и по биомассе в биоценозе доминировали двустворчатые моллюски, включая доминантный вид. Их плотность видов в среднем равнялась 3,12±0,31 вид/0,1 м2, а их доля в видовом богатстве биоценоза была 22 %. Плотность видов могла доходить до 6 вид/0,1 м2. Численность особей колебалась от 10 до 760 экз./м2, биомасса от 7,3 до 1491 г/м2. На их долю приходилось не менее 7 %, в среднем 34–45 % численности особей
- не менее 60 %, в среднем 92–98 % биомассы биоценоза. Важную роль среди двустворчатых моллюсков играл M. lineatus. Его доля в общей численности особей была даже выше, чем у доминантного вида 25–88 %. Этот вид был распределен крайне неравномерно. В основном он образовывал щетки или друзы численностью до 48 экземпляров.
На втором месте стояли ракообразные. Встречаемость этой группы – 80–96 %. Плотность видов в среднем равнялась 1,88±0,48 вид/0,1 м2. Но могла доходить до 8 вид/0,1 м2. На их
91
Терентьев А. С.
![]()
долю приходилось 29 % видового богатства биоценоза. Численность особей могла доходить до 520 экз./м2, биомасса – до 32 г/м 2. На их долю в среднем приходилось 28–43 % общей численности особей и 1–2 % общей биомассы биоценоза. Таким образом, по численности особей их можно считать содоминантами двустворчатых моллюсков. Среди ракообразных доминировал морской желудь A. improvisus. На его долю в среднем приходилось 80–97 % общей численности особей и 58–77 % общей биомассы ракообразных. Этот вид в качестве субстрата очень часто использует живые и мертвые раковины двустворчатых моллюсков, в том числе и анадары. Высокой биомассой также отличался голландский крабик R. harrisii. Однако, этот вид встречался намного реже и имел довольно низкую численность. Она ни разу не превысила 30 экз./м2. Его высокая доля в биомассе ракообразных объясняется только крупными размерами самого животного.
Асцидии по биомассе были сопоставимы с ракообразными. Были представлены только одним видом и встречались реже. В целом их численность не была высокой. Однако, в редких случаях могла достигать 100 экз./м2.
На третьем месте по численности стояли полихеты. Их встречаемость была 73–92 %. Плотность видов в среднем равнялась 2,41±0,48 вид/0,1м2. В отдельных случаях доходила до
- вид/0,1 м2. Численность могла доходить до 440 экз./м2, биомасса – до 12,52 г/м2. На их долю в среднем приходилось 17–25 % общей численности особей и 0,3–0,8 % общей биомассы биоценоза. Среди полихет доминировала M. palmata. На втором месте стояла A. succinea. Высокой численностью и биомассой также отличался N. hombergii.
Брюхоногие моллюски встречались достаточно часто (35–59 %). На их долю приходилось
- % всего видового богатства биоценоза. Однако плотность видов была невысокой, в среднем равнялась 0,65±0,19 вид/0,1м2 и не превышала 2 вид/0,1 м2. Численность особей не превышала 14 экз./м2, а биомасса – 2,54 г/м2. На их долю в среднем приходилось в среднем всего 0,55–1,03 % численности особей и 0,03–0,11 % биомассы биоценоза. Но, не более чем
- % по численности и 2 % по биомассе. Среди них наиболее часто встречалась R. truncatula. На ее долю приходилось 28–51 % численности и 10–16 % биомассы брюхоногих моллюсков.
Книдарии и асцидии также встречались достаточно часто. Но их доля в видовом богатстве была небольшой – всего 6 %. При этом, на их долю в среднем приходилось всего 2,5–4,8 % численности особей и 0,77–3,84 % биомассы биоценоза.
Основная часть видового богатства биоценоза приходилась на полихет, ракообразных и двустворчатых моллюсков. По численности видов доминировали брюхоногие моллюски и ракообразные. Значительная доля видов приходилась на полихет. Биомассу биоценоза в основном определяли двустворчатые моллюски. На долю всех остальных видов приходилось всего 3–6 % биомассы биоценоза.
Руководящие, характерные, редкие и очень редкие виды играли разную роль в видовом богатстве, численности и биомассе биоценоза. На долю доминантного вида приходилось 2 % видового богатства, в среднем 6–13 % численности особей и 75–85 % биомассы биоценоза
(рис. 4).
Наиболее низкая доля доминантного вида в общей численности особей биоценоза наблюдалась в его экотоне с широко распространенном в Черном море биоценозом полихеты M. palmata. Это была самая заиленная часть биоценоза. При этом, на долю анадары здесь приходилось 37 % общей биомассы, а на долю M. palmata всего 1,2 %.
-
- руководящим видам кроме доминантного относились: морской желудь A. improvisus, C. glaucum и M. palmata. На их долю, без учета доминантного вида, приходилось 6 % видового богатства, 48–63 % общей численности особей и 5–9 % общей биомассы биоценоза. На отдельных участках биоценоза их доля по численности особей доходила до 88 %, а по биомассе до 37 %. Плотность видов в среднем равнялась 2,18±0,25 вид/0,1м2. Средняя численность особей руководящих видов равнялась 207±65 экз./м2, при биомассе 29±15 г/м2. На отдельных участках она доходила до 940 экз./м2, при биомассе 261 г/м2. По численности особей доминировал M. improvisus. На его долю приходилось 47–69 % общей численности особей руководящих видов. По биомассе доминировала C. glaucum. На ее долю в среднем
92
Биоценоз Anadara kagoshimensis (Tokunaga, 1906)
в Керченском проливе (Азово-Черноморский бассейн)
![]()
Видовое богатство Численность особей Биомасса
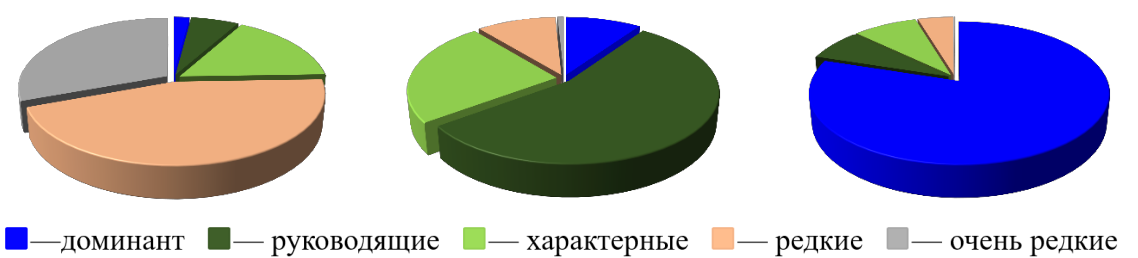
Рис. 4. Доля доминанта, руководящих, характерных, редких и очень редких видов в видовом богатстве, численности и биомассе особей биоценоза Anadara kagoshimensis в Керченском проливе (1986–2016 гг.)
приходилось 64–93 % от общей биомассы постоянных видов и 4–8 % от общей биомассы биоценоза.
-
- характерным видам относились: A. equina, A. succinea, M. appendiculata, M. lineatus, N. hombergii, P. exiguum, R. truncatula и R. harrisii. Плотность этих видов в среднем равнялась
2,6±0,4 вид/0,1м2, а на отдельных участках доходила до 5 вид/0,1м2. Средняя численность особей в биоценозе равнялась 91±37 экз./м2, при биомассе 33±14 г/м2. На отдельных участках численность доходила до 480 экз./м2, при биомассе 183 г/м2. На долю характерных видов приходилось 16 % видового богатства биоценоза, 19–29 % общей численности особей и 5– 12 % биомассы. На отдельных участках биоценоза их доля по численности особей доходила до 47 %, а по биомассе до 36 %. Среди характерных видов доминировал M. lineatus. На его долю в среднем приходилось 44–91 % численности особей и 40–86 % биомассы.
На долю редких видов приходилось 45 % видового богатства биоценоза. Плотность этих видов в среднем равнялось 2,24±0,49 вид/0,1м2. В редких случаях доходила до 9 вид/0,1м2. Средняя численность особей редких видов равнялась 38±14 экз./м2, при средней биомассе 18±12 г/м2. На отдельных участках их численность доходила до 240 экз./м2, а биомасса до 205 г/м2. На долю редких видов в среднем приходилось 8–13 % численности особей и 2–7 % биомассы биоценоза. В очень редких случаях до 50 и 40 % соответственно.
Очень редко встречались: B. reticulatum, C. chinensis, C. crassicornis, D. pugilator, E. difformis, G. subtypicus, H. filiformis, J. ocia, L. koreni, L. mediterraneum, M. picta, N. cirrosa, P. cultrifera, T. neritea и T. reticulata. Их встречаемость в целом была довольно низкой – 18– 40 %. Плотность видов в среднем равнялась 0,88±0,44 вид/0,1м2, но изредка доходила до 7 вид/0,1м2. Численность особей в среднем равнялась 2,9±1,5 экз./м2, а биомасса – 0,25±0,17 г/м2. На отдельных участках их численность доходила до 23 экз./м2, при биомассе 2,700 г/м2. На долю этих видов в среднем приходилось 31 % видового богатства, 0,4–1,2 % численности особей и 0,02–0,11 % биомассы биоценоза. При этом, величина этих показателей не превышала значений – 9 % по численности и 2 % по биомассе.
Редкие и очень редкие виды играют небольшую роль в численности особей и особенно в биомассе биоценоза, но очень большую в его видовом богатстве. Главную роль в численности особей играют характерные и добавочные виды. На долю доминантного вида приходится основная часть биомассы биоценоза.
Большая часть (30–56 % от общей площади) биоценоза располагалась на заиленной ракуше, 16–41 % на иле, 10–32% на ракуше и 1–14 % на песке. Уровень развития биоценоза сильно зависел от типа грунта (табл. 2).
Наиболее сильно от типа грунта зависела общая численность особей в биоценозе, численность не доминантных видов, и их доля в общей численности особей зообентоса. Значительное влияние также оказывалось на плотность видов и выровненность видового состава биоценоза. На остальные показатели уровня развития биоценоза значительное влияние оказывали неорганизованные факторы.
93
Терентьев А. С.
![]()
Таблица 2
Влияние типа грунта на уровень развития биоценоза Anadara kagoshimensis
в Керченском проливе (1986–2016 гг.)
| Организованный фактор | Влияние фактора (%) | ||
| Организованного | Не организованного | ||
| Плотность видов | 22–42 | 58–78 | |
| Численность видов | 53–65 | 35–47 | |
| Биомасса | 5–22 | 78–95 | |
| Значения индекса полидоминантности Симпсона | 8–25 | 75–92 | |
| Доминантный вид: | |||
| Численность | 2–19 | 81–98 | |
| Биомасса | 3–20 | 80–97 | |
| Недоминантные виды: | |||
| Численность | 67–76 | 24–33 | |
| Биомасса | 7–24 | 76–93 | |
| Доля недоминантных видов: | |||
| в численносте | 30–41 | 59–70 | |
| в биомассе | 4–19 | 81–96 | |
Наиболее высоким видовым богатством и плотностью видов отличалась часть биоценоза, лежащая на ракуше, а наиболее низкая на песке (табл. 3).
| Таблица 3 | |||||||
| Уровень развития биоценоза Anadara kagoshimensis на разных грунтах | |||||||
| в Керченском проливе (1986–2016 гг.) | |||||||
| Тип грунта | |||||||
| Характеристики биоценоза | Песок | Ракуша | Заиленная | Ил | |||
| ракуша | |||||||
| Общие характеристики биоценоза: | |||||||
| Видовое богатство | 11 | 29 | 26 | 17 | |||
| Плотность видов, вид/0,1м2 | 4,7±1,0 | 14,7±4,8 | 8,3±1,4 | 7,8±1,1 | |||
| Численность особей, экз./м2 | 100±29 | 840±250 | 306±99 | 124±32 | |||
| Биомасса, г/м2 | 93±42 | 610±260 | 460±240 | 232±96 | |||
| Индекс полидоминантности Симпсона | 4,20±1,00 | 5,20±2,10 | 3,19±0,70 | 3,52±0,41 | |||
| Доминантный вид: | |||||||
| Численность, экз. | 6,7±4,3 | 68±37 | 34±19 | 38±31 | |||
| Биомасса, г/м2 | 71±32 | 460±240 | 400±230 | 162±43 | |||
| Недоминантные виды: | |||||||
| Численность, экз | 92±27 | 770±260 | 272±94 | 87±15 | |||
| Биомасса, г/м2 | 23±14 | 152±64 | 62±41 | 71±58 | |||
| Доля в общей численности, % | 86–93 | 87–96 | 85–92 | 57–82 | |||
| Доля в общей биомассе, % | 14–34 | 10–39 | 7–19 | 14–47 | |||
На ракуше было обнаружено 59 % всего видового богатства биоценоза анадары, в то время как на песке всего 22 %. Плотность видов на ракуше колебалась от 8 до 24 вид/0,1 м2, а на песке не превышала 11 вид/0,1 м2. На заиленной ракуше могла доходить до 13 вид/0,1 м2, а на иле была не более 10 вид/0,1 м2.
Наиболее высокой общей численностью особей отличалась часть биоценоза, лежащая на ракуше. Она колебалась от 343 до 1180 экз./м2. На заиленной ракуше численность особей
94
Биоценоз Anadara kagoshimensis (Tokunaga, 1906)
в Керченском проливе (Азово-Черноморский бассейн)
![]()
изменялась от 70 до 700 экз./м2. На иле, была ниже и находилась в пределах от 53 до 207 экз./м2. На песке не превышала 100 экз./м2.
При этом индекс полидоминантности на всех типах грунта был довольно близким по значению. Главную роль в численности особей играло относительно небольшое количество видов. В большей части это относится к участкам, расположенным на иле и заиленной ракуше, в меньшей к участкам, лежащим на ракуше и песке. По классификации А. А. Шорыгина (1955) биоценоз A. kagoshimensis следует считать островершинным.
Наиболее высокая биомасса биоценоза наблюдалась на ракуше, где она находилась в пределах от 345 до 1137 г/м2. Средняя биомасса биоценоза на заиленной ракуше статистически не отличалась от средней биомассы на ракуше. Биомасса биоценоза здесь колебалась от 8 до 1526 г/м2. На иле она изменялась от 70 до 503 г/м2, а на песке не превышала
- г/м2.
Наиболее высокой численности и биомассы доминантный вид достигал на ракуше, где его численность колебалась от 10 до 135 экз./м2, а биомасса – от 130 до 930 г/м2. На заиленной ракуше она была ниже и находилась в пределах от 10 до 127 экз./м2, а биомасса колебалась от
- до 1470 г/м2 и статистически не отличалась от средней биомассы на ракуше. Численность анадары на иле статистически не отличалась от ее численности на заиленной ракуше и находилась в пределах от 3 до 130 экз./м2. Но биомасса была ниже и находилась в пределах от 61 до 256 г/м2. Наиболее низкая численность и биомасса доминантного вида наблюдалась в части биоценоза, лежащей на песке, где она не превышала 7 экз./м2 и 71 г/м2. На ракуше средний вес особей равнялся 6,7±3,0 г. На заиленной ракуше средний вес особей равнялся 11,8±5,4 г. На иле преобладали мелкие особи, средний вес которых 4,3±2,1 г. На песке преобладали немногочисленные крупные особи со средним весом 10,6±4,8 г.
Наиболее высокая численность особей и биомасса недоминантных видов в биоценозе анадары наблюдалась на ракуше. В среднем по всему биоценозу на долю недоминантных видов приходилось 83–97 % по численности особей и 15–24 % биомассы. При этом, она никогда не превышала 63 % от общей биомассы биоценоза.
-
- целом наиболее высокого уровня развития этот биоценоз достигает на ракуше, а наименьшего на песке (рис. 5).
Видовое богатство части биоценоза, лежащей на ракуше было в 2,6 раза, плотность видов в среднем составила 2,3–3,9, численность – в 6,1–10,7, а биомасса – в 3,8–9,3 раза выше, чем на песке. Части биоценоза, расположенные на иле и заиленной ракуше, образуют отдельную группу, которая ближе к части, располагающейся на песке. Они слабо различаются по плотности видов. Но при этом видовое богатство на заиленной ракуше в 1,5 раза, численность особей в 1,4–3,5, а биомасса в 1,2–2,7 раза выше, чем на иле.
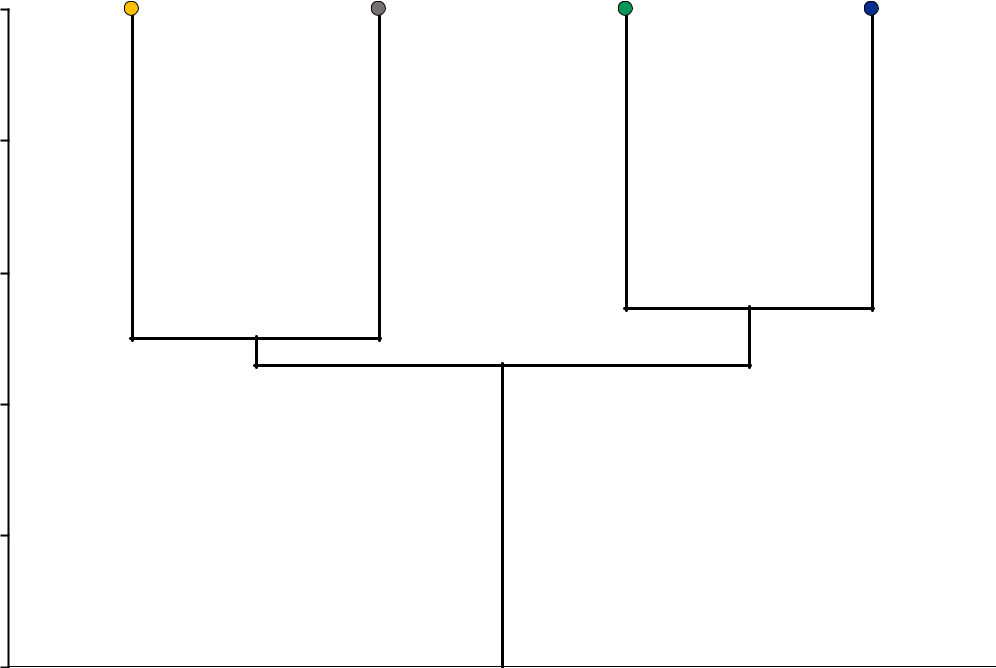
Видовой состав биоценоза A. kagoshimensis на разных грунтах отличается довольно высоким сходством (табл. 4).
Первая располагается на илисто-песчаных грунтах, включающих песок и ил. Вторая часть на ракушечниках, включающих ракушу и заиленную ракушу. Сходство между этими частями по Чекановскому-Сёренсу равнялась 0,46. При этом 67 % видового богатства было общим для обоих частей биоценоза. В первой группе видовое богатство зообентоса почти в 2 раза ниже, чем во второй. Такая разница прежде всего связана с тем, что в видовом богатстве на ракушечниках почти в 2 раза больше полихет и в более чем в 4 раза больше ракообразных.
Биоценоз анадары, расположенный на ракушечниках (ракуша, а также заиленная ракуша) расположен преимущественно к северу от косы Тузла, в основном на месте, ранее существовавшего там биоценоза C. glaucum. Этот биоценоз широко распространен в Азовском море (Воробьев, 1949; Экологический атлас…, 2011; Ревков, Болтачева, 2021; Болтачева и др., 2022). Включает 40 видов животных. Плотность видов колеблется от 4 до 24, а в среднем равняется 10,4±2,0 вид/0,1м2. Численность особей в биоценозе колебалась от 70 до 1180 экз./м2, в среднем равнялась 480±130 экз./м2. Его биомасса колебалась от 7,83 до 1525,97 г/м2, в среднем равнялась 510±170 г/м2. На долю доминантного вида приходилось 7–
- % общей численности особей и 74–90 % общей биомассы биоценоза. На долю ранее
95
Терентьев А. С.
![]()
Таблица 4
Уровень сходства биоценоза Anadara kagoshimensis на разных грунтах в Керченском
проливе (1986–2016 гг.)
Индекс сходства Чекановского-Сёренсена
| Тип грунта | Песок | Ракуша | Заиленная ракуша | Ил |
| Песок | 0,30 | 0,32 | 0,50 | |
| Ракуша | 0,55 | 0,55 | 0,39 | |
| Заиленная ракуша | 0,55 | 0,58 | 0,47 | |
| Ил | 0,64 | 0,53 | 0,59 | |
| Индекс сходства Синкевича-Симпсона | ||||
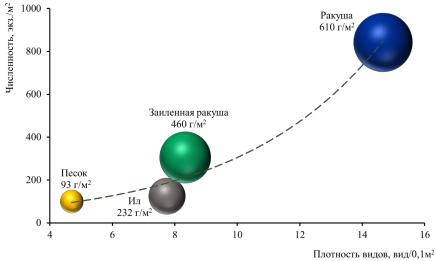
Рис. 5. Зависимость, плотности вида, численности и биомассы особей биоценоза Anadara kagoshimensis от типа грунта в Керченском проливе (1986–2016 гг.)
доминировавшей C. glaucum соответственно 2–9 и 3–10 %. При этом ее встречаемость была 78–99 %. По сравнению с исходным биоценозом видовое богатство осталось на прежнем уровне. Плотность видов выросла в 2–3 раза. Общая численность особей осталась на прежнем уровне. Биомасса увеличилась в 2–4 раза. Ранее доминировавшая C. glaucum уменьшила свою численность в 4–8, а биомассу в 2–5 раза.
-
- среднем индекс сходства Чекановского-Сёренсена равнялся 0,42±0,04, а индекс Синкевича-Симпсона – 0,57±0,02. Общими видами для всех типов грунтов кроме доминантного были: A. improvisus, C. glaucum и M. palmata.
- биоценозе по видовому составу выделяются две части (рис. 6). Часть биоценоза, расположенная на песке к югу от косы Тузла, на месте, ранее существовавшего биоценоза C. gallina. Этот биоценоз характерен для Черного моря (Киселева, 1977; Revkov, Nikolaenko, 2002; Воробьева, Синегуб, 2014; Ревков и др., 2014; Селифонова, Часовников, 2017) в том числе и в районе Керченского предпроливья Черного моря (Терентьев, 2004). На долю ранее доминировавшего вида приходилось 35–50 % численности особей и 13–23 % биомассы биоценоза. Встречаемость C. gallina снизилась до 16–38 %. По сравнению с исходным
96
Биоценоз Anadara kagoshimensis (Tokunaga, 1906)
в Керченском проливе (Азово-Черноморский бассейн)
![]()
| Индекс сходства Чекановского — Сёренса |
Песок Ил Заиленная ракуша Ракуша
1,0
0,8
0,6
0,4
0,2
| 0,0 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | |
| 0,5 |
Рис. 6. Дендрограмма сходства по видовому составу биоценоза Anadara kagoshimensis на разных грунтах в Керченском проливе (1986–2016 гг.)
биоценозом видовое богатство уменьшилось в 6,5, плотность видов в 1,3–2,1, общая численность особей в 2,7–5,1, а биомасса в 1,7–3,7 раза. Ранее доминировавшая C. gallina уменьшила свою численность в 2–3, а биомассу в 7–10 раз.
Часть биоценоза, лежащая на иле, встречается как в северной части пролива, происходит из биоценоза C. glaucum, так и в южной и располагается на месте биоценоза Ch. gallina.
-
- случае трансформации биоценоза C. glaucum в биоценоз A. kagoshimensis видовое богатство уменьшается в 1,2 раза, при этом плотность видов увеличилась в 2,0–2,4 раза. Сходство с исходным биоценозом оказалось довольно значительным (ICS=0,49). Причем, 53 % видов было общими для обоих биоценозов. Изменение видового богатства произошло в основном за счет редких и очень редких видов. Снизилась встречаемость N. hombergii и напротив увеличилась встречаемость литофильных видов, таких как A. equina, Am. improvisus
- M. lineatus. Чаще встречаться стали M. appendiculata, P. exiguum, R. truncatula и R.harrisii.
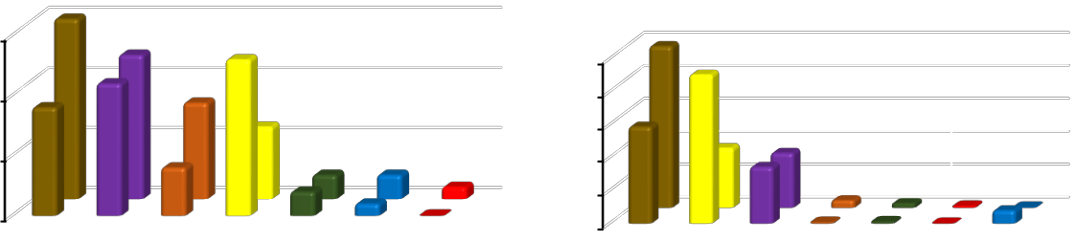
Полностью исчезли иглокожие. Хотя их встречаемость в исходном биоценозе не превышала 4 %. В 1,7 раз уменьшилось видовое богатство двустворчатых моллюсков и в 2 раза брюхоногих моллюсков. При этом, в 2,2 раза увеличилось видовое богатство ракообразных, что в целом компенсировало снижение видового богатства других таксономических групп
(рис. 7).
Общая численность особей в биоценозе практически не изменилась. При этом, 1,2–2,1 раза уменьшилась численность двустворчатых моллюсков. На первое место по численности особей вышли ракообразные, увеличив ее в 1,5–3,5 раза. Общая биомасса увеличилась в 1,9– 4,5 раза. Ее увеличение прежде всего связано с тем, что доминантным видом стал более крупный и массивный моллюск, чья биомасса в 2,0–5,3 раза превосходила биомассу C. glaucum в исходном биоценозе. Численность ранее доминировавшего вида уменьшилась в 3,4–8,9, а его биомасса в 1,4–5,3 раза. При этом, C. glaucum продолжает оставаться руководящим видом, ее встречаемость – 78–99 %.
-
- случае трансформации биоценоза C. gallina в биоценоз A. kagoshimensis видовое богатство уменьшается в 3,6 раза, при этом плотность видов осталась на прежнем уровне.
97
Терентьев А. С.
![]()
| Видовоебогатство | 15 | 2Численность,экз./м | 0 | ||
| 0 | |||||
| 250 | |||||
| 10 | Cerastoderma | 200 | |||
| 150 | |||||
| 5 | Anadara | 100 | |||
| 50 |
Таксономические группы

| 2м | 500 | ||
| г/ | |||
| 400 | |||
| , | |||
| Биомасса | 200 | Anadara | |
| 300 | Cerastoderma | ||
100
0
Таксономические группы
Cerastoderma
Anadara
Таксономические группы

Рис. 7. Динамика видового богатства, численности и биомассы особей при трансформации биоценоза Cerastoderma glaucum в биоценоз Anadara kagoshimensis в Керченском проливе (1986–2016 гг.)
| Видовое богатство |
| Биомасса, г/м2 |
25
20
15
10
5
0
250
200
150
100
50
0
Chamelea
Anadara

Chamelea
Anadara
Таксономическая группа
| Численность, экз./м2 |
250
200
150
100
50
0
Chamelea
Anadara
Таксономическая группа

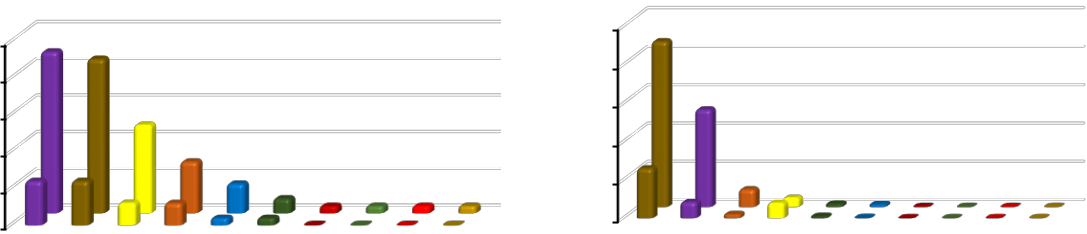
Рис. 8. Динамика видового богатства, численности особей и биомассы при трансформации биоценоза Chamelea gallina в биоценоз Anadara kagoshimensis в Керченском проливе (1986–2016 гг.)
98
Биоценоз Anadara kagoshimensis (Tokunaga, 1906)
в Керченском проливе (Азово-Черноморский бассейн)
![]()
Сходство с исходным биоценозом оказалось невысоким (ICS=0,37). Причем, 85 % видов было общими для обоих биоценозов, то есть разница в сходстве видового богатства объясняется прежде всего его сокращением. Из видового богатства практически полностью исчезли форониды, панцирные моллюски, иглокожие и крупные виды немертин (рис. 8).
Из 4 видов асцидий продолжала встречаться только M. appendiculata. В 4,0 раза сокращается видовое богатство ракообразных, в 3,7 – полихет, в 3,5 – двустворчатых моллюсков и в 2,3 раза – брюхоногих моллюсков. Общая численность особей биоценоза уменьшилась в 2,6–4,2 раза. Численность полихет сократилась в 3,9–8,1 раз, брюхоногих моллюсков – в 2,4–6,3 раза. Двустворчатые моллюски продолжают доминировать, но их численность уменьшилась в 2,2–4,5 раза. Общая биомасса снизилась в 1,2–1,7 раза. Наиболее большие потери в биомассе понесли брюхоногие моллюски. Их биомасса сократилась в 78– 163 раза. Биомасса полихет уменьшилась в 5,5–16 раз. Биомасса двустворчатых моллюсков уменьшилась в 1,1–1,6 раза. При трансформации биоценоза C. gallina в биоценоз
- kagoshimensis ранее доминировавший вид практически исчезает из биоценоза. Встречаются только его разрозненные единичные особи.
При образовании биоценоза A. kagoshimensis на месте биоценоза C. glaucum статистически значимых изменений численности и биомассы недоминантных видов не произошло. В то время как при его формировании на месте биоценоза C. gallina численность недоминантных видов сократилась в 2,0–4,1, а их биомасса – в 3,0–7,9 раза. В первом случае произошло внедрение вселенца в ранее существующий биоценоз. Во втором, образование нового биоценоза сопровождалось разрушением предшествующего.
При образовании биоценоза A. kagoshimensis на наиболее заиленных участках как в северной, так и в южной частях пролива наблюдается значительное уменьшение численности особей зообентоса. При этом, снижение биомассы исходных биоценозов компенсируется биомассой нового доминантного вида.
ЗАКЛЮЧЕНИЕ
Биоценоз Anadara kagoshimensis в Керченском проливе образовался на месте биоценозов Cerastoderma glaucum и Chamelea gallina. В его составе насчитывается 49 видов животных. Плотность видов колеблется от 1 до 24 и в среднем равняется 8,9±1,2 вид/0,1м2. В видовом богатстве преобладают ракообразные. Численность особей находится в пределах от 10 до 1320, в среднем – 380±100 экз./м2. Доминируют по численности особей двустворчатые моллюски совместно с ракообразными. Биомасса изменяется от 8 до 1526, в среднем – 400±100 г/м2. По биомассе доминируют двустворчатые моллюски. На долю доминантного вида в среднем приходится 6–13 % численности видов и 75–85 % биомассы биоценоза. Наиболее высокого уровня развития этот биоценоз достигает на ракуше, а наиболее низкого на песке. При трансформации биоценоза C. glaucum видовое богатство уменьшилось в 1,2 раза, при этом плотность видов увеличилась в 2,0–2,4 раза, общая численность особей в биоценозе осталась на прежнем уровне, общая биомасса, за счет биомассы анадары, увеличилась в 1,9–4,5 раза. При трансформации биоценоза C. gallina видовое богатство уменьшилось в 3,6 раза, плотность видов практически не изменилась, общая численность уменьшилась в 2,6–4,2 раза, общая биомасса – в 1,2–1,7 раза. При образовании биоценоза анадары на месте биоценоза C. glaucum произошло внедрение вселенца в ранее существовавшее сообщество, в котором он занял лидирующее место. В то время как его образование на месте биоценоза C. gallina сопровождалось существенной перестройкой предшествующего сообщества.
Список литературы
Болтачева Н. А., Ревков Н. К., Надольный А. А., Аннинская И. Н. Донная фауна юго-западной части Азовского моря. Таксономический состав и биоценотическая организация макрозообентоса в 2016–2017 гг. // Морской биологический журнал. – 2022 – Т. 1, № 2. – С. 3–22.
99
Терентьев А. С.
![]()
Броцкая В. А., Зенкевич Л. А. Количественный учет донной фауны Баренцева моря // Труды ВНИРО. – 1939. – Т. IV. – С. 5–126.
Воробьев В. П. Бентос Азовского моря // Труды АзЧерНИРО. – 1949. – Вып. 13. – 193 с.
Воробьева Л. В., Синегуб И. А. Зообентос биоценозов Одесского морского региона Черного моря // Экосистемы, их оптимизация и охрана. – 2014. – Вып. 11. – С. 198–206.
Жадин В. И. Методы гидробиологических исследований. – М.: Высшая школа, 1960. – 191 с.
Живоглядова Л. А., Ревков Н. К., Фроленко Л. Н., Афанасьев Д. Ф. Экспансия двустворчатого моллюска Anadara kagoshimensis (Tokunada, 1906) в Азовском море // Российский журнал биологических инвазий. – 2021. – №1. – С. 83–94.
Киселева М. И. Структура биоценоза Venus gallina в Черном море // Биология моря. Вопросы гидробиологии Черноморского шельфа. – 1977. – Вып. 43. – С. 85–93.
Киселева М. И. Сравнительная характеристика донных сообществ у побережья Кавказа // Многолетние изменения зообентоса Чёрного моря / [Ред. В. Е. Заика]. – Киев: Наукова думка, 1992. – С. 84–99.
Лейбсон Р. Г. Количественный учет донной фауны Мотовского залива // Труды ВНИРО. – 1939. – Т. IV. –
- 127–198.
Любищев А. А. Дисперсионный анализ в биологии. – Москва: МГУ, 1986. – 200 с.
Определитель фауны Черного и Азовского морей. Т. 1. Свободноживущие беспозвоночные. Простейшие, губки, кишечнополостные, черви, щупальцевые. – Киев: Наукова думка, 1968. – 437 с.
Определитель фауны Черного и Азовского морей. Т. 2. Свободноживущие беспозвоночные. Ракообразные. – Киев: Наукова думка, 1969. – 536 с.
Определитель фауны Черного и Азовского морей. Т. 3. Свободноживущие беспозвоночные. Членистоногие (кроме ракообразных), моллюски, иглокожие, щетинкочелюстные, хордовые. – Киев: Наукова думка, 1972. – 340 с. Песенко Ю. А. Принципы и методы количественного анализа в фаунистических исследованиях. – Москва:
Наука, 1982. – 287 с.
Ревков Н. К., Тимофеев В. А., Лисицкая Е. В. Состав и сезонная динамика макрозообентоса локального биотического комплекса Chamelea gallina (западный Крым, Черное море) // Экосистемы, их оптимизация и охрана. – Вып. 11. – 2014. – С. 247–259.
Ревков Н. К. Особенности колонизации Чёрного моря недавним вселенцем – двустворчатым моллюском Anadara inaequivalvis (Bivalvia: Arcidae) // Морской биологический журнал. – Т. 1, № 2. – 2016. – С. 3–17.
Ревков Н. К., Болтачева Н. А. Донная фауна юго-западной части Азовского моря: трансформация биоценоза макрозообентоса в начале XXI века // Экосистемы. – Вып. 26 (56). – 2021. – С. 51–66.
Розенберг Г. С. Несколько слов об индексе разнообразия Симпсона // Самарская Лука. – Т. 16, № 3 (21). – 2007. – С. 581–584.
Селифонова Ж. П., Часовников В. К. Экологическое состояние зообентоса прикавказской зоны Черного моря (район Джугба – Хоста) // Система контроля окружающей среды. – Вып. 10 (30). – 2017. – С. 109–118.
Терентьев А. С. Биоценоз Chamelea gallina в Керченском предпроливье Черного моря. Основные результаты комплексных исследований ЮгНИРО в Азово-Черноморском бассейне и миовом океане // Труды ЮгНИРО. –
- 45. – 2004. – С. 34–39.
Терентьев А. С. Макрозообентос юго-западной части Азовского моря в условиях эксплуатации газоконденсатных месторождений // Экологическая безопасность прибрежной и шельфовой зоны и комплексное использование ресурсов шельфа: Сборник научных трудов. – 2009. – Вып. 17.– С. 327–348.
Фомичёва А. И., Фроленко Л. Н. Состояние биоценоза моллюска-вселенца Cunearca cornea (Scapharca inaequivalvis) в Азовском море // Эколого-биологические проблемы вод и биоресурсов: пути решения / Сборник научных трудов Всероссийской конференции. Ульяновск, 2007. – С. 2003–2004.
Фроленко Л. Н., Мальцева О. С. О сообществе Anadara в Азовском море // Актуальные рыбохозяйственные
- экологические проблемы Азово-Черноморского региона / Материалы IX международной научно-практической конференции. Керчь. 6 октября 2017. – 2017. – С. 99–103.
Шорыгин А. А. О биоценозах // Бюллетень МОИП. Отдел биологический. – Т. 60, вып. 6. – 1955. – С. 87–98. Экологический атлас Азовского моря / [Гл. ред. акад. Г. Г. Матишов; отв. ред. Н. И. Голубева,
В. В. Сорокина]. – Ростов-на-Дону: ЮНЦ РАН, 2011. – 328 с.
Balogh J. Lebensgemeinschaften der Landtiere. – Berlin, 1958. – 560 р.
Bodenheimer F. S. Precisd’ecologieanimal. – Paris, 1955. – 315 р.
Wesselingh F. P., Neubauer T. A., Anistratenko V. V., Vinarski M. V., Yanina T., ter Poorten J. J., Kijashko P.,
Albrecht C., Anistratenko O. Yu., D’Hont A., Frolov P., Gándara A. M., Gittenberger A., Gogaladze A., Karpinsky M.,
Lattuada M., Popa L., Sands A. F., van de Velde S., Vandendorpe J., Wilke T. Mollusc species from the Pontocaspian region – an expert opinion list // ZooKeys 827. – 2019. – Р. 31–124.
Hurlbert S. H. The nonconcept of species diversity: A critique and alternative parameters // Ecology. – 1971. – Vol. 52, N 4– P. 577–586.
Krapal A.-M., Popa O. P., Levarda A. F., Iorgu E. I., Costache M., Crocetta F., Popa L. O. Molecular confirmation on the presence of Anadara kagoshimensis (Tokunaga, 1906) (Mollusca: Bivalvia: Arcidae) in the Black Sea. Travaux du Museum National d’Histoire Naturelle “Grigore Antipa”. – 2014. – Vol. 57, N 1.– P. 9–12.
Pilombo F. B. Phylogenetic analysis of the Balanidae (Cirripedia, Ballanomorpha) // Zoologica Scripta. – 2004. – Vol. 33, N 3.– P. 261–276.
100
Биоценоз Anadara kagoshimensis (Tokunaga, 1906)
в Керченском проливе (Азово-Черноморский бассейн)
![]()
Revkov N. K., Nikolaenko T. V. Biodiversity of Zoobenthos in the Coastal Zone of South Coast of Crimea (Laspi Bay Area) // Russian Journal of Marine Biology. – 2002. – Vol. 28, N 3.– P. 151–162.
Simpson E. H. Measurement of diversity // Nature. – Vol. 163, N 688. – 1949. – 688 p.
Terentijev A. S., Litvinenko N.M. Biocenosis of intruders Mya arenaria and Cunearca cornea (Scapharca) in the north-western Azov Sea. // The Black Sea ecological problems / International symposium «Black Sea Strategic Action Plan Implementations (1996-2000)». – Odessa. SCSEIO, 2000. – P. 315–317.
World Register of Marine Species (WoRMS). URL: (дата обращения 28.12.2022).
Zaitzev Yu., Mamaev V. Biodiversity in the Black Sea: A study of Change and Decline. New York: United Nations Publications. – 1997. – 208 p.
Terentev A. S. Biocoenosis of the ark clam Anadara kagoshimensis (Tokunaga, 1906) in the Kerch Strait (Azov and Black Sea Basin) // Ekosistemy. 2023. Iss. 36. P. 87–101.
A bivalve mollusk Anadara kagoshimensis is a recent invasive species in the Azov and Black Sea Basin, originating from the temperate waters of the Pacific Ocean. It has become one of the dominant species in the Kerch Strait. The biocenosis includes 49 species of animals. The density of species varies from 1 to 24 and averages 8.9±1.2 species/0.1 m2. Crustaceans predominate in terms of species richness. The population ranges from 10 to 1320 individuals, with 80±100 ind./m2 on average. Bivalve mollusks, together with crustaceans, play a key role in the population density of the bioceonosis. The biomass varies from 8 to 1526, with an average of 400±100 g/m2. Bivalve mollusks dominate in biomass. The dominant species, on average, is responsible for 6–13 % of the total abundance and 75–85 % of the total biomass. The highest development level is reached on shelly substrates and the lowest one is observed on sandy substrates. In general, the species composition of the biocoenosis on different substrates is quite similar. The most pronounced difference in the species richness is recorded for the parts of the biocoenosis residing on sandy and shelly bottoms. By 2016, the biocoenosis had expanded over the entire northern area of the Strait; however, it did not spread into the Black Sea. It was formed in the place of Cerastoderma glaucum and Chamelea gallina biocoenosis, characteristic to the Black and Azov Seas. During the transformation of C. glaucum biocoenosis, the species richness decreased by 1.2 times, while its density increased by 2.0– 2.4 times. Total abundance of the biocoenosis remained stable. The total biomass increased by 1.9-4.5 times due to the biomass of Anadara kagoshimensis. The transformation of Ch. gallina biocoenosis has resulted in the decrease in the species richness by 3.6 times. Its species density remained virtually unchanged. The total abundance decreased by 2.6–4.2 times, and the total biomass declined by 1.2–1.7 times. The formation of An. kagoshimensis biocenosis in place of C. glaucum biocenosis resulted in the introduction of the invasive species into the pre-existing community, where it took a dominant position. Meanwhile, its formation in the place of the Ch. gallina bioceonosis was accompanied by the destruction of the previous community.
Key words: Anadara kagoshimensis, Kerch Strait, Azov and Black Sea basin, biocenosis, zoobenthos, succession.
Поступила в редакцию 14.01.23
Принята к печати 22.09.23
101

