| Экосистемы, 37: 7–16 (2024) | https://ekosystems.cfuv.ru |
| УДК 551.464(262.5-751) | DOI: 10.29039/2413-1733-2024-37-7-16 |
Биологическое обрастание бассейна Карадагского дельфинария (Крым, Чёрное море)
Рябушко Л. И., Мирошниченко Е. С., Широян А. Г.
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
larisa.ryabushko@yandex.ru, mircyano@gmail.com, arminka_shir@mail.ru
В работе представлены результаты изучения обрастания и гидрохимических показателей бассейна Карадагского дельфинария в мае 2019 г. Найдены разнообразные виды беспозвоночных (асцидии, балянусы, губки, инфузории, мшанки, двустворчатые моллюски и др.), фрагменты талломов красной водоросли Ceramium sp. Обнаружены диатомовые водоросли (17 видов и внутривидовых таксонов, 13 родов). В массовых количествах отмечены колониальные гетеротрофные виды Bacillaria paxillifer, Berkeleya rutilans, Nitzschia hybrida f. hyalina, Parlibellus delognei, а также указан единично потенциально токсичный вид Halamphora coffeiformis. Впервые обнаружены цианобактерии (12 видов, 7 родов) с преобладанием колоний Phormidium и Spirulina, а также новые для Крыма и Чёрного моря виды Gloeocapsopsis pleurocapsoides, Leptolyngbya ectocarpi и Phormidium roseum.
Среди цианобактерий отмечено 6 фикоэритрин-содержащих видов, у которых в прижизненном состоянии клетки имеют интенсивную окраску от розового до фиолетового цвета. Составлен список диатомовых и цианобактерий с указанием экологических и фитогеографических характеристик. Приведены микрофотографии некоторых видов биоты в прижизненном состоянии. Показано, что концентрации минеральных форм азота и фосфора в воде дельфинария высокие, а содержание кремния имеет близкие значения к морским водам. По результатам биологического анализа и гидрохимическим показателям состояние бассейна является удовлетворительным для содержания млекопитающих животных, но рекомендуется чаще производить механическую чистку стенок бассейна для недопущения обильного развития обрастания.
Ключевые слова: беспозвоночные; диатомовые водоросли; цианобактерии; Карадагский дельфинарий; Чёрное море.
ВВЕДЕНИЕ
Дельфинарии являются искусственно созданными экосистемами, в которых благоприятное для млекопитающих состояние окружающей среды должно поддерживаться человеком и отвечать множеству строгих требований (ПП РФ № 1937, 2019). Но даже при самом тщательном соблюдении всех предписанных правил по содержанию и очистке резервуаров для животных, на их стенках возникает пленка обрастания, содержащая бактерии, микроводоросли, простейшие, а в дальнейшем – более крупные прикрепленные гидробионты.
В конце 1960-х годов в СССР началось изучение дельфинов и Карадагская биостанция стала первым учреждением, поместившим дельфинов в условия бассейна с целью исследований биоакустики, слуховой рецепции, акустической ориентации дельфинов и ластоногих. В результате многолетних научных исследований по Карадагскому дельфинарию к настоящему моменту накоплен обширный экспериментальный материал и получены уникальные результаты (https://karadag-dolphin.ru).
Роль организмов обрастания в функционировании как природных, так и искусственных экосистем разнообразна. Микроводоросли, особенно диатомовые, обладают способностью усваивать биогенные элементы, и очищать воду от органических веществ, являются индикаторами «цветения» воды в море и потенциально токсичных видов, опасных для биоты и людей (Moestrup, Lundholm, 2002; Рябушко, 2003, 2013). Они участвуют в процессах минерализации и биодеградации различных типов загрязнения, в самоочищении водной среды, формируют высокое биоразнообразие и могут быть источником вторичного загрязнения среды (Рябушко и др., 2020; Jenkinson, Lappin-Scott 2001; Larned, 2010; Ryabushko et al., 2021).
Среди микроводорослей обрастания ведущее место занимают диатомовые водоросли, которые являются показателями качества водной среды в море (Прошкина-Лавренко, Алфимов, 1954; Гусляков и др., 1992; Рябушко, 2013; Балычева, 2014; Балычева, Рябушко, 2017; Рябушко и др., 2019; Рябушко и др., 2020; Barinova et al., 2019). Из-за слабой изученности цианобактерий в прибрежье моря (Садогурская, 2000, 2007, 2013; Виноградова, Брянцева, 2017) их биоиндикаторные характеристики используются гораздо реже диатомовых водорослей (Stoyanov et al., 2016; Рябушко и др., 2020; Ryabushko et al., 2021).
Исследования микро- и макрообрастания в местах содержания млекопитающих животных в дельфинариях имеют важное значение, прежде всего для контроля за их здоровьем, поскольку кожные покровы китообразных могут подвергаться обрастанию различными организмами, в том числе патогенными (Рябушко, 1992, 2002; Биркун, Гольдин, 1997). Это особенно касается дельфинов, находящихся в закрытых бассейнах, в которых проводятся регулярная смена воды и санитарная обработка.
Первые исследования микроводорослей обрастания кафельных стенок Карадагского дельфинария проведены при разных уровнях освещённости, а также соскобов с поверхности кожи дельфинов-афалин, находящихся как в дельфинарии, так и в море (Рябушко, 2002, 2013). На наш взгляд, важными параметрами их содержания являются не только биологические характеристики, но и гидрохимические показатели внутри бассейна с млекопитающими животными и сравнение их с морской водой близ Карадага (Трощенко и др., 2020).
Для оценки качества морской воды в океанариумах необходимо проводить одновременные комплексные исследования биоты и гидрохимических показателей. Поэтому результаты данной работы являются актуальными и помогут выявить некоторые особенности развития организмов обрастания в закрытом бассейне.
Цель работы — оценить видовое разнообразие биоты обрастания в бассейне Карадагского дельфинария.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования биоты послужили соскобы суспензии со стенок кафеля Карадагского дельфинария после слива воды из бассейна, осуществленные 17 мая 2019 года. Основными объектами изучения были диатомовые водоросли и цианобактерии, клетки которых исследовали в прижизненном состоянии в световом микроскопе Axioskop 40 С Zeiss (Германия) с использованием программы AxioVision Rel. 4.6.
Идентификацию видов диатомовых и цианобактерий, оценку их эколого-фитогеографических характеристик проводили с использованием следующих источников (Косинская, 1948; Диатомовый анализ…, 1950; Прошкина-Лавренко, 1963; Гусляков и др., 1992; Komárek, Anagnostidis, 1999, 2005; Рябушко, 2013; Рябушко, Бегун, 2016; Рябушко и др., 2017; Рябушко и др., 2019; Barinova et al., 2019; AlgaeBase, 2022) с учётом таксономической ревизии цианобактерий Чёрного моря (Виноградова, Брянцева, 2017). Отбор проб для анализа гидрохимических показателей проводили в поверхностных водах и на дне бассейна при солёности 17,92 ‰, а также в море при 17,99 ‰ (табл. 1).
Таблица 1
Гидрохимические показатели Карадагского дельфинария
| Место отбора проб | O2, мл/л |
Окисление, мгО/л |
NO2 | NO3 | NН4 | PO4 | Si |
| мкг/л | |||||||
| Бассейн (поверхность) | 4,42 | – | 8,6 | 125,2 | 56,6 | 25,4 | 103,3 |
| Бассейн (дно) | 5,81 | 3,28 | 8,7 | 101,6 | 103,3 | 29,4 | 110,5 |
| Сброс воды в море | 5,16 | 3,66 | 11,3 | 105,9 | 344,6 | 45,6 | 100,0 |
| Море (2-х метровая полоса) | 5,93 | 3,96 | 1,6 | 8,8 | 2,6 | 4,2 | 135,6 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Содержание кислорода в воде из бассейна находилось не ниже предельно допустимых концентраций (4,42 мл/л), величины окисляемости также не превышали ПДК (3,28 мгО/л), что характерно для чистых вод (табл. 1). Концентрации биогенных элементов в бассейне дельфинария и в местах сброса воды в море превышали эти значения для открытых вод, что обусловлено накоплением растворенного органического вещества от животных и продуктов его минерализации. Ранее было отмечено, что концентрации биогенных элементов в 2-метровой зоне моря в 3,5 раз выше по сравнению с прибрежными водами (Трощенко и др., 2020).
Однако биологический метод контроля качества воды является наиболее универсальным, так как при этом используются самые разнообразные гидробионты. В бассейне найдено более 2-х десятков экземпляров асцидий (Tunicates) разного возраста (рис. 1): Diplosoma sp., Molgula euprocta (Drasche, 1884) – одиночная, прикреплённая, Botryllus schlosseri (Pallas, 1766) – колониальная асцидия, Pyura herdmani (Drasche, 1884) – сидячая асцидия, а также более одного десятка губок, в единичных экземплярах встречался двустворчатый моллюск Mytilaster lineatus (Gmelin, 1791), а также Sipunculida – тип морских первичноротых червеобразных животных, планктонные формы инфузорий, усоногий рак Balanus improvisus Darwin, 1854 (рис. 1 а), колониальные мшанки Conopeum seurati (Canu, 1928), в большом количестве полихеты рода Spirorbis, которые обрастали всех беспозвоночных и входили в состав биоплёнки обрастания. Показано, что все беспозвоночные в дельфинарии представлены в основном видами морского происхождения.
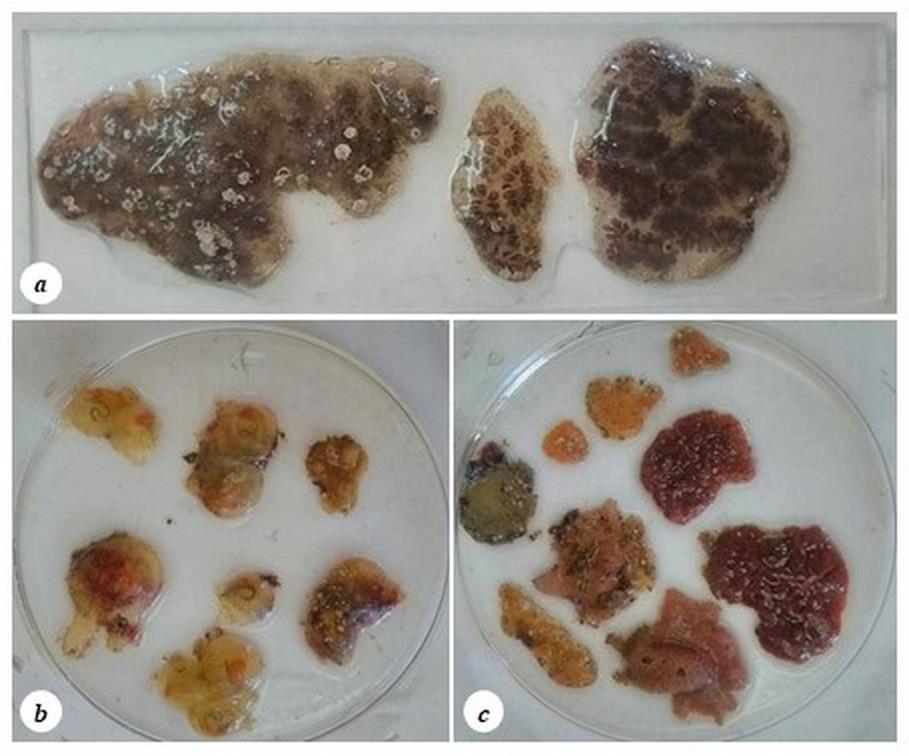
Рис. 1. Асцидии вместе с балянусами из обрастания Карадагского дельфинария на предметном стекле (а) и в чашках Петри (b, c)
Из водорослей-макрофитов отмечены фрагменты талломов красной водоросли Ceramium sp. вместе с цианобактериями (рис. 2). Основное внимание в работе уделено изучению видового разнообразия диатомовых водорослей и цианобактерий, представленных разными видами, относящихся к бентосным формам. Составлен их список с указанием экологических и фитогеографических характеристик. Всего обнаружено 29 видов, 20 родов, из них Bacillariophyta – 17 видов, 13 родов и Cyanobacteria – 12 видов, 7 родов (табл. 2, рис. 3).
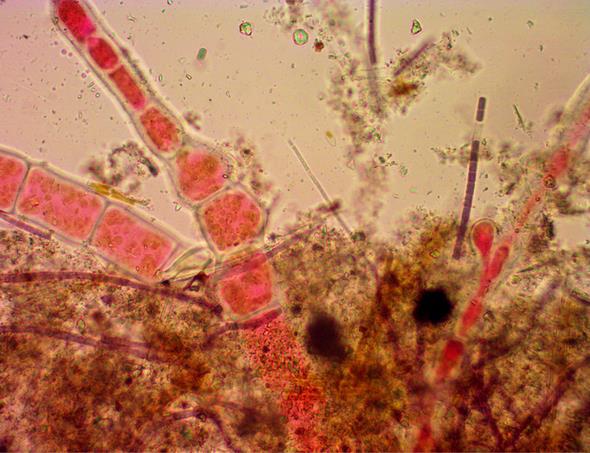
Рис. 2. Фрагменты талломов красной водоросли-макрофита Ceramium sp. и колонии цианобактерий Карадагского дельфинария
Отношение видов диатомовых водорослей к солёности воды распределялось следующим образом: солоноватоводно-морские (9 видов), морские (5), солоноватоводные (2), преобладали космополиты 6 видов (табл. 2). Найдено 9 сапробионтных видов с преобладанием β-мезосапробионтов – индикаторов умеренного органического загрязнения вод, которые являются обычными в прибрежных водах Чёрного, Азовского и Японского морей (Рябушко, 2013; Рябушко, Бегун, 2015; Рябушко и др., 2019; Barinova et al., 2019).
Обилие биоты в дельфинарии можно объяснить повышенным содержанием биогенных элементов в бассейне (табл. 1) по сравнению с морем (Трощенко и др., 2020). Как было установлено ранее, млекопитающие животные Океанариума в Казачьей бухте Чёрного моря также оказывали влияние на увеличение концентрации биогенных элементов и на возрастание численности бентосных диатомовых водорослей в бухте вблизи бассейна с животными в 2– 2,5 раза по сравнению с открытым морем (Рябушко, 2013).
Почти во всех пробах встречалось одновременно множество колоний диатомовых водорослей и цианобактерий (рис. 3).
Анализ полученных данных показал, что повышенное содержание биогенных элементов влияет на обилие диатомовых и цианобактерий, среди которых в массе представлены гетеротрофные колониальные виды диатомовых водорослей Bacillaria paxillifer, Tabularia
Таблица 2
Список донных диатомовых водорослей и цианобактерий Карадагского дельфинария и их эколого-фитогеографические характеристики (Крым, Чёрное море)
| Таксоны | Характеристики | |||
| ЭХ | ФГХ | |||
| ЖФ | S, ‰ | S | ||
| CYANOBACTERIA (12 видов, 7 родов) | ||||
| Aphanocapsa salina Woronichin 1929 | Б | С | – | АБТ |
| Cyanosarcina chroococcoides (Geitler) Kovácik 1988 | Б | П | – | БТ нот |
| Gloeocapsopsis pleurocapsoides (Novácek) Komárek & Anagnostidis ex Komárek 1993 * | Б | П | – | АБТ нот |
| Jaaginema subtilissimum (Kützing ex Forti) Anagnostidis & Komárek 1988 | Б | эг | α | К |
| Leptolyngbya ectocarpi (Gomont) Anagnostidis & Komárek 1988 * | Б | М | – | БТ |
| Leptolyngbya fragilis (Gomont) Anagnostidis & Komárek 1988 | Б | М | β-ο | К |
| Leptolyngbya foveolarum (Gomont) Anagnostidis & Komárek 1988 | Б | П | β-α | БТ |
| Lyngbya agardhii Gomont 1892 | Б | М | – | БТ |
| Phormidium breve (Kützing ex Gomont) Anagnostidis & Komárek 1988 | Б | П | α | АБТ нот |
| Phormidium roseum (Batters) Anagnostidis 2001 * | Б | М | – | БТ |
| Spirulina subsalsa Oersted ex Gomont 1892 | Б | эг | β-ο | БТ нот |
| Spirulina versicolor Cohn ex Gomont 1892 | Б | М | – | Б |
| BACILLARIOPHYTA (бентосные виды, 17 видов, 13 родов) | ||||
| Achnanthes brevipes С.A. Agardh 1824 | Кол, ОШ | СМ | β | К |
| Amphora bigibba Grunow ex Schmidt 1875 | ОЖ, ДШ | М | – | БТ |
| Amphora macilenta Gregory 1857 | ОЖ, ДШ | М | – | Б нот |
| Bacillaria paxillifer (O.F. Müller) N. Hendey 1951 | Кол, ОШ | СМ | о-β | К |
| Berkeleya rutilans (Trentepohl) Grunow 1880 | Кол, ДШ | СМ | – | АБ нот |
| Caloneis liber (W. Smith) P.T. Cleve 1894 | ОЖ ДШ | М | β | K |
| Fallacia pygmaea (Kützing) A.J. Stickle et D.G. Mann 1990 | ОЖ, ДШ | CМ | – | БТ |
| Grammatophora angulosa Ehrenberg 1839 | Кол, БШ | М | β | K |
| Halamphora coffeiformis (C.A. Agardh) Z. Levkov 2009 | ОЖ, ДШ | СМ | α | АБТ |
| Nitzschia hybrida f. hyalina Proschkina-Lavrenko 1963 | Кол, KШ | СМ | β | Б |
| Nitzschia lanceolata W. Smith 1852 | ОЖ, KШ | С | β | БТ нот |
| Nitzschia macilenta Gregory 1857 | ОЖ, КШ | М | – | Б нот |
| Nitzschia sigma (Kützing) W. Smith 1853 | ОЖ, KШ | C | – | АБТ |
| Parlibellus delognei (Van Heurk) E.J. Cox 1988 | Кол, ДШ | М | – | АБТ |
| Pleurosigma elongatum W. Smith 1852 | ОЖ, ДШ | СМ | – | К |
| Tabularia tabulata (C.A. Agardh) Snoeijs 1992 | Кол, БШ | СМ | β—α | К |
| Tryblionella coarctata (Grunow) D.G. Mann 1990 | ОЖ, БШ | CМ | β-p | БТ |
Примечание к таблице. * – новые виды для Чёрного моря. ЭХ – экологическая характеристика. ЖФ – жизненные формы: Б – бентосные виды, Кол – колониальные, ОЖ – одиночноживущие, БШ – бесшовные, ОШ – одношовные, ДШ – двушовные и KШ – каналошовные; S ‰ – отношение видов к солёности воды (M – морские, СМ – солоноватоводно-морские, С – солоноватоводные, П – пресноводные, эг – эвригалинные); S – индексы сапробности: β – бетамезосапробионты, β-α – бета—альфамезосапробионты, β-p – бетаполисапробионты, α – альфамезосапробионты, o—α – олиго—альфамезосапробионты, о-β – олиго-бетамезосапробионты. ФГХ – фитогеграфическая характеристика: Б – бореальные; БТ – бореально-тропические; AБ – аркто-бореальные; АБТ – аркто-бореально-тропические; К – космополиты; нот – нотальные виды, указанные в южном и северном полушарии.
tabulata, Berkeleya rutilans, Parlibellus delognei, Nitzschia hybrida f. hyalina, а также цианобактерии Aphanocapsa salina, Leptolyngbya fragilis, L. foveolarum, Lyngbya agardhii, Spirulina subsalsa, S. versicolor (рис. 3), часто встречаемые в прибрежных водах Крыма (Рябушко, 2013; Балычева, 2014; Балычева, Рябушко, 2017; Рябушко и др., 2017; Рябушко и др., 2020; Ryabushko et al., 2021).
Цианобактерии в Чёрном море ещё недостаточно изучены (Косинская, 1948; Садогурская, 2000, 2007, 2013; Рябушко, 2013; Виноградова, Брянцева, 2017; Рябушко и др., 2020; Ryabushko et al., 2021). Поэтому более подробно приведём их характеристики для Карадагского дельфинария. Все обнаруженные цианобактерии в мае в бассейне являются бентосными, из них 7 – морские и эвригалинные, а также 4 – пресноводные и один солоноватоводный вид (табл. 2). По фитогеографической шкале большинство видов принадлежит к бореально-тропическим и аркто-бореально-тропическим формам, а также отмечено три космополита и один бореальный. Пять индикаторов сапробности относится к мезосапробной зоне.
Морские виды цианобактерий Leptolyngbya ectocarpi, Phormidium roseum и пресноводный Gloeocapsopsis pleurocapsoides ранее не были указаны в крымском прибрежье и Чёрном море, два первых из них отмечены в Средиземном море (Komárek, Anagnostidis, 2005, AlgaeBase…, 2022). Вид Gl. pleurocapsoides чаще обитает на поверхности скал аэрофитно (Komárek, Anagnostidis, 1999) и, возможно, в бассейн занесён случайно. Шесть видов A. salina, C. chroococcoides, L. foveolarum, L. agardhii, S. subsalsa, S. versicolor, широко распространённые в Чёрном море, также часто встречаются у южного берега Крыма (Косинская, 1948; Algae of Ukraine…, 2006; Рябушко, 2013; Садогурская, 2013; Балычева, 2014; Виноградова, Брянцева, 2017).
У видов цианобактерий A. salina, C. chroococcoides, L. ectocarpi, L. agardhii, P. roseum и S. versicolor отмечена интересная особенность, а именно: в прижизненном состоянии их клетки имеют интенсивную окраску от розового до фиолетового цвета (рис. 4), что свидетельствует о высоком содержании в их клетках пигментов С-фикоэритринов, представляющих большой интерес для биотехнологии.
Окраска клеток цианобактерий обусловлена соотношением в них количества пигментов, которое может меняться в зависимости от характеристик света, его интенсивности и глубины проникновения, а также мутности, турбулентности, минеральной насыщенности воды и наличия некоторых органических веществ (Кондратьева, 1996; Стадничук и др., 2015). По соотношению разных фикобилипротеинов в морских цианобактериях, найденные нами виды с красными клетками, по-видимому, входят в группу с преобладанием фикоэритрина над фикоцианином. Отмечено, что фикоэритрин-содержащие цианобактерии чаще обитают в затенённых местообитаниях.
ЗАКЛЮЧЕНИЕ
По данным гидробиологической съёмки установлен состав обрастателей бассейна Карадагского дельфинария, состоящий из видов мейобентоса, бентосных диатомовых водорослей и цианобактерий. Обнаружено 29 видов микрообрастания, принадлежащих к 20 родам, из них Bacillaryophyta – 17 видов, 13 родов и Cyanobacteria – 12 видов, 7 родов. Преобладают солоноватоводно-морские и морские виды, а среди цианобактерий отмечены и пресноводные виды. Всего выявлено 14 сапробионтных видов диатомовых и цианобактерий с доминированием β-мезосапробионтов – индикаторов умеренного органического загрязнения вод. Виды цианобактерий Gloeocapsopsis pleurocapsoides, Leptolyngbya ectocarpi и Phormidium roseum впервые указаны для вод Крыма и Чёрного моря. Единично встречен
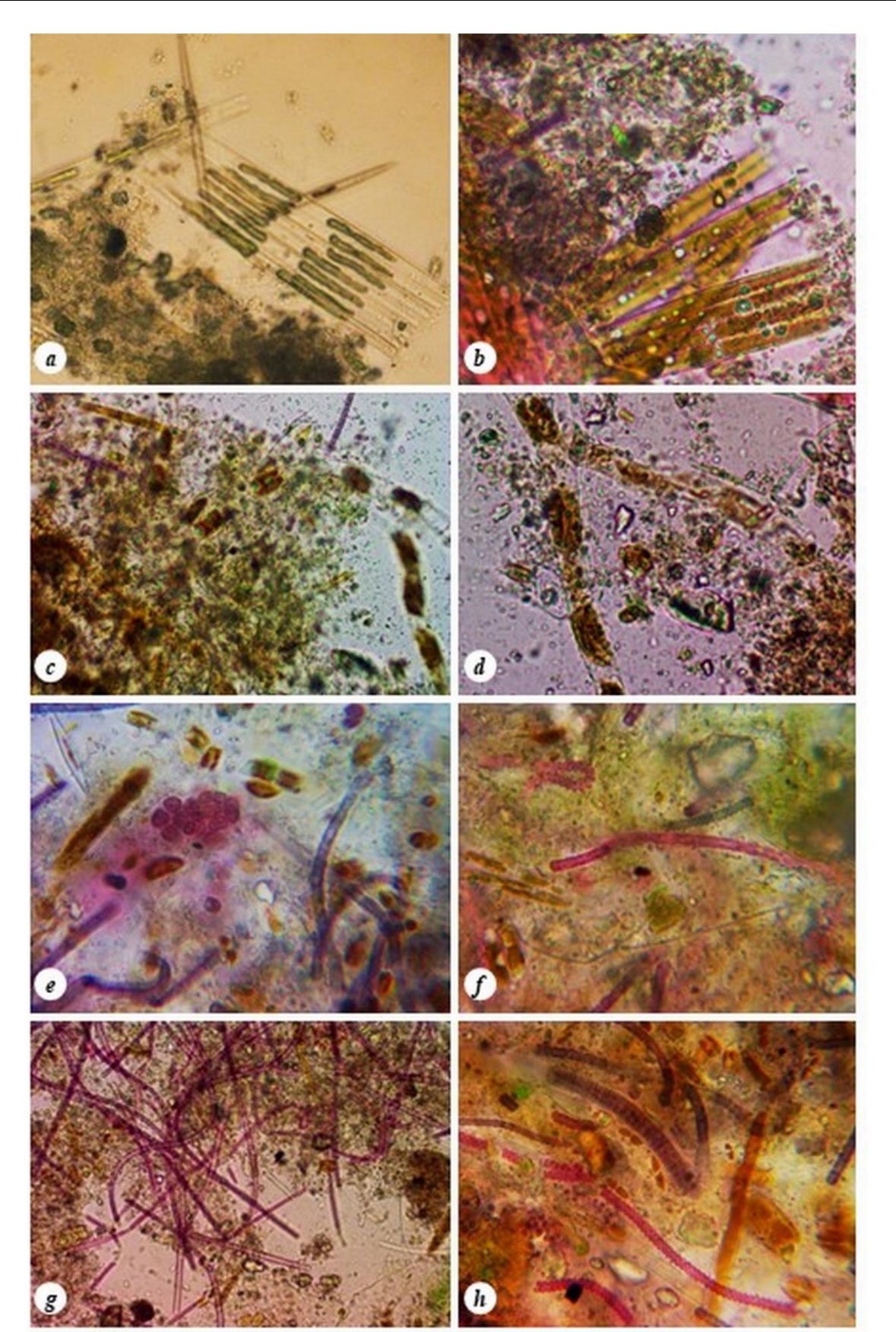
Рис. 3. Колонии диатомовых водорослей Карадагского дельфинария: Bacillaria paxillifer (a), Tabularia tabulata (b), Berkeleya rutilans (c), Parlibellus delognei (d-е), цианобактерии (f-h)
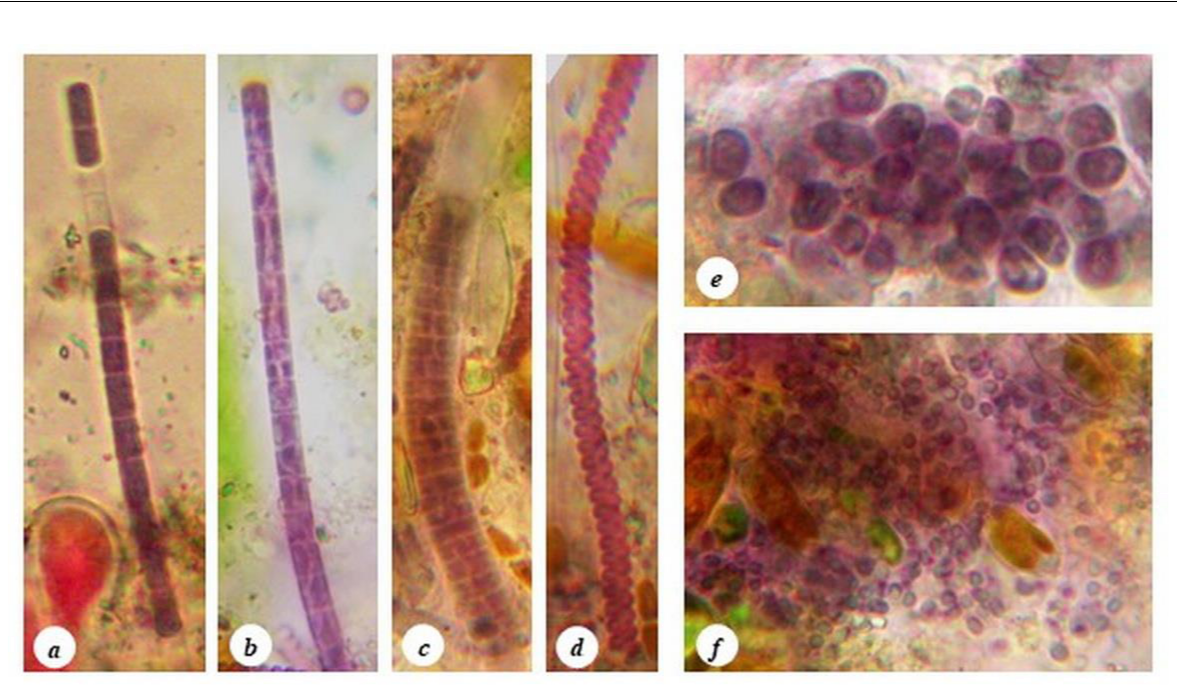
Рис. 4. Фикоэритрин-содержащие цианобактерии Карадагского дельфинария: Phormidium roseum (a, b), Lyngbya agardhii (c), Spirulina versicolor (d), Cyanosarcina chroococcoides (e), Aphanocapsa salina (f)
потенциально токсичный одиночноживущий вид диатомовой водоросли Halamphora coffeiformis. Сообщества макрообрастания, диатомовых водорослей и цианобактерий на стенках дельфинария сильно развито за счёт повышенной по сравнению с морем концентрации биогенных элементов.
В целом по санитарно-химическим показателям и биогенным элементам состояние Карадагского дельфинария можно считать не загрязнённым и удовлетворительным местом обитания для дельфинов. Однако в связи с большим количеством многочисленных обрастателей растительного и животного происхождения можно рекомендовать для улучшения состояния среды обитания морских млекопитающих дельфинария не только менять воду, но чаще производить механическую чистку стенок бассейна для недопущения развития обильного обрастания.
Благодарности. Приносим свою признательность сотрудникам Отдела аквакультуры и морской фармакологи ИнБЮМ РАН к. б. н. В. А. Гринцову за консультацию по определению некоторых видов беспозвоночных мейобентоса и к. г. н. Н. П. Ковригиной за предоставление гидрохимических данных.
Работа выполнена по государственному заданию ФИЦ ИнБЮМ № 121030300149-0.
Список литературы
Балычева Д. С. Видовой состав и структурно-функциональные характеристики микроводорослей перифитона антропогенных субстратов в крымском прибрежье Чёрного моря: автореф. дис. … канд. биол. наук: 03.02.10 – Гидробиология. – Севастополь, 2014. – 24 с.
Балычева Д. С., Рябушко Л. И. Микроводоросли бентоса заповедника «Лебяжьи острова» (Чёрное море) // Nature Conservation Research. Заповедная наука. – 2017. – T. 2 (Suppl. 2). – С. 9–18. https://doi:org/10.24189/ncr.2017.027.
Биркун А. А. мл., Гольдин Е. Б. Микроскопические водоросли в патологии китообразных // Мікробіологический журнал. – 1997. – Т. 59, № 2. – С. 96–107.
Виноградова О. Н., Брянцева Ю. В. Таксономическая ревизия Cyanobacteria/Cyanoprokaryota черноморского побережья Украины // Альгология. – 2017. – Т. 27, № 4. – С. 436–457.
Гусляков Н. Е., Закордонец О. А., Герасимюк В. П. Атлас диатомовых водорослей бентоса северо-западной части Чёрного моря и прилегающих водоёмов. – Киев: Наукова думка, 1992. – 112 с.
Диатомовый анализ. Определитель ископаемых и современных диатомовых водорослей. Кн. 3. – Л.: Госгелиоиздат, 1950. – 398 с.
Косинская Е. К. Определитель морских синезеленых водорослей. – М.–Л.: Изд-во АН СССР. – 1948. – 278 с.
Кондратьева Н. В. Автотрофные прокариоты: учебное пособие. – М.: Изд-во МГУ, 1996. – 312 с.
Прошкина-Лавренко А. И. Диатомовые водоросли бентоса Чёрного моря. – M.–Л.: Изд-во Академии наук СССР, 1963. – 243 с.
Прошкина-Лавренко А. И., Алфимов Н. Н. Об использовании диатомовых водорослей при оценке санитарного состояния морских вод // Ботанический журнал – 1954. – Т. 39, № 1. – С. 108–112.
Рябушко Л. И. Микроводоросли обрастаний черноморских дельфинов-афалин. – Севастополь, 1992. – 14 с. Деп. в ВИНИТИ 09.03.92, №747-В92.
Рябушко Л. И. Микроводоросли кожных покровов черноморских дельфинов-афалин и мест их обитания // Mорські біотехнічні системи. – 2002. – Вип. 2. – С. 188–203.
Рябушко Л. И. Потенциально опасные микроводоросли Азово-Черноморского бассейна / [Ред. В. И. Рябушко]. – Севастополь: ЭКОСИ–Гидрофизика, 2003. – 288 с.
Рябушко Л. И. Микрофитобентос Чёрного моря / [Ред. А. В. Гаевская]. – Севастополь: ЭКОСИ-Гидрофизика., 2013. – 416 с.
Рябушко Л. И., Бегун А. А. Диатомовые водоросли микрофитобентоса Японского моря. В 2-х т. Т. 1. – Симферополь: Н. Орiанда, 2015. – 228 с.
Рябушко Л. И., Бегун А. А. Диатомовые водоросли микрофитобентоса Японского моря (Синопсис и Атлас). В 2-х т. Т. 2. – Севастополь: ПК «КИА», 2016. – 324 с.
Рябушко Л. И., Поспелова Н. В., Балычева Д. С., Ковригина Н. П., Трощенко О. А., Капранов С. В. Микроводоросли эпизоона культивируемого моллюска Мytilus galloprovincialis Lam. 1819, фитопланктон и гидролого-гидрохимические характеристики акватории мидийно-устричной фермы (Севастополь, Чёрное море) // Морской биологический журнал. – 2017. – Т. 2, № 4. – С. 67–83. DOI: 10.21072/mbj.2017.02.4.07.
Рябушко Л. И., Бондаренко А. В., Баринова С. С. Индикаторные микроводоросли бентоса в оценке степени органического загрязнения вод на примере крымского прибрежья Азовского моря // Морской биологический журнал. – 2019. – Т. 4, № 3. – С. 69–80. DOI: 10.21072/mbj.2019.04.3.07
Рябушко Л. И., Бондаренко А. В., Мирошниченко Е. С., Лишаев Д. Н., Широян А. Г. Диатомовые водоросли и цианобактерии перифитона экспериментальных синтетических полимерных материалов в Карантинной бухте Чёрного моря // Биология внутренних вод. – 2020. – № 4 – С. 355–363.
Садогурская С. А. Предварительные данные о видовом разнообразии Cyanophyta супралиторали южного берега Крыма // Экология моря. – 2000. – Вып. 52. – С. 48–51.
Садогурская С. А. Новые для Украины таксоны Cyanophyta (Cyanoprocaryota) // Альгология. – 2007. – Т. 17, № 2. – С. 254–261.
Садогурская С. А. Аннотированный список Cyanoprocaryota морской каменистой супралиторали природного заповедника «Мыс Мартьян» // Черноморский ботанический журнал. – 2013. – Т. 9, № 1. – С. 125–138.
Стадничук И. Н., Красильников П. М., Зленко Д. В. Фикобилисомы и фикобилипротеины цианобактерий // Микробиология. – 2015. – Т. 84, № 2. – С. 131–143.
Трощенко О. А., Ковригина Н. П., Лисицкая Е. В., Родионова Н. Ю., Капранов С. В., Еремин И. Ю. Абиотические и биотические характеристики прибрежных вод района Карадага в мае 2019 г. // Труды Карадагской научной станции им. Т. И. Вяземского – природного заповедника РАН. – 2020. – Вып. 1 (13). – С. 10–18.
Чепурнов В. А. Бентосные диатомовые водоросли и гарпактикоиды черноморского каменистого мелководья района Карадага и их пищевые отношения: автореф. дис. … канд. биол. наук: 03.00.18 Гидробиология. – Севастополь, 1988. – 25 с.
AlgaeBase. World-wide electronic publication, National University of Ireland, Galway / [Eds. M. D. Guiry, G. M. Guiry]. – 2022. URL: http://www.algaebase.org [accessed: 20.03.2022].
Algae of Ukraine: Diversity, Nomenclature, Taxonomy, Ecology and Geography. Vol. 1. Cyanoprocaryota, Euglenophyta, Chrysophyta, Xanthophyta, Raphidophyta, Phaeophyta, Dinophyta, Cryptophyta, Glaucocystophyta, and Rhodophyta / [Eds. P. M. Tsarenko, S. P. Wasser and E. Nevo]. – A.R.G. Gantner Verlag, Ruggell/Liechtenstein. – 2006. – 716 p.
Barinova S. S., Bondarenko A. V., Ryabushko L. I., Kapranov S. V. Microphytobenthos as indicator of water quality and organic pollution in the Western coastal zone of the Sea of Azov // Oceanological and Hydrobiological Studies. – 2019. – Vol. 48, N 2. – P. 21–35. https://karadag-dolphin.ru
Jenkinson H. F., Lappin-Scott H. M. Biofilms adhere to stay // Trends in Microbiology. – 2001. – N 9. – P. 9–10. Komárek J., Anagnostidis K. Cyanoprokaryota. 1 Teil: Chroococcales. Süßwasserflora von Mitteleuropa. Bd 19/1. Heidelberg, Berlin: Spektrum Akademischer Verlag. – 1999. – 523 p.
Komárek J., Anagnostidis K. Cyanoprokaryota. 2 Teil: Oscillatoriales. Süßwasserflora von Mitteleuropa. Bd 19/2. München: Elsevier GmbH. – 2005. – 759 p.
Larned S. T. A prospectus for periphyton: recent and future ecological research // Journal of the North American Benthological Society. – 2010. – Vol. 29, N 1. – P. 182–206.
Moestrup Ø., Lundholm N. Diatoms (Class Bacillariophyceae, Phylum Heterokontae). IOC Taxonomic Reference List of Toxic Algae, IOC of UNESCO. – 2002. http://ioc.unesco.org/hab/data4 taxlist.htm.
Ryabushko L., Miroshnichenko E., Blaginina A., Shiroyan A., Lishaev D. Diatom and cyanobacteria communities on artificial polymer substrates in the Crimean coastal waters of the Black Sea // Marine Pollution Bulletin. – 2021. – Vol. 169. Article no. 112521 (10 p.). DOI: 10.1016/j.marpolbul.2021.112521 SCOPUS 1.548/Q1.
Stoyanov P., Teneva I., Mladenov R., Belkinova D. Filamentous cyanoprokaryotes (Cyanoprokaryota/Cyanobacteria) in standing waters of Bulgaria: diversity and ecology // Journal of BioScience and Biotechnology – 2016. – Vol. 5, N 1. – P. 19–28.
Ryabushko L. I., Miroshnichenko E. S., Shiroyan A. G. Biological fouling of the Karadag Dolphinarium (Crimea, Black Sea) // Ekosistemy. 2024. Iss. 37. P. 7–16.
The article discusses the results of the study of biofouling and hydrochemical indicators conducted in Karadag Dolphinarium in May 2019. The different species of invertebrates (ascidians, sponges, balanus, ciliates, bryozoans, mitilasters, etc.), fragments of the red algae Ceramium sp. were found. Diatoms (17 species and infraspecific taxa, 13 genera) were also identified. Colonial heterotrophic species Bacillaria paxillifer, Berkeleya rutilans, Nitzschia hybrida f. hyalina, Parlibellus delognei were observed in large quantities. Moreover, a single potentially toxic species of Halamphora coffeiformis was recorded. Сyanobacteria (12 species, 7 genera) with a predominance of colonies of Phormidium and Spirulina were detected for the first time. Additionally, the researchers documented new species for Crimea and the Black Sea: Gloeocapsopsis pleurocapsoides, Leptolyngbya ectocarpi, and Phormidium roseum. Among cyanobacteria, 6 species containing phycocyanin pigments were noted with intense cells colours ranging from pink to purple. A list of diatoms and cyanobacteria was compiled, indicating ecological and phytogeographic characteristics. Microphotographs of some species of biota in their living state were provided. It was proved that the concentration of mineral forms of nitrogen and phosphorus in the water of dolphinarium was high, while the content of silicon was close to the seawater. According to the results of biological analysis and hydrochemical indicators, the condition of the pool is satisfactory for keeping mammals. However, it is recommended to clean the pool walls mechanically more often to prevent the excessive biofouling development.
Key words: invertebrates, diatoms, cyanobacteria, Karadag Dolphinarium, Black Sea.
Поcтупила в редакцию 26.09.23
Принята к печати 31.10.23

