БАКТЕРИАЛЬНАЯ РЕМИДИАЦИЯ И ПЕРСПЕКТИВЫ ЕЕ ИСПОЛЬЗОВАНИЯ (ОБЗОР)
BACTERIAL REMEDIATION AND PROSPECTS FOR ITS UTILIZATION (REVIEW)
JOURNAL: «EKOSISTEMY», Issue 38, 2024
Publication text (PDF): Download
UDK: 574.24, 57.044, 579.222
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Sizentsov A. N., Salnikova E. V.
Orenburg State University, Orenburg, Russia
TYPE: Article
DOI: https://doi.org/10.29039/2413-1733-2024-38-150-165
PAGES: from 150 to 165
STATUS: Published
LANGUAGE: Russian
KEYWORDS: bioremediation, biosorption, heavy metals, detoxification.
ABSTRACT (ENGLISH):
The escalating technogenic burden on the environment has adverse effects on ecological systems at various levels. Heavy metals significantly contribute to environmental contamination due to their strong biological impact and cumulative properties. The search for new methodological approaches to mitigate the consequences of technogenic pollution induced by heavy metals is an urgent task for ensuring the environmental sustainability of the region. Physical and chemical remediation techniques have several drawbacks, such as high costs and incomplete removal, which can lead to secondary contamination. Bacterial remediation is a highly efficient method that ensures a reduction in the level of human-induced pressure on the ecological system: bacteria – water – soil – plant – animal – human. The article examines meta-analytical data on the mechanisms of interaction between bacterial cells and metals, as well as methods of soil bioremediation and assessment of the sorption characteristics of microorganisms from the genus Bacillus sp. The results of empirical studies presented in the review demonstrate significant bioremediation potential of representatives of this group towards essential and xenobiotic elements from the group of heavy metals. Thus, the level of mercury sorption from substrates can reach up to 96.40 % of the applied concentration, lead – up to 99.5 %, cadmium – 98.3 %, arsenic – 98.3 %, nickel – 99.2 %, chromium – 95.0 %, copper – 91.8 % and zinc – 87.0 %, respectively. The research focuses on developing alternative methods that are not only highly efficient but also environmentally friendly for remediating areas affected by human-induced stress, by utilizing bacterial cell populations. The majority of the analyzed works studies use indigenous strains the tolerance to metals and sorption capacity of which are determined by their selection characteristics under conditions of excessive cationic load of metals on their environment.
ВВЕДЕНИЕ
Загрязнение окружающей среды опасными отходами, органическими загрязнителями и тяжелыми металлами отрицательно влияет на природные экосистемы и наносит существенный ущерб здоровью человека. Основным источником данных загрязнителей являются не только антропогенные факторы, но так же и различные стихийные бедствия (ураганы, извержения вулканов, землетрясения и т. д.). Тяжелые металлы обладают выраженным кумулятивным действием и проявляют свою токсичность за счет накопления в сельскохозяйственных почвах с последующим внедрением в пищевую цепочку, создавая тем самым серьезную угрозу продовольственной безопасности. Традиционные и физические методы дороги и малоэффективны в районах с низкой токсичностью металлов. Таким образом, биоремедиация является экологически чистым и эффективным методом восстановления окружающей среды, загрязненной тяжелыми металлами, путем использования внутренних биологических механизмов микроорганизмов и растений для уничтожения опасных загрязнителей (Ojuederie, Babalola, 2017).
Биоремедиация – это метод, используемый для удаления загрязнителей окружающей среды из экосистемы. Он использует биологические механизмы, присущие микроорганизмам и растениям, для удаления опасных загрязнителей и восстановления экосистемы до ее первоначального состояния. Основные принципы биоремедиации включают снижение растворимости этих загрязнителей окружающей среды за счет изменения pH, окислительно-восстановительных реакций и адсорбции поллютантов из окружающей среды (Ayangbenro, Babalola, 2017).
Цель наших исследований – провести анализ литературных данных исследования механизмов бактериальной сорбции тяжелых металлов и практического использования биоремедиационного потенциала микроорганизмов.
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
Механизмы сорбции металлов бактериальными клетками
Микробная ремедиация описывается как использование микроорганизмов для поглощения, осаждения, окисления и восстановления тяжелых металлов в почве. Микроорганизмы обладают удивительными метаболическими путями, которые используют различные токсичные соединения в качестве источника энергии для роста и развития посредством дыхания, ферментации и кометаболизма. Благодаря своим характерным ферментам, разрушающим конкретный загрязнитель, они развили разнообразные механизмы поддержания гомеостаза и устойчивости к тяжелым металлам, чтобы адаптироваться к токсичным металлам в экосистеме (Su, 2014). Стратегии, разработанные микроорганизмами для дальнейшего существования в средах, загрязненных тяжелыми металлами, включают такие механизмы, как биоаккумуляция, биоминерализация, биосорбция и биотрансформация. Эти механизмы используются для восстановления на месте (очистка на месте загрязнения) или ex situ (загрязненный участок можно выкопать или откачать и обработать вдали от места загрязнения). Благодаря этим способностям они эффективно используются в качестве биосорбентов для удаления и восстановления тяжелых металлов. Большинство тяжелых металлов разрушают мембраны микробных клеток, но микроорганизмы могут вырабатывать защитные механизмы, которые помогают им преодолеть токсическое воздействие (Wei et al., 2014).
Детоксикация может происходить посредством механизма валентной трансформации. Это особенно применимо в случае металлов, различные валентные состояния которых различаются по токсичности. Так, например, у ртуть устойчивых бактерий ртутьорганическая лиаза превращает метилртуть в Hg(II), которая в сто раз менее токсична, чем метилртуть (Wu, et al. 2010). Восстановление Cr(VI) до Cr(III) широко изучено, причем Cr(III) обладает меньшей подвижностью и токсичностью. Другие механизмы детоксикации тяжелых металлов осуществляются посредством связывания металлов, компартментализации вакуолей и улетучивания. Связывание металлов включает хелаторы, такие как металлотеин, пептиды, производные глутатиона, называемые фитохелатинами, и пептиды, связывающие металлы. Эти хелаторы связываются с тяжелыми металлами и способствуют микробной абсорбции и транспортировке ионов металлов. Механизмы улетучивания включают перевод ионов металлов в летучее состояние. Это возможно только с легколетучими соединениями элементов, такими как ртуть и селен. Устойчивые к ртути бактерии используют фермент MerA для восстановления Hg(II) до летучей формы Hg0 (Wu et al., 2010). Восстановление Se(V) до элементарного Se0 использовалось для очистки загрязненных вод и почв. Метаболические процессы этих организмов помогают трансформировать загрязняющие вещества в окружающей среде (Siddiquee et al., 2015).
Биосорбция, биоаккумуляция, биотрансформация и биоминерализация являются методами используемыми микроорганизмами для их дальнейшего существования в загрязненной металлами среде. Эти стратегии используются для процедур восстановления экосистемы (Gadd, 2000; Lin, 2005). Удаление тяжелых металлов может осуществляться как живыми организмами, так и биоматериалом погибших клеток. Крупномасштабное технико-экономическое применение биосорбционных процессов показало, что мертвая биомасса более применима, чем подход биоаккумуляции, который предполагает использование живых организмов и, следовательно, требует подачи питательных веществ и сложной системы биореактора. Также токсичность загрязняющих веществ, а также другие неблагоприятные условия окружающей среды могут способствовать невозможности поддержания здоровой микробной популяции. Однако, многие характерные свойства живых микроорганизмов не использовались в крупномасштабных исследованиях (Park et al., 2010). Для достижения цели восстановления выбранный организм должен выработать устойчивость к ионам металлов при контакте с загрязнителем тяжелых металлов. Выбранный организм может быть родным для загрязненной окружающей среды или быть изолированным из другой среды и принесен на загрязненный участок (Sharma et al., 2000).
Клеточная структура микроорганизма способна улавливать ионы тяжелых металлов и впоследствии сорбировать их на местах связывания клеточной стенки (Malik, 2004). Данный процесс называется биосорбцией или пассивным поглощением и не зависит от метаболического цикла. Количество сорбированного металла зависит от кинетического равновесия и состояния металла на клеточной поверхности. Механизм включает в себя несколько процессов такие как электростатическое взаимодействие, ионный обмен, осаждение, окислительно-восстановительные реакции и поверхностное комплексообразование (Yang et al., 2015). Эти процессы быстрые и могут реализовываться в течение нескольких минут. Биосорбция может осуществляться фрагментами клеток и тканей или мертвой биомассой или живыми клетками в виде пассивного поглощения посредством поверхностного комплексообразования на клеточной стенке и других внешних слоях (Fomina, Gadd, 2014). Другой метод представляет собой процесс, при котором ионы тяжелых металлов проходят через клеточную мембрану в цитоплазму в рамках клеточного метаболического цикла. Это называется биоаккумуляцией или активным поглощением. Биоаккумуляция является сложным процессом живой клетки, который зависит от множества физических, химических и биологических механизмов. Эти факторы включают внутриклеточные и внеклеточные процессы, где биосорбция играет ограниченную и неясную роль (Fomina, Gadd, 2014). Организм, который будет накапливать тяжелые металлы, должен иметь толерантность к одному или нескольким металлам в более высоких концентрациях и должен проявлять повышенные трансформационные способности, переводя токсичные химические вещества в безвредные формы (рис. 1), что позволяет организму уменьшить токсическое действие металла и в то же время, держать металл под контролем (Mosa et al., 2016).
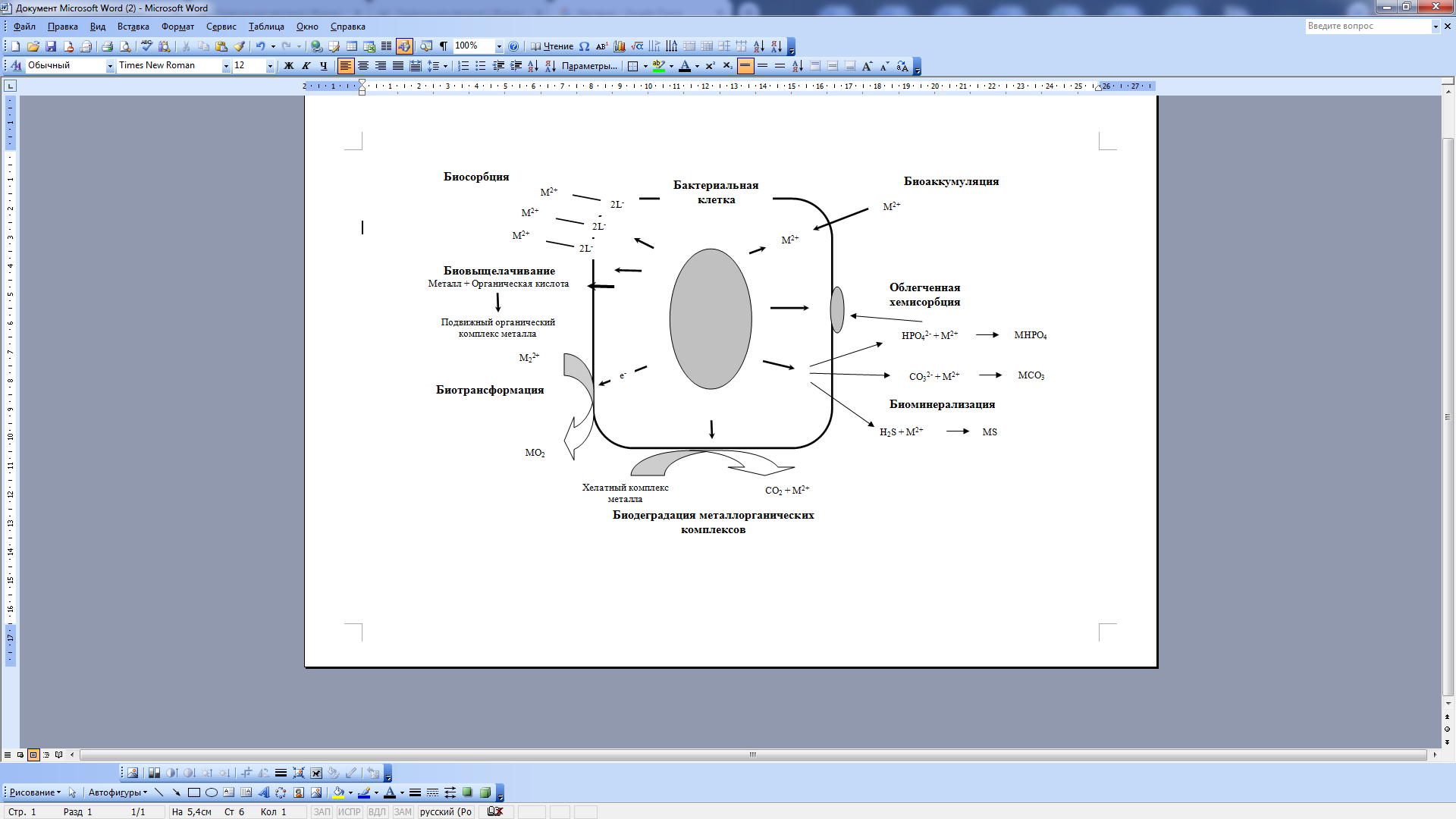
Рис. 1. Механизмы взаимодействия бактериальной клетки с металлами
Механизмы поглощения металлов различными биосорбентами зависят от клеточной поверхности микроорганизмов, а также от обмена ионов металлов и комплексных образований с ионами металлов на химически активных участках клеточной поверхности. Они были тщательно изучены в отношении различных изотерм биосорбции, полученных в результате экспериментов по сорбции и влияния различных факторов, таких как pH, предварительная обработка биомассы и биомасса организмов. Затем на поверхности клетки происходит осаждение избыточных ионов металлов в результате реакций нуклеации. Все микроорганизмы имеют отрицательный заряд на поверхности своих клеток из-за наличия анионных структур, которые позволяют им связываться с катионами металлов. Отрицательно заряженными группами, участвующими в адсорбции металлов, являются спиртовая, аминная, карбоксильная, сложноэфирная, гидроксильная, сульфгидрильная, фосфорильная, сульфонатная, тиоэфирная и тиоловая группы (Gavrilescu, 2004).
Биосорбция – это физико-химический, независимый от метаболизма процесс поглощения тяжелых металлов клеточными мембранами. Он действует через соединения с отрицательным зарядом, которые присутствуют в клеточных мембранах. Важно отметить, что биомасса, используемая для биосорбции, обычно представляет собой неживую биомассу, так как при этом процесс протекает более эффективно, чем при использовании живых микроорганизмов. Эффективность этой стратегии в основном зависит от нескольких параметров, включая свойства поверхности, например, функциональные группы, присутствующие на клеточной мембране (pH, температура и электростатические взаимодействия) (Zabochnicka-Świątek, Krzywonos, 2014). В настоящее время установлено несколько механизмов, происходящих в процессе сорбции, причем разные механизмы могут протекать одновременно с разной скоростью. Среди них можно выделить следующие:
1) Ионная замена – обратимая химическая реакция, включающая обмен ионов на другие ионы того же заряда;
2) Комплексообразование – ионы тяжелых металлов связываются с функциональными группами, присутствующими в клеточных мембранах;
3) Физическая адсорбция, вызванная межмолекулярными взаимодействиями, включая силы Ван-дер-Ваальса (Tiquia-Arashiro, 2018).
Другим важным механизмом биоремедиации тяжелых металлов, которым обладают многие металлотолерантные бактерии, является поглощение металлов посредством секреции внеклеточных полимерных веществ (ВПВ) (Tiquia-Arashiro, 2018; Kumawat et al., 2021). ВПВ включают такие соединения, как нуклеиновые кислоты, гуминовые кислоты, белки и полисахариды, которые связывают катионные металлы с различной степенью специфичности и сродства (Pal, Paul, 2008). Их значение в процессе биоремедиации основано на их участии во флокуляции и связывании ионов металлов из растворов (Salehizadeh, Shojaosadati, 2003). Наибольшее значение в биоремедиации тяжелых металлов имеют микроорганизмы, секретирующие экзополисахариды (Kumawat et al., 2021). Факторы, модулирующие удаление металлов с помощью ВПВ, включают начальную концентрацию металлов и pH (Tiquia-Arashiro, 2018).
Биоаккумуляция представляет собой клеточный энергозависимый процесс, осуществляемый активными метаболическими микроорганизмами (Issazadeh et al., 2013). По сравнению с биосорбцией, поглощение тяжелых металлов занимает больше времени, поскольку оно зависит от биохимических особенностей, внутренней структуры бактериальных штаммов, генетических и физиологических способностей, а также условий окружающей среды, на которые влияет активность биоаккумуляции. Наряду с этим установлено, что на процесс биоаккумуляции влияют свойства клеточной поверхности, включая изменения заряда. Температура существенно влияет и на процесс биоаккумуляции, а именно более высокая температура может существенно нарушить метаболическую активность бактериальной клетки (Sharma, Shukla, 2021). Наиболее изученный механизм биоаккумуляции основан на связывании тяжелых металлов с помощью металлотионеинов. Данные вещества представляют собой богатые цистеином белки (молекулы с низкой молекулярной массой, могут кодироваться геном bmtA, который способствует биоаккумуляции тяжелых металлов (например, Pb, Hg, Ni, Cd)) внутри клетки. Бактериальные клетки обычно производят металлотионеины в ответ на усиленное воздействие металлов (Blindauer et al., 2002; Liu et al., 2003). Следует отметить, что этот механизм может передаваться плазмидами, способствуя ее распространению из одной бактериальной клетки в другую (Das et al., 2016).
Биопреципитация это стратегия биоремедиации, обнаруженная у бактерий, которая предполагает преобразование концентрации свободных металлов в нерастворимые комплексы, тем самым снижая их биодоступность и токсичность. Микроорганизмы могут способствовать осаждению, катализируя окислительные и восстановительные процессы, что приводит к осаждению загрязняющих веществ, включая Pb, Cd, Cr, Fe и U. Также было обнаружено, что у некоторых микроорганизмов они могут выделять фосфаты и увеличивать осаждение фосфатов металлов, в то время как другие бактерии способны осаждать гидроксиды или карбонаты, образуя алканы (Kaksonen, Puhakka, 2007). В современной научной литературе представлены данные свидетельствующие, что Bacillus sp. способны биоосаждать наиболее токсичные тяжелые металлы, включая свинец и кадмий. Например, свинцово-устойчивые штаммы B. iodinium GP13 и B. pumilus S3 осаждают Pb в форме сульфида свинца (PbS) (De et al., 2008). Кроме того, к бактериям, способным преципитировать свинец в фосфат свинца, относится и B. thuringiensis 016 (Chen et al., 2015).
Методы бактериальной ремедиации почвы
Передовые методы восстановления тяжелых металлов включают физико-химические и биологические методы. Последние можно далее разделить на биоремедиацию in situ и ex situ. Процесс in situ включает биовентиляцию, биопромывку, биостимуляцию, биоаугментацию и фиторемедиацию. Биоремедиация ex situ включает земледелие, компостирование, биоотвалы и биореакторы. Биоремедиация использует встречающиеся в природе микроорганизмы, такие как Pseudomonas, Sphingomonas, Rhodococcus, Alcaligenes и Mycobacterium. Как правило, биоремедиация требует меньше усилий, она менее трудоемка, её отличает относительная дешевизна, экологичность, устойчивость и простота в реализации (Sayqal, Ahmed, 2021).
Методы биоремедиации in situ устраняют загрязнение на участке без удаления почвы. Использование данных методов зависит от различных факторов: загрязненной площади, свойств задействованных соединений, концентрации загрязняющих веществ и времени необходимого для завершения биоремедиации. Этот процесс чаще рекомендуется, поскольку он требует перемещения меньшего количества материалов, является относительно дешевым и включает в себя различные типы, такие как биовентиляция, биопромывка, биостимуляция и биоаугментация (табл. 1) (Vidali, 2001; Thapa et al., 2012; Mangunwardoyo et al., 2013).
Микроорганизмы, участвующие в биодеградации включают следующие родовые группы: Acinetobacter (An et al., 2021), Actinobactera, Alcaligenes, Arthrobacter, Bacillus (Wu et al., 2022; Liaqat et al., 2023), Beijerinckia, Flavobacterium, Methylosinus, Mycobacterium, Mycococcus, Nitrosomonas, Nocardia, Xanthobacter, Penicillium (Oliveira et al., 2023), Phanerochaete, Pseudomonas (Bai et al., 2020), Rhizoctonia, Trametes и Serratia (Díaz et al., 2022(a); 2022(b); Huang et al., 2023) (табл. 2).
Поиск среди аборигенных видов микроорганизмов и их комбинаций, обладающих наилучшей биосорбционной активностью в отношении цинка, свинца, кадмия, меди и никеля, проводимого В. Яковлевичем с группой ученых (Jakovljević et al., 2022), основанного на выделении, идентификации (Enterobacter cloacae, Klebsiella oxytoca, Serratia odorifera и Saccharomyces cerevisiae), способности образовывать биопленки, а так же анализе биосорбции позволили установить, что лучшими продуцентами биопленок в контрольной среде были K. oxytoca / S. odorifera (KS), за ними следовали K. oxytoca / S. odorifera /S. cerevisiae (KSC) и E. cloacae / K. oxytoca / S. odorifera (EKS) после 10 дней инкубации. Смешанные культуры, состоящие из трех видов, показали максимальный показатель толерантности к присутствию всех исследованных металлов с наилучшей биосорбционной способность КSC по Cu2+ (99,18 %), затем EKS по Pb2+ (99,14 %) и Cd2+ (99,03 %), K. oxytoca по Ni2+ (98,47 %) и E. cloacae по Zn2+ (98,06 %).
Таблица 1
Методы биоремедиации in situ
| Метод | Описание и использование |
| Биовентиляция | Воздух и питательные вещества подаются в загрязненную почву для стимулирования микроорганизмов. Данный методический подход требует ограниченного потока воздуха и низкого уровня кислорода для выброса загрязняющих веществ в атмосферу посредством биоразложения. Он может имитировать биоразложение простых углеводородов в почве in situ, и, следовательно, загрязнение происходит глубоко под поверхностью (Chipasa, Mędrzycka, 2006). Биовентиляция ограничена неспособностью доставлять кислород в загрязненную почву и недостаточной аэрацией неглубоких загрязнений (Azubuike et al., 2016) |
| Биопромывка | Нагнетание воздуха под низким давлением ниже уровня грунтовых вод для повышения уровня кислорода в грунтовых водах и повышения скорости бактериальной биоремедиации загрязняющих веществ (Vidali, 2001). Методы биовентиляции и биобарботажа использовались одновременно, чтобы гарантировать эффективное удаление загрязняющих веществ из почвы, несмотря на любые неблагоприятные условия. Биопромывка может также объединить почву и грунтовые воды для снижения концентрации растворенных нефтяных соединений в грунтовых водах, смешанных с почвой ниже уровня грунтовых вод и в пределах капиллярной границы. Это простая и недорогая процедура, обладающая значительной гибкостью |
| Биостимуляция | Усиление роста бактерий для инициирования процесса биоремедиации. Загрязненную почву смешивают с обогащенными питательными и жизненно важными веществами, чтобы стимулировать микробную активность для быстрого разложения загрязняющих веществ или токсичных соединений в источник углерода или источник азота и фосфора (Medina-Bellver et al., 2005). Бактерии и грибы, являются первоначальными переработчиками природы. Способность микроорганизмов превращать химическое загрязнение в источники энергии и полезных материалов предполагает важные биологические процессы, которые являются менее затратными и безопасными для окружающей среды |
| Биоаугментация | Используется на определенных участках, где микроорганизмы необходимы для извлечения загрязняющих веществ. Они также способны победить местные микроорганизмы, а это значит, что они могут быстро очистить территорию. Сообщалось об удалении токсичных химикатов посредством биоаугментации в таких средах, как почва и вода. Однако имеется и ряд ограничений, например, замечено уменьшение количества экзогенных микроорганизмов после их попадания на загрязненный участок из-за абиотических и биотических стрессов. Они возникают из-за недостаточного количества питательных веществ для роста, таких как субстраты, изменений температуры и pH, а также конкуренции между интродуцированными и аборигенными микроорганизмами (Bouchez et al., 2000) |
Из всех тяжелых металлов, обнаруженных в окружающей среде, наибольшую опасность представляют повышенные количества Cd и Pb, являющиеся балластными элементами для живых организмов. Данные металлы поступают в биологический круговорот преимущественно через сельскохозяйственные культуры, поглощая металлы из почв (Pham et al., 2022). Исследования показали, что эти элементы вызывают изменения клеточного цикла, канцерогенеза или апоптоза (Dell’Anno et al., 2020). Такие металлы как цинк, медь, марганец и никель, выполняют ключевую роль в регулировании различных биологических процессов в живых системах, многие тяжелые металлы, такие как ртуть, мышьяк, кадмий, хром и свинец, могут быть токсичными даже при низких концентрациях. За прошедшие годы были, по существу, исследованы многие физические и химические методы удаления тяжелых металлов, но их недостатки, такие как образование химических отходов, сложная последующая обработка и неэкономичная стоимость обоих методов, сделали их неэффективными. Микробная биоремедиация, особенно использование бактерий, привлекла внимание из-за возможности и эффективности их использования для удаления тяжелых металлов из загрязненной среды. У бактерий существуют различные стратегии переработки тяжелых металлов посредством механизмов общей резистентности, механизмов биосорбции, адсорбции и оттока. Bacillus sp. являются модельными грамположительными бактериями,
Таблица 2
Распределение тяжелых металлов в окружающей среде и микроорганизмы, участвующие в биодеградации (по Sayqal, Ahmed, 2021)
| Металл | Микроорганизм | Распределение в окружающей среде | Ссылка |
| As | Sporosarcina ginsengisoli | Почва, извержение вылкана | Sharma et al., 2000;Ojuederie, Babalola, 2017; Tanmoy, Nimai, 2019 |
| Cd | Bacillus sp.Klebsiella planticola | Почва, осадочные породы, вода | Rani et al., 2010;Kapahi, Sachdeva, 2019 |
| Cr | B. cereus XMCr-6B. cereusPseudomonas putida
Enterobacter cloacae B2-DHA B. subtilis |
Все возможные среды (объекты окружающей среды) | Kanmani et al., 2012;Dong et al., 2013;Balamurugan et al., 2014;
Rahman et al., 2015 |
| Pb | Rhodobacter sphaeroidesLeclercia adecarboxylataKocuria flava | Почва | Rigoletto et al., 2020 |
| Hg | Bacillus sp. strain CSB_B078Klebsiella pneumoniae isolateEnterobacter sp. strain 08
Acinetobacterseohaensis strain |
Вода, почва, воздух | Pushkar et al., 2019 |
| Cu | Kocuria flava | Земная кора, океаны, озера и реки | Coelho et al., 2015 |
| Zn | Pseudomonas putida | Поверхностные воды, почва | Pardo et al., 2003;Chen et al., 2005 |
| Ni | Desulfovibrio desulfuricansB. licheniformis | Воздух, почва и вода | Zhou et al., 2007;Kim et al., 2015 |
| Co | Bacillus sp.Rhodopseudomonas palustris | Воздух, почва и вода | Rani et al., 2010;Mani, Kumar. 2014;Gao et al., 2017 |
которые широко изучались на предмет их биосорбционных способностей и молекулярных механизмов, обеспечивающих их выживание, а также их способности удалять и детоксицировать тяжелые металлы (Alotaibi et al., 2021).
Сорбционные характеристики представителей рода Bacillus sp.
Bacillus sp. это грамположительные палочковидные, спорообразующие (Cai et al., 2019) бактерии, принадлежащие к типу Firmicutes. В большинстве источников их характеризуют как почвенные аэробные или факультативно анаэробные микроорганизмы, также они могут быть обнаружены в воздухе, воде, пищевых продуктах, кишечнике человека и животных (Kotb, 2015). С точки зрения особенностей, представленных в виде генетического или коммерческого применения, группа Bacillus является наиболее гетерогенной, поскольку некоторые виды хорошо охарактеризованы как условно-патогенные микроорганизмы и производители токсинов, тогда как другие имеют широкое промышленное и медицинское применение (Elshaghabee et al., 2017). Одной из уникальных характеристик Bacillus sp. является их способность к образованию спор в экстремальных условиях, которое обычно запускается при дефиците питательных веществ. Данный механизм устойчивости позволяет им выдерживать серьезные воздействия окружающей среды, такие как высыхание, высокая температура, влажность, а также радиация (Wolken et al., 2003). Именно благодаря этой особенности они находят различные коммерческие применения как более эффективные биопрепараты по сравнению с вегетативными клетками (Sanders et al., 2003).
В настоящее время положительные аспекты использования Bacillus sp. в различных областях обусловлено их характерным особенностям, а исследования позволили использовать эти особенности в интересах человека. Так, например, в аквакультуре Bacillus используются в качестве продуктов биоконтроля (Hong et al., 2005), в медицине, промышленности и охране окружающей среды преимущество использования грамположительных бактерий, таких как Bacillus sp., заключается в том, что они не участвуют в переносе генетического материала от грамотрицательных бактерий. Более того, они быстро размножаются и могут выжить во многих условиях окружающей среды.
Многие представители Bacillus sp., такие как B. subtilis, B. coagulans, B. pumilus, B. licheniformis и B. cereus, используются для разнообразных целей (Sanders et al., 2003).
Результаты многих исследований указывают на безопасность B. subtilis для использования пробиотиков из-за демонстрации противомикробного и противоракового действия (Lee et al., 2019). Bacillus sp. также используются для производства различных ферментов, таких как амилаза, протеаза, целлюлаза и пектиназа, в пищевой промышленности (Ouattara et al., 2017), а также в некоторых дополнительных питательных веществах, таких как витамины и каротиноиды (Tanaka et al., 2014; Takano, 2016). Так же Bacillus sp. широко исследуются на предмет их роли в уменьшении выбросов тяжелых металлов из загрязненной окружающей среды посредством биосорбции (таблица 3), биоаккумуляции и многих других методов, поскольку сообщается о том, что на загрязненных участках часто доминируют грамположительные бактерии из-за их универсальных метаболических свойств и лучшие качества биосорбции (Chikere et al., 2009; Nwinyi et al., 2014).
Таблица 3
Обзор литературных данных исследования биосорбционных характеристик представителей рода Bacillus sp. в отношении тяжелых металлов
| Металл | Исследуемый микроорганизм | Тестируемая концентрация | Уровень сорбции | Ссылка |
| 1 | 2 | 3 | 4 | 5 |
| Эссенциальные элементы | ||||
| Zn | B. subtilis | 178 мг/л | 49,70 мг/л | Wierzba, 2015 |
| Bacillus sp. KF710041 | — | 73,29 % | Singh, Chopra, 2014 | |
| B. subtilis KF710042 | ? | 78,15 % | ||
| B. licheniformis | — | 53,00 % | Kamika, Momba, 2013 | |
| B. cereus | 0–200 мг/л | 66,60 мг/г | Joo et al., 2010 | |
| B. jeotgali | 75 мг/л | 30,00 % | Green-Ruiz et al., 2008 | |
| B. subtilis D215 | 100 мг/л | 63,73 % | Sabae et al., 2006 | |
| B. firmus | 100 мг/л | 61,80 % | Salehizadeh, Shojaosadati, 2003 | |
| B. altitudinis | 100 мг/л | 87,00 мг/л | Khan et al., 2022 | |
| Cu | B. cereus | 100 ppm | 54,00 % | Raj et al., 2018 |
| B. cereus | 400 ppm | 48,00 % | Rohini, Jayalakshmi,. 2015 | |
| B. thuringiensis OSM29 | 25 мг/л | 91,80 % | Oves et al., 2013 | |
| B. licheniformis | 5 г/л | 32,00 % | Karakagh et al., 2012 | |
| B. thioparans | 40 мг/л | 27,30 мг/г | Rodríguez-Tirado et al., 2012 | |
| B. subtilis D215 | 100 мг/л | 67,18 % | Sabae et al., 2006 | |
| B. sphaericus | 17,6 мг/л | 5,60 моль/г | da Costa, Duta, 2001 | |
| B. cereus | 44,0 мг/л | 5,90 моль/г | ||
| Bacillus sp. | 88,0 мг/л | 6,40 моль/г | ||
| Bacillus sp. SG-1 | — | 60,00 % | He, Tebo, 1998 | |
| Cr | B. cereus NWUAB01 | 100 мг/л | 43,00 % | Ayangbenro, Babalola, 2020 |
| B. cereus | 100 мг/л | 81,00 % | Nayak et al., 2018 | |
| B. salmalaya 139SI | 50 ppm | 20,35 мг/г | Dadrasnia et al., 2015 | |
| B. cereus FA-3 | 1000 мкг/мл | 72,00 % | Singh et al., 2013 | |
| B. licheniformis | 15 мг/л | 95,00 % | Samarth et al., 2012 | |
| Bacillus sp. B | 500–4500 мг/л | 47,00 % | Chaturvedi, 2011 | |
| B. marisflavi | 200 мг/л | 5,78 % | Mishra, Doble, 2008 | |
| B. licheniformis | 300 мг/г | 69,40 % | Zhou et al., 2007 | |
| B. thuringiensis | 250 мг/л | 83,30 % | Şahin, Öztürk, 2005 | |
| B. licheniformis | — | 62,00 мг/г | Zouboulis et al., 2004 | |
Таблица 3 (продолжение)
| 1 | 2 | 3 | 4 | 5 |
| Cr | B. laterosporus | 72,60 мг/г | ||
| B. circulans | 0,96 мг/л | 34,50 % | Srinath et al., 2002 | |
| Mo | Bacillus sp. Zeid 14 | — | 200,00 мг/л | Adnan et al., 2016 |
| Условно-эссенциальные элементы | ||||
| Ni | B. subtilis | 2,14 ppm | 85,61 % | Mardiyono et al., 2019 |
| B. subtilis BM1 | 2–32 мг/л | 98,54 % | Al‐Gheethi et al., 2017 | |
| B. subtilis BM2 | 99,2 % | |||
| B. subtilis BM3 | 96,3 % | |||
| B. subtilis | 178 мг/л | 57,80 мг/г | Wierzba, 2015 | |
| Bacillus sp. KL1 | 100 ppm | 55,06 % | Taran et al., 2015 | |
| B. thuringiensis KUNi1 | 0–7,5 мм | 82,00 % | Das et al., 2014 | |
| B. thuringiensis OSM29 | 25–150 мг/л | 94,00 % | Oves et al., 2013 | |
| B. thuringiensis | 250 мг/л | 15,70 % | Öztürk, 2007 | |
| Mn | B. thuringiensis HM7 | 400 мг/л | 95,04 % | Huang et al., 2020 |
| Ag | B. licheniformis R08 | 100 мг/л | 73,60 мг/г | Sun et al., 2013 |
| Токсичные элементы | ||||
| As | Bacillus sp. KM02 | 100 ppm | 51,45 % (As3+) | Dey et al., 2016 |
| B. licheniformis | 0–100 мМ | 100 ppm (As0) | Anderson, Cook, 2004 | |
| B. polimyxa | 0–20 мМ | 100 ppm (As0) | ||
| Bacillus sp. IIIJ3–1 | 350 smM (As5+)10 мМ (As3+) | 350 smM (As5+)10 мМ (As3+) | Ghosh. et al., 2020 | |
| B. barbaricus | — | 20 мМ (As5+)0. мМ (As3+) | Jiménez, et al., 2013 | |
| B. indicus Sd/3T | 0 мМ | 20 мМ (As5+)30 мМ (As3+) | Suresh et al., 2004 | |
| B. selenatiredreducens | 10 мМ | 0 мМ (As5+)0,3 мМ (As3+) | Switzer Blum, et al. 1998 | |
| B. arsenicus con a/3 | 20 мМ | 20 мМ (As5+) | Shivaji, et al. 2005 | |
| 0,5 мМ | 0,3 мм (As3+) | |||
| B. cereus W2 | 50 мг/л | 1,87 мг/л (As3+) | Miyatake, Hayashi, 2011 | |
| B. cereus EA5 | 15 мг/л | 94,9 % | Mohamed, Farag, 2015 | |
| B. fusiformis EA2 | 15 мг/л | 99,7 % | ||
| B. arsenicus MTCC 4380 | 2000 мг/л | 89,46 % (As5+) | Podder, Majumder, 2016 | |
| 1800 мг/л | 83,04 % (As3+) | |||
| Cd | B. safensis | 40 ppm | 83,50 % | Rajesh et al., 2014 |
| 60 ppm | 98,10 % | |||
| B. licheniformis | — | 98,34 % | Basha, Rajaganesh, 2014 | |
| B. catenulatus JB-022 | 150 мг/л | 66,00 % | Kim et al., 2015 | |
| B. thuringiensis DM55 | 0,25 мм | 79,00 % | El-Helow et al., 2000 | |
| Pb | B. pumilus MF472596 | 100–1000 ppm | 96,00 % | Sahoo, Goli, 2020 |
| B. subtilis X3 | 200–1400 мг/л | 590,49 мг/г | Qiao et al., 2019 | |
| B. cereus | 5–100 мг/л | 36,71 мг/г | Pan et al., 2007 | |
| Bacillus sp. S1 | 75 мг/л | 53,00 % | Arifiyanto et al., 2017 | |
| 100 мг/л | 51,00 % | |||
| Bacillus sp. SS19 | 50 мг/мл | 57,00 % | ||
| Bacillus sp. AS2 | 500 ppm | 74,50 мг/г (99,50 %) | Cephidian et al., 2016 | |
| Hg | B. thuringiensis CASKS3 | 200 мг/л | 62,40 % | Saranya,et al. 2019 |
| 400 мг/л | 54,00 % | |||
| 600 мг/л | 40,00 % | |||
| B. licheniformis | 50 мг/л | 70,00% | Upadhyay, et al. 2017 | |
| B. cereus BW-03(pPW-05) | 5–50 ppm | 96,40 % | Dash, Das, 2015 | |
| B. licheniformis | 100 мкг/мл | 70,00 % | Muneer et al., 2013 | |
| B. cereus | 5 мг/л | 104,10 мг/г | Sinha, Khare, 2012 | |
| Bacillus sp. | 1–10 мг/л | 7,90 мг/г | Green-Ruiz, 2006 | |
Примечание к таблице. ppm – частей на миллион (10-6 — 1мг/кг).
ЗАКЛЮЧЕНИЕ
Обобщая литературные данные, по оценке сорбционных характеристик микроорганизмов, следует отметить высокий интерес международного научного сообщества к данному направлению исследования. Биологическая активность и безопасность применения бактериальной ремедиации обеспечивается не только их полиметальной резистентность, но и высокими сорбционными характеристиками условно-токсичных и токсичных элементов. Интерес к представителям рода Bacillus sp. обусловлен их способностью к образованию спор в экстремальных условиях, которое обычно запускается при дефиците питательных веществ. Данный механизм обеспечивает их устойчивость к высыханию, высоким температурам и другим абиотическим и биотическим факторам.
Работа выполнена в рамках государственного задания по теме «Биотехнологические аспекты использования биоремедиаторов в экологических системах различного уровня организации» № FSGU-2023-0007
Adnan A. S. M., Abu Zeid I. M., Ahmad S. A., Halmi M. I. E., Abdullah S. R. S., Masdor N. A., Shukor M. S., Shukor M. Y. A molybdenum-reducing Bacillus sp. strain Zeid 14 in soils from Sudan that could grow on amides and acetonitrile // Malaysian Journal of Soil Science. – 2016. – Vol. 20. – P. 111–134.
Al-Gheethi A., Mohamed R., Noman E., Ismail N., Kadir O. A. Removal of heavy metal ions from aqueous solutions using Bacillus subtilis biomass pre–treated by supercritical carbon dioxide // CLEAN–Soil Air Water. – 2017. – Vol. 45, N 10. – P. 1700356. DOI: org/10.1002/clen.201700356
Alotaibi B. S., Khan M., Shamim S. Unraveling the Underlying Heavy Metal Detoxification Mechanisms of Bacillus Species // Microorganisms. – 2021. – N 9 (8). –1628 р. DOI: 10.3390/microorganisms9081628
An Q., Jin L., Deng S., Li Z., Zhang C. Removal of Mn(II) by a nitrifying bacterium Acinetobacter sp. AL-6: efficiency and mechanisms // Environmental Science and Pollution Research. – 2021. – Vol. 28. – P. 31218–31229. DOI: 10.1007/s11356-021-12764-6.
Anderson C. R., Cook G. M. Isolation and characterization of arsenate-reducing bacteria from arsenic-contaminated sites in New Zealand. Current Microbiology. – 2004. – N 48 (5). – P. 341–7. DOI: 10.1007/s00284-003-4205-3.
Arifiyanto A., Apriyanti F. D., Purwaningsih P., Kalqutny S. H., Agustina D., Surtiningsih T., Shovitri M., Zulaika E. Lead (Pb) bioaccumulation; Genera Bacillus isolate S1 and SS19 as a case study // AIP Conference Proceedings. – 2017. – N 1854. – P. 020003. DOI 10.1063/1.4985394.
Ayangbenro A. S., Babalola O. O. A New Strategy for Heavy Metal Polluted Environments: A Review of Microbial Biosorbents // International Journal of Environmental Research and Public Health. – 2017. – N 14 (1). – P. 94. DOI: 10.3390/ijerph14010094.
Ayangbenro A. S., Babalola O. O. Genomic analysis of Bacillus cereus NWUAB01 and its heavy metal removal from polluted soil // Scientific reports. – 2020. – N 10 (1). – P. 19660. DOI. 10.1038/s41598-020-75170-x.
Azubuike C. C., Chikere C. B., Okpokwasili G. C. Bioremediation techniques–classification based on site of application: principles, advantages, limitations and prospects // World Journal of Microbiology & Biotechnology. – 2016. – Vol. 32. – P. 180. DOI. 10.1007/s11274-016-2137-x.
Bai Y., Su J., Wen Q., Li G., Xue L., Huang T. Removal of tetracycline by denitrifying Mn(II)-oxidizing bacterium Pseudomonas sp. H117 and biomaterials (BMO and MBMO): Efficiency and mechanisms // Bioresource Technology. – 2020. – N 312. – P. 123565. DOI 10.1016/j.biortech.2020.123565.
Balamurugan D., Udayasooriyan C., Kamaladevi B. Chromium (VI) reduction by Pseudomonas putida and Bacillus subtilis isolated from contaminated soils // International Journal of Environmental Sciences. – 2014. – Vol. 5. N 3. – P. 522. DOI 10.6088/ijes.2014050100046.
Basha S. A., Rajaganesh K. Microbial bioremediation of heavy metals from textile industry dye effluents using isolated bacterial strains // International Journal of Current Microbiology and Applied Sciences (IJCMAS). – 2014. – Vol. 3. – P. 785–794.
Blindauer C. A., Harrison M. D., Robinson A. K., Parkinson J. A., Bowness P. W., Sadler P. J., Robinson N. J. Multiple bacteria encode metallothioneins and SmtA-like zinc fingers // Molecular Microbiology. – 2002, N 45 (5). – P. 1421–1432. DOI: 10.1046/j.1365-2958.2002.03109.x.
Bouchez T., Patureau D., Dabert P., Juretschko S., Doré J., Delgenès P., Moletta R., Wagner M.. Ecological study of a bioaugmentation failure // Environmental microbiology. – 2000. – Vol. 2, N 2. – P. 179–190. DOI: 10.1046/j.1462-2920.2000.00091.x.
Cai D., Rao Y., Zhan Y., Wang Q., Chen S. Engineering Bacillus for efficient production of heterologous protein: current progress, challenge and prospect // Journal of Applied Microbiology. – 2019. – N 126 (6). – P. 1632–1642. DOI: 10.1111/jam.14192.
Cephidian A., Makhdoumi A., Mashreghi M., Mahmudy Gharaie M. H. Removal of anthropogenic lead pollutions by a potent Bacillus species AS2 isolated from geogenic contaminated site // International journal of environmental science and technology. – 2016. – Vol. 13. – P. 2135–2142. DOI: 10.1007/s13762-016-1023-2.
Chaturvedi M. K. Studies on chromate removal by chromium-resistant Bacillus sp. isolated from tannery effluent // Journal of Environmental Protection. – 2011. – Vol. 2, N 01. – P. 76–82. DOI:10.4236/jep.2011.21008.
Chen X. C., Wang Y. P., Lin Q., Shi J. Y., Wu W. X., Chen Y. X. Biosorption of copper (II) and zinc (II) from aqueous solution by Pseudomonas putida CZ1 // Colloids and Surfaces B: Biointerfaces. – 2005. – Vol. 46, N 2. – P. 101–107. DOI: 10.1016/j.colsurfb.2005.10.003.
Chen Z., Pan X., Chen H., Lin Z., Guan X. Investigation of lead(II) uptake by Bacillus thuringiensis 016 // World Journal of Microbiology & Biotechnology. – 2015. – Vol. 31, N 11 – P. 1729–36. DOI: 10.1007/s11274-015-1923-1.
Chikere C. B., Okpokwasili G. C., Chikere B. O. Bacterial diversity in a tropical crude oil-polluted soil undergoing bioremediation // African Journal of Biotechnology. – 2009. – Vol. 8. – P. 2535–2540.
Chipasa K. B., Mędrzycka K. Behavior of lipids in biological wastewater treatment processes // Journal of industrial microbiology and biotechnology. – 2006. –Vol. 33. N 8. – P. 635–645. DOI: 10.1007/s10295-006-0099-y
Coelho L. M., Rezende H. C., Coelho L. M., De Sousa P. A., Melo D. F., Coelho N. M. Bioremediation of polluted waters using microorganisms // Advances in Bioremediation of Wastewater and Polluted Soil. – 2015. – Vol. 10. – P. 60770. DOI:10.5772/60770.
da Costa A. C. A., Duta F. P. Bioaccumulation of copper, zinc, cadmium and lead by Bacillus sp., Bacillus cereus, Bacillus sphaericus and Bacillus subtilis // Brazilian Journal of Microbiology. – 2001. – Vol. 32. – P. 1–5. DOI: 10.1590/S1517-83822001000100001.
Dadrasnia A., Chuan Wei K. S., Shahsavari N., Azirun M. S., Ismail S. Biosorption potential of Bacillus salmalaya strain 139SI for removal of Cr (VI) from aqueous solution // International journal of environmental research and public health. – 2015. – Vol. 2, N 12. – P. 15321–15338. DOI: 10.3390/ijerph121214985.
Das P., Sinha S., Mukherjee S. K. Nickel bioremediation potential of Bacillus thuringiensis KUNi1 and some environmental factors in nickel removal // Bioremediation journal. – 2014. – Vol. 18, N 2. – P. 169–177. DOI: 10.1080/10889868.2014.889071
Das S., Dash H. R., Chakraborty J. Genetic basis and importance of metal resistant genes in bacteria for bioremediation of contaminated environments with toxic metal pollutants // Applied microbiology and biotechnology. – 2016. – Т. 100. – P. 2967–2984.
Dash H. R., Das S. Bioremediation of inorganic mercury through volatilization and biosorption by transgenic Bacillus cereus BW-03 (pPW-05) // International Biodeterioration & Biodegradation. – 2015. – Vol. 103. – P. 179–185. DOI: 10.1016/j.ibiod.2015.04.022.
Dell’Anno F., Brunet C., van Zyl L. J., Trindade M., Golyshin P. N., Dell’Anno A., Ianora A., Sansone C. Degradation of hydrocarbons and heavy metal reduction by marine bacteria in highly contaminated sediments // Microorganisms. – 2020. – Vol. 8. – P. 1402. DOI: 10.3390/microorganisms8091402.
Dey U., Chatterjee S., Mondal N. K. Isolation and characterization of arsenic-resistant bacteria and possible application in bioremediation // Biotechnology Reports. – 2016. – N 10. – P. 1–7. DOI: 10.1016/j.btre.2016.02.002.
Díaz A., Marrero J., Cabrera G., Coto O., Gómez J. M. Biosorption of nickel, cobalt, zinc and copper ions by Serratia marcescens strain 16 in mono and multimetallic systems // Biodegradation. – 2022a. – N 33 (1). – P. 33–43. DOI: 10.1007/s10532-021-09964-9.
Díaz A., Marrero J., Cabrera G., Coto O., Gómez J. M. Optimization of nickel and cobalt biosorption by native Serratia marcescens strains isolated from serpentine deposits using response surface methodology // Environmental Monitoring and Assessment. – 2022b. – Vol. 10, N 194 (3). – P. 167. DOI: 10.1007/s10661-022-09816-w.
Dong G., Wang Y., Gong L., Wang M., Wang H., He N., Zheng Y., Li Q. Formation of soluble Cr (III) end-products and nanoparticles during Cr (VI) reduction by Bacillus cereus strain XMCr-6 // Biochemical engineering journal. – 2013. – Vol. 70. – P.166–172. DOI: 10.1016/j.bej.2012.11.002.
El-Helow E. R., Sabry S. A., Amer R. M. Cadmium biosorption by a cadmium resistant strain of Bacillus thuringiensis: regulation and optimization of cell surface affinity for metal cations // BioMetals. – 2000. – N 13 (4). P. 273–280. DOI: 10.1023/a:1009291931258.
Elshaghabee F. M., Rokana N., Gulhane R. D., Sharma C., Panwar H. Bacillus as potential probiotics: status, concerns, and future perspectives // Frontiers in microbiology. – 2017. – Vol. 8. – P. 1490. DOI: 10.3389/fmicb.2017.01490.
Fomina M., Gadd G. M. Biosorption: current perspectives on concept, definition and application // Bioresource Technology. – 2014. – N 160. P. 3–14. DOI: 10.1016/j.biortech.2013.12.102.
Gadd G. M. Bioremedial potential of microbial mechanisms of metal mobilization and immobilization // Current Opinion in Biotechnology. – 2000. – Vol. 11. N 3. – P. 271–279. DOI: 10.1016/S0958-1669(00)00095-1.
Gao R., Wang Y., Zhang Y., Tong J., Dai W. Cobalt (II) bioaccumulation and distribution in Rhodopseudomonas palustris // Biotechnology & Biotechnological Equipment. – 2017. – Vol. 31, N 3. – P. 527–534. DOI: 10.1080/13102818.2017.1292148.
Gavrilescu M. Removal of heavy metals from the environment by biosorption // Engineering in Life Sciences. – 2004. – Vol. 4. – P.219–232. DOI: 10.1002/elsc.20040026
Ghosh S., Mohapatra B., Satyanarayana T., Sar P. Molecular and taxonomic characterization of arsenic (As) transforming Bacillus sp. strain IIIJ3–1 isolated from As-contaminated groundwater of Brahmaputra river basin, India // BMC Microbiology. – 2020. – Vol. 20. – P. 256. DOI: 10.1186/s12866-020-01893-6.
Green-Ruiz C., Rodriguez-Tirado V., Gomez-Gil B. Cadmium and zinc removal from aqueous solutions by Bacillus jeotgali: pH, salinity and temperature effects // Bioresour Technol. – 2008. – 99 (9). Р. 3864–3870. DOI: 10.1016/j.biortech.2007.06.047.
Green-Ruiz C. Mercury(II) removal from aqueous solutions by nonviable Bacillus sp. from a tropical estuary // Bioresource Technology. – 2006. – N 97(15). – P. 1907–11. DOI: 10.1016/j.biortech.2005.08.014.
He L. M., Tebo B. M. Surface Charge Properties of and Cu(II) Adsorption by Spores of the Marine Bacillus sp. Strain SG-1 // Applied and Environmental Microbiology. – 1998. – N 64(3). – P. 1123–9. DOI: 10.1128/AEM.64.3.1123-1129.1998.
Hong H. A., Duc L. H., Cutting S. M. The Use of Bacterial Spore Formers as Probiotics // FEMS Microbiology Reviews. – 2005. – N 29(4). – P. 813–835. DOI: 10.1016/j.femsre.2004.12.001
Huang H., Zhao Y., Xu Z., Ding Y., Zhou X., Dong M. A high Mn(II)-tolerance strain, Bacillus thuringiensis HM7, isolated from manganese ore and its biosorption characteristics // PeerJ Publishing. – 2020. – N 8. – P. 8589 DOI: 10.7717/peerj.8589.
Huang X., Nong X., Liang K., Chen P., Zhao Y., Jiang D., Xiong J. Efficient Mn(II) removal mechanism by Serratia marcescens QZB-1 at high manganese concentration // Frontiers in Microbiology. – 2023. – N 14. – P. 1150849. DOI: 10.3389/fmicb.2023.1150849.
Issazadeh K., Jahanpour N., Pourghorbanali F., Raeisi G., Faekhondeh J. Heavy metals resistance by bacterial strains // Annals of Biological Research. – 2013. – Vol. 4. – N 2. – P. 60–63.
Jakovljević V., Grujić S., Simić Z., Ostojić A., Radojević I. Finding the best combination of autochthonous microorganisms with the most effective biosorption ability for heavy metals removal from wastewater // Frontiers in Microbiology. – 2022. – N 13. – P. 1017372. DOI: 10.3389/fmicb.2022.1017372.
Jiménez G., Blanch A. R., Tamames J., Rosselló-Mora R. Complete Genome Sequence of Bacillus toyonensis BCT-7112T, the Active Ingredient of the Feed Additive Preparation Toyocerin // Genome Announcements. – 2013. – N 1 (6). – P. 01080–13. DOI: 10.1128/genomeA.01080-13.
Joo J. H., Hassan S. H., Oh S. E. Comparative study of biosorption of Zn2+ by Pseudomonas aeruginosa and Bacillus cereus // International Biodeterioration & Biodegradation. – 2010. – Vol. 64, N 8. – P. 734–741. DOI: 10.1016/j.ibiod.2010.08.007.
Kaksonen A. H., Puhakka J. A. Sulfate reduction based bioprocesses for the treatment of acid mine drainage and the recovery of metals // Engineering in Life Sciences. – 2007. – Т. 7 (6). – P. 541–564.
Kamika I., Momba M. N. Assessing the resistance and bioremediation ability of selected bacterial and protozoan species to heavy metals in metal-rich industrial wastewater // BMC Microbiology. – 2013, N 6. – P. 13–28. DOI: 10.1186/1471-2180-13-28.
Kanmani P., Aravind J., Preston D. Remediation of chromium contaminants using bacteria // International journal of Environmental Science and Technology. – 2012. – N 9. P. 183–193. DOI: 10.1007/s13762-011-0013-7.
Kapahi M., Sachdeva S. Bioremediation options for heavy metal pollution // Journal of health and pollution. – 2019. – Vol. 9. N 24 – Р. 191–203.
Karakagh R. M., Chorom M., Motamedi H., Kalkhajeh Y. K., Oustan S. Biosorption of Cd and Ni by inactivated bacteria isolated from agricultural soil treated with sewage sludge // Ecohydrology & Hydrobiology. – 2012. – Vol. 12, N 3. – Р. 191–198. DOI: 10.1016/S1642-3593(12)70203-3.
Khan M., Ijaz M., Chotana G. A., Murtaza G., Malik A., Shamim S. Bacillus altitudinis MT422188: A potential agent for zinc bioremediation // Bioremediation Journal. – 2022. – Vol. 26, N 3. – Р. 228–248. DOI: 10.1080/10889868.2021.1927973.
Kim I. H., Choi J. H., Joo J. O., Kim Y. K., Choi J. W., Oh B. K. Development of a microbe-zeolite carrier for the effective elimination of heavy metals from seawater // Journal of microbiology and biotechnology. – 2015. – Vol. 25, N 9. – Р.1542–1546. DOI: 10.4014/jmb.1504.04067.
Kim S. Y., Jin M. R., Chung C. H., Yun Y. S., Jahng K. Y., Yu K. Y. Biosorption of cationic basic dye and cadmium by the novel biosorbent Bacillus catenulatus JB-022 strain // Journal of bioscience and bioengineering. – 2015. – Vol. 119, N 4. – P. 433–439. DOI: 10.1016/j.jbiosc.2014.09.022.
Kotb E. Purification and partial characterization of serine fibrinolytic enzyme from Bacillus megaterium KSK-07 isolated from kishk, a traditional Egyptian fermented food // Applied Biochemistry and Microbiology. – 2015. – Vol. 51. – P. 34–43. DOI: 10.1134/S000368381501007X.
Kumawat T. K., Kumawat V., Sharma S., Kandwani N., Biyani M. Applications of EPS in environmental bioremediations // In Microbial Exopolysaccharides as Novel and Significant Biomaterials, 1st ed., Nadda A. K., Sajna K. V., Sharma S., Eds.; Springer: Cham, Switzerland. – 2021. P. 285–302.
Lee N. K., Kim W. S., Paik H. D. Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier // Food Science and Biotechnology. – 2019. – Vol. 28. – P. 1297–1305. DOI: 10.1007/s10068-019-00691-9.
Liaqat I., Muhammad N., Ara C., Hanif U., Andleeb S., Arshad M., Aftab M. N., Raza C., Mubin M. Bioremediation of heavy metals polluted environment and decolourization of black liquor using microbial biofilms // Molecular Biology Reports. – 2023. – N 50 (5). – P. 3985–3997. DOI: 10.1007/s11033-023-08334-3.
Lin C. C., Lin H. L. Remediation of soil contaminated with the heavy metal (Cd2+) // Journal of Hazardous Materials. – 2005. – N 122 (1-2). P. 7–15. DOI: 10.1016/j.jhazmat.2005.02.017.
Liu T., Nakashima S., Hirose K., Uemura Y., Shibasaka M., Katsuhara M., Kasamo K. A metallothionein and CPx-ATPase handle heavy-metal tolerance in the filamentous cyanobacterium Oscillatoria brevis // FEBS Letters. – 2003. – N 542 (1-3). – P. 159–163. DOI: 10.1016/s0014-5793(03)00370-3.
Malik A. Metal bioremediation through growing cells // Environment International. – 2004. – N 30(2). P. 261–278. DOI: 10.1016/j.envint.2003.08.001.
Mangunwardoyo W., Sudjarwo T., Patria M. P. Bioremediation of effluent wastewater treatment plant Bojongsoang Bandung Indonesia using consortium aquatic plants and animals // International Journal of Research and Reviews in Applied Sciences. – 2013. – Vol. 14, N 1. – P. 150–160.
Mani D., Kumar C. Biotechnological advances in bioremediation of heavy metals contaminated ecosystems: an overview with special reference to phytoremediation // International journal of environmental science and technology. – 2014. – Vol. 11. – P.843–872. DOI: 10.1007/s13762-013-0299-8.
Mardiyono M., Sajidan S., Masykuri M., Setyono P. Bioremediation of nickel heavy metals in electroplating industrial liquid waste with Bacillus subtilis // International Conference on Science and Applied Science (ICSAS) 2019 AIP Conf. Proc. – 2022. – 1. DOI: 10.1063/1.5141697.
Medina-Bellver J. I., Marín P., Delgado A., Rodríguez-Sánchez A., Reyes E., Ramos J. L., Marqués S. Evidence for in situ crude oil biodegradation after the Prestige oil spill // Environmental microbiology. – 2005. – Vol.7. N 6. – P. 773–779. DOI: 10.1111/j.1462-2920.2005.00742.x.
Mishra S., Doble M. Novel chromium tolerant microorganisms: isolation, characterization and their biosorption capacity // Ecotoxicology and Environmental Safety. – 2008. – N 71 (3). – P. 874–9. DOI: 10.1016/j.ecoenv.2007.12.017.
Miyatake M., Hayashi S. Characteristics of arsenic removal by Bacillus cereus strain W2 // Resources Processing. – 2011. – Vol. 58. – N 3. – Р. 101–107. DOI: 10.4144/rpsj.58.101.
Mohamed E. A., Farag A. G. Arsenic removal from aqueous solutions by different Bacillus and Lysinibacillus species // Bioremediation Journal. – 2015. – Vol. 19. N 4. – P. 269–276. DOI: 10.1080/10889868.2014.995375.
Mosa K. A., Saadoun I., Kumar K., Helmy M., Dhankher O. P. Potential Biotechnological Strategies for the Cleanup of Heavy Metals and Metalloids // Frontiers in Plant Science. – 2016. – N 7. – P. 303. DOI: 10.3389/fpls.2016.00303.
Muneer B., Iqbal M. J., Shakoori F. R., Shakoori A. R. Tolerance and biosorption of mercury by microbial consortia: Potential use in bioremediation of wastewater // Pakistan Journal of Zoology. – 2013. – Vol. 45. – P. 247–254.
Nayak A. K., Panda S. S., Basu A., Dhal N. K. Enhancement of toxic Cr (VI), Fe, and other heavy metals phytoremediation by the synergistic combination of native Bacillus cereus strain and Vetiveria zizanioides L.// International journal of phytoremediation. – 2018. – Vol. 20, N 7. – P. 682–691. DOI: 10.1080/15226514.2017.1413332.
Nwinyi O. C., Kanu I. A., Tunde A., Ajanaku K. O. Characterization of diesel degrading bacterial species from contaminated tropical ecosystem // Brazilian Archives of Biology and Technology. – 2014. – Vol. 57. – P. 789–796. DOI: 10.1590/S1516-8913201402250.
Ojuederie O. B., Babalola O. O. Microbial and Plant-Assisted Bioremediation of Heavy Metal Polluted Environments: A Review // International Journal of Environmental Research and Public Health (IJERPH). – 2017. – N 14(12). – P. 1504. DOI: 10.3390/ijerph14121504.
Oliveira A. F., Machado R. B., Ferreira A. M., Sena I. D. S., Silveira M. E., Almeida A. M. S., Braga F. S., Rodrigues A. B. L., Bezerra R. M., Ferreira I. M., Florentino A. C. Copper-Contaminated Substrate Biosorption by Penicillium sp. Isolated from Kefir Grains // Microorganisms. – 2023. – N 11(6). P. 1439. DOI: 10.3390/microorganisms11061439.
Ouattara H. G., Reverchon S., Niamke S. L., Nasser W. Regulation of the synthesis of pulp degrading enzymes in Bacillus isolated from cocoa fermentation // Food Microbiology. – 2017. – Vol. 63. – P. 255–262. DOI: 10.1016/j.fm.2016.12.004.
Oves M., Khan M. S., Zaidi A. Biosorption of heavy metals by Bacillus thuringiensis strain OSM29 originating from industrial effluent contaminated north Indian soil // Saudi journal of biological sciences. – 2013. – Vol. 20, N 2. – P. 121–129. DOI: 10.1016/j.sjbs.2012.11.006
Öztürk A. Removal of nickel from aqueous solution by the bacterium Bacillus thuringiensis // Journal of Hazardous Materials. – 2007. – Vol. 147, N 1–2. – P. 518–523. DOI: 10.1016/j.jhazmat.2007.01.047.
Pal A., Paul A. K. Microbial extracellular polymeric substances: central elements in heavy metal bioremediation // Indian Journal of Microbiology. 2008. – N 48 (1). – P. 49–64. DOI: 10.1007/s12088-008-0006-5.
Pan J. H., Liu R. X., Tang H. X. Surface reaction of Bacillus cereus biomass and its biosorption for lead and copper ions // Journal of Environmental Sciences. – 2007. – Vol. 19, N 4. – P. 403–408. DOI: 10.1016/S1001-0742(07)60067-9.
Pardo R., Herguedas M., Barrado E., Vega M. Biosorption of cadmium, copper, lead and zinc by inactive biomass of Pseudomonas putida // Analytical and Bioanalytical Chemistry. – 2003. – Vol. 376. – P. 26–32. DOI: 10.1007/s00216-003-1843-z.
Park D, Yun Y. S., Park J. M. The past, present, and future trends of biosorption // Biotechnol Bioproc E. – 2010. – Vol. 15. – P. 86–102. DOI: 10.1007/s12257-009-0199-4.
Pham V. H. T., Kim J., Chang S., Chung W. Bacterial biosorbents, an efficient heavy metals green clean-up strategy: Prospects, challenges, and opportunities // Microorganisms. – 2022. – Vol. 10. – P. 610. DOI: 10.3390/microorganisms10030610
Podder M. S., Majumder C. B. Biosorptive Performance of Bacillus arsenicus MTCC 4380 Biofilm Supported on Sawdust/MnFe2O4 Composite for the Removal of As(III) and As(V) // Water Conservation Science and Engineering. – 2016. – Vol. 1. – P.103–125. DOI: 10.1007/s41101-016-0007-x.
Pushkar B., Sevak P., Singh A. Bioremediation treatment process through mercury-resistant bacteria isolated from Mithi river // Appl Water Sci. – 2019. – Vol. 9. – P. 117. DOI: 10.1007/s13201-019-0998-5.
Qiao W., Zhang Y., Xia H., Luo Y., Liu S., Wang S., Wang W. Bioimmobilization of lead by Bacillus subtilis X3 biomass isolated from lead mine soil under promotion of multiple adsorption mechanisms // Royal Society open science. – 2019. – Vol. 6, N 2. – P. 181701. DOI: 10.1098/rsos.181701.
Rahman A., Nahar N., Nawani N. N., Jass J., Hossain K., Saud Z. A., Saha A. K., Ghosh S., Olsson B., Mandal A. Bioremediation of hexavalent chromium (VI) by a soil-borne bacterium, Enterobacter cloacae B2-DHA // Journal of Environmental Science and Health, Part A. – 2015. – Vol. 50, N 11. – P. 1136–1147. DOI: 10.1080/10934529.2015.1047670.
Raj A. S., Muthukumar P. V., Bharathiraja B., Priya M. Comparative biosorption capacity of copper and chromium by Bacillus cereus // International Journal of Engineering & Technology. – 2018. – Vol. 7. – P. 442–444. DOI:10.14419/ijet.v7i3.34.19355.
Rajesh P., Athiappan M., Paul R., Raj K. D. Bioremediation of cadmium by Bacillus safensis (JX126862), a marine bacterium isolated from mangrove sediments // International Journal of Current Microbiology and Applied Sciences. – 2014. – Vol. 3, N 12. – P. 326–335.
Rani M. J., Hemambika B., Hemapriya J., Kannan V. R. Comparative assessment of heavy metal removal by immobilized and dead bacterial cells: a biosorption approach //African Journal of Environmental Science and Technology. – 2010. – Vol. 4. – N 2. – P.77–83.
Rigoletto M., Calza P., Gaggero E., Malandrino M., Fabbri D. Bioremediation methods for the recovery of lead-contaminated soils: A review // Applied Sciences. – 2020. – Vol. 10, N 10. – P. 3528. DOI: 10.3390/app10103528.
Rodríguez-Tirado V., Green-Ruiz C., Gómez-Gil B. Cu and Pb biosorption on Bacillus thioparans strain U3 in aqueous solution: Kinetic and equilibrium studies // Chemical Engineering Journal. – 2012. – Vol. 181. – P. 352–359. DOI: 10.1016/j.cej.2011.11.091.
Rohini B., Jayalakshmi S. Bioremediation potential of Bacillus cereus against copper and other heavy metals // International Journal of Advanced Research in Biological Sciences. – 2015. – Vol. 2, N 2. – P. 200–209.
Sabae S. Z., Hazaa M., Hallim S. A., Awny N. M., Daboor S. M. Bioremediation of Zn+2, Cu+2 and Fe+2 using Bacillus subtilis D215 and Pseudomonas putida biovar A D225 // Bioscience Research. – 2006. – Vol. 3. – P.189–204.
Şahin Y., Öztürk A. Biosorption of chromium (VI) ions from aqueous solution by the bacterium Bacillus thuringiensis // Process Biochemistry. – 2005. – Vol. 40, N 5. – P. 1895–1901. DOI: 10.1016/j.procbio.2004.07.002.
Sahoo S., Goli D. Bioremediation of lead by a halophilic bacteria Bacillus pumilus isolated from the mangrove regions of Karnataka // International Journal of Science and Research. – 2020. – Vol. 9. – P. 1337–1343. DOI: 10.21275/ART20204172.
Salehizadeh H., Shojaosadati S. A. Removal of metal ions from aqueous solution by polysaccharide produced from Bacillus firmus // Water Research. – 2003. Vol. 37, N 17. – P. 4231–4235. DOI: 10.1016/S0043-1354(03)00418-4.
Samarth D. P., Chandekar C. J., Bhadekar R. K. Biosorption of heavy metals from aqueous solution using Bacillus licheniformis // International Journal of Pure and Applied Sciences and Technology. – 2012. – Vol. 10, N 2. – P. 12–19.
Sanders M. E., Morelli L., Tompkins T. A. Sporeformers as Human Probiotics: Bacillus, Sporolactobacillus, and Brevibacillus. // Comprehensive Reviews in Food Science and Food Safety. – 2003. – N 2 (3). – P. 101–110. DOI: 10.1111/j.1541-4337.2003.tb00017.x.
Saranya K., Sundaramanickam A., Shekhar S., Swaminathan S. Biosorption of mercury by Bacillus thuringiensis (CASKS3) isolated from mangrove sediments of southeast coast India // Indian Journal of Geo-Marine Sciences. – 2019. – Vol. 48. – P.143–150. http://nopr.niscpr.res.in/handle/123456789/45639.
Sayqal A., Ahmed O. B. Advances in Heavy Metal Bioremediation: An Overview // Applied Bionics Biomechanics. – 2021. – N 5. – P. 1–8. DOI: 10.1155/2021/1609149.
Sharma B., Shukla P. Lead bioaccumulation mediated by Bacillus cereus BPS-9 from an industrial waste contaminated site encoding heavy metal resistant genes and their transporters // Journal of Hazardous Materials. – 2021. – N 401. – P. 123285. DOI: 10.1016/j.jhazmat.2020.123285.
Sharma P. K., Balkwill D. L., Frenkel A., Vairavamurthy M. A. A new Klebsiella planticola strain (Cd-1) grows anaerobically at high cadmium concentrations and precipitates cadmium sulfide // Applied and Environmental Microbiology. – 2000. – N 66 (7). – P. 3083–7. DOI: 10.1128/AEM.66.7.3083-3087.2000.
Shivaji S., Suresh K., Chaturvedi P., Dube S., Sengupta S. Bacillus arsenicus sp. nov., an arsenic-resistant bacterium isolated from a siderite concretion in West Bengal, India // International Journal of Systematic and Evolutionary Microbiology. – 2005. – N 55 (Pt 3). – P. 1123–1127. DOI: 10.1099/ijs.0.63476-0.
Siddiquee S., Rovina K., Azad S. A., Naher L., Suryani S., Chaikaew P. Heavy Metal Contaminants Removal from Wastewater Using the Potential Filamentous Fungi Biomass: A Review // Journal of Microbial & Biochemical Technology. – 2015. – Vol. 7. – P. 384–393. DOI:10.4172/1948-5948.1000243
Singh N., Verma T., Gaur R. Detoxification of hexavalent chromium by an indigenous facultative anaerobic Bacillus cereus strain isolated from tannery effluent // African journal of biotechnology. – 2013. – Vol. 12, N 10. – P. 1091–1103.
Singh P. P., Chopra A. K. Removal of Zn2+ and Pb2+ using new isolates of Bacillus spp. PPS03 and Bacillus subtilis PPS04 from paper mill effluents using indigenously designed Bench-top Bioreactor // Journal of Applied and Natural Science. – 2014. – Vol. 6, N 1. – P. 47–56.
Sinha A., Khare S. K. Mercury bioremediation by mercury accumulating Enterobacter sp. cells and its alginate immobilized application // Biodegradation. – 2012. – N 23 (1). – P. 25–34. DOI: 10.1007/s10532-011-9483-z.
Srinath T., Verma T., Ramteke P. W., Garg S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria // Chemosphere. – 2002. – N 48 (4). – P. 427-435. DOI: 10.1016/S0045-6535(02)00089-9.
Su C. A review on heavy metal contamination in the soil worldwide: Situation, impact and remediation techniques // Environmental Skeptics and Critics. – 2014. – Vol. 3, N 2. – P. 24.
Sun D., Li X., Zhang G. Biosorption of Ag(I) from aqueous solution by Bacillus licheniformis strain R08 // Applied Mechanics and Materials. – 2013. – N 295–298. – P. 129–134. DOI: 10.4028/www.scientific.net/AMM.295-298.129
Suresh K., Prabagaran S. R., Sengupta S., Shivaji S. Bacillus indicus sp. nov., an arsenic-resistant bacterium isolated from an aquifer in West Bengal, India // International journal of systematic and evolutionary microbiology. – 2004. – Vol. 54, N 4. – P. 1369–1375. DOI: 10.1099/ijs.0.03047-0.
Switzer Blum J., Burns Bindi A., Buzzelli J., Stolz J. F., Oremland R.S. Bacillus arsenicoselenatis, sp. nov., and Bacillus selenitireducens, sp. nov.: two haloalkaliphiles from Mono Lake, California that respire oxyanions of selenium and arsenic // Archives of Microbiology. – 1998. – N 171 (1). – P. 19–30. DOI: 10.1007/s002030050673.
Takano H. The regulatory mechanism underlying light-inducible production of carotenoids in nonphototrophic bacteria // Bioscience, Biotechnology, and Biochemistry. – 2016. – Vol. 80. – P. 1264–1273. DOI: 10.1080/09168451.2016.1156478.
Tanaka K., Takanaka S., Yoshida K. A second-generation Bacillus cell factory for rare inositol production // Bioengineered. – 2014. – Vol. 5. – P. 331–334. DOI: 10.4161/bioe.29897.
Tanmoy P., Nimai C. Environmental Arsenic and Selenium Contamination and Approaches Towards Its Bioremediation Through the Exploration of Microbial Adaptations: A Review // Pedosphere. – 2019. – Vol. 29, N 5. – P. 554–568. DOI: 10.1016/S1002-0160(19)60829-5.
Taran M., Sisakhtnezhad S., Azin T. Biological removal of nickel (II) by sp. KL1 in different conditions: optimization by Taguchi statistical approach // Polish Journal of Chemical Technology. – 2015. – Vol. 17, N 3. – P. 29–32. DOI: 10.1515/pjct-2015-0046
Thapa B., Kc A. K., Ghimire A. A review on bioremediation of petroleum hydrocarbon contaminants in soil // Kathmandu university journal of science, engineering and technology. – 2012. – Vol. 8, N 1. – P. 164–170.
Tiquia-Arashiro S. M. Lead absorption mechanisms in bacteria as strategies for lead bioremediation // Applied Microbiology and Biotechnology. – 2018. – Vol. 102. – P. 5437–5444.
Upadhyay K. H., Vaishnav A. M., Tipre D. R., Patel B. C., Dave S. R. Kinetics and mechanisms of mercury biosorption by an exopolysaccharide producing marine isolate Bacillus licheniformis // 3 Biotech. – 2017. – Vol. 7. – P. 1–10. DOI: 10.1007/s13205-017-0958-4.
Vidali M. Bioremediation. an overview // Pure and applied chemistry. – 2001. – Vol. 73., N 7. – P. 1163–1172.
Wei W., Liu X., Sun P., Wang X., Zhu H., Hong M., Mao Z. W., Zhao J. Simple whole-cell biodetection and bioremediation of heavy metals based on an engineered lead-specific operon // Environmental Science & Technology. – 2014. – N 48 (6). – P. 3363–71. DOI: 10.1021/es4046567.
Wierzba S. Biosorption of lead (II), zinc (II) and nickel (II) from industrial wastewater by Stenotrophomonas maltophilia and Bacillus subtilis // Polish Journal of Chemical Technology. – 2015. – Vol. 17, N 1. – P. 79–87. DOI: 10.1515/pjct-2015-0012.
Wu G., Kang H., Zhang X., Shao H., Chu L., Ruan C. A critical review on the bio-removal of hazardous heavy metals from contaminated soils: issues, progress, eco-environmental concerns and opportunities // Journal of Hazardous Materials. – 2010. – N 174 (1-3). – P. 1–8. DOI: 10.1016/j.jhazmat.2009.09.113.
Wu J., Kang F., Wang Z., Song L., Guan X., Zhou H. Manganese removal and product characteristics of a marine manganese-oxidizing bacterium Bacillus sp. FF-1 // International Microbiology. – 2022. – N 25 (4). – P. 701–708. DOI: 10.1007/s10123-022-00254-9.
Yang T., Chen M. L., Wang J. H. Genetic and chemical modification of cells for selective separation and analysis of heavy metals of biological or environmental significance // TrAC Trends in Analytical Chemistry. – 2015. – Vol. 66. – P. 90–102. DOI: 10.1016/j.trac.2014.11.016.
Zabochnicka-Świątek M., Krzywonos M. Potentials of biosorption and bioaccumulation processes for heavy metal removal // Polish Journal of Environmental Studies. – 2014. – Vol. 23. – P. 551–561.
Zhou M., Liu Y., Zeng G., Li X., Xu W., Fan T. Kinetic and equilibrium studies of Cr (VI) biosorption by dead Bacillus licheniformis biomass // World Journal of Microbiology and Biotechnology. – 2007. – Vol. 23. – P. 43–48. DOI: 10.1007/s11274-006-9191-8.
Zouboulis A. I., Loukidou M. X., Matis K. A. Biosorption of toxic metals from aqueous solutions by bacteria strains isolated from metal-polluted soils // Process biochemistry. – 2004. – Vol. 39, N 8. – P. 909–916. DOI: 10.1016/S0032-9592(03)00200-0.

