Publication text (PDF): Download
УДК 595.132-15:551.465.4(262.5)
Функционально-трофические группы сообщества нематод бентали в редокс-зоне в северо-восточном секторе
Чёрного моря
Иванова Е. А., Гулин M. Б.
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
Представлены результаты изучения сообщества свободноживущих бентосных нематод в редокс-хемоклине северо-восточного сектора Чёрного моря. Зона хемоклина Черного моря характеризуется высокой пространственно-временной динамикой. Вертикальные колебания местоположения изопикны STh=16.2 были зарегистрированы в интервале глубин от 136 до 174 м. Отмечен тренд снижения с глубиной общей численности мейобентоса в хемоклине Чёрного моря. Всего в сообществе нематод черноморской редокс-зоны отмечено 12 видов с явным доминированием представителей класса Chromadorea. Пик общей численности мейофауны на исследуемых глубинах приурочен к горизонту 173 м, где основным компонентом биоты были одноклеточные организмы – морские инфузории. Максимальная численность нематод (до 71,2 экз./0,1 м2) отмечена на горизонте 160 м, где доминировали виды функционально-трофической группы «с-p 2», составляя 55 % общей численности; на группы «с-p 3–5» приходилось 45 %; сообщество нематод было представлено 9 видами. Глубже 160 м обнаружены лишь единичные экземпляры четырёх видов, относящихся к группе нематод «с-p 3–5» (“persisters”), представленные, в основном, хищниками: – Desmoscolex minutus (Claparède, 1863), Viscosia glabra (Bastian, 1865) de Man, 1890, Camacolaimus bathycola (Filipjev, 1922), Tricoma sp.1. На глубине 260 м мейобентос отсутствовал, однако на 263 м была обнаружена нематода Tricoma sp. 1. Особенностью фауны нематод черноморского хемоклина является отсутствие такой функционально-трофичесой группы, как «с-p 1», относимых к r-стратегам (‘extreme colonizers’ or ‘enrichment opportunists’). Высказано предположение, что вероятной причиной отсутствия данной группы морских круглых червей видится низкая плотность поселений нематод на глубинах ниже 160 м, в то время как короткий жизненный цикл группы «с-p 1» подразумевает высокую плотность поселений.
Ключевые слова: мейобентос, свободноживущие морские нематоды, функционально-трофические группы нематод, хемоклин, гипоксия, сероводородное заражение, Чёрное море.
ВВЕДЕНИЕ
В течение последних десятилетий работы по анализу сообществ свободноживущих нематод морских донных осадков показали, что особенности их видового состава отражают свойство и качество окружающей среды. Трофическая и функциональная структура сообщества нематод является удобным инструментом оценки экологической ситуации донной среды, степени её «пригодности» для обитания – от экстремальных малонаселённых гипоксических биотопов до благоприятных нормоксических грунтов (Ferris, Bongers, 2009).
Главной особенностью черноморского хемоклина, располагающегося между кислородной и глубинной сероводородной зонами водной толщи, являются его пространственные масштабы, намного превосходящие все аналогичные местообитания Мирового океана. Содержание растворённого кислорода в редокс-зоне снижается до пороговых значений чувствительности измерительных датчиков (около 0,03 мг/л) (Стунжас и др., 2019). Глубже находится бескислородная зона, содержащая сероводород, метан, аммонийный азот и другие восстановленные химические вещества в значительных количествах. Ранее было установлено, что в северо-западной части моря вблизи Крыма, в месте соприкосновения хемоклина водной толщи со склоном бентали, растворённый кислород способен проникать до горизонта 200–204 м (Гулин, 2013).
В настоящее время преобладающим является мнение о том, что с глубиной численность многоклеточной бентосной фауны в Чёрном море снижается (Заика и др., 1992) и в глубоководной аноксической зоне активно функционирующим населением грунтов является
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
лишь бактериобентос. Исследование нематод отряда Desmoscolecida в северо-западной части Чёрного моря показало, что наибольшее видовое богатство этой группы приурочено к глубинам 120 и 130 м, наименьшее – к глубинам 180, 190 и 240 м (Кошелева, 2012). Анализ биоты в нефиксированных пробах донных осадков методом прямого микроскопирования (Гулин, 2013) показало, что в прибосфорском районе Чёрного моря наибольшее количество живых, двигательно-активных особей в донных осадках сосредоточено на глубине 172 м – над верхней границей сероводородной зоны пелагиали, примыкающей к материковому склону (185–188 м). В субоксидной зоне крымского района, так же, как и у Босфора, непосредственно над верхней границей сероводородной зоны найден максимум численности живого микрооксифильного бентоса, располагавшийся на глубинах 135–153 м (Гулин, 2013). Наибольшей глубиной на шельфе Крыма, где были обнаружены живые организмы, оказался горизонт 204 м. Здесь преобладали крупные нематоды. Глубже, на 376 м, живых организмов не обнаружено (Гулин, 2013). Однако, недавние исследования глубоководного мейобентоса на турецком шельфе (Sergeeva, Ürkmez, 2017) свидетельствуют о большем разнообразии мейобентосных сообществ. Авторы утверждают, что как простейшие, так и многоклеточные животные, в частности, нематоды, обитают на глубине до 300 м, что вполне согласуется с предыдущими оценками М. И. Киселёвой о нижней границе распространения эукариот в меромиктической системе Чёрного моря (Киселёва, 1979).
В нашей работе представлены результаты изучения сообщества свободноживущих морских нематод в редокс-зоне северо-восточного сектора Чёрного моря.
Целью данной работы стало изучить сообщества свободноживущих морских нематод в редокс-зоне северо-восточного сектора Чёрного моря, а также проанализировать функционально-трофическую структуру таксоцена в условиях дефицита кислорода в донной морской среде.
МАТЕРИАЛ И МЕТОДЫ
Исследования проводились в северо-восточном секторе Чёрного моря в 89 рейсе НИС
«Профессор Водяницкий» в октябре 2016 года и МНИС БПМ-74 «Ашамба» в июне – июле 2015 и 2017 годов (табл. 1) на траверзе Геленджикской бухты – в районе заякоренной океанологической станции «Аквалог» (Островский и др., 2013).
Бентосная съёмка выполнялась грунтоотборником «Румолот», снабжённым прозрачной акриловой трубкой с внутренним диаметром 54 мм. На её верхнем торцевом конце расположен клапан, заслонка которого выполнена из пластика с резиновым кольцевым уплотнителем и имеет слабую отрицательную плавучесть. Заслонка лишена возвратной запорной пружины и закрывается при подъёме прибора под собственным весом в сочетании с напором встречного потока воды. Румолот позволяет отбирать преимущественно пробы
Таблица 1
Координаты исследуемых станций, глубина и гидрологические особенности
| Глубина отбора проб, м | Широта | Долгота | Глубина STh=16,2* |
| 160 | 44°46’25» | 35°31’24» | 145–147 м |
| 173 | 44°54’56» | 32°30’32» | 145–147 м |
| 205 | 44°27’23» | 33°13’30» | 145–147 м |
| 238 | 44°49’02» | 37°97’55» | 136–140 м |
| 244 | 44°31’02» | 37°57’67» | 166–174 м |
| 260 | 44°29’39» | 37°58’08» | 166–174 м |
| 263 | 44°48’69» | 37°98’61» | 136–140 м |
Примечание к таблице. * Изопикна 16,2, зарегистрирована СТД-зондом в момент отбора проб.
илистых грунтов. Получаемые с его помощью колонки грунта сохраняют, как правило, ненарушенное строение, с естественной слоистой текстурой осадков (Стунжас и др., 2019). Непосредственно после доставки грунтозаборного устройства на палубу судна измерялась концентрация кислорода в надосадочном слое, для чего использовался высокоселективный LDO-оксиметр HQ40d (Hach, США). Одновременно проводились гидрологические съемки зондом SBE-19-plus с кассетой батометров. Пробы грунта фиксировались 76 % раствором этанола, промывались через сито 30 мкм, окрашивались красителем «Бенгальский розовый». Таксономическая идентификация нематод проводилась с использованием светового микроскопа в соответствии с World Register of Marine Species (2019).
РЕЗУЛЬТАТЫ
Физико-химические показатели придонной воды. Пробы морского грунта, отобранные в зоне хемоклине Черного моря, характеризовались высокой пространственно- временной динамикой. Так, по данным автоматического зонда «Аквалог» (Стунжас, и др., 2018), в период 2013–2015 годов вертикальные колебания местоположения STh=16,2 были зарегистрированы в интервале глубин 125–215 м, с преобладающим залеганием на горизонте 155–175 м.
В 2015 году над склоном с глубинами 199–263 м изопикна STh=16,2, обычно соответствующая глубине залегания верхней границы сероводородной зоны, располагалась сравнительно глубоко — на горизонте 166–174 м. В 2016 году изопикны STh=16,2 были зарегистрированы на глубинах 145–147 м. В 2017 году верхняя граница зоны H2S (изопикны 16,2) была зафиксирована нами в момент отбора проб на глубине 136–140 м (Стунжас, и др., 2018).
Наши приборные измерения во время отбора проб показали, что окислительно- восстановительный потенциал (Eh) на глубине 173 м и 244 м составлял −203 мВ и −294 мВ соответственно. Такие низкие отрицательные значения Eh свидетельствуют о критических условиях существования мейофауны (Giere, 2009).
Мейофауна в хемоклине. Общая численность мейобентоса грунтов в хемоклине Чёрного моря снижалась с глубиной, что показано в таблице 2.
Заметный пик общей численности мейофауны наблюдался на глубине 173 м, где основным компонентом биоты были одноклеточные инфузории – силиаты. Однако, максимальная численность нематод отмечена на 160 м.
Количество видов нематод и их обильность имели чёткую тенденцию снижения с глубиной и, соответственно, с усилением гипоксических условий на фоне увеличения концентрации сероводорода в воде и донных осадках. На исследуемых глубинах нематоды были представлены 12 видами с явным доминированием класса Chromadorea (85 %) (табл. 3).
Таблица 2
Численность мейофауны в хемоклине Чёрного моря (экз./100 см2)
| Глубина, м | Общая численность мейофауны | Численность нематод |
| 160 | 124,60 | 71,20 |
| 173 | 656,40 | 35,60 |
| 205 | 23,70 | 13,35 |
| 238 | 52,29 | 4,15 |
| 244 | 92,96 | 3,32 |
| 260 | 0,00 | 0,00 |
| 263 | 4,15 | 0,83 |
Таблица 3
Видовой состав фауны нематод в гипоксических осадках на различных глубинах в зоне черноморского хемоклина на исследуемых станциях
| Глубина, м | Класс | Семейство | Род | Вид |
| 160 | Chromadorea | Desmoscolecidae | Tricoma | Tricoma sp. 1 |
| 160 | Chromadorea | Xyalidae | Daptonema | Daptonema oxycerca (de Man, 1888) |
| 160 | Chromadorea | Chromadoridae | Ptycholaimellus | Ptycholaimellus ponticus
(Filipjev, 1922) Gerlach, 1955 |
| 160 | Chromadorea | Chromadoridae | Spilophorella | Spilophorella sp. 1 |
| 160 | Enoplea | Oncholaimidae | Viscosia | Viscosia elongata (Filipjev, 1922) |
| 160 | Chromadorea | Microlaimidae | Microlaimus | Microlaimus sp. 1 |
| 160 | Chromadorea | Plectida | Leptolaimidae | Leptolaimus sp. 1 |
| 160 | Chromadorea | Xyalidae | Linhystera | Linhystera sp. 1 |
| 173 | Chromadorea | Desmoscolecidae | Desmoscolex | Desmoscolex minutus
(Claparède, 1863) |
| 205 | Chromadorea | Desmoscolecidae | Desmoscolex | Desmoscolex minutus |
| 238 | Enoplea | Oncholaimidae | Viscosia | Viscosia glabra (Bastian, 1865) de Man, 1890 |
| 244 | Chromadorea | Camacolaimidae | Camacolaimus | Camacolaimus bathycola
(Filipjev, 1922) |
| 260 | ‒ | ‒ | ‒ | ‒ |
| 263 | Chromadorea | Desmoscolecidae | Tricoma | Tricoma sp. 1 |
Обильная фауна нематод с разнообразным таксономическим составом присутствовала только на глубине 160 м (табл. 3). Глубже в пробах были обнаружены лишь единичные экземпляры представленных видов. На глубине 260 м мейобентос в донных осадках отсутствовал, а на 263 м обнаружена нематода Tricoma sp. 1.
ОБСУЖДЕНИЕ
Согласно методике (Bongers et al., 1991), семейства нематод ранжированы на пять функционально-трофических групп в зависимости от их экологической стратегии жизни: от экстремальных r-стратегов до экстремальных K-стратегов (так называемый “colonizers- persisters” groups или с-p groups). Загрязнение, эвтрофикация или другие экологические сдвиги среды ведут к изменению соотношения функциональных групп (с-p групп) среди нематод, являясь хорошим индикатором общего экологического состояния грунтов (Ferris, Bongers, 2009).
Соотношение функциональных групп нематод в сообществе на разных глубинах черноморского хемоклина представлено на треугольной диаграмме, оси которой соответствуют доли функциональных групп нематод (рис. 1).
На глубине 160 м нематоды группы «с-p 2» составляют 55 %, а группа «с-p 3–5» 45 % от общей численности. Здесь нематодное сообщество представлено 9 видами с высокой численностью, тогда как глубже обнаружены лишь единичные экземпляры четырёх видов, относящихся к группе нематод «с-p 3–5» – Desmoscolex minutus, Viscosia glabra, Camacolaimus bathycola, Tricoma sp. 1. На глубине 260 м мейобентос не обнаружен, однако на 263 м в пробе
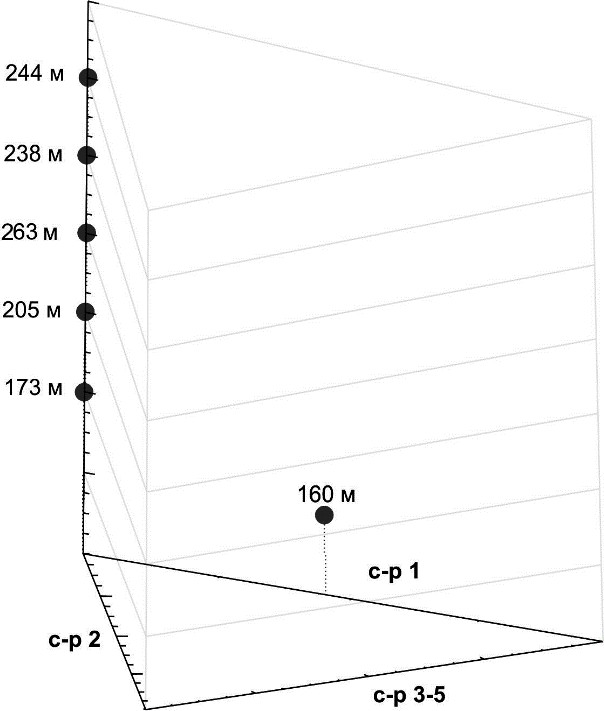
Рис. 1. Соотношение функциональных групп (с-p групп) “colonizers-persisters” внутри нематодного сообщества, ранжированные от «с-p 1» до «с-p 5» на различных глубинах
черноморского хемоклина
присутствовала нематода Tricoma sp.1. Следует также отметить результаты проведённых нами визуальных наблюдений нефиксированных проб грунта на 240 м, проведённых сразу после поднятия румолота (Стунжас и др., 2019), где живой мейобентос не обнаружен.
Сопоставление наших данных о распределении нематод со значениями Eh на 244 м (‒294 мВ) может приводить к допущению, что обнаруживаемые в таких условиях единичные экземпляры живых нематод находятся в критических условиях существования при практически полном отсутствии кислорода длительные периоды времени и в постоянном присутствии сероводорода. Нельзя исключить попадание этих организмов на такие глубины в результате седиментационных процессов, оползней, действия придонных течений и последующего оседания на дно организмов из вышележащих, более благоприятных для жизни грунтов. Погибший в аноксийно-сероводородных условиях мейобентос может сохраняться достаточно долго в отсутсвии кислорода и обнаруживаться в пробах донных осадков (Иванова, 2017). Аналогичная картина в хемоклине сероводородных озёр-лагун отмечалась нами на побережье Белого моря (Иванова и др., 2021).
К группе «с-p 1» относят нематод с коротким жизненным циклом, питающихся первичной бактериальной продукцией и обычно показывающих взрывной рост в насыщенных органикой грунтах, устойчивы к загрязнению продуктами распада органического вещества в грунтах. Нематоды группы «с-p 2» отличаются коротким жизненным циклом и сравнительно высоким уровнем воспроизводства, хотя и ниже, чем в группе «с-p 1». Распространены круглые черви группы «с-p 2» практически повсеместно, как в бедных, так и в обогащенных органическим веществом донных осадках; они устойчивы к загрязнениям и другим стрессовым факторами и представлены в основном нематодами, поедающими бактерий и некоторыми хищниками (Ferris, Bongers, 2009). Нематоды групп «с-p 3–5» (“persisters”) объединены на одной оси, они характеризуются более длинным жизненным циклом, чем первые две группы; большей чувствительностью к стрессорам среды; представлены, в основном, хищниками (рис 1).
В комплексной работе по оценке экологического статуса донной среды с использованием широкого ряда индексов сообщества морских нематод (Moreno et al., 2011) было заключено,
что анализ нематодного сообщества на уровне рода и процентное соотношение «c-p» групп нематод являются одними из наиболее релевантных индикаторов экологического статуса донной среды. Согласно предложенной авторами классификации, состояние сообщества нематод на горизонте 160 м характерно для грунтов среднего экологического статуса, а сообщества, обитающие глубже, демонстрируют параметры хорошего статуса. Это является достаточно интересным фактом, учитывая, что хемоклин – это зона дефицита кислорода и периодического присутствия токсичного сероводорода и такие условия донной среды находятся в критической области для существования мейофауны.
Анализируя физико-химические процессы на этих глубинах, можно предположить, что зона хемоклина, как наиболее высокоизменчивая кислородно-гипоксичесая среда, формирует более разнообразные, но неустойчивые сообщества. Тогда как проникающие глубже в сероводородную зону нематодные сообщества имеют обеднённый видовой состав, но, видимо, более устойчивы к гипоксии и сероводородному заражению морских осадков. Дополнительным подтверждением данного предположения являются аналогичные результаты по видовому разнообразию Desmoscolecida, которые были получены и в северо- западной части Чёрного моря на глубинах дна более 160 м (Кошелева, 2012).
Глубже 160 м обнаружены только нематоды групп «с-p 3–5» (“persisters”), представленные, в основном, хищниками. На глубине 260 м мейобентос отсутствует, а на 263 м глубине отмечена Tricoma sp. 1.
Также, другой характерной особенностью фауны нематод черноморского хемоклина видится полное отсутствие такой группы, как «с-p 1», относимых к r-стратегам (‘extreme colonizers’ or ‘enrichment opportunists’). Вероятно, это связано с уменьшением плотности нематодных сообществ с глубиной, тогда как короткий жизненный цикл нематод группы «с- p 1» предполагает высокую плотность поселений.
ЗАКЛЮЧЕНИЕ
Общая численность мейобентоса грунтов в хемоклине Чёрного моря снижалась с глубиной. Пик мейофауны на исследуемых глубинах приурочен к глубине 173 м, где основным компонентом биоты были одноклеточные инфузории – силиаты. Максимальная численность свободноживущих морских нематод отмечена на горизонте 160 м. Всего на исследованных глубинах нематоды представлены 12 видами с явным доминированием представителей класса Chromadorea. На глубине 160 м нематоды группы «с-p 2» составляли
55 %, а группы «с-p 3–5» 45 % от общей численности. Здесь нематодное сообщество представлено 9 видами с высокой численностью, тогда как глубже 160 м обнаружены лишь единичные экземпляры четырёх видов, относящихся к группе нематод «с-p 3–5» (“persisters”)
– Desmoscolex minutus, Viscosia glabra, Camacolaimus bathycola, Tricoma sp. 1, представленные хищниками. На глубине 260 м мейобентос не обнаружен, а на 263 м глубине отмечена Tricoma sp. 1.
Дополнительной характерной особенностью фауны нематод черноморского хемоклина является отсутствие такой фунционально-трофичесой группы, как «с-p 1», относимых к r- стратегам (‘extreme colonizers’ or ‘enrichment opportunists’). Вероятной причиной отсутствия данной группы морских круглых червей видится низкая плотность поселений нематод на глубинах ниже 160 м, в то время как короткий жизненный цикл этой группы подразумевает высокую плотность поселений.
Благодарности. Авторы глубоко признательны проф. А. Г. Зацепину (ИО им. Ширшова РАН, Москва) и В. П. Чекалову (ИнБЮМ им. Ковалевского РАН, Севастополь) за помощь при организации и проведении полевых работ.
Работа выполнялась по теме «Функциональные, метааболические и токсикологические токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом» № 121041400077-1.
Список литературы
Гулин М. Б. Батиметрическое распределение живых активных форм зообентоса в хемоклине Чёрного моря // Морской экологический журнал. – 2013. – Т. XII, № 1. – С. 5–17.
Заика В. Е., Киселева М. И., Михайлова Т. В., Маккавеева Е. Б., Сергеева Н. Г., Повчун А. С., Колесникова Е. А., Чухчин В. Д. Многолетние изменения зообентоса Чёрного моря. – Киев: Наукова думка, 1992. – 248 с.
Иванова Е. А. Экология мейобентоса метановых сипов Чёрного моря: фаунистические характеристики и результаты наблюдений физиологического состояния методом прямого микроскопирования // Экосистемы. – 2017. – Вып. 10. – С. 28–34.
Иванова Е. А., Краснова Е. Д., Воронов Д. А., Тимофеев В. А., Гулин М. Б. Результаты исследования функционального состояния мейобентосной фауны в высокосульфидных биотопах прибрежных озёр-лагун Кандалакшского залива (Белое море) // Экосистемы. – 2021. – № 26. – С. 43–50.
Киселёва М. И. Зообентос. Состав, размерная характеристика и вертикальное распределение. – Основы биологической продуктивности Чёрного моря / [Ред. Грезе В. Н.]. – Киев: Наук. думка, 1979. – С. 208 – 211.
Кошелева Т.Н. Нематоды (Nematoda, Desmoscolecida) глубоководного днепровского каньона (Чёрное море) // Морской экологический журнал. – 2012. – Т. XI, № 3. – С. 57–62.
Островский А. Г., Зацепин А. Г., Соловьев В. А., Цибульский А. Л., Швоев Д. А. Автономный мобильный аппаратно-програмный комплекс вертикального зондирования морской среды на заякоренной буйковой станции // Океанология. – 2013. – Т. 53, № 2. – С. 149–154.
Стунжас П. А., Гулин М. Б., Иванова Е. А., Подымов О. И. Исследования кислородного режима в придонном слое вод и реакции зообентоса на условия гипоксии/аноксии в зоне контакта черноморского хемоклина с континентальным склоном // Некоторые результаты комплексной прибрежной экспедиции «Черное море-2017» на МНИС «Ашамба». – Москва: Научный мир, 2018. – Гл. 7. – С. 149–154.
Стунжас П. А., Гулин М. Б., Зацепин А. Г., Иванова Е. А. О возможности присутствия кислорода в верхнем слое осадков сероводородной зоны Чёрного моря // Океанология. – 2019. – Т. 59, № 1. – С. 166–169.
Ferris H., Bongers T. Indices developed specifically for analysis of nematode assemblages / Nematodes as Environmental Indicators // Wallingford: CABI Publishing 2009. – P. 124–145.
Giere O. Meiobenthology – the Microscopic Motile Fauna of Aquatic Sediments, 2nd ed. – Berlin, Heidelberg: Springer – Verlag, 2009. – 527 p.
Moreno, M., Semprucci F., Vezzulli L., Balsamo M., Fabiano M., Albertelli G. The use of nematodes in assessing ecological quality status in the Mediterranean coastal ecosystems // Ecological Indicators. – 2011. – Vol. 11. – Р. 328–336.
Segeeva N., Ürkmez D. Current views on the diversity and distribution of deep-water meiobenthos at the Turkish shelf (Black Sea) // Ecologica Montenegrina. – 2017. – Vol. 14. – Р. 60–73.
WoRMS Editorial Board. – World Register of Marine Species [Electronic resource]. –http://www.marinespecies.org
2022
Ivanova E. A., Gulin M. B. Functional-trophic groups of the benthic nematode community in the redox zone in the northeastern sector of the Black Sea // Ekosistemy. 2022. Iss. 29. P. 123–129.
The results of studying the community of free-living benthic nematodes in the redox chemocline of the northeastern sector of the Black Sea are presented. The chemocline zone of the Black Sea is characterized by high spatial and temporal dynamics. Vertical fluctuations in the location of the isopycna STh=16,2 were recorded in the depth range from 136 to 174 m. The researchers recorded the trend of decrease in the total abundance of meiobenthos in the Black Sea chemocline with increasing depth. The peak of the total number of meiofauna at the studied depths is confined to the horizon of 173 m, where the main component of the biota are unicellular organisms – ciliates. The maximum number of nematodes was registered at 160 m, where nematodes of the functional-trophic group «c-p 2» made up 55 %, and the group «c-p 3–5» («persisters») represented mainly by predators, accounted for 45 % of the total number. On this isobath, the nematode community is represented by 9 numerous species (up to 71,2 specimens/0,1 m2), while only few specimens of four species belonging to the «c-p 3–5» group of nematodes were found deeper: – Desmoscolex minutus (Claparède, 1863), Viscosia glabra (Bastian, 1865) de Man, 1890, Camacolaimus bathycola (Filipjev, 1922), Tricoma sp. 1. In total, 12 species with a clear dominance of representatives of the Chromadorea class were recorded in the nematode community of the Black Sea redox zone. There was no meiobenthos at the depth of 260 m, however, the nematode Tricoma sp. 1 was recorded at the depth of 263 m. A peculiar feature of the nematode fauna of the Black Sea chemocline is the absence of such a functional trophic group as «c-p 1», referred to as r-strategists (‘extreme colonizers’ or ‘enrichment opportunists’). It is suggested that the probable reason for the absence of this group of marine roundworms is the low density of nematode assemblages at depths below 160 m, while the short life cycle of the «c-p 1» group implies a high density of settlements.
Key words: meiobenthos, free-living nematode, functional and trophic groups of Nematoda, chemocline, hypoxia, hydrogen sulfide contamination, Black Sea.
Поступила в редакцию 12.04.22 Принята к печати 10.05.22

