Экосистемы, 32: 52–59 (2022) https://ekosystems.cfuv.ru
![]()
УДК 579.6 : 579.222
Зайцева Т. Б., Руссу А. Д., Медведева Н. Г.
Санкт-Петербургский Федеральный исследовательский центр РАН, Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН Санкт-Петербург, Россия
zaytseva.62@list.ru, angelarussu@list.ru, ngmedvedeva@gmail.com
Загрязнение объектов окружающей среды гормоноподобными ксенобиотиками, оказывающими негативное влияние на эндокринную систему животных и человека, представляет серьезную экологическую проблему. Нонилфенол (НФ) является одним из наиболее распространенных гормоноподобных ксенобиотиков. Для очистки природных экосистем, загрязненных данным поллютантом, наиболее экологичными являются биотехнологические методы с использованием микроорганизмов, в частности, бактерий. Цель данной статьи – выделение из загрязненной нонилфенолом почвы и идентификация активного бактериального штамма-деструктора НФ, изучение его деструктивных свойств в воде и почве. Идентификацию выделенного штамма 8 проводили по фенотипическим признакам с использованием стандартных методов и методом секвенирования по Сэнгеру фрагмента последовательности гена 16S рРНК (rrs). Содержание НФ определяли методом высокоэффективной жидкостной хроматографии. Новый бактериальный штамм Lelliottia jeotgalis 8 выделен из дерново-подзолистой почвы, загрязненной нонилфенолом. Выявлена высокая эффективность штамма для деградации НФ в аэробных условиях в водной среде при различных концентрациях НФ (50–300 мг/л) и в почве (100 мг/кг с.п.). Представленное исследование впервые демонстрирует способность L. jeotgalis 8 деструктировать НФ. Результаты этого исследования предоставляют полезную информацию для применения L. jeotgalis 8 в процессах биоремедиации загрязненных гормоноподобными ксенобиотиками экосистем.
Ключевые слова: гормоноподобный ксенобиотик нонилфенол; биодеградация; Lelliottia jeotgalis 8; идентификация.
ВВЕДЕНИЕ
Гормоноподобные ксенобиотики – различные синтетические вещества, которые, имитируя функции нормальных гормонов, разрушают эндокринную систему, оказывают неблагоприятное воздействие на человека и состояние окружающей среды (Ismanto et al., 2022).
- числу гормоноподобных соединений относится нонилфенол (НФ) – продукт неполного разложения широко используемых в промышленных и бытовых препаратах неионогенных поверхностно-активных веществ оксиэтилированных нонилфенолов, занимающих одно из первых мест среди контаминантов экосистем (Acir, Klaus, 2018).
В окружающую среду НФ попадает в основном со сточными водами и обнаруживается в воздухе, почве, воде, донных отложениях (Gavrilescu et al., 2015). Загрязнение нонилфенолом объектов окружающей среды происходит, главным образом, за счет сбросов в окружающую среду бытовых и промышленных сточных вод, недостаточно очищенных на водоочистных сооружениях. Об этом свидетельствует тот факт, что, как правило, наиболее высокие концентрации нонилфенолов фиксируются в точках отбора непосредственно вблизи стоков
(Barber et al., 2015).
Уровень загрязнения водных экосистем нонилфенолом может достигать сотен микрограмм в литре (Sole et al., 2000), морских и пресноводных донных осадков – тысяч мг/кг (Guo et al., 2021), почв – сотен миллиграмм на килограмм (Careghini et al., 2015). НФ оказывает негативное воздействие на природные экосистемы, вызывая существенные изменения в численности и составе микробиоты (Кузикова и др., 2019; Kuzikova et al., 2022).
Загрязнение нонилфенолом окружающей среды вызывает серьезную озабоченность вследствие его токсичности для водных организмов, животных и людей (Guo et al., 2021;
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Микробиологическая деградация гормоноподобных ксенобиотиков
![]()
Khalid, Abdollahi, 2021; Shao et al., 2021). Поскольку НФ обладает низкой растворимостью и высокой гидрофобностью, он способен накапливаться в человеческом организме и вызывать или усугублять различные заболевания. НФ нарушает работу репродуктивной, эндокринной, иммунной и центральной нервной систем, может обладать канцерогенными свойствами, вызывает сердечно-сосудистые и аллергические заболевания, артериальную гипертензию и так далее (Suen et al., 2012; Acir, Klaus, 2018; Ismanto et al., 2022).
Высокая токсичность НФ в сочетании с его персистентностью и значительным потенциалом биоаккумуляции в водных организмах, стали основанием для признания для его включения в список приоритетных опасных веществ в рамках Европейской водной рамочной директивы (Directive 2000/60/EC). В настоящее время в ряде стран введены ограничения на производство и использование НФ, регламентировано содержание НФ в объектах окружающей среды.
- окружающей среде (воде, донных осадках, почве) НФ может трансформироваться до менее токсичных соединений за счет абиотических (гидролиза, фотолиза) и биологических процессов (Bhandari et al., 2021). Однако одной из основных стратегий снижения содержания НФ в окружающей среде является микробная деградация.
Известно, что микроорганизмы различных таксономических групп обладают способностью деградировать НФ (Ma et al., 2018; Zaytseva, Medvedeva, 2019; Kuzikova et al., 2020; Feng et al., 2022).
Способностью к деструкции нонилфенола обладает широкий спектр бактериальных штаммов, принадлежащих к разным родам: Acidovorax, Arthrobacter, Bacillus, Maricurvus, Pseudomonas, Sphingomonas, Rizobium и другие (Bhandari et al., 2021). Отмечается, что деградация НФ может осуществляться не только отдельными бактериальными культурами, но и их консорциумами (Bai et al., 2017).
Цель настоящей работы – выделить из загрязненной гормоноподобным ксенобиотиком нонилфенолом почвы активный бактериальный штамм-деструктор НФ, идентифицировать его и изучить его деструктивные свойства в воде и почве.
МАТЕРИАЛЫ И МЕТОДЫ
-
- качестве объектов исследования использованы образцы верхних горизонтов дерново-подзолистой суглинистой почвы (Ленинградская область), технический нонилфенол – НФ
(CAS: 84852-15-3) производства Sigma-Aldrich (США).
Почвенные бактерии-деструкторы НФ выделяли из загрязненной нонилфенолом в концентрации 300 мг/кг сухой почвы (с.п.) и инкубированной в течение 90 суток почвы с использованием метода накопительной культуры в жидкой Минимальной Минеральной Среде (ММС) следующего состава (массовая доля): (NH4)2SO4 – 0,4; KH2PO4 – 0,15; K2HPO4 – 0,15; MgSO4×7H2O – 0,02, содержащей НФ (50 мг/л) в качестве селективного агента. Накопительные культуры инкубировали на роторном шейкере Certomat BS-1 при 230 об./мин., 28 °С в темновых условиях. Каждые 4 суток производили пересев – пассаж (10 % об.) в свежую среду того же состава. Выделение бактериальных культур проводили после 4 и 5-го пассажей методом Коха на двух средах – на СПА, содержащем 50 мг/л НФ, и на агаризованной среде ММС, содержащей агар – 2 %; глюкозу – 0,5 %; дрожжевой экстракт – 0,2 %; НФ – 50 мг/л. Посевы инкубировали при 28 °С в течение 3 дней. Морфологически различные колонии бактерий были отобраны для дальнейшего изучения их способности деструктировать НФ.
Отобранные бактериальные изоляты инкубировали в ММС, содержащей НФ (100 мг/л), на роторном шейкере при 230 об./мин, 28 °С в темноте в течение 7 дней, после чего отбирали образцы для измерения концентрации НФ и выбора наиболее активных штаммов-деструкторов.
Идентификацию бактериального штамма-деструктора нонилфенола проводили по фенотипическим признакам с использованием общепринятых методик (Krige, Padgett, 2011)
- по секвенированию ITS региона ДНК.
53
Зайцева Т. Б., Руссу А. Д., Медведева Н. Г.
![]()
При идентификации штамма 8 применен метод секвенирования по Сэнгеру фрагмента последовательности гена 16S рРНК (rrs). Для амплификации участка гена 16S рРНК (около 1500 пн) применяли праймеры fD1 (5’-AGAGTTTGATCCTGGCTCAG-3’) и rD1 (5’-CTTAAGGAGGTGATCCAGCC-3’) (Weisburg et al., 1991).
Определение нуклеотидной последовательности ПЦР-продукта проводили на генетическом анализаторе ABI 3500xl («Applied Biosystems», США). Штамм 8 был
идентифицирован в Ведомственной коллекции полезных микроорганизмов сельскохозяйственного назначения (ВКСМ, Санкт-Петербург).
Культивирование штамма 8 проводили в глубинных условиях на среде ММС, содержащей НФ, на роторном шейкере Certomat BS-1 при 230 об./мин., 28 °С в темновых условиях. Нонилфенол вносили в питательную среду в виде этанольных растворов, создавая концентрации 50,0–300,0 мг НФ/л. Продолжительность культивирования составляла 7 суток.
-
- экспериментах по изучению деструкции НФ штаммом 8 в почве поллютант вносили в почву в виде ацетоновых растворов по методике, описанной ранее (Кузикова и др., 2019), создавая концентрацию 100 мг НФ/кг с.п. Почвенные образцы (контрольные и содержащие штамм 8) инкубировали в темновых условиях при комнатной температуре в течение 30 суток
- влажности почвы 60 % при периодическом перемешивании.
- качестве инокулята в экспериментах по деградации НФ как в жидкой среде, так и в почве использовали суспензии клеток, выращенных при 28 °С в течение 48–72 часов на агаризованной среде ММС, содержащей агар – 2 %; глюкозу – 0,5 %; дрожжевой экстракт – 0,2 %; НФ – 50 мг/л. Бактериальные суспензии вносили в содержащие нонилфенол жидкую среду культивирования ММС и почву в таком количестве, чтобы плотность клеток составляла 2±1×108 клеток/мл и 4±1×108 клеток/г с.п. соответственно.
Содержание НФ в почвенных образцах, культуральных жидкостях (клетки+среда) и в абиотических контролях определяли методом высокоэффективной жидкостной хроматографии на хроматографе «Hewlett-Packard» H 1090 по методикам, представленным ранее (Кузикова и др., 2019; Kuzikova et al., 2020).
Скорость убыли НФ в быстрой фазе оценивали по продолжительности периода 50 % деструкции поллютанта Т50 и по величине коэффициента скорости реакции первого порядка k (сутки-1), рассчитанных с использованием линейного регрессионного анализа (Liu et al., 2013).
Статистическую обработку данных проводили с использованием пакета компьютерных программ Statistica software (версия 6). Статистическая значимость была установлена при p≤0,05. Полученные данные представлены как среднее значение±стандартное отклонение трех независимых повторов каждого варианта с тремя параллельными повторностями в каждом.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из образца дерново-подзолистой почвы, загрязненной нонилфенолом (300 мг/кг с.п.), выделен бактериальный штамм 8, продемонстрировавший высокую деструктивную активность в отношении НФ (50 мг/л): после 4 суток культивирования степень биодеструкции поллютанта составила 75 %. Следует отметить, что в контрольных вариантах (без клеток бактерий) убыль нонилфенола в среде не происходила (данные не приводятся).
Клетки штамма 8 – грамотрицательные неспорообразующие подвижные палочки. На СПА штамм образует округлые колонии молочного цвета диаметром 3–4 мм, имеющие выпуклый профиль, ровный край, гладкую, блестящую поверхность, мелкозернистую
структуру, жидкую консистенцию. Штамм 8 – каталазоположительный, оксидазоотрицательный, является факультативным анаэробом. Реакция Фогес-Проскауэра положительная, индол не образует. Штамм не способен к использованию мочевины. Атмосферный азот ассимилирует слабо. Способен к денитрификации, потребляет азот минеральных солей, катаболизирует лактозу, рамнозу, арабинозу, фруктозу, галактозу, маннозу, ксилозу, маннит, сорбит, глюкозу (с образованием кислоты и газа), дульцит, инозит, крахмал. Протеолитической активностью в отношении казеина и желатины не обладает.
54
Микробиологическая деградация гормоноподобных ксенобиотиков
![]()
Штамм проявляет амилолитическую и липолитическую активность в отношении Твин 60. Штамм способен к росту в широком диапазоне температур (5–36 °С) и рН 3–9, однако при рН 3 рост слабый. Хорошо растет в присутствии 2,5–6,5 % NaCl (при 10 % NaCl рост очень слабый).
Методом секвенирования фрагмента последовательности гена 16S рРНК показано, что ген 16S рибосомальной РНК штамма 8 проявляет высокие степени идентичности (>99 %) с аналогичными генами бактерий Lelliottia: Lelliottia amnigenapartial HAMBI1 289 (99,66 %), Lelliottia sp. WB101 (99,79 %), Lelliottia jeotgali PFL01T (99,59 %), Lelliottia amnigena JCM1237T (99,37 %) и 100 % сходство гена 16S рибосомальной РНК с аналогичным геном типового штамма Lelliottia jeotgalis PFL01T. По совокупности морфолого-культуральных, физиолого-биохимических свойств и результатов, полученных при секвенировании фрагмента последовательности гена 16S рРНК, штамм 8 идентифицирован как Lelliottia jeotgali 8.
Следует отметить, что деструктивные свойства в отношении алкилфенолов у бактерий рода Lelliottia выявлены впервые. Выделенные бактерии-деструкторы Lelliottia входят в филум Proteobacteria, который, как показано ранее, является доминирующим филумом в таксономической структуре микробного сообщества дерново-подзолистой суглинистой почвы после ее загрязнения нонилфенолом (Кузикова и др., 2019).
Установлено, что выделенный бактериальный штамм L. jeotgali способен деструктировать НФ жидкой среде в широком диапазоне концентраций 50–300 мг/л (рис. 1).
Анализ кривых степени удаления НФ в условиях данных экспериментов позволил выделить 2 фазы – более быструю и замедленную (рис. 1). Следует отметить, что аналогичный двухфазный характер убыли НФ ранее также был отмечен в присутствии бактерий, цианобактерий и микромицетов (Bai et al., 2017; Zaytseva, Medvedeva, 2019; Kuzikova et al., 2020).
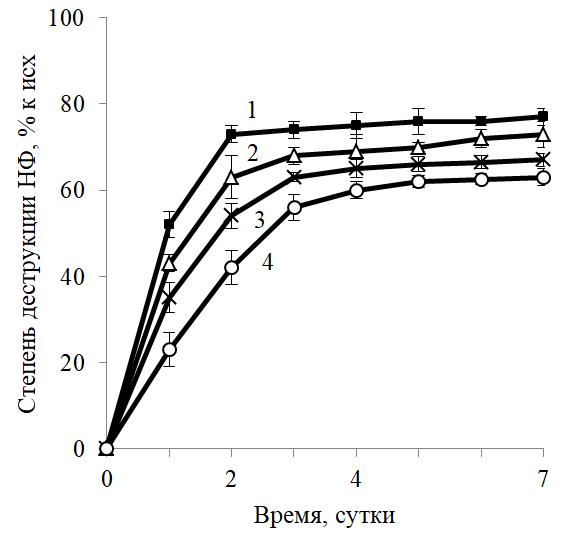
Рис. 1. Зависимость степени деструкции нонилфенола бактерией Lelliottia jeotgali от его содержания в среде: 1 – 50 мг/л; 2 – 100 мг/л; 3 – 200 мг/л; 4 – 300 мг/л
Продолжительность быстрой фазы убыли НФ зависела от его содержания в среде и составляла 2 суток при 50 и 100 мг НФ/л и 3 суток – при 200 и 300 мг НФ/л. К окончанию быстрой фазы удаления НФ степень его биодеградации бактерий L. jeotgali в зависимости от его исходной концентрации составила 60–73 %. Затем наблюдалось замедление процесса биодеструкции.
55
Зайцева Т. Б., Руссу А. Д., Медведева Н. Г.
![]()
Повышение содержания НФ в среде приводило к дозо-зависимому увеличению времени его 50 % удаления и снижению скорости биодеградации (табл. 1).
Так, при увеличении начального содержания НФ от 50 до 300 мг/л коэффициент скорости деструкции k снизился в 2,4 раза, а длительность полураспада нонилфенола возросла в 2,2 раза.
Таблица 1
Зависимость величины коэффициента скорости деградации нонилфенола k и продолжительности его полудеструкции бактерией L. jeotgali 8 от концентрации
нонилфенола в среде
| Степень | ||||||
| Нонилфенол, | Уравнение линейной | k, сутки-1 | Т50, | R2 | биодеструкции | |
| мг/л | регрессии | сутки | нонилфенола | |||
| (7 суток), % | ||||||
| 50 | ln(Сt/С0)=−0,64×t −0,04 | 0,64±0,07 | 1,15±0,11 | 0,957 | 77±0,11 | |
| 100 | ln(Сt/С0)= −0,45×t −0,02 | 0,45±0,05 | 1,51±0,23 | 0,953 | 73±0,25 | |
| 200 | ln(Сt/С0) =−0,33×t −0,05 | 0,33±0,04 | 1.95±0,09 | 0,981 | 67±0,09 | |
| 300 | ln(Сt/С0) =−0,27×t −0,02 | 0,27±0,03 | 2,49±0,18 | 0,971 | 63±0,18 | |
Примечание к таблице. k – коэффициент скорости деструкции нонилфенола; Т50 – продолжительность периода 50 % деструкции НФ; R2 – коэффициент детерминации.
Полученные результаты сопоставимы с данными других авторов, показавших снижение скорости деструкции НФ с повышением его концентрации в среде бактериальными штаммами Sphingobium amiense и Sphingomonas cloacae (Ikunaga et al., 2004). Однако Watanabe с соавторами (Watanabe et al., 2012) представили противоположные результаты: при увеличении концентрации нонилфенола от 50 до 100 мг/л скорость его деструкции бактерией Pseudomonas fulava оставалась постоянной, в то время как скорость его деградации бактерией Acidovorax sp. возрастала.
При изучении деструкции НФ в почве выявлено, что в контрольном варианте (без L. jeotgali 8) происходит деградация поллютанта автохтонной микробиотой: коэффициент скорости его деградации составил 0,021 суток-1, время полудеградации – 32,1 суток, степень деструкции после 30 суток инкубирования – 42 % (рис. 2, табл. 2).
Внесение в почву клеток L. jeotgali 8 приводило к значительному ускорению процесса деструкции НФ: коэффициент k возрастал в 5,7 раза, уровень Т50 снижался в 5,3 раза, степень деструкции после 30 суток инкубирования повышалась в 2,1 раза (рис. 2, табл. 2).
Следует отметить, что деградации НФ в почве, как и в жидкой среде имеет двухфазный характер. Предполагается, что замедление процесса биодеструкции может быть вызвано ухудшением качества среды вследствие образования токсичных для бактерий метаболитов или гибелью деструкторов (Bai et al., 2017).
ЗАКЛЮЧЕНИЕ
Из образца дерново-подзолистой почвы, загрязненной нонилфенолом выделен бактериальный штамм-деструктор НФ, идентифицированный как Lelliottia jeotgali 8. Выделенный штамм способен к деструкции нонилфенола в аэробных условиях в жидкой среде при различных концентрациях НФ (50–300 мг/л) и в почве (100 мг/кг с.п.).
Результаты данного исследования предоставляют полезную информацию для применения бактерии L. jeotgali 8 в процессах биоремедиации.
56
Микробиологическая деградация гормоноподобных ксенобиотиков
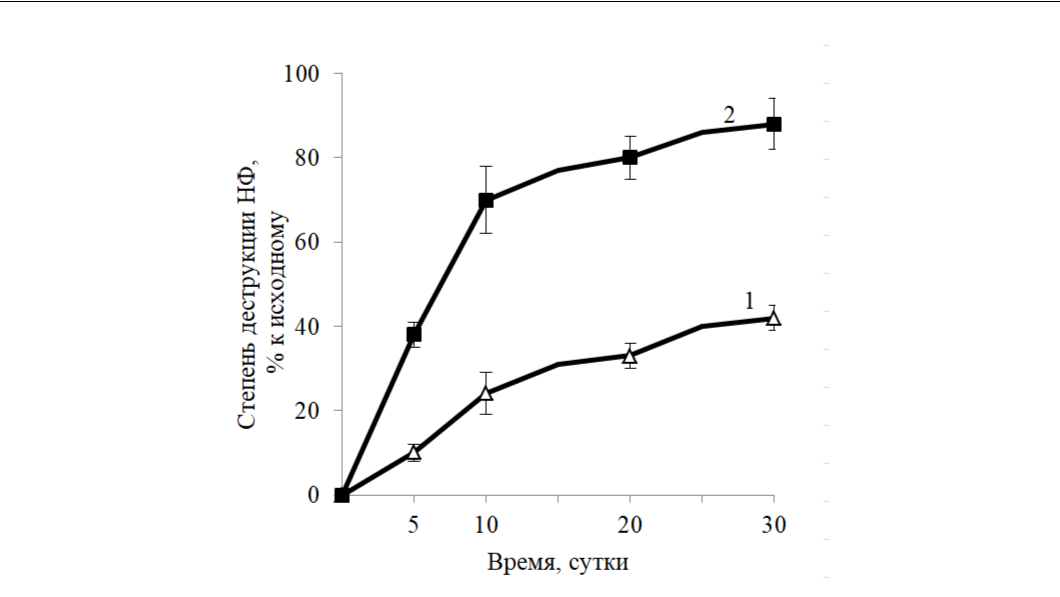
Рис. 2. Деструкция нонилфенола в почве бактерией L. jeotgali 8: 1 – контрольный вариант (без L. jeotgali 8), 2 – вариант почвы, обработанный клетками L. jeotgali 8
Таблица 2
Влияние бактерии L. jeotgali 8 на скорость деградации нонилфенола в почве
| Степень | ||||||
| Вариант почвы | Уравнение линейной | k, сутки-1 | Т50, | R2 | биодеструкции | |
| регрессии | сутки | нонилфенола | ||||
| (30 суток), % | ||||||
| Контроль (без | ln(Сt/С0)= −0,021×t− | 0,021±0,005 | 32,1±2,6 | 0,957 | 42 | |
| L. jeotgali 8) | 0,019 | |||||
| Обработанная | ln(Сt/С0)= −0,12×t | |||||
| клетками | 0,12±0,03 | 6,1±0,7 | 0,989 | 88 | ||
| +0,04 | ||||||
| L. jeotgali 8 | ||||||
Примечание к таблице. k – коэффициент скорости деструкции нонилфенола; Т50 – продолжительность периода 50 %-й деструкции НФ; R2 – коэффициент детерминации.
Полученные результаты могут быть использованы при решении актуальной фундаментальной задачи по разработке конвергентных биотехнологий для очистки экосистем, загрязненных гормоноподобными экотоксикантами.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 122041100086-5).
Список литературы
Кузикова И. Л., Зайцева Т. Б., Кичко А. А., Зиновьева С. В., Руссу А. Д., Маячкина Н. В., Медведева Н. Г. Влияние нонилфенолов на численность и таксономическую структуру почвенного микробного сообщества // Почвоведение. – 2019. – № 6. – С. 724–735.
Acir I.-H., Klaus G. Endocrine-disrupting metabolites of alkylphenol ethoxylates – A critical review of analytical methods, environmental occurrences, toxicity, and Regulation // Science of the Total Environment. – 2018. – N 635. – P. 1530–1546. DOI: 10.1016/j.scitotenv.2018.04.079
Bai N., Abuduaini R., Wang S., Zhang M., Zhu X., Zhao Y. Nonylphenol biodegradation characterizations and bacterial composition analysis of an effective consortium NP-M2 // Environmental Pollution. – 2017. – Vol. 220. – P. 95– 104. DOI:10.1016/j.envpol.2016.09.027
57
Зайцева Т. Б., Руссу А. Д., Медведева Н. Г.
![]()
Barber L. B., Loyo-Rosales J. E., Rice C. P., Minarik T. A., Oskouie A. K. Endocrine disrupting alkylphenolic chemicals and other contaminants in wastewater treatment plant effluents, urban streams, and fish in the Great Lakes and Upper Mississippi River Regions // Science of The Total Environment. – 2015. – Vol. 517. – P. 195–206. DOI: 10.1016/j.scitotenv.2015.02.035.
Bhandari G., Bagheri A. R., Bhatt P., Bilal M. Occurrence, potential ecological risks, and degradation of endocrine disrupter, nonylphenol, from the aqueous environment // Chemosphere. – 2021. – Vol. 275, 130013. DOI: 10.1016/j.chemosphere.2021.13
Careghini A., Mastorgio A. F., Saponaro S., Sezenna E. Bisphenol A, nonylphenols, benzophenones, and benzotriazoles in soils, groundwater, surface water, sediments, and food: a review // Environmental Science and Pollution Research. – 2015. – Vol. 22. – P. 5711–5741. DOI: 10.1007/s11356-014-3974-5
Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy // Official Journal of the European Communities. – L. 327 (1). – P. 1– 72.
Feng Y., Wang A., Fu W., Song D. F. Growth performance, antioxidant response, biodegradation and transcriptome analysis of Chlorella pyrenoidosa after nonylphenol exposure // Science of the Total Environment. – 2022. – Vol. 806, N 150507. DOI: 10.1016/j.scitotenv.2021.150507.
Gavrilescu M., Demnerová K., Aamand J., Agathos S., Fava F. Emerging pollutants in the environment: Present and future challenges in biomonitoring, ecological risks and bioremediation // New Biotechnology. – 2015. – Vol. 32. – P. 147– 156.
Guo H., Liang Z., Zheng P., Li L., Xian J., Zhu X. Effects of nonylphenol exposure on histological changes, apoptosis and timecourse transcriptome in gills of white shrimp Litopenaeus vannamei // Science of the Total Environment. – 2021. – Vol. 781, N 146731. DOI: 10.1016/j.scitotenv.2021.146731
Ikunaga Y., Miyakawa S., Hasegawa M., Kasahara Y., Kodama O., Ohta H. Degradation profiles of branched nonylphenol isomers by Sphingobium amiense and Sphingomonas cloacae // Soil Science and Plant Nutrition. – 2004. – Vol. 50, N 6. – P. 871– 875. DOI:10.1080/00380768.2004.10408548
Ismanto A., Hadibarata T., Kristanti R. A., Maslukah L., Safinatunnajah N., Kusumastuti W. Endocrine disrupting chemicals (EDCs) in environmental matrices: Occurrence, fate, health impact, physio-chemical and bioremediation technology // Environmental Pollution. – 2022. – Vol. 302, N 119061. DOI: 10.1016/j.envpol.2022.119061
Khalid M., Abdollahi M. Environmental Distribution of Personal Care Products and Their Effects on Human Health // Iranian Journal of Pharmaceutical Research. – 2021. – Vol. 20, N 1. – P. 216–253. DOI: 10.22037/ijpr.2021.114891.15088.
Krige N. R., Padgett P. J. Phenotypic and physiological characterization methods // Methods in Microbiology [Eds.: Rainey F., Oren A.]. – Academic Press, New York, 2011. – Vol. 38. – P. 15–60. DOI: 10.1016/B978-0-12-387730-7.00003-6
Kuzikova I., Andronov E., Zaytseva T., Metelkova L., Zhakovskaya Z., Medvedeva N. A microcosm approach for evaluating the microbial nonylphenol and butyltin biodegradation and bacterial community shifts in co-contaminated bottom sediments from the Gulf of Finland, the Baltic Sea // Environmental Science and Pollution Research. – 2022. – Vol. 46. – P. 69849-69860. DOI: 10.1007/s11356-022-20751-8
Kuzikova I., Rybalchenko O., Kurashov E., Krylova Y., Safronova V., Medvedeva N. Defense Responses of the Marine-Derived Fungus Аspergillus tubingensis to Alkylphenols Stress // Water, Air, & Soil Pollution. – 2020. – Vol. 231, N 6. – P. 271. DOI: 10.1007/s11270-020-04639-2.
Liu Y., Dai X., Wei J. Toxicity of the nonylphenol and its biodegradation by the alga Cyclotella caspia // Journal of Environmental Science. – 2013. – Vol. 25, N 8. – P. 1662–1671.
Shao Y., Zhao W., Wei J., Wang S., Wang Y., Zhang Y. Growth and reproduction effects and transgenerational effects of nonylphenol in Moina mongolica Daday (Crustacea: Cladocera) // Environmental Science and Pollution Research. – 2021. – Vol. 23. – P. 29221–29230. DOI:10.1007/s11356-021-12592-8
Sole M., Lopez de Alda M. J., Castillo M., Porte C., Ladegaard-Pedersen K., Barcelo D. Estrogenicity determination in sewage treatment plants and surface waters from Catalonian area (NE Spain) // Environmental Science & Technology. – 2000. – Vol. 34. – P. 5076–5083. DOI: 10.1021/es991335n
Suen J.-L., Hung C.-H., Yu H.-S., Huang S.-K. Alkylphenols—potential modulators of the allergic response // Kaohsiung Journal of Medical Sciences. – 2012. – Vol. 28, N 7. – P. 43–48.
Watanabe W., Hori Y., Nishimura S., Takagi A., Kikuchi M., Sawai J. Bacterial degradation and reduction in the estrogen activity of 4-nonylphenol // Biocontrol Science. – 2012. – Vol. 17, N 3. – P. 143– 147.
Weisburg W. G., Barns S. M., Pelletier D. A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study // Journal of Bacteriology. – 1991. – Vol. 173. – P. 697–703.
Zaytseva T. B., Medvedeva N. G. Molecular mechanisms of the response to 4-tert-octylphenol-induced stress in a cyanobacterium Planktothrix agardhii // Microbiology. – 2019. – Vol. 88, N 4. – P. 416–422. DOI: 10.1134/S0026261719040143.
58
Микробиологическая деградация гормоноподобных ксенобиотиков
![]()
Zaytseva T.B., Russu A.D., Medvedeva N.G. Microbiological degradation of endocrine disrupting
xenobiotics // Ekosistemy. 2022. Iss. 32. P. 52–59.
Pollution of environmental objects with endocrine disrupting xenobiotics, which negatively influence the endocrine system of animals and humans, is a significant environmental problem. Nonylphenol (NP) is one of the most common endocrine disruptors. The biotechnological methods using microorganisms, in particular bacteria, are the most environmentally friendly for the purification of natural ecosystems contaminated with this pollutant. The aim of this research was to isolate efficient nonylphenol-degrading bacterial strain from the NP-contaminated soil and to identify it. Moreover, the authors studied its NP-degrading capacity in water and soil. The strain 8 was identified by phenotypic features using standard methods and by Sanger sequencing of a fragment of the 16S rRNA gene sequence (rrs). The nonylphenol concentration was determined by high-performance liquid chromatography. A new bacterial strain Lelliottia jeotgalis 8 was isolated from sod-podzolic soil contaminated with nonylphenol. The high efficiency of the strain for NP degradation under aerobic conditions in the aquatic environment at various NP concentrations (50–300 mg/L) and in soil (100 mg/kg d.w.) was revealed. The present study demonstrates the ability of L. jeotgalis to degrade NP. The results of this study provide useful information for the application of L. jeotgalis 8 in the processes of bioremediation of ecosystems contaminated with endocrine disrupting xenobiotics.
Key words: endocrine disrupting xenobiotic nonylphenol; biodegradation; Lelliottia jeotgalis 8; identification.
Поступила в редакцию 15.11.22
Принята к печати 19.12.22
59

