Экосистемы, 30: 69–83 (2022) https://ekosystems.cfuv.ru
![]()
УДК 591.524.11(262.54.04)
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
Институт биологии южных морей имени А. О. Ковалевского РАН Севастополь, Россия
verakopiy@gmail.com; bondarenko.luda@gmail.com; tamplier74@mail.ru; podzorova@imbr-ras.ru; kovalmargarita@mail.ru
Учитывая огромное значение Керченского пролива для функционирования экосистем азово-черноморского бассейна, а также для осуществления хозяйственной деятельности человека, актуальным является своевременная оценка состояния его биоценозов. В прибрежной зоне Керченского пролива и акватории Таманского полуострова (глубина 0,5–1,5 м) в сентябре 2019 года обнаружены 32 вида Polychaeta, 28 видов Crustacea, 12 видов Mollusca, 1 вид Phoronidae и не идентифицированные до вида Ascidiidae, Chironomidae, Oligochaeta, Platyhelminthes, Nemertea, Actiniidae. Наибольшее количество видов зарегистрировано на побережье Аршинцевской косы (58 видов), наименьшее (13) – в акватории у станицы Голубицкая. Индекс Чекановского–Сёренсена варьировал от 0,17 до 0,32, что свидетельствует о низком фаунистическом сходстве видового состава гидробионтов, обитающих в разных районах. Средние значения численности и биомассы макрозообентоса составили 4933±3857 экз./м2 и 59,85±48,01 г/м2 соответственно.Трофическая структура макрозообентоса представлена поли-, фито-, детритофагами, плотоядными животными и гидробионтами, пищевой спектр которых не изучен. Самая многочисленная группа – полифаги, наименьшее количество видов относится к детритофагам.
Ключевые слова: макрозообентос, Керченский пролив, численность, биомасса, трофическая структура.
ВВЕДЕНИЕ
Керченский пролив соединяет Чёрное и Азовское моря. Берега Керченского и Таманского полуостровов ограничивают пролив с запада и с востока. Морские и прибрежные биотопы Керченского пролива – места обитания многих видов животных и растений. Видовой состав, структуру и распределение донных сообществ макрозообентоса Керченского пролива изучали с начала XX века (Воробьев, 1949; Несис, 1957; Иванов, 1987; Алёмов, 2008; Fashchuk, 2011; Головкина, 2012; Kolyuchkina et al., 2013; Бирюкова и др., 2016; Спиридонов
- др., 2016; Терентьев, Колесников, 2021). Пролив является важнейшей транспортной артерией и рыбопромысловым районом Азово-Черноморского бассейна, где осуществляются миграции многих азово-черноморских видов рыб (Брянцев, 2005; Фащук, Петренко, 2008; Сапожников и др., 2013). Большое внимание в литературе отведено исследованию антропогенного влияния на макрозообентос, включая аварии танкеров и сухогрузов во время шторма (Бирюкова и др., 2016; Спиридонов и др., 2016) и интенсивное судоходство (Фащук, Петренко, 2008). Как отдельный аспект антропогенного вмешательства рассматривается вселение в воды Керченского пролива новых видов гидробионтов и вызванные ими изменения в структуре донных сообществ (Zolotarev, 1996; Иванов, Синегуб, 2008; Ковалев и др., 2017;
Syomin et al., 2021).
Учитывая огромное значение Керченского пролива для функционирования экосистем азово-черноморского бассейна, а также для осуществления хозяйственной деятельности человека, актуальной является своевременная оценка состояния его биоценозов.
Цель нашего исследования – изучить видовой состав и выявить основные биоценотические параметры макрозообентоса мелководья Керченского пролива и прибрежной части Таманского полуострова в условиях комплексной антропогенной нагрузки.
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
![]()
ХАРАКТЕРИСТИКА РАЙОНА ИССЛЕДОВАНИЯ
Керченский пролив расположен в северо-восточной части азово-черноморского бассейна. Длина пролива около 43 км, ширина изменяется от 3,7 до 15 км, глубина со стороны Азовского моря не более 10,5 м, со стороны Чёрного – 18 м (Садогурский, 2006). Общая площадь Керченского пролива приблизительно равна 805 км2, объём вод – 4,56 км3. Его берега
- основном невысокие с песчаными косами, местами обрывистые и скалистые. Зимой вода у берегов замерзает, пролив покрыт плавучим льдом (Щербак и др., 2007; Багрий и др., 2008).
Солёность воды в проливе изменяется от 10 ‰ на севере до 18 ‰ на юге, в Таманском заливе – от 14,8 до 15,5 ‰. Преобладает перенос вод из Азовского моря в Чёрное (Садогурский, 2006; Головкина, Набоженко, 2012).
Керченский пролив оказывает мощное влияние на формирование гидрологического режима, качественный и количественный состав флоры и фауны Азовского и Чёрного морей (Садогурский, 2006).
Существенные изменения в Керченском проливе произошли после прорыва косы Тузла. Анализ влияния прорыва на гидрологический режим вод Керченского пролива позволил установить, что существенные изменения произошли только в южной части и в Таманском заливе. Режим северных районов при этом остался почти неизменным. До образования промоины южная часть пролива даже при азовских течениях оказывалась под постоянным влиянием относительно тёплых и солёных черноморских вод. Во все сезоны года, заходя в пролив вдоль его восточного кавказского побережья, они формировали у косы Тузла устойчивые циклонические круговороты. Водообмен с транзитными черноморскими водами, осуществляется через проливный разрез коса Чушка – коса Тузла (Надеждин, 1947; Беренбейм, 1995; Фащук, Петренко, 2008).
Состав донных отложений Керченского пролива разнообразен: песок, глинистый ил, алевриты, глинисто-песчаный ил с высоким содержанием детрита, ракушечник, мергель, галька, камни и скалы. В южной и юго-западной частях залива, а также в центральной части Таманского залива наблюдаются заиленные грунты с повышенным содержанием Сорг (Куринная и др., 2021). Обширные площади Керченского пролива заняты морскими травами и водорослями. Высокая концентрация взвешенного вещества объясняется разрушением берегов, ветровой эрозией, стоком впадающих в пролив рек (Мелек-Чесме, Булганак), придонными течениями и рыхлостью грунтов (Ломакин и др., 2008).
Побережье у Аршинцевской косы со стороны Камыш-Бурунской бухты представлено твёрдыми грунтами в северной части, в южной части расположены заиленные участки, местами с ракушей. В бухте произрастает зостера, в северной части бухты и у дамбы, делящей бухту в центральной части, встречаются заросли цистозиры (Милованов, 2015).
Коса Чушка является структурой Керченско-Таманской складчатой области. В пределах косы выделено два водоносных горизонта. Колебания уровня воды связано с соотношением уровней в Чёрном и Азовском морях, а также влиянием ветровых сгонов и нагонов воды. Средняя годовая температура воды составляет +12,7 ºС, максимальная +29,8 ºС. Зимой температура воды у дна держится в пределах +0,5–1 ºС (Заключение…, 2015).
-
- Керченском проливе расположены объекты особо охраняемых природных территорий
– гидрологический памятник природы «Прибрежный аквальный комплекс у мыса Хрони» и ландшафтно-рекреационный парк «Мыс Такиль» (Распоряжение Совета министров Республики Крым от 5 февраля 2015 года № 69-р).
МАТЕРИАЛ И МЕТОДЫ
- основу работы положены материалы бентосной съёмки рыхлых грунтов вдоль прибрежной зоны Керченского пролива и Таманского полуострова, собранные в сентябре
2019 года (рис. 1).
70
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова (Азово-Черноморский бассейн)
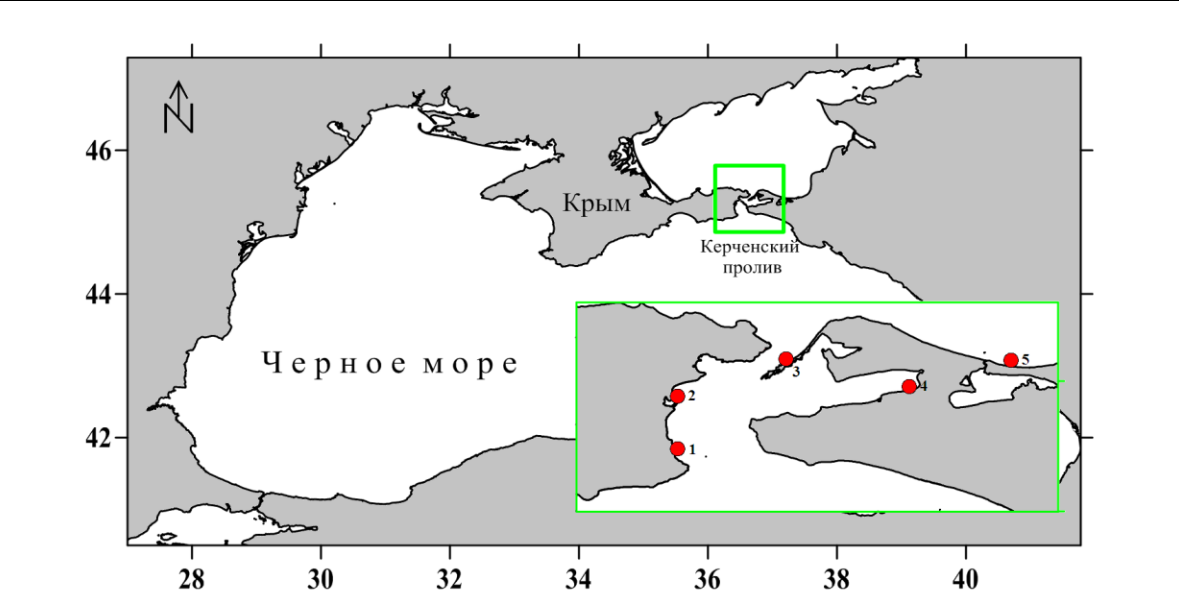
Рис. 1. Карта-схема отбора проб вдоль мелководья Керченского пролива и прибрежной зоны Таманского полуострова (сентябрь, 2019 г.)
1 – с. Набережное, 2 – Аршинцевская коса, 3 – коса Чушка, 4 – п. Сенной, 5 – ст. Голубицкая.
Сбор проб бентоса проводили в двух повторностях ручным дночерпателем, площадью захвата 0,04 м2. Глубина захвата грунта составляла 5–7 см. В каждом районе пробы отбирали на 2–4 станциях с глубин 0,5–1,5 м.
Побережье у села Набережное – отобраны 4 пробы на глубине 1 м. Грунт представлен плотным песком с примесью гравия и редкими зарослями зостеры. Акватория у села Набережное открытая и подвержена влиянию волнения моря. Температура воды 21 ºС, солёность – 17,8 ‰.
Побережье Аршинцевской косы – отобраны 6 проб на глубине 0,5 м. Грунт представлен плотным мелким песком с заиленной ракушей и редкими зарослями зостеры. Данная акватория отделена от Керченского пролива песчаной косой и характеризуется спокойным гидрологическим режимом. Температура воды 22 ºС, солёность – 17,7 ‰.
Побережье косы Чушка – отобраны 4 пробы на глубине 1 м. Грунт представлен плотным мелким песком. Побережье у косы Чушка песчаное с включениями гравия. Температура воды 19,5 ºС, солёность – 15,8 ‰.
Побережье у посёлка Сенной – отобраны 4 пробы на глубине 0,5 м. Грунт представлен плотным мелким песком, на поверхности которого слой зостеры. Температура воды 24 ºС, солёность – 16,7 ‰.
Побережье у станицы Голубицкая – отобраны 6 проб (2 пробы на глубине 0,5 м, 2 – на глубине 1 м, 2 – на глубине 1,5 м). Грунт представлен мелким, средним песком с примесью ракуши. На глубине 1,5 м песок более плотный, на его поверхности – слой зостеры. Доля мелкого песка больше, чем ракуши. Температура воды 23 ºС, солёность – 12,9 ‰.
При описании количественного развития макрозообентоса применены показатели численности (N, экз./м2) и биомассы (В, г/м2). Видовую идентификацию и выделение
трофических групп осуществляли с помощью литературных источников (Определитель…,1972; Киселева, 1981, 2004; Грезе, 1985; Grintsov, Sezgin, 2011).
Таксономическая принадлежность приводилась в соответствие с базами данных World Register of Marine Species (2022).
Индекс функционального обилия (ИФО) определяли по формуле:
ИФО N 0,25xB0,75 ,
71
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
![]()
где: N – численность вида; B – биомасса вида (Мальцев, 1990).
Для определения фаунистического сходства в сравниваемых списках использовался индекс Чекановского–Сёренсена:
i 2a / b c ,
где: a – число общих видов; b и c – число видов в сравниваемых списках.
Коэффициент Чекановского–Сёренсена может изменяться от 0 (отсутствие сходства) до 1 (полное сходство).
Оценку ожидаемого числа видов проводили с помощью алгоритма экстраполяции видового богатства Chao-2 (Петров, Неврова, 2012; Chao, Chiu, 2016a, 2016b).
Для определения солёности и температуры (S, ‰) использовали солемер «Senshe Sension-1».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Макрозообентос мелководья Керченского пролива и прибрежной части Таманского полуострова представлен организмами, относящимися к 10 крупным таксонам (табл. 1).
Таблица 1
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова
| 1 | 2 | 3 | 4 | 5 | 6 | ||||||||||||||
| Таксон | Набережное | Аршинцевская | Чушка | Сенной | Голубицкая | ||||||||||||||
| коса | |||||||||||||||||||
| Ascidiidae Herdman, 1882 | — | 13 | — | 25 | — | ||||||||||||||
| 16,67 | 0,131 | ||||||||||||||||||
| Insecta | |||||||||||||||||||
| Chironomidae | — | 29 | — | — | — | ||||||||||||||
| 0,006 | |||||||||||||||||||
| Crustacea | |||||||||||||||||||
| Amphipoda gen. spp. | — | — | — | — | 4 | ||||||||||||||
| 0,01 | |||||||||||||||||||
| Ampithoe ramondi | — | 4 | — | — | |||||||||||||||
| Audouin, 1826 | 0,001 | ||||||||||||||||||
| Apherusa bispinosa | — | 17 | — | 31 | — | ||||||||||||||
| (SpenceBate, 1857) | 0,004 | 0,008 | |||||||||||||||||
| Bathyporeia guilliamsoniana | — | — | 13 | — | — | ||||||||||||||
| (SpenceBate, 1857) | 0,008 | ||||||||||||||||||
| Caprella acanthifera | 1894 | 8 | 219 | — | |||||||||||||||
| Leach, 1814 | 0,238 | 0,001 | 0,029 | ||||||||||||||||
| Cumella (Cumella) limicola | 6 | 31 | 6 | — | |||||||||||||||
| Sars, 1879 | 0,0006 | 0,004 | 0,0003 | ||||||||||||||||
| Dexamine spinosa | 19 | 79 | 13 | 81 | — | ||||||||||||||
| (Montagu, 1813) | 0,012 | 0,068 | 0,003 | 0,029 | |||||||||||||||
| Echinogammarus sp. | — | 4 | — | — | — | ||||||||||||||
| 0,002 | |||||||||||||||||||
| Echinogammarus foxi | — | — | — | 6 | — | ||||||||||||||
| (Schellenberg, 1928) | 0,0006 | ||||||||||||||||||
| Ericthonius difformis | — | 21 | — | 325 | — | ||||||||||||||
| H. Milne Edwards, 1830 | 0,005 | 0,057 | |||||||||||||||||
| Eurydice pontica | — | — | 56 | — | — | ||||||||||||||
| (Czerniavsky, 1868) | 0,125 | ||||||||||||||||||
| Gammarus sp. | — | — | — | — | 8 | ||||||||||||||
| 0,013 | |||||||||||||||||||
| Gammarus insensibilis | 1144 | — | — | — | — | ||||||||||||||
| Stock, 1966 | 0,304 | ||||||||||||||||||
72
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова (Азово-Черноморский бассейн)
![]()
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | ||||||||||||||||
| Idotea balthica | — | — | — | 19 | — | ||||||||||||||||
| (Pallas, 1772) | 0,038 | ||||||||||||||||||||
| Iphinoe elisae | — | 17 | — | 6 | — | ||||||||||||||||
| Băcescu, 1950 | 0,005 | 0,0006 | |||||||||||||||||||
| Jaera (Jaera) nordmanni | — | 4 | — | — | — | ||||||||||||||||
| (Rathke, 1836) | 0,002 | ||||||||||||||||||||
| Lekanesphaera hookeri | — | — | 6 | — | 292 | ||||||||||||||||
| (Leach, 1814) | 0,116 | 3,742 | |||||||||||||||||||
| Microdeutopus gryllotalpa | — | 908 | 31 | 200 | — | ||||||||||||||||
| Costa, 1853 | 0,369 | 0,005 | 0,054 | ||||||||||||||||||
| Microdeutopus versiculatus | — | 8 | — | — | — | ||||||||||||||||
| (Spence Bate, 1857) | 0,006 | ||||||||||||||||||||
| Monocorophium acherusicum | — | 13 | — | — | — | ||||||||||||||||
| (Costa, 1853) | 0,003 | ||||||||||||||||||||
| Mysida gen. spp. | — | — | — | — | 4 | ||||||||||||||||
| 0,007 | |||||||||||||||||||||
| Palaemon adspersus | — | 8 | — | — | — | ||||||||||||||||
| Rathke, 1836 | 9,75 | ||||||||||||||||||||
| Pleonexes helleri | — | — | 6 | — | — | ||||||||||||||||
| (Karaman, 1975) | 0,008 | ||||||||||||||||||||
| Plumulojassa ocia | — | — | 13 | — | — | ||||||||||||||||
| (SpenceBate, 1862) | 0,001 | ||||||||||||||||||||
| Pontogammarus maeoticus | — | — | — | — | 1471 | ||||||||||||||||
| (Sovinskij, 1894) | 0,975 | ||||||||||||||||||||
| Rhithropanopeus harrisii | — | 8 | — | 6 | — | ||||||||||||||||
| (Gould, 1841) | 2,25 | 1,5 | |||||||||||||||||||
| Stenosoma capito | — | 4 | — | 13 | — | ||||||||||||||||
| (Rathke, 1836) | 0,004 | 0,004 | |||||||||||||||||||
| Stenothoe monoculoides | — | 13 | 13 | 113 | — | ||||||||||||||||
| (Montagu, 1813) | 0,0006 | 0,0006 | 0,009 | ||||||||||||||||||
| Всего | 3063 | 1116 | 181 | 1025 | 1779 | ||||||||||||||||
| 0,56 | 12,47 | 0,27 | 1,73 | 4,75 | |||||||||||||||||
| Mollusca | |||||||||||||||||||||
| Abra segmentum | 19 | 33 | — | 56 | — | ||||||||||||||||
| (Récluz, 1843) | 0,469 | 0,258 | 0,113 | ||||||||||||||||||
| Anadara kagoshimensis | — | — | 6 | — | |||||||||||||||||
| (Tokunaga, 1906) | 78,13 | ||||||||||||||||||||
| Arcuatula senhousia | — | 304 | — | 238 | — | ||||||||||||||||
| (Benson, 1842) | 51,67 | 36,25 | |||||||||||||||||||
| Bittium reticulatum | — | — | — | 25 | — | ||||||||||||||||
| (daCosta, 1778) | 0,25 | ||||||||||||||||||||
| Cerastoderma glaucum | 563 | 213 | — | 250 | 38 | ||||||||||||||||
| (Bruguière, 1789) | 0,294 | 22,92 | 21,25 | 1,75 | |||||||||||||||||
| Lentidium mediterraneum | — | 8 | — | 108 | |||||||||||||||||
| (O. G. Costa, 1830) | 0,033 | 1,083 | |||||||||||||||||||
| Loripes orbiculatus | — | — | — | 13 | — | ||||||||||||||||
| Poli, 1795 | 0,625 | ||||||||||||||||||||
| Mytilaster lineatus | — | 925 | — | 1156 | 17 | ||||||||||||||||
| (Gmelin, 1791) | 31,67 | 8,125 | 3,75 | ||||||||||||||||||
| Mytilus galloprovincialis | — | 17 | — | — | — | ||||||||||||||||
| Lamarck, 1819 | 2,5 | ||||||||||||||||||||
| Rissoa membranacea | — | — | — | 263 | — | ||||||||||||||||
| (J.Adams, 1800) | 3,75 | ||||||||||||||||||||
| Rissoa parva | — | — | — | 225 | — | ||||||||||||||||
| (daCosta, 1778) | 2,5 | ||||||||||||||||||||
| Tritia neritea | — | 338 | — | — | — | ||||||||||||||||
| (Linnaeus, 1758) | 0,21 | ||||||||||||||||||||
| Всего | 581 | 1838 | 6 | 2225 | 163 | ||||||||||||||||
| 0,76 | 109,25 | 78,13 | 72,86 | 6,58 | |||||||||||||||||
73
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
![]()
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | ||||||||||||||||
| Phoronida | |||||||||||||||||||||
| Phoronis psammophila | — | 21 | — | — | — | ||||||||||||||||
| Cori, 1889 | 0,121 | ||||||||||||||||||||
| Polychaeta | |||||||||||||||||||||
| Alitta succinea | — | 8 | — | — | — | ||||||||||||||||
| (Leuckart, 1847) | 0,242 | ||||||||||||||||||||
| Amphiglena mediterranea | — | 4 | — | — | — | ||||||||||||||||
| (Leydig, 1851) | 0,008 | ||||||||||||||||||||
| Capitella capitata | 50 | 471 | — | 31 | — | ||||||||||||||||
| (Fabricius, 1780) | 0,013 | 0,142 | 0,025 | ||||||||||||||||||
| Exogone naidina | — | 8 | — | — | — | ||||||||||||||||
| Örsted, 1845 | 0,0004 | ||||||||||||||||||||
| Fabricia stellaris | — | 850 | — | — | — | ||||||||||||||||
| (Müller, 1774) | 0,695 | ||||||||||||||||||||
| Ficopomatus enigmaticus | — | 696 | — | — | — | ||||||||||||||||
| (Fauvel, 1923) | 1,153 | ||||||||||||||||||||
| Genetyllis sp. | — | 4 | — | — | — | ||||||||||||||||
| 0,004 | |||||||||||||||||||||
| Genetyllis tuberculata | — | 21 | — | 6 | — | ||||||||||||||||
| (Bobretzky, 1868) | 0,033 | 0,006 | |||||||||||||||||||
| Harmothoe imbricata | — | 79 | — | 6 | — | ||||||||||||||||
| (Linnaeus, 1767) | 0,208 | 0,006 | |||||||||||||||||||
| Harmothoe reticulata | — | 33 | — | — | — | ||||||||||||||||
| (Claparède, 1870) | 0,027 | ||||||||||||||||||||
| Heteromastus filiformis | — | 8 | — | 13 | — | ||||||||||||||||
| (Claparède, 1864) | 0,017 | 0,006 | |||||||||||||||||||
| Leiochone leiopygos | — | 8 | — | 31 | — | ||||||||||||||||
| (Grube, 1860) | 0,017 | 0,1 | |||||||||||||||||||
| Megadrilus purpureus | — | — | — | — | 17 | ||||||||||||||||
| (Schneider, 1868) | 0,008 | ||||||||||||||||||||
| Microspio mecznikowiana | 9 | 54 | — | — | — | ||||||||||||||||
| (Claparède, 1869) | 0,0009 | 0,025 | |||||||||||||||||||
| Nereididae gen. spp. | — | 4 | — | — | 4 | ||||||||||||||||
| Blainville, 1818 | 0,002 | 0,15 | |||||||||||||||||||
| Nephtys hombergii | — | 371 | — | 6 | — | ||||||||||||||||
| Savigny in Lamarck, 1818 | 0,57 | 0,188 | |||||||||||||||||||
| Nereiphylla pusilla | — | 8 | — | — | — | ||||||||||||||||
| (Claparède, 1870) | 0,002 | ||||||||||||||||||||
| Nereis zonata | — | 100 | 6 | — | — | ||||||||||||||||
| Malmgren, 1867 | 0,279 | 0,006 | |||||||||||||||||||
| Oriopsis armandi | — | 125 | — | — | — | ||||||||||||||||
| (Claparède, 1864) | 0,013 | ||||||||||||||||||||
| Perinereis cultrifera | — | 38 | — | — | — | ||||||||||||||||
| (Grube, 1840) | 0,188 | ||||||||||||||||||||
| Phyllodoce maculata | 75 | — | — | — | — | ||||||||||||||||
| (Linnaeus, 1767) | 0,65 | ||||||||||||||||||||
| Phyllodoce mucosa | 50 | — | — | 13 | — | ||||||||||||||||
| Örsted, 1843 | 0,6 | 0,031 | |||||||||||||||||||
| Platynereis dumerilii | 9 | 217 | 6 | 113 | 317 | ||||||||||||||||
| (Audouin& Milne Edwards, 1833) | 0,005 | 0,262 | 0,003 | 0,856 | 0,067 | ||||||||||||||||
| Polydora cornuta | 13 | 2063 | — | — | — | ||||||||||||||||
| Bosc, 1802 | 0,007 | 0,433 | |||||||||||||||||||
| Prionospio cirrifera | — | 4 | — | — | — | ||||||||||||||||
| Wirén, 1883 | 0,0006 | ||||||||||||||||||||
| Protodorvillea kefersteini | — | 4 | — | 19 | 17 | ||||||||||||||||
| (McIntosh, 1869) | 0,004 | 0,013 | 0,008 | ||||||||||||||||||
| Salvatoria clavata | — | 2329 | — | — | — | ||||||||||||||||
| (Claparède, 1863) | 0,449 | ||||||||||||||||||||
| Scolelepis squamata | — | — | 6 | — | — | ||||||||||||||||
| (Müller, 1806) | 0,0006 | ||||||||||||||||||||
74
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова (Азово-Черноморский бассейн)
![]()
Таблица 1 (продолжение)
| 1 | 2 | 3 | 4 | 5 | 6 | |||||||||||||||||
| Scolelepis tridentata | 38 | — | 13 | — | — | |||||||||||||||||
| (Southern, 1914) | 0,0009 | 0,001 | ||||||||||||||||||||
| Sphaerosyllis bulbosa | — | 725 | — | 6 | — | |||||||||||||||||
| Southern, 1914 | 0,074 | 0,0006 | ||||||||||||||||||||
| Spio decorata | — | 113 | — | 13 | — | |||||||||||||||||
| Bobretzky, 1870 | 0,183 | 0,022 | ||||||||||||||||||||
| Streblospio gynobranchiata | — | 4 | — | — | — | |||||||||||||||||
| Rice&Levin, 1998 | 0,0004 | |||||||||||||||||||||
| Всего | 244 | 8350 | 31 | 256 | 354 | |||||||||||||||||
| 1,276 | 5,032 | 0,011 | 1,254 | 0,233 | ||||||||||||||||||
| Oligochaeta | — | 196 | — | 6 | — | |||||||||||||||||
| 0,016 | 0,0006 | |||||||||||||||||||||
| Nemertea | — | 183 | — | — | — | |||||||||||||||||
| 0,1 | ||||||||||||||||||||||
| Platyhelminthes | 13 | 171 | 6 | — | 1075 | |||||||||||||||||
| 0,005 | 0,1 | 0,003 | 0,217 | |||||||||||||||||||
| Actiniidae Rafinesque, 1815 | — | — | — | 88 | — | |||||||||||||||||
| 1,387 | ||||||||||||||||||||||
| ИТОГО | 3900 | 12104 | 225 | 3625 | 3371 | |||||||||||||||||
| 2,599 | 143,88 | 78,4 | 77,37 | 11,78 | ||||||||||||||||||
Примечание к таблице. Числитель – численность, экз./м2; знаменатель – биомасса, г/м2.
На исследуемом полигоне в пробах бентоса зарегистрированы 73 вида, включающих 32 вида Polychaeta, 28 видов Crustacea, 12 видов Mollusca, 1 вид Phoronidae и неидентифицированные до вида Ascidiidae, Chirоnomidae, Oligochaeta, Platyhelminthes, Nemertea и Actiniidae. Из них в центральной части Керченского пролива обнаружены 67 видов, тогда как в данной акватории в период с 2003 по 2005 годы найдены 48 видов макрозообентоса (Панов и др., 2013).
Наибольшее видовое разнообразие зарегистрировано у побережья Аршинцевской косы (58 видов), наименьшее (13) – в акватории, расположенной недалеко от станицы Голубицкая. Выявлено, что полихета P. dumerilii обнаружена в акватории всех исследуемых районов, тогда как 39 видов встречены только в одном из районов (табл. 1).
Индекс Чекановского–Сёренсена варьировал от 0,17 до 0,32, что свидетельствует о низком фаунистическом сходстве видового состава гидробионтов, обитающих в разных акваториях (табл. 2).
Таблица 2
Фаунистическое сходство макрозообентоса отдельных пунктов мелководья Керченского
пролива и прибрежной части Таманского полуострова, оцененное с использованием индекса
Чекановского–Сёренсена
| Районы | Набережное | Аршинцевская | Чушка | Сенной | Голубицкая | |
| коса | ||||||
| Набережное | 0 | |||||
| Аршинцевская коса | 0,30 | 0 | ||||
| Чушка | 0,32 | 0,14 | 0 | |||
| Сенной | 0,32 | 0,24 | 0,20 | 0 | ||
| Голубицкая | 0,27 | 0,19 | 0,28 | 0,17 | 0 | |
Полноту полученных нами данных характеризует кривая накопленного числа видов (рис. 2).
75
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
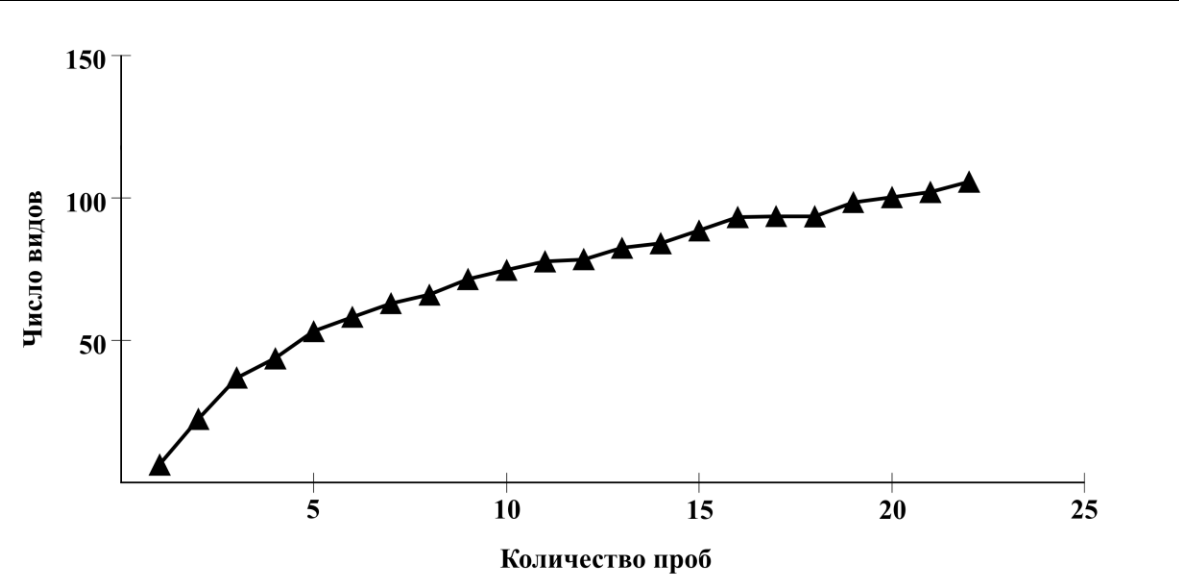
Рис. 2. Кумулятивная кривая ожидаемого числа видов макрозообентоса в прибрежной зоне Керченского пролива и Таманского полуострова
При расчете индекса Chao-2 выявлено, что кривая постепенно возрастает, но не выходит на плато, поэтому мы можем говорить о том, что количество проб, отобранных на участках, недостаточно для того, чтобы охватить всё видовое богатство данной акватории.
Средние значения численности и биомассы макрозообентоса составили 4933±3857 экз./м2 (средняя ± доверительный интервал) и 59,85±48,01 г/м2 соответственно.
-
- центральной части Керченского пролива средняя численность гидробионтов с 2003 по 2005 годы возросла от 802 до 1138 экз./м2 (Панов и др., 2013), в 2019 году она составила 6288 экз./м2. Биомасса в 2003–2005 годах изменилась от 179,1 до 230,8 г/м2. Доля двустворчатых моллюсков в суммарной биомассе зообентоса составила от 80 до 92 % (Панов
- др., 2013). В 2019 году этот показатель снизился до 84,79 г/м2. По-видимому, это связано с тем, что в общей биомассе макрозообентоса 43 % приходится на долю молоди митилид с низкой биомассой.
- бентосных пробах 2019 года Polychaeta представлены шестью отрядами (Capitellida, Eunicida, Phyllodocida, Protodrilida, Sabellida и Spionida), 14 семействами и 27 родами.
Наибольшее количество видов (15) относится к отряду Phyllodocida. Значения численности и биомассы полихет в пробах варьировали соответственно от 25 до 25300 экз./м2 и от 0,003 до 16,11 г/м2. Существенный вклад в формирование численности внесла полихета S. clavata (26 % общей численности), 16 % биомассы приходится на F. enigmaticus.
Максимальные количественные показатели отмечены в акватории Аршинцевской косы,
где наибольший вклад в численность полихет вносит S. clavata (28 %), в биомассу – F. enigmaticus (23 %).
Malacostraca представлены шестью отрядами (Amphipoda, Isopoda, Cumacea, Mysida, Tanaidacea и Decapoda), 19 семействами и 24 родами. Наибольшее количество видов (17) относится к разноногим ракам. Значения численности и биомассы ракообразных в пробах варьировали соответственно от 25 до 12225 экз./м2 и от 0,003 до 61,12 г/м2. Существенный вклад в формирование численности внёс P. maeoticus (26 % общей численности), 52 % биомассы приходится на P. adspersus.
Максимальные количественные показатели отмечены в акватории Аршинцевской косы, где наибольший вклад в численность ракообразных вносят амфипода M. gryllotalpa (81 %), в биомассу – декапода P. adspersus(78 %).
Моллюски представлены девятью отрядами (Arcida, Caenogastropoda, Cardiida, Myida, Mytilida, Littorinimorpha, Lucinida, Neogastropoda и Nudibranchia). К отряду Mytilida относятся
76
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова (Азово-Черноморский бассейн)
![]()
три вида, к остальным – по одному виду. Средние значения численности моллюсков составили 789±708 экз./м2, биомассы – 48,81±40,81 г/м2. Существенный вклад в формирование численности внёс M. lineatus (42 % общей численности), 33 % биомассы приходится на двустворчатого моллюска A. senhousia.
Максимальные количественные показатели отмечены в акватории Аршинцевской косы, где наибольший вклад в численность моллюсков вносят M. lineatus (50 % общей численности), в биомассу – A. senhousia (47 %).
Вклад остальных групп (Actiniidae, Platyhelminthes, Nemertea, Oligochaeta, Ph. psammophila, Chirоnomidae, Ascidiidae) составил 9 % общей численности и 8 % биомассы бентоса.
Исходя из вышеизложенного следует отметить, что в акватории Аршинцевской косы зарегистрированы наибольшее количество видов (58) и высокие показатели численности и биомассы, которые варьировали от 300 до 38225 экз/м2 и от 0,22 до 465,53 г/м2 соответственно. Численность макрозообентоса сформирована полихетами (70 %), биомасса – моллюсками (76 %). В 2013 году в акватории косы Тузла, расположенной недалеко от Аршинцевской косы, обнаружено 30 видов макрозообентоса (Терентьев, Сёмик, 2019). Плотность поселения и биомасса изменялись от 7472 до 169425 экз/м2 и от 7 до 182 г/м2 соответственно. В 2013 году наибольшим разнообразием отличались ракообразные (37 % видового богатства), тогда как в 2019 году их сменили полихеты, для 66 % которых характерно обитание на илистых грунтах. Возможно, это обусловлено процессом заиления отдельных участков дна (Панов, 2013; Фащук и др., 2013).
А. С. Терентьев (2014) связывает заиление акватории Керченского предпроливья Чёрного моря с последствиями донных траловых промыслов и завалов, приводящих к разрушению донных биоценозов. В частности, произошла смена биоценозов двустворчатых моллюсков M. galloprovincialis и Modiolula phaseolina (Philippi, 1844) на биоценоз полихеты Terebellides stroemii Sars, 1835.
- помощью индекса функционального обилия определили лидеров исследованного полигона: двустворчатые моллюски A. senhousia, M. lineatus и C. glaucum.
- акватории побережья у села Набережное доминировали амфиподы G. insensibilis, C. acanthifera и полихета Ph. maculata; у Аршинцевской косы – двустворчатые моллюски
A. senhousia, M. lineatus и C. glaucum; у косы Чушка – двустворчатый моллюск A. kagoshimensis, изоподы E. pontica и L. hookeri; в акватории побережья у посёлка Сенной – двустворчатые моллюски A. senhousia, C. glaucum и M. lineatus; в акватории побережья у станицы Голубицкая – изопода L. hookeri, амфипода P. maeoticus и двустворчатый моллюск
- lineatus.
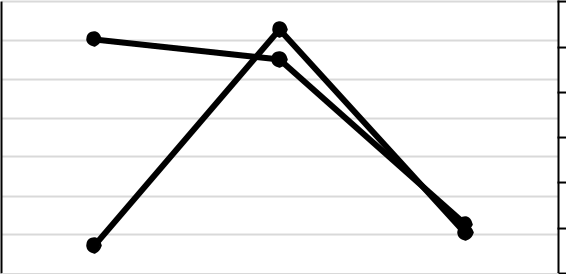
- связи с отсутствием литературных данных по состоянию макрозообентоса Таманского залива на глубинах до 1,5 м в данной работе представлены результаты по исследованию южной части залива и проведён сравнительный анализ таксономического состава и количественного развития макрозообентоса в 1955, 2008 (глубины 4–5 м) (Несис, 1957;
Kolyuchkina et al., 2013) и 2019 годах (рис. 3).
По количеству видов оказались близки годы 1955 и 2019 (по 12 видов), в 2008 году – 18 видов. Наиболее высокие показатели биомассы отмечены в 2008 году, они сформированы двустворчатым моллюском C. glaucum, образующим в данной акватории сообщество с субдоминантом брюхоногим моллюском B. reticulatum (Kolyuchkina et al., 2013). По нашим данным C. glaucum доминирует вместе с другими Bivalvia. Важно отметить, что одним из них, как было показано выше, является новый для данного региона вид A. senhousia.
Впервые в Чёрном море A. senhousia обнаружен в 2002 году на западном участке шельфа у берегов Румынии (Micu, 2004a, 2004b). Известно, что данный вид включён в Чёрный список морских инвазивных видов (Otero et al., 2013). A. senhousia может формировать плотные поселения численностью до 170000 экз./м2 (Munari, 2008). В акватории Керченского пролива 2 экземпляра аркуатулы обнаружены на глубине 2 м в 2015 году (Ковалёв и др., 2017). В бентосных пробах 2019 года данный вид зарегистрирован нами на рыхлых субстратах в акватории Аршинцевской косы с плотностью поселения 304 экз./м2, в акватории побережья
77
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
![]()
посёлка Сенной – 119 экз./м2. Максимальный размер этого моллюска в пробах составил 22 мм. A. senhousia встречается в диапазоне солёности от 18 до 36 ‰ при температуре от 1 до 31 ºС, толерантен к пониженной концентрации кислорода (до 1–3 мг/л) (Slack-Smith, Brearley, 1987; McDonald, Wells, 2009; Симакова и др., 2021), что сопоставимо с нашими данными по температуре и солёности.
Следует отметить, что в бентосных пробах исследованной акватории Керченского пролива нами обнаружены ещё 4 вида-вселенца: полихеты F. enigmaticus, P. cornuta, S. gynobranchiata и десятиногий рак R. harrisii. Эти гидробионты способны обитать также в широком диапазоне солёности и температуры (Radashevsky, Selifonova, 2013; Залота, 2017; Копий и др., 2022).
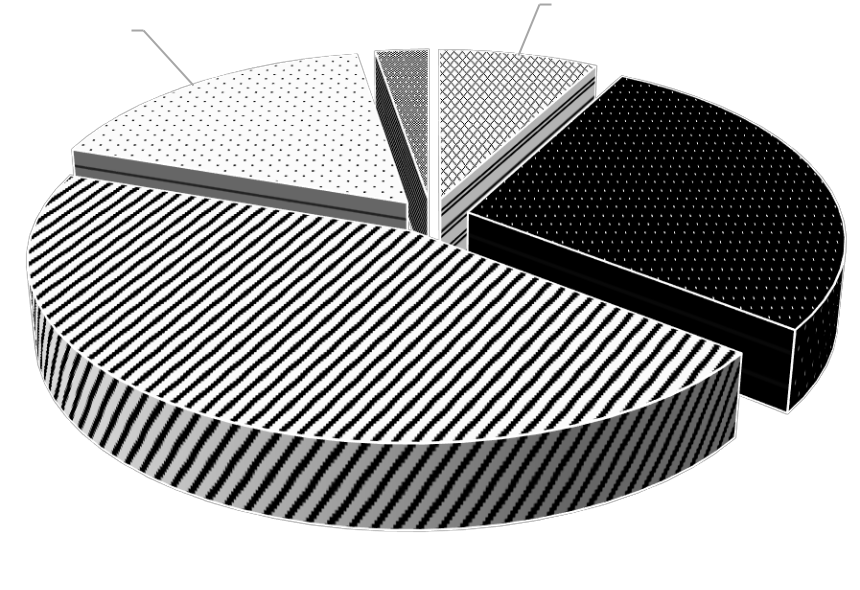
Трофическая структура макрозообентоса представлена поли-, фито-, детритофагами, плотоядными животными и гидробионтами, пищевой спектр которых не изучен (рис. 4).
| Численность, экз/м2 |
14000
12000
10000
8000
6000
4000
2000
0
1955 2008 2019
Годы
![]() Численность
Численность ![]() Биомасса
Биомасса
| 300 | ||
| 250 | 2 | |
| 200 | г/м | |
| , | ||
| 50 | ||
| Биомасса | ||
| 150 | ||
| 100 | ||
| 0 |
Рис. 3. Сравнительный анализ количественных показателей макрозообентоса акватории Таманского залива в разные временные периоды: 1955 год по (Несис, 1957), 2008 год по (Kolyuchkina et al., 2013), 2019 год – наши данные
| не | детритофаги | |
| плотоядные | исследовано | 8 % |
| 17 % | 3 % |
фитофаги
27 %
полифаги 
45 %
Рис. 4. Трофическая структура видов макрозообентоса мелководья Керченского пролива и прибрежной части Таманского полуострова
78
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова (Азово-Черноморский бассейн)
![]()
Самая многочисленная группа – полифаги, к которой принадлежат 34 вида (17 видов полихет, 5 ракообразных, 9 моллюсков, а также Ascidiidae, Chironomidae и Oligochaeta), на их долю приходится 45 % общего количества зарегистрированных видов. Наименьшее количество видов относится к детритофагам: 1 вид полихет и 5 видов ракообразных.
-
- центральной части Керченского пролива в трофической структуре макрозообентоса ведущая роль принадлежала также полифагам (44 % общего количества видов). Доля этих организмов по численности составила 65 %, по биомассе – 98 %. Из них 24 % численности и 83 % биомассы сформированы сестонофагами. Их доля в суммарной биомассе зообентоса в 2003 и 2005 годах была высокой – от 80 до 92 %, в численности – до 50 %, что авторы (Панов и др., 2013) связывают с изменениями количества взвеси в водах центральной части Керченского пролива.
Наименьшие показатели макрозообентоса отмечены для детритофагов (8 % видового состава, 0,28 % численности и 0,01 % биомассы). Тогда как в 2003–2005 годах они составляли 54–57 % видового богатства, от 40 до 65 % суммарной численности зообентоса и 16 % суммарной биомассы (Панов и др., 2013).
Все трофические группы зарегистрированы на четырёх исследованных участках, в акватории побережья у станицы Голубицкая не обнаружены детритофаги. Доля полифагов варьировала от 36 до 64 % общего количества видов, наибольшее их количество отмечено у побережья станицы Голубицкая. Фитофаги преобладали в акватории косы Чушка (50 % общего количества видов), плотоядные – у побережья села Набережное (21 %).
Ранжированный ряд по численности возглавляют плотоядные животные (рис. 5), формирует этот показатель гастропода T. neritea (92,3 %). Далее следуют полифаги, лидируют
- этой группе двустворчатые моллюски M. galloprovincialis и M. lineatus, на долю которых приходится 41,9 и 29,6 % общей численности полифагов. Фитофаги занимают третье место.
Основная роль в формировании численности фитофагов принадлежит гастроподе R. membranacea (69,3 % общей численности фитофагов). Детритофаги и гидробионты, пищевой спектр которых не изучен, вносят незначительную долю в общую численность макрозообентоса – всего 1,34 %.

| детритофаги | не | ||
| 0,28 % | исследовано | ||
| полифаги | 1,06 % | ||
| 32,68 % | |||
| плотоядные | |||
| 39,70 % | |||
фитофаги
26,27 %
Рис. 5. Трофическая структура макрозообентоса мелководья Керченского пролива и прибрежной зоны Таманского полуострова (по численности)
79
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
![]()
Ранжированный ряд по биомассе возглавляют полифаги. Значительный вклад в этот показатель вносят митиллиды A. senhousia и M. lineatus, на долю которых приходится 29,2 и 29,6 % общей численности полифагов. Затем следуют фитофаги, лидерство среди них принадлежит изоподе L. hookeri и гастроподе R. membranacea (34,3 и 29,4 % общей биомассы детритофагов соответственно). На долю плотоядных, детритофагов и гидробионтов, пищевой спектр которых не изучен, приходится 4,36 % общей биомассы макрозообентоса.
ЗАКЛЮЧЕНИЕ
- рыхлых грунтах мелководья Керченского пролива и прибрежной зоны Таманского полуострова (глубина 0,5–1,5 м) в сентябре 2019 года обнаружены 32 вида Polychaeta, 28 видов Crustacea, 12 видов Mollusca, 1 вид Phoronidae и не идентифицированные до вида
Ascidiidae, Chirоnomidae, Oligochaeta, Platyhelminthes, Nemertea и Actiniidae. Наибольшее количество видов зарегистрировано на побережье Аршинцевской косы (58 видов), наименьшее (13) – в акватории побережья у станицы Голубицкая. Индекс Чекановского– Сёренсена варьировал от 0,17 до 0,32, что свидетельствует о низком фаунистическом сходстве видового состава гидробионтов, обитающих в разных районах исследованной акватории.
Средние значения численности и биомассы макрозообентоса составили 4933 ±3857 экз./м2 и 59,85±48,01 г/м2, соответственно.
Трофическая структура макрозообентоса представлена поли-, фито-, детритофагами, плотоядными животными и гидробионтами, пищевой спектр которых не изучен. Самая многочисленная группа – полифаги, наименьшее количество видов относится к детритофагам.
При расчете индекса Chao-2 выявлено, что количество проб, отобранных на участках, недостаточно для того, чтобы охватить всё видовое богатство исследованной акватории. В связи с этим, работы в данном направлении необходимо продолжить.
Благодарности. Авторы выражают благодарность к. б. н. М. В. Макарову за помощь в определении гастропод и С. Е. Литвинюку за помощь в сборе материала.
Статья подготовлена в рамках Государственного задания ФГБУН ФИЦ «Институт биологии южных морей имени А. О. Ковалевского РАН» «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана», № 121030100028-0
Список литературы
Алёмов С. В. Исследование макрозообентоса Керченского пролива в связи с аварийным разливом нефтепродуктов // Современные проблемы гидробиологии. Перспективы, пути и методы решений – 2: Матер. междунар. науч. конф. (Херсон, 26–29 августа 2008 г.). – Херсон, 2008. – С. 39–44.
Багрий И. Д., Почтаренко В. И., Аксьом С. Д., Шехунова С. Б., Знаменская Т. А., Маслун Н. В.,
Дубосарский В. Р., Кравчинский Р. Л., Янцевич А. А. Особенности лито-динамических процессов и вещественного состава донных отложений в прибрежной части о. коса Тузла // Геолог Украины. – 2008. – Вып. № 1–2. – С. 99–110.
Беренбейм Д. Я. Тузлинская промоина и проблема рыболовства в Керченском проливе // Известия Всесоюзного географического общества. – 1995. – Т. 87, вып. 2. – С. 175–179.
Бирюкова С. В., Сёмин В. Л., Громов В. В. Состояние донных сообществ Таманского залива после постройки дамбы Тузла в Керченском проливе // Наука юга России (Вестник Южного Научного центра). Биология. – 2016. – Т. 12, № 2. – С. 53–67.
Брянцев В. А. Возможные экологические последствия сооружения Тузлинской дамбы (Керченский пролив) // Морской экологический журнал. – 2005. – Т. 4, № 1. – С. 47–50.
Воробьев В. П. Бентос Азовского моря // Труды Азово-Черноморского научно-исследовательского института морского рыбного хозяйства и океанографии. – 1949. – Вып. 13. – 195 с.
Головкина Е. М., Набоженко М. В. Современное состояние донных сообществ Керченского пролива (российский сектор) и заливов Таманского полуострова // Вестник южного научного центра РАН. – 2012. – Т. 8, № 2. – С. 53–61.
Грезе И. И. Высшие ракообразные. Бокоплавы. Фауна Украины. – Т. 26, вып. 5. – Киев: Наукова думка, 1985. – 163 с.
80
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова (Азово-Черноморский бассейн)
![]()
Заключение экспертной комиссии государственной экологической экспертизы проектной документации «Реконструкция пирса автопассажирской паромной переправы и его корневой части в морском порту Кавказ». – Москва: Министерство природных ресурсов и экологии Российской Федерации, 2015. – 29 с.
Залота А. К. Чужеродные виды десятиногих ракообразных (Crustacea Decapoda) в морях России и сопредельных водах: автореф. дис. …канд. биол. Наук. – Москва: ФГБУ ИОРАН, 2017. – 24 с.
Иванов А. И. Распределение и запасы мидий в Керченском проливе // Океанология. – 1987. – Т. 27, вып. 5. – С. 850–854.
Иванов Д. А., Синегуб И. А. Трансформация биоценозов Керченского пролива после вселения хищного моллюска Rapana thomasiana и двустворчатых Mya arenaria и Сunear cacornea // Cовременные проблемы экологии азово-черноморского региона: Матер. III Междунар. конф. (Керчь, 10–11 октября 2007 г.). – Керчь: Южный научно-исследовательский институт морского рыбного хозяйства и океанографии, 2008. – C. 45–51.
Киселева М. И. Бентос рыхлых грунтов Чёрного моря. – Киев: Наукова думка, 1981. – 163 с.
Киселева М. И. Многощетинковые черви (Polychaeta) Чёрного и Азовского морей. – Апатиты: Изд-во Кольского научного центра РАН, 2004. – 409 с.
Ковалёв Е. А., Живоглядова Л. А, Ревков Н. К, Фроленко Л. Н., Афанасьев Д. Ф. Первая находка двустворчатого моллюска Arcuatula senhousia (Benson, 1842) в российской части азово-черноморского бассейна // Российский журнал биологических инвазий. – 2017. – № 3. – С. 24–29.
Копий В. Г., Зайцева О. В., Петров С. А. Особенности биологии полихеты Ficopomatus enigmaticus (Fauvel, 1923) из массовых поселений в прибрежной акватории Керченского пролива (Чёрное море) // Российский журнал биологических инвазий. – 2022. – Т. 15, № 1. – С. 76–90. https://doi.org/10.35885/1996-1499-15-1-76-90)
Куринная Ю. С., Орехова Н.А., Гуров К. И., Забегаев И. А. Физико-химические характеристики донных отложений в районе Керченского пролива. Моря России: тезисы докладов Всероссийской научной конференции (Севастополь, 20–24 сентября 2021 г.) – Севастополь: ФГБУН ФИЦ МГИ, 2021. – С. 423–424.
Ломакин П. Д., Спиридонова Е. О., Чепыженко А. И., Чепыженко А. А. Антропогенные и природные источники взвешенного вещества в водах Керченского пролива // Морской экологический журнал. – 2008. – Т. 7, № 4. – С. 51–59.
Мальцев В. И. О возможности применения показателя функционального обилия для структурных исследований зооценозов // Гидробиологический журнал. – 1990. – Т. 26, № 1. – С. 87–89.
Милованов А. И. Особенности пространственного распределения бычков (Gobiidae, Perciformes) в Керченском проливе // Труды Южного научно-исследовательского института морского рыбного хозяйства и океанографии. – 2015. – Т. 53. – С. 75–79.
Надеждин В. М. Влияние Тузлинской промоины на гидрологический режим Керченского пролива. – Керчь: Азово-Черноморский научно-исследовательский институт морского рыбного хозяйства и океанографии, 1947. – С. 3–7.
Несис К. Н. Донные биоценозы Керченского пролива // Сборник работ студенческого научного общества Московского технического института рыбной промышленности и хозяйства, секция ихтиологии. – 1957. – Вып.
- – С. 3–11.
Определитель фауны Чёрного и Азовского морей / [Под ред. Ф. Д. Мордухай-Болтовского]. – Киев: Наукова думка, 1972. – Т. 1. – 437 с.; Т. 2. – 536 с.; Т. 3. – 340 с.
Панов Б. Н., Спиридонова Е. О., Литвиненко Н. М. Влияние взвешенного вещества морских вод на формирование зообентоса центральной части Керченского пролива // Системы контроля окружающей среды (сб. научн. тр. МГИ НАНУ). – Севастополь, 2013. – Вып. 19.– С. 214–220.
Петров А. Н., Неврова Е. Л. Прогностическая оценка видового богатства бентосных диатомовых водорослей // Альгология. – 2012. – Т. 22, № 4. – С. 360–382.
Распоряжение Совета министров Республики Крым от 5 февраля 2015 года № 69-р «Об утверждении Перечня
особо охраняемых природных территорий регионального значения Республики Крым».https://ru.wikipedia.org/wiki/Керчь-Еникальский_канал
Садогурский С. Е. Макрофитобентос водоёмов острова Тузла и прилегающих морских акваторий (Керченский пролив, Украина) // Альгология. – 2006. – Т. 16, № 3. – С. 337–354.
Сапожников В. В., Аржанова Н. В., Лапина Н. М., Агатова А. И., Торгунова Н. И., Зозуля Н. М., Бондаренко Л. Г., Вишневский С. Л., Радченко С. В., Рой В. И, Столярский С. И., Полонский В. Е. Комплексные экологические исследования Керченского пролива и Таманского залива после катастрофы танкера с мазутом (2007–2010 гг.) // Труды Всероссийского научно-исследовательского института рыбного хозяйства и океанографии. Среда обитания водных биологических ресурсов. – 2013. – Т. 150. – С. 65–77.
Симакова У. В., Ковалева М. А., Семин В. Л., Тимофеев В. А., Копий В. Г., Колючкина Г. А. Инвазивный двустворчатый моллюск Arcuatula senhousia в Керченском проливе: новый этап инвазии // Морские исследования
- образование (MARESEDU-2021): труды X Междунар. науч.-практ. конф. (Москва 25–29 октября 2021 г.) – Москва, 2021. – Т. 2 (III). – С. 218–223.
Спиридонов В. А., Колючкина Г. А., Беляев Н. А., Басин А. Б., Козловский В. В. Современное состояние макрозообентоса ультрамелководной зоны Таманского залива Азовского моря // Океанология. Морская биология. – 2016. – Т. 56, № 2. – С. 266–277.
Терентьев А. С., Сёмик А. М. Макрозообентос косы Тузла (Керченский пролив) в летний период 2013 года // Экосистемы. – 2019. – 20 (50). – С. 82–91.
81
Копий В. Г., Бондаренко Л. В., Тимофеев В. А., Подзорова Д. В., Ковалёва М. А.
![]()
Терентьев А. С., Колесников М. В. Донные сообщества Керченского пролива Чёрного моря // Труды государственного океанографического института. – 2021. – Т. 222. – С. 251–270.
Терентьев А. С. Реакция массовых видов зообентоса на заиление Керченского предпроливья Чёрного моря // Экосистемы, их оптимизация и охрана. – 2014. – № 11. – С. 235–246.
Фащук Д. Я., Петренко О. А. Керченский пролив – важнейшая транспортная артерия и рыбопромысловый район Азово-Черноморского бассейна // Юг России: экология, развитие. – 2008. – № 1. – С. 16–24.
Фащук Д. Я., Ковальчук С. К., Терентьев А. С., Дубинец Г. А., Крискевич Л. В. Изменения прибрежной зоны Чёрного моря в Керченском проливе и ее экологические последствия // Известия Российской академии наук. Серия географическая. – 2013. – № 5. – С. 125–138.
Щербак С. С., Лаврова О. Ю., Митягина М. И. Возможности спутникового дистанционного зондирования для изучения влияния атмосферных процессов на формирование течений в Керченском проливе // Современные проблемы дистанционного зондирования Земли из космоса. – 2007. – Т. 1, вып. 4. – С. 376–383.
Chao A., Chiu C. H. (2016a). Nonparametric Estimation and Comparison of Species Richness http://chao.stat.nthu.edu.tw/wordpress/paper/114.pdf
Chao, A. Chiu, C. H. (2016b). Species richness: estimation and comparison. Wiley StatsRef: Statistics Reference Online. – P. 1–26. http://chao.stat.nthu.edu.tw/wordpress/paper/119.pdf
Fashchuk D. Ya. Marine Ecological Geography. Theory and Experience.– Environmental Science and Engineering. – Berlin, Heidelberg: Springer – Verlag, 2011. – 433 p.
Grintsov V., Sezgin M. Manual for identification of Amphipoda from the Black Sea. – Sevastopol: Digit Print, 2011. – 151 p.
Kolyuchkina G. A., Spiridonov V. A., Basin A. B., Kozlovskii V. V., Simakova U. V. Long-Term Changes of Taman Bay Macrozoobenthic Communities // 4th Black Sea Scientific Conference Black Sea – Challenges Towards Good Environmental Status (Constanța, Romania, 28–31 October 2013). – Constanța, 2013. – С. 82–84.
McDonald J. I., Wells F. E. Results of a 2007 survey of the Swan River region for four introduced marine species. – Fisheries Research Report No 189. – Western Australia, North Beach: Department of Fisheries, Western Australia, 2009. – 24 p.
Micu D. Annotated checklist of the marine Mollusca from the Romanian Black Sea // In: International workshop on Black Sea Benthos / [Eds. Bayram Öztürk, Vadim O. Mokievsky, Bülent Topaloğlu]. – Topaloglu (Istanbul, Turkey, 19-23 April 2004). – Istanbul, Turkey, 2004a. – P. 84–149.
Micu D. First record of Musculista senhousia (Brenson in Cantor, 1842) from the Black Sea. – In: Abstracts of the International Symposium of Malacology (Romania, Sibiu, 2004). – Sibiu, 2004b. – P. 47.
Munari C. Effects of the exotic invader Musculista senhousia on benthi communities of two Mediterranean lagoons // Hydrobiologia. – 2008. – Vol. 611, N 1. – P 29–43.
Otero M., Cebrian E., Francour P., Galil B., Savini D. Monitoring Marine Invasive Species in Mediterranean Marine Protected Areas (MPAs): A strategy and practical guide for managers. – Malaga, Spain: IUCN, 2013. – 136 p.
Radashevsky V. I., Selifonova Zh. P. Records of Polydora cornuta and Streblospio gynobranchiata (Annelida, Spionidae) from the Black Sea // Mediterranean Marine Science. – 2013. – N 14 (2). – P. 261–269.DOI: 10.12681/mms.415.
Slack-Smith S. M., Brearley A. Musculista senhousia (Benson, 1842); a mussel recently introduced into the Swan River estuary, Western Australia (Mollusca: Mytilidae) // Records of the Western Australian Museum. – 1987. – Vol. 13, N 2. – P. 225–230.
Syomin V. L., Kolyuchkina G. A., Ptushkin M. D., Timofeev V. A., Simakova U. V. Polydora websteri – а сommensal of Anadara kagoshimensis in the Azov-Black Sea Region // Russian Journal of Biological Invasions. – 2021.
– Vol. 12, iss. 3. – P. 309–316.https://doi.org/10.1134/S2075111721030139
WoRMS Editorial Board (2022): World Register of Marine Species. Available from https://www.marinespecies.org at VLIZ. Accessed 2022-06-07.DOI:10.14284/170
Zolotarev V. The Black Sea ecosystem changes related to the introduction of new mollusc species // Marine ecology. – 1996. – Vol. 17, iss. 1–3. – P. 227 – 236.
82
Макрозообентос мелководья Керченского пролива и прибрежной зоны
Таманского полуострова (Азово-Черноморский бассейн)
![]()
Kopiy V. G., Bondarenko L. V., Timofeev V. A., Podzorova D. V., Kovalevа M. A. Macrozoobenthos of the shallow waters of the Kerch Strait and coastal waters of the Taman Peninsula (Azov-Black Sea basin) // Ekosistemy. 2022. Iss. 30. P. 69–83.
Considering the great importance of the Kerch Strait for the functioning of the ecosystems of the Azov-Black Sea basin, as well as for the implementation of human economic activity, it is relevant to assess the state of its biocenoses. In September 2019 32 species of polychaetes, 27 species of crustaceans, 12 species of Mollusca, 1 species of Phoronidae and not identified to the species Ascidiidae, Chironomidae, Oligochaeta, Platyhelminthes, Nemertea, Actiniidae were found in the coastal zone of the Kerch Strait and the aquatory of the Taman Peninsula (depth 0.5–1.5 m). The largest number of species was recorded on the coast of the Arshintsevskaya Spit (58 species), the smallest (13) – in the water area of the coast near the village of Golubitskaya. The Czekanowski–Sorensen index varied from 0.17 to 0.32, which indicates a low faunal similarity of hydrobionts living in different areas. The average values of abundance and biomass of macrozoobenthos were 4933±3857 ind./m2 and 59.85±48.01 g/m2, respectively. The trophic structure of macrozoobenthos is represented by poly-, phyto-, detritophages, carnivores and hydrobionts, the food spectrum of which has not been studied. The largest group is polyphages, the smallest number of species belongs to detritophages.
Key words: macrozoobenthos, Kerch Strait, abundance, biomass, trophic structure.
Поступила в редакцию 24.06.22
Принята к печати 05.08.22
83

