Экосистемы, 31: 155–161 (2022) https://ekosystems.cfuv.ru
УДК 577.29:573.6:57.021
Инновационный олигонуклеотидный инсектицид Хрит-11 показывает высокую эффективность и избирательность действия на Macrosiphoniella sanborni Gillette
Пузанова Е. В.1, Оберемок В. В.1, 2
- Крымский федеральный университет имени В. И. Вернадского Симферополь, Республика Крым, Россия liza.puzanova1996@gmail.com
- Ордена Трудового Красного Знамени Никитский ботанический сад – Национальный научный центр РАН Ялта, Республика Крым, Россия voloberemok@gmail.com
Macrosiphoniella sanborni Gillette – широко распространенный вредитель Chrysanthemum morifolium Ramat., наносящий значительный ущерб мировому цветоводству. Наряду с прямым негативным влиянием на растение, хризантемовая тля способна к распространению сопутствующих инфекций, негативно сказывающихся на растениях. На сегодняшний день применение химических инсектицидов является вынужденной мерой, связанной с отсутствием альтернативных конкурентоспособных препаратов, способных эффективно подавлять численность вредителей и при этом не наносить ущерб экосистеме. Биологические методы борьбы, в свою очередь, малоэффективны и часто трудоемки. Средством, объединяющим в себе положительные качества химических и биологических методов борьбы с насекомыми-вредителями, может выступить олигонуклеотидный инсектицид (ДНК-инсектицид) Хрит-11, основанный на комплементарной последовательности 5.8S рРНК вредителя. В результате проведенного опыта по изучению влияния немодифицированного антисмыслового ДНК олигонуклеотида Хрит-11 была зафиксирована смертность особей бескрылой формы на уровне 67,153,32 % при однократной обработке раствором в концентрации 100 нг/мкл и 97,382,49 % при двукратной обработке раствором той же концентрации с суточным интервалом. Дополнительно было изучено влияние случайного олигонуклеотида Слог-11, а также Хрит-11-3′ и Хрит-11-5′ с заменой одного азотистого основания на 3′- и 5′-концах соответственно. Наблюдения за саженцами, пораженными тлей, проводились в течение семи суток. Максимальная суточная эффективность была отмечена на третий день при любом из изученных вариантов обработки: эффект стремительно нарастал к третьим суткам, а затем плавно нивелировался. Произведена оценка экспрессии целевого гена на третьи сутки после обработки и нуклеазной активности гомогената насекомых. Данное исследование показывает перспективность рибосомальных генов вредителей как мишеней для действия ДНК-инсектицидов, а также демонcтрирует высокую специфичность таких препаратов.
Ключевые слова: антисмысловые технологии, олигонуклеотидные инсектициды, хризантемовая тля, защита
растений.
ВВЕДЕНИЕ
Первые сообщения об успешном использовании ДНК-инсектицидов
(олигонуклеотидных инсектицидов) в борьбе с насекомыми из подотряда Грудохоботных
(отряд Полужесткокрылые) датируются 2020 годом (Gal’chinsky et al., 2020; Oberemok et al., 2020; Useinov et al., 2020) и указывают на высокую степень уязвимости данной группы к воздействию немодифицированных антисмысловых олигонуклеотидов. Приступая к опытам на тлях, мы учитывали, что высокий репродуктивный потенциал вредителя может стать преградой для быстрого достижения летального эффекта. Однако обладая мягкими покровами, не защищенными мощным восковым налетом, тли представляют собой удобный модельный объект для испытания олигонуклеотидных инсектицидов (олинцидов).
Локализация очагов хризантемовой тли ассоциирована с теплицами, садоводческими центрами и, возможно, мелкими частными хозяйствами по всему миру. Macrosiphoniella sanborni Gillette (хризантемовая тля) представляет опасность не только прямым повреждением почек и молодых побегов за счёт питания флоэмным соком, но и способностью к распространению целого ряда РНК-вирусов (Blackman, Eastop, 1984), а также
ISSN 2414-4738 Published by V. I. Vernadsky Crimean Federal University, Simferopol
провоцированию развития сажистых грибов (Volesky, Schrumm, 2021). Все эти факторы истощают растение, снижают эффективность фотосинтеза, нарушают метаболизм, сказываясь на рентабельности цветочного производства. Помимо прочего, волна «зеленых» технологий и необходимость заботы об окружающей среде содействуют повышению требований потребителей к производимой продукции. На сегодняшний день для борьбы с хризантемовой тлей используются химические инсектициды (Dhakal et al., 2019; Naveena, 2019) и биологические методы борьбы, в том числе ботанические инсектициды на основе Toona sinensis L., Tithonia diversifolia (Hemsl.) A. Gray., Azadirachta indica A. Juss (Rahardjo et al., 2021) и различных эфирных масел (Ikbal, Pavela, 2019). Среди биологических методов борьбы обрели популярность выпуск в биотоп Coccinella septempunctata L. (Emam, 2016), обработка растений бластоспорами Verticillium lecanii и Beauveria bassiana (Helyer et al., 1992; Sudan et al., 2005). Однако у обеих групп методов есть существенные недостатки: первая – негативно воздействует на все компоненты природной среды и способствует развитию резистентности (Schulz et al., 2021), вторая часто недостаточно эффективна, трудоемка и характеризуется по некоторым из форм способностью влиять на других участников симбиотических отношений через поражение нецелевых объектов или изменение метагенома растений. Олинциды обладают рядом достоинств, охватывая преимущества химических и биологических средств контроля численности насекомых-вредителей (Oberemok et al., 2015): избирательность, эффективность, отсутствие углеродного следа при производстве нуклеиновых кислот и медленному развитию резистентности насекомых.
Целью данной работы стало изучение инсектицидного потенциала, а также избирательности действия олигонуклеотидного инсектицида Хрит-11 на хризантемовой тле.
МАТЕРИАЛ И МЕТОДЫ
Материалом для работы послужили пораженные M. sanborni саженцы хризантемы, полученные в Джанкойском интродукционно-карантинном питомнике НБС-ННЦ. Опыт проводился в лабораторных условиях на изолированных растениях при температуре 23 С. Плотность популяции тлей на хризантемах вначале опыта составляла 3,44 особей/см2. Учет смертности осуществлялся ежедневно.
Синтез олигонуклеотидов проводили амидофосфитным методом на синтезаторе нуклеиновых кислот ASM-800ЕТ (Биоссет, Россия). В качестве действующих веществ для эксперимента были синтезированы ДНК-олигонуклеотиды, а также праймеры для ПЦР
(табл. 1).
Таблица 1
Характеристики ДНК-фрагментов, использовавшихся в опыте с Macrosiphoniella sanborni
| Название | Последовательность | Назначение |
| Хрит-11 | 5′-TGTGTTCGTTA-3′ | Блокирование экспрессии гена 5,8S рРНК хризантемовой тли |
| Хрит-11-3′-Т | 5′-TGTGTTCGTTT-3′ | 3′- и 5′-концевые замены
(трансверсии) азотистых |
| Хрит-11-5′-А | 5′-AGTGTTCGTTA-3′ | оснований для оценки специфичности действия
Хрит-11 |
| Слог-11 | 5′-ACTGACTGACT-3′ | Сравнение эффективности нокдауна нерибосомальных генов |
| Agex-F | 5′-TGCAAGTGCGCTTCCACTTA-3′ | Прямой праймер для ПЦР |
| Agex-R | 5′-TAGCAGACGAAACGGCAGAT-3′ | Обратный праймер для ПЦР |
Разведение растворов до нужных концентраций осуществляли на спектрофотометре NanoDrop Lite (Thermo Scientific, США). Выделение РНК и синтез кДНК проводили в соответствии с протоколами производителей с помощью реактива ExtractRNA (Евроген, Россия) и набора для ОТ-ПЦР (Синтол, Россия) соответственно. Для корректности получаемых данных была проведена экстракция РНК в трёх повторностях. Для синтеза кДНК брали 10 мкл РНК в концентрации 20 нг/мкл. Были получены идентичные по размеру и количеству полосы РНК-образцов, что указывает на воспроизводимость выделения РНК из насекомых. ПЦР в реальном времени для оценки экспрессии целевого гена проводили с использованием реагента SYBR Green Master Mix (Roche, Швейцария) в соответствии с протоколом производителя на амплификаторе Light Cycler 96 (Roche, Швейцария), добавляя неразбавленную матрицу кДНК.
Температуру отжига праймеров рассчитывали по общепринятой формуле (Marmur, Doty, 1962): Tm= (wA+xT)×2+(yG+zC)×4, где w, x, y, z – количество оснований A, T, G и С в последовательности соответственно.
Нуклеазную активность оценивали по авторской методике. Гомогенат готовили путем смешивания 100 мг насекомых и 1 мл высокоочищенной деионизованной воды и центрифугировали в течение 5 минут при 13000 оборотов/минуту. Гомогенат сначала инкубировали при 25 °C в твердотельном термостате Термит (ДНК-Технологии, Россия) в течение 30, 45, 60 и 180 минут соответственно, затем в течение 60 минут при 90 °C для денатурации белка. После этого 9 мкл гомогената смешивали с 3 мкл 4X Gel Loading Dye, Blue (Евроген, Россия) и наносили в 1,8 % агарозный гель, подвергая электрофоретическому разделению под напряжением 10 В/см в трис-боратном буфере (1XTBE) на протяжении 40 минут в камере для электрофреза SE-2 (Хеликон, Россия) с источником питания Mini-300 (Major Science, Австралия). Визуализировали нуклеиновые кислоты в агарозном геле с помощью трансиллюминатора Vilber Lourmat (Франция) и маркера длин ДНК 50bp+ (Евроген, Россия).
Статистический анализ приведен с использованием t-критерия Стьюдента и 2-критерия Пирсона с поправкой Йейтса (STATISTICA 10.0, MS Excel 2010).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Разработанный нами на основе последовательности 5,8S рРНК хризантемовой тли олинцид Хрит-11 показал высокую эффективность, приводя к смертности 67,153,32 % особей вредителя (χ2=448,8, p<0,001, N=1100, dF=1) к 7 дню эксперимента после однократной обработки рабочим раствором в концентрации 100 нг/мкл и 97,382,49 % (χ2=360,9, p<0,001, N=1100, dF=1) к 7 дню эксперимента после двукратной обработки с суточным интервалом тем же раствором (рис. 1). Для оценки достоверного различия между средними значениями групп использовался критерий Пирсона (χ2) с поправкой Йейтса.
Введение группы с двукратной обработкой обусловлено следующим наблюдением: живородящие самки, в отличие от личиночных форм, обладали большей устойчивостью к действию олинцида Хрит-11. Вероятнее всего инсектицидная нагрузка на новорожденных тлей была крайне низка. Вторая обработка позволяла охватить большее количество уязвимых особей. Максимальная убыль численности насекомых отмечена в течение третьих суток от начала эксперимента и составляла 18,730,41% в группе с одной и 28,821,02 % в группе с двумя обработками. Нужно отметить, что олинцид Хрит-11 в концентрации 10 нг/мкл уже не оказывал значимого влияния на смертность 5,790,86 % (χ2=0,01, p=0,916, N=825, dF=1).
Для подтверждения высокой избирательности ДНК-фрагментов было изучено влияние двух сходных к олигонуклеотиду Хрит-11 фрагментов – Хрит-11-3′ и Хрит-11-5′, которые отличаются от него заменами азотистых оснований на 3′- и 5′-концах. В первом случае заменой аденина на тимин, во втором – тимина на аденин на соответствующих концах. Они
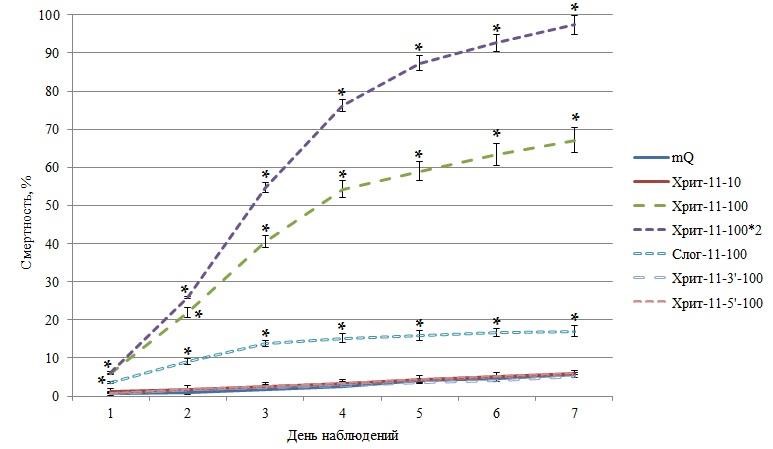
Рис. 1. Смертность тли при обработке различными ДНК-олигонуклеотидами mQ – высокоочищенная деионизированная вода; Хрит-11-10 – олинцид Хрит-11, 10 нг/мкл; Хрит-11100 – олинцид Хрит-11, 100 нг/мкл; Хрит-11-100*2 – олинцид Хрит-11, 100 нг/мкл двукратно; Слог-11100 – олигонуклеотид Слог-11, 100 нг/мкл; Хрит-11-3′-100 – олигонуклеотид Хрит-11-3′, 100 нг/мкл;
Хрит-11-5′-100 – олигонуклеотид Хрит-11-5′, 100 нг/мкл;
*достоверное различие по сравнению с контрольной группой (р<0,001).
не оказали значимого влияния на смертность тли. За 7 дней смертность достигла 5,070,47 % (χ2=0,2, p=0,689, N=1100, dF=1) и 5,920,25 % (χ2=0,02, p=0,897, N=1100, dF=1) соответственно, что находится в пределах показателей контрольной группы.
Незначительная смертность после обработки фрагментом Слог-11, комплементарным различным частям геномов представителей семейства Aphididae, может быть объяснена тем, что данный олигонуклеотид комплементарен фрагментам мРНК генов 2 субъединицы рецептора гамма-аминомасляной кислоты типа B, протеинкиназы C-связывающего белка NELL1, белка GATA домена цинковых пальцев 10, фактора рибозилирования АДФ (по данным GenBank). В то же самое время эти данные показывают, что рибосомальные гены являются более подходящей мишенью для действия олинцидов.
Было отмечено повышение экспресии 5,8S рРНК на третий день после обработки олинцидом Хрит-11 в концентрации 100 нг/мкл на 13,31,6 % (p<0,001). Наряду с понижением экспрессии гена, характерным для золотого стандарта действия антисмысловых олигонуклеотидов на рибосомальные гены (Oberemok et al., 2019; Gal’chinsky et al., 2020; Useinov et al., 2020), мы уже фиксировали увеличение экспрессии в ответ на применение ДНКинсектицидов у других видов насекомых. По-видимому, рибосомальные гены являются тем звеном, которое очень сильно гиперкомпенсирует подавление своей экспрессии. И это приводит к последующим нарушениям в функционировании клеток вредителя.
Анализ нуклеазной активности гомогената тканей тли (рис. 2) показывает, что в течение короткого периода времени менее трех часов клеточные нуклеазы полностью разрушают попавшие в организм ДНК-фрагменты. По сути, функционирование олигонуклеотида Хрит11 в качестве блокатора экспрессии рибосомального гена ограничено действием разрушающих его клеточных ферментов, но этого времени достаточно, чтобы спровоцировать долгосрочный эффект и вывести из строя работу синтетического аппарата клетки. Также возможно, что в интактной клетке ДНК-олигонуклеотиды сохраняются более длительное время и могут продолжать оказывать инсектицидное действие. Тонкие детали данного механизма еще мало изучены, однако высокая эффективность и избирательность олинцидов, показанная на представителях подотряда Грудохоботных, позволяет активно внедрять данный класс инсектицидов для регуляции численности карантинных видов вредителей, часто попадающих на территорию Крыма и юга России с посадочным материалом декоративных растений.

Рис. 2. Нуклеазная активность гомогената хризантемовой тли
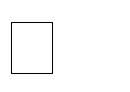 1, 7, 12, 18 – олинцид Хрит-11, 170 нг/мкл; 2, 8, 13, 19 гомогенат, инкубированный при 25 °C в течение
1, 7, 12, 18 – олинцид Хрит-11, 170 нг/мкл; 2, 8, 13, 19 гомогенат, инкубированный при 25 °C в течение
30, 45, 60 и 180 минут соответственно; 3-5, 9-11, 14-16, 20-22 – смесь (1:1) гомогената и олинцида Хрит-
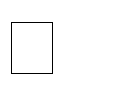 11, 340 нг/мкл инкубировали при 25 C в течение 30, 45, 60 и 180 минут соответственно (в трех повторностях); 6, 17
11, 340 нг/мкл инкубировали при 25 C в течение 30, 45, 60 и 180 минут соответственно (в трех повторностях); 6, 17 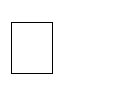 маркер длин ДНК 50 bp+; стрелки указывают на место локализации олигонуклеотида Хрит-11.
маркер длин ДНК 50 bp+; стрелки указывают на место локализации олигонуклеотида Хрит-11.
ЗАКЛЮЧЕНИЕ
В ходе исследования был разработан и синтезирован олигонуклеотидный инсектицид (ДНК-инсектицид) Хрит-11, показавший наибольшую эффективность в рамках исследованных опытных групп, в дозировке 100 нг/мкл при двукратной обработке с суточным интервалом. С помощью фрагментов Хрит-11-3′ и Хрит-11-5′ была продемонстрирована высокая избирательность, заключающаяся в отсутствии эффекта при замене даже одного азотистого основания из одиннадцати, не позволяющая олинциду эффективно работать. Данный факт говорит о безопасности Хрит-11 для нецелевых объектов и, в тоже время, дает возможность при необходимости создавать универсальные для близкородственных вредителей олигонуклеотидные препараты, опираясь на данные о геномах насекомых. Выяснено, что нуклеазы организма тли разрушают Хрит-11 менее чем за 180 минут, что показывает высокий уровень биоразлагаемости препарата.
Разработка и регистрация ДНК-инсектицидов против насекомых-вредителей из подотряда Грудохоботные является чрезвычайно важным и актуальным направлением защиты растений. С ростом числа секвенированных последовательностей геномов насекомых в GenBank разработка этого класса инсектицидов обретет еще большую надежность и широкое распространение, так как будет опираться не на единичные расшифрованные геномные последовательности насекомых-вредителей, а на массив большого количества аналогичных данных, собранных исследователями с разных уголков мира.
Благодарности. Авторы выражают признательность к. б. н. А. К. Шармагию (НБС-
ННЦ) за предоставление пораженных тлёй саженцев хризантем, а также благодарят младшего научного сотрудника И. А. Новикова (КФУ имени В. И. Вернадского) за синтез последовательностей нуклеиновых кислот.
Работа выполнена в рамках проекта РНФ по теме «Разработка олигонуклеотидных инсектицидов для защиты растений против насекомых-вредителей из подотряда Грудохоботные (отряд Полужесткокрылые) на основе коротких антисмысловых олигонуклеотидов рибосомальных генов», № 22-16-20052.
Список литературы
Blackman R. L., Eastop V. F. 1984. Aphids on the World’s Crops: An Identification and Information Guide. 476 pp.
Dhakal R., Ghimire R., Sapkota M., Thapa S., Bhatta A. K., Regmi R. Bioefficacy of different insecticides on cowpea aphid (Aphis craccivora Koch) // International Journal of Entomological Research. 2019. Vol. 7, N 1. P. 17.
Emam A. K. Biological Control of the Chrysanthemum Aphid, Macrosiphoniella sanborni (Gillete) by Release Coccinella septempunctata L. on Chrysanthemum Plants // Journal of Plant Protection and Pathology. 2016. Vol. 7, N 5. P. 291295.
Gal’chinsky N., Useinov R., Laikova K., Novikov I., Gorlov M., Plugatar Y., Oberemok V. A breakthrough in the efficiency of contact DNA insecticides: rapid high mortality rates in the sap-sucking insects Dynaspidiotusbritannicus
Comstock and Unaspis euonymi Newstead // Journal of Plant Protection Research. 2020. Vol. 60. P. 220223.
Helyer N., Gill G., Bywater A. Elevated humidities for control of chrysanthemum pests with Verticillium lecanii //
Pesticide Science. 1992. Vol. 36, N 4. P. 373-378.
Ikbal C., Pavela R. Essential oils as active ingredients of botanical insecticides against aphids // Journal of pest science. 2019. Vol. 92. N 3. P. 971-986.
Marmur J., Doty P. Determination of the base composition of deoxyribonucleic acid from its thermal denaturation temperature // Journal of molecular biology. 1962. Vol. 5. P. 109118.
Naveena J. B., Sharanabasappa. Effect of different insecticides against aphids, Aphis gossypii and whiteflies,
Bemisiatabaci // Journal of Pharmacognosy and Phytochemistry. 2019. Vol. 8, N 5. P. 15721573.
Oberemok V. V., Zaitsev A., Levchenko N., Nyadar P. A Brief Review of Most Widely Used Modern Insecticides and Prospects for the Creation of DNA Insecticides // Entomological Review. 2015. Vol. 97. P. 507–518.
Oberemok V., Laikova K., Gal’chinsky N., Useinov R., Novikov I.,Temirova Z., Shumskykh M., Krasnodubets A., Repetskaya A., Dyadichev V., Fomochkina I., Bessalova E., Makalish T., Gninenko Y., Kubyshkin A. DNA insecticide developed from the Lymantria dispar 5.8S ribosomal RNA gene provides a novel biotechnology for plant protection // Scientific Reports. 2019. Vol. 9, N. 1. P. 6197.
Oberemok V., Laikova K., Useinov R., Gal’chinsky N., Novikov I., Gorlov M. High Mortality of Sap-sucking Insects One Week After Topical Application of DNA Insecticides // In vitro biology meeting, San-Diego, June 4. 2020. Rahardjo I. B., Hutapea D., Marwoto B., Budiarto K. Effects of Several Botanical Insecticides Applied in Different Periods to Control Aphids (Macrosiphoniella sanborni Gillete) on Chrysanthemum // AGRIVITA Journal of Agricultural
Science. 2021. Vol. 43, N 3. P. 495506.
Schulz R., Bub S., Petschick L. L., Stehle S., Wolfram J. Applied pesticide toxicity shifts toward plants and invertebrates, even in GM crops // Science. 2021. Vol. 372, N 6537. P. 81–84.
Sudan Y. E.,Yuhui D., Feng M. G. Time and concentration dependent interactions of Beauveria bassiana with sublethal rates of imidacloprid against the aphid pests Macrosiphoniella sanborni and Myzus persicae // Annals of Applied
Biology. 2005. Vol. 146, N 4. P. 459468.
Useinov R., Gal’chinsky N., Yatskova E., Novikov I., Puzanova Y., Trikoz N., Sharmagiy A., Plugatar Y., Laikova K., Oberemok V. To bee or not to bee: creating DNA insecticides to replace non-selective organophosphate insecticides for use against the soft scale insect Ceroplastes japonicus Green // Journal of Plant Protection Research. 2020. Vol. 60, N 4. P. 406–409.
Volesky N., Schrumm Z. R. 2021. High Tunnel Pest Management-Aphids. Factsheet. N. ENT-225-21-PR. P. 17.
Puzanova E. V., Oberemok V. V. The innovative oligonucleotide insecticide Hrit-11 shows high efficiency and selectivity on Macrosiphoniella sanborni Gillette // Ekosistemy. 2022. Iss. 31. P. 155–162.
Macrosiphoniella sanborni Gillette is a widespread pest of Chrysanthemum morifolium Ramat., causing significant damage to the world floriculture. Along with its direct negative effect on the plant, chrysanthemum aphid is capable of spreading concomitant infections that adversely affect plants. To date, the use of chemical insecticides is a forced measure due to the lack of alternative competitive preparations that can effectively suppress the number of pests and at the same time not damage the ecosystem. Biological control methods, in turn, are ineffective and often time-consuming. An oligonucleotide insecticide (DNA insecticide) Hrit-11, based on the 5.8S rRNA gene sequence of the pest, can be a substance that combines the positive characteristics of chemical and biological methods of insect pest control. For Hrit-11 oligonucleotide the mortality rate of individuals of the wingless form was recorded at the level of 67.153.32 % with a single treatment with a solution at a concentration of 100 ng/µl and 97.382.49 % with double treatment with a solution of the same concentration with a daily interval. In addition, the influence of a random oligonucleotide Slog-11, as well as Hrit-11-3′ and Hrit-11-5′ with the replacement of one nitrogenous base at the 3′- and 5′-ends, respectively, was studied. Seedlings affected by aphids were monitored for seven days. The maximum daily efficiency was detected on the third day with any of the studied treatment options: the effect rapidly increased by the third day, and then gradually leveled off. The expression of the target 5.8S rRNA gene on the third day after treatment and the nuclease activity of the insect homogenate were evaluated. This study shows the promise of pest ribosomal genes as targets for the action of DNA insecticides, and also demonstrates the high specificity of such preparations
Key words: antisense technologies, oligonucleotide insecticides, chrysanthemum aphid, plant protection.
Поступила в редакцию 26.10.22
Принята к печати 20.11.22

