THE STUDY OF POPULATION DYNAMICS OF ECOLOGICAL GROUPS OF MICROORGANISMS EPIPHYTIC MICROBIOTA STELLARIA MEDIA AND URTICA DIOICA
JOURNAL: «EKOSISTEMY», Issue 25, 2021
Publication text (PDF): Download
UDK:
58.072+579.26
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
- Lapkina E. Z., Saveleva E. E., Bulgakova N.A., Krasnoyarsk State Medical University named after Professor V.F. Voino-Yasenetsky, Krasnoyarsk, Russia
- Tyrranen L. S., Krasnoyarsk Science Centre of the Siberian Branch of Russian Academy of Science, Krasnoyarsk, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-25-22-29
PAGES: from 22 to 29
STATUS: Published
LANGUAGE: Russian
KEYWORDS: Stellaria media, Urtica dioica, plant microbiota, phyllosphere, root microbiota, epiphytic microflora, dynamics of the strength of microorganisms, ecological and trophic groups of microorganisms.
ABSTRACT (ENGLISH): The dynamics of the strength of the epiphytic microbiota of the root zone and phyllosphere of the Stellaria media and Urtica dioica in the vegetation phase of plants (seedlings, flowering, fruiting) was studied. The data on the strength of microorganisms of ecotrophic groups are presented: ammonifying bacteria using mineral forms of nitrogen, bacteria of the Escherichia coli group, micromycetes and bacteria in the spore stage. It was determined that the medium-sized microbiota of the Stellaria media is more strengthen than the Urtica dioica, which is probably due to the morphoanatomical features of plants and the metabolites produced. The microbiota of the rhizosphere of plants of the Stellaria media and Urtica dioica is much more strength than the phyllosphere due to the root exudates of plants that provide food for microorganisms. The dynamics of the microbiota of the rhizosphere reflects the unequal level of metabolite production by plants in different phases of vegetation. The total strength of aerobic bacteria that metabolize organic nitrogen in the basal zone of Stellaria media increases in the flowering phase, and in the basal zone of Urtica dioica – in the phase of seedlings.The greatest strength of microscopic fungi during the flowering phase of Stellaria media is probably associated with the production of metabolites by plants and favorable weather conditions for the development of micromycetes. Micromycetes belong to the following genera: Trichoderma, Penicillium, Fusarium, Botrytis, Mucor, Aspergillus, Cladosporium. The strength of phyllosphere microorganisms varies according to the stages of plant vegetation. The Stellaria media and the Urtica dioica have a specific microbial complex, both in the aboveground and underground parts, which varies during the growing season and differs in a certain ratio of ecological and trophic groups of microorganisms.
ВВЕДЕНИЕ
Растения являются неотъемлемой частью урбоэкосистемы, улучшая газовый состав воздуха и микроклимат городской среды, испытывая при этом антропогенную нагрузку. Микробные сообщества играют фундаментальную роль в развитии, питании, стрессоустойчивости, иммунитете и продуктивности растительных организмов.
Практически все органы растений населены микроорганизмами, формирующими разного уровня специфические взаимодействия с организмом хозяина. В соответствии с занимаемой экологической нишей различают эпифитные микробные комплексы, формирующиеся на поверхности растений, и эндофитные, способные осуществлять жизнедеятельность в растительных тканях (Thomas et al., 2013). Среди эпифитных микроорганизмов большего разнообразия достигает ризосфера, поскольку формируется за счет корневых выделений растений (экссудаты), отмирающих клеток корневой системы (источник целлюлозы и пектиновых веществ), слизи, образуемой клетками корневой системой (Бойко и др., 2006; Барчева, 2008; Бороздина, Заикина, 2010; Бороздина, Мануйлов, 2011). Корневые выделения растений могут содержать органические кислоты, витамины, а также вещества, обладающие антимикробной активностью, что существенно сказывается на специфичности структуры микробиома ризосферы в зависимости от вида растений, а также возраста и стадии развития растений (Звягинцев, 1987; Добровольская и др., 1989; Звягинцев, Зенова, 2001; Добровольская, 2002). Филлосфера растений обычно обладает меньшим видовым разнообразием, вследствие бедности субстрата и в большей степени зависит от абиотических факторов окружающей среды, таких как влажность и температура (Агеева и др., 2015). Численность и видовой состав микроорганизмов филлосферы может зависеть от особенностей строения эпидермы растений (наличие железок, волосков, строение устьичного аппарата). Предполагается, что эндофитные микроорганизмы могут быть популяцией микроорганизмов ризосферы, способных адаптироваться в условиях внутренней среды растений путем модификации метаболизма. Однако эндофиты обнаруживаются в межклетниках отмирающих клеток, что может указывать на их латентный патогенез в растениях. При этом эпифитная микробиота вступает в конкурентные взаимоотношения с фитопатогенами (Рамазанова, Асадулаев, 2013; Сорокин, Афанасова, 2016).
Эпифитная микрофлора является индикатором физиологической активности растений, поскольку формируется под действием выделяемых растением различных биологически активных веществ: фенолов, терпеноидов, алкалоидов и так далее (Давыдова, 2006; Ерина и др., 2015; Ерина, Коптева, 2015).
В условиях усиления антропогенного фактора изучение обсемененности лекарственных, космополитных видов растений позволяет понимать закономерности функционирования эпифитных микроорганизмов и осуществлять микробиологический мониторинг растительного яруса урбоэкосистемы города Красноярска.
Микробные комплексы растений урбанизированной экосистемы изучали на широко распространенных в окрестностях города Красноярска рудеральных растениях: звездчатка средняя и крапива двудомная.
Крапива двудомная (Urtica dioica L.) – многолетнее травянистое корневищное растение высотой до 150–170 см с прямостоячим стеблем и супротивными, крупнопильчатыми, черешковыми листьями. Стебель и листья покрыты жгучими хрупкими волосками, содержащими муравьиную кислоту и гистамин. Растет по опушкам лесов, по берегам рек и ручьев, по оврагам, пустырям, как сорняк около жилья и дорог.
Звездчатка средняя (Stellaria media L.) – однолетнее травянистое растение со стержневым разветвленным корнем, стелющимся ветвистым стеблем 10–30 см. Листья до 2 см в длину и в ширину, нижние – черешковые, верхние – сидячие. Встречается на огородах и полях, в сорных местах, на лесных опушках, по берегам рек и других водоемов. Предпочитает увлажненные места обитания.
Цель исследования – изучить динамику численности микробиоты ризосферы и филлосферы звездчатки средней и крапивы двудомной в течение вегетационного периода.
МАТЕРИАЛ И МЕТОДЫ
Объекты исследования: звездчатка средняя и крапива двудомная, произрастающие в лесном массиве микрорайона Академгородок города Красноярска.
Учет микроорганизмов почвы, ризосферы и филлосферы растений проводили методом предельных разведений и микробиологического посева на элективные твердые питательные среды (Добровольская и др., 1989; Добровольская, 2002; Теппер, 2004; Практикум по микробиологии, 2005). Пробы отбирали в фазы проростков, цветения и плодоношения растений.
Учёт общего количества аэробных бактерий проводили на 3 сутки. БГКП культивировали при температуре 37 °С, их количество учитывали на 1–2 сутки. Микромицеты выращивали при комнатной температуре с добавлением в питательную среду стрептомицина и пенициллина для подавления роста бактериальной эпифитной микробиоты, количество их учитывали на 3–4 сутки, идентифицировали до рода (Благовещенская, 2015). Результаты исследований обрабатывали методами вариационной статистики, используя Microsoft Office.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
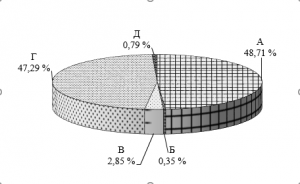
До определения динамики численности микрофлоры растений предварительно исследовали микробиоту почвы опытного участка (рис. 1).
Почва лесного массива Академгородка города Красноярска представлена бактериями, использующими минеральные и органические формы азота в равном соотношении, что свидетельствует о наличии азотного питания для микроорганизмов. Микробиота почвы также представлена 0,35 % БГКП, 0,79 % споровых бактерийв стадии спор, менее 3 % микромицетов.
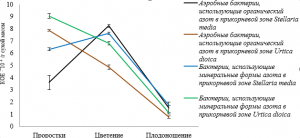
Экспериментальные данные по динамике численности микрофлоры прикорневой зоны и филлосферы звездчатки средней и крапивы двудомной свидетельствуют о том, что численность микроорганизмов зависит от вида растения, произрастающего на одном и том же опытном участке и фазы вегетационного развития (рис. 2–5, табл. 1).
Микрофлора ризосферы звездчатки средней достигает наибольшей численности в фазу цветения, что, по всей видимости, связано с увеличением синтеза корневых выделений в этот период. В случае же крапивы двудомной численность микроорганизмов ризосферы достигает максимума в стадию проростков, при этом, бактерий, использующих минеральные формы азота, в 2 раза больше, чем в этот же период у звездчатки средней, а бактерий, усваивающих органический азот – больше в 1,5 раза.
Численность вышеуказанных групп бактерий снижается в стадию плодоношения растений, что, может быть, связано с неблагоприятными условиями окружающей среды в период отбора проб, таких как снижение среднесуточной температуры и изменение влажности почвы. В фазу плодоношения происходит смена состава микроорганизмов, использующие продукты экзосмоса растений, на те, которые способны разлагать растительную биомассу, что может приводить к изменению их численности (рис. 2).
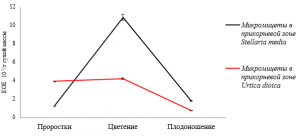
Динамика численности микромицетов в прикорневой микробиоте в зависимости от стадии вегетации сходна как у растений крапивы двудомной, так и звездчатки средней (рис. 3).
Наибольшая численность микроскопических грибов в микрофлоре прикорневой зоны растений звездчатки средней составляет 10,85·102 КОЕ/г сухой массы в фазу цветения, к фазе плодоношения этот показатель составляет 1,80·102 КОЕ/г сухой массы. У растений крапивы двудомной происходит снижение численности микромицетов от 4,20·102 КОЕ/г сухой массы
Рис. 1. Соотношение численности микроорганизмов почвы опытного участка А – общее количество аэробных бактерий, использующих органический азот, Б – бактерии группы кишечной палочки, В – микромицеты, Г – бактерии, использующие минеральные формы азота, Д – споровые бактерии в стадии спор.
Рис. 2. Динамика численности аэробных бактерий, использующих органический азот и бактерий, усваивающих минеральные формы азота в прикорневой зоне Stellaria media и Urtica dioica в зависимости от фазы вегетационного периода
Рис. 3. Динамика численности микроскопических грибов в прикорневой зоне Stellaria media и Urtica dioica в зависимости от фазы вегетационного периода
в фазу цветения до 0,79·102 КОЕ/г сухой массы в фазу плодоношения. Микроскопические грибы прикорневой микробиоты звездчатки средней и крапивы двудомной представлены следуюших родов: Trichoderma, Penicillium, Fusarium, Botrytis, Muсor, Aspergillus, Cladosporium.
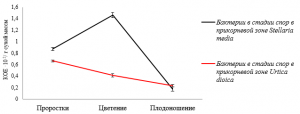
Динамика численности споровых бактерий в стадии спор в микробиоте прикорневой зоны звездчатки средней достигает максимального числа в фазу цветения со снижением численности к фазе плодоношения, а у крапивы двудомной – в фазу проростков с общей тенденцией уменьшения численности на 20,04 % (рис. 4).
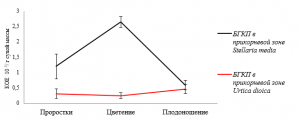
Численность бактерий группы кишечной палочки в прикорневой микробиоте звездчатки средней в стадию проростков больше в 3,78 раза, чем в прикорневой микробиоте крапивы двудомной (рис. 5).
Рис. 4. Динамика численности споровых бактерий в стадии спор в прикорневой зоне Stellaria media и Urtica dioica в зависимости от фазы вегетационного периода
Рис. 5. Динамика численности бактерий группы кишечной палочки в прикорневой зоне Stellaria media и Urtica dioica в зависимости от фазы вегетационного периода
В стадию цветения у крапивы двудомной этот показатель изменяется незначительно, а у звездчатки средней возрастает более чем в 2 раза. У крапивы двудомной численность бактерий группы кишечной палочки повышается с 0,26·102 КОЕ/г сухой массы в фазу проростков до 0,48·102 КОЕ/г сухой массы в фазу плодоношения. В прикорневой микробиоте звездчатки средней численность бактерий группы кишечной палочки снижается с 2,65·102 КОЕ/г сухой массы до 0,6·102 КОЕ/г сухой массы.
В филлосфере звездчатки средней отмечается большая численность микроорганизмов, чем в филлосфере крапивы двудомной, что, возможно, связано с морфо-анатомическими особенностями растения и с выделяемыми биологически активными веществами в процессе экзосмоса растений. Так, звездчатка средняя имеет стелющийся стебель, что может приводить к заносу микрофлоры с пылью и почвой.
Листья крапивы двудомной содержат волоски 3-х типов: жгучие, ретортовидные и головчатые. Жгучие волоски имеют легко обламывающуюся головку. Эпидермис нижней стороны листа состоит из сильноизвилистых клеток и содержит устьица аномоцитного типа, эпидермис верхней стороны листа состоит из прямых или слабоизвилистых клеток (Государственная фармакопея…, 2018).
Листья звездчатки средней содержат лишь у основания многоклеточные железистые волоски. Устьица аномоцитного типа содержатся в большей степени на нижней стороне листьев. Эпидермис нижней стороны листа представлен более извилистыми клетками (Горина и др., 2010).
Отмечено, что численность всех эколого-трофических групп микроорганизмов филлосферы звездчатки средней и крапивы двудомной увеличивается в фазу плодоношения. Так, численность аммонифицирующих бактерий у звездчатки средней увеличивается в 2,6 раза по сравнению с фазой проростков, что, возможно, связано с интенсивным продуцированием метаболитов растениями в данный период (табл. 1).
Таблица 1
Динамика численности эколого-трофических групп микроорганизмов филлосферы Stellaria media и Urtica dioica в зависимости от фазы вегетационного периода
| Эколого-трофическая группа микроорганизмов | Фаза проростков | Фаза цветения | Фаза плодоношения | |||
| Stellaria media | Urtica dioica | Stellaria media | Urtica dioica | Stellaria media | Urtica dioica | |
| Общее количество аэробных бактерий, использующих органический азот | 25,28·103
±2,18 |
0,01·103
±0,001 |
9,47·103
±0,35 |
0,32·103
±0,08 |
66,30·103
±0,41 |
0,41·103
±0,02 |
| Бактерии, усваивающие минеральные формы азота | 32,21·103
±2,48 |
роста нет | 4,53·103
±0,87 |
0,20·103
±0,06 |
27,49·103
±3,73 |
0,44·103
±0,03 |
| Бактерии группы кишечной палочки | 0,11·102
±0,01 |
роста нет | 0,08·102
±0,01 |
роста нет | 0,23·102
±0,02 |
0,02·102
±0,004 |
| Споровые бактерии в стадии спор | роста нет | роста нет | 0,07·102
±0,01 |
роста нет | 0,01·102
±0,01 |
роста нет |
| Микроскопические грибы | 5,28·102
±0,29 |
0,02·102
±0,003 |
17,87·102
±2,02 |
0,11·102
±0,01 |
7,46·102
±0,2 |
0,57·102
±0,06 |
В филлосфере крапивы двудомной общее количество аэробных бактерий, использующих органический азот значительно ниже, чем в филлосфере звездчатки средней. Также, отмечено отсутствие или низкая численность бактерий в стадии спор и БГКП во все фазы вегетационного развития растений крапивы двудомной.
Соотношение общего количества аммонифицирующих бактерий (6,63·104 КОЕ/г сухой массы) к численности бактерий, усваивающих минеральные формы азота (2,75·104 КОЕ/г сухой массы), в филлосфере звездчатки средней в фазу плодоношения указывает на процессы минерализации органического вещества.
Содержание БГКП низкое (до 0,24·102 КОЕ/г сухой массы), следовательно, растения биологически не загрязнены. Динамика численности бактерий в стадии спор филлосферы повторяет тенденцию динамики численности в прикорневой зоне.
Фитопатогенные бактерии и дрожжи в микробиоте звездчатки средней и крапивы двудомной не были обнаружены.
ЗАКЛЮЧЕНИЕ
Микробиота ризосферы растений звездчатки средней и крапивы двудомной значительно многочисленнее по сравнению с филлосферой за счет корневых экссудатов растений, обеспечивающих питание микроорганизмов.
Динамика численности микробиоты ризосферы отражает неодинаковый уровень продуцирования метаболитов растениями в разные фазы вегетации. Общее количество аэробных бактерий, усваивающих органический азот, в прикорневой зоне звездчатки средней увеличивается в фазу цветения, а в прикорневой зоне крапивы двудомной – в фазу проростков.
Низкое содержание бактерий группы кишечной палочки, судя по всему, связано проявлением бактериостатических свойств метаболитов изучаемых растений.
Соотношение бактерий, усваивающих органический азот, и бактерий, использующих минеральные формы азота, указывает на большую интенсивность процессов минерализации органического вещества в прикорневой зоне растений в сравнении с филлосферой. Наибольшая численность микроскопических грибов в фазу цветения Stellaria media, вероятно, связана с продуцированием метаболитов растениями и благоприятными метеоусловиями для развития микромицетов. Обнаружены микромицеты рода: Trichoderma, Penicillium, Fusarium, Botrytis, Muсor, Aspergillus, Cladosporium.
Численность микроорганизмов филлосферы изменяется по стадиям вегетации растений. Микробиота филлосферы звездчатки средней многочисленнее, чем крапивы двудомной и обеспечивается морфо-анатомическими и физиологическими особенностями растений.
Таким образом, можно полагать, что крапива двудомная и звездчатка средняя обладают специфическим микробным комплексом, как в надземной, так и подземной части, изменяющимся в течение вегетационного периода и различающимся определенным соотношением эколого-трофических групп микроорганизмов.
REFERENCES
Агеева Н. М., Супрун И. И., Прах А. В. Видовое многообразие микрофлоры на ягодах винограда // Научный журнал КубГАУ. – 2015. – № 111 (07). – С. 1586–1595.
Барчева А. В. Изучение эпифитных микромицетов филлосферы древесных растений. – Астрахань: АГТУ, 2008. – 23 с.
Благовещенская Е. Ю. Фитопатогенные микромиценты: учебный определитель. – М.: Ленанд, 2015. – 240 с.
Бороздина И. Б., Заикина И. А. Сезонная динамика микробиологических показателей Pseudomonas и Bacillus, выделенных с поверхности филлоплана и цветка у представителей семейства Compositae // Вестник Алтайского государственного аграрного университета. – 2010. – № 10 (72). – С. 43–46.
Бороздина И. Б., Мануйлов И. М. Микрофлора семян лекарственных растений // Вестник Алтайского государственного аграрного университета. – 2011. – № 9 (83). – С. 43–47.
Бойко И. Е., Агеева Н. М., Минакова А. Д., Блягоз А. Р. Идентификация состава эпифитной микрофлоры плодовых культур республики Адыгея // Известия ВУЗов. Пищевая технология. – 2006. – № 5. – С. 15–16.
Горина Я. В., Бабешина Л. Г., Краснов Е. А. Анатомическое изучение растений рода звездчатка // Фармация. – 2010. – № 6. – С. 22–24.
Государственная фармакопея Российской Федерации. – М.: ФЭМБ, 2015. – Т. 3. – 1292 с.
Добровольская Т. Г., Скворцова И. Н., Лысак Л. В. Методы выделения и идентификации почвенных бактерий. – М.: МГУ, 1989. – 40 с.
Добровольская Т. Г. Структура бактериальных сообществ почв. – М.: МГУ, 2002. – 282 с.
Давыдова Е. А. Микроорганизмы – ассоцианты растений Artemisia austriaca Jacg., произрастающих на засоленных почвах астраханской области // Вестник АГТУ. – 2006.– № 3 (32). – С.188–192.
Ерина Н. В., Коптева Т. С., Заикина И. А. Видовой состав эпифитной микрофлоры некоторых растений семейства Grossulariaceae и различные типы их взаимодействий // Научный журнал КубГАУ. – 2015. – № 114 (10). – С. 98–106.
Ерина Н. В., Коптева Т. С. Микробные сообщества филлосферы некоторых растений семейства Grossulariaceae // Научный журнал КубГАУ. – 2015. – № 110 (06). – С. 660–671.
Звягинцев Д. Г. Почва и микроорганизмы. – М.: МГУ, 1987. – 256 с.
Звягинцев Д. Г., Зенова Г. М. Экология актиномицетов. – М.: МГУ, 2001. – 256 с.
Практикум по микробиологии / [Ред. А. И. Нетрусов]. – М.: Академия, 2005. – 608 с.
Рамазанова З. Р., Асадулаев З. М. Эпифитная микрофлора и фитонцидная активность листьев некоторых древесных растений г. Махачкалы // Известия Дагестанского государственного педагогического университета. Естественные и точные науки. – 2013. – № 3 (24). – С. 24–28.
Сорокин Н. Д., Афанасова Е. Н. Структура и динамика микробных комплексов филлосферы и ризосферы хвойных видов лесных биогеоценозов приенисейской Сибири (на примере предивинского лесхоза) // Вестник КрасГАУ. – 2016. – № 8. – С. 53–58.
Сорокин Н. Д., Афанасова Е. Н., Сенашова В. А. Микробные комплексы филлосферы как индикаторы состояния древостоев-эдификаторов // Вестник КрасГАУ. – 2016. – № 9. – С. 3–8.
Теппер Е. З. Практикум по микробиологии / [Ред. К. Шильникова]. – М.: Дрофа, 2004. – 256 с.
Turner T. R, James E. K, Poole P. S. The plant microbiome // Genome Biology. – 2013. – Vol. 14. – P. 209–219.