BOTTOM FAUNA OF LAKE DONUZLAV UNDER CONDITIONS OF INDUSTRIAL SAND MINING
JOURNAL: «EKOSISTEMY», Issue 27, 2021
Publication text (PDF):Download
UDK: 591.524.11:556.65(292.471):622.271.63
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Revkov N. K., Boltacheva N. A., Revkova T. N., Bondarenko L. V., Schurov S. V., Lukjanova L. F.
A. O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-27-5-22
PAGES: from 5 to 22
STATUS: Published
LANGUAGE: Russian
KEYWORDS: macrozoobenthos, meiobenthos, Chara algae biocoenosis, Donuzlav, Black Sea, sand mining.
ABSTRACT (ENGLISH):
In 2019, the composition and quantitative representation of the zoobenthos in Donuzlav Lake, in the area of fine sediment discharge after the sand mining, and in the adjacent water area were studied. The accounting of the macrozoobenthos at the species level and of the meiobenthos at the major taxa level indicates the presence of a typical Pontic bottom fauna in the Lake, which has developed over 58 years of it existence. The benthic macrofauna was represented by a biocoenosis of Chara algae with Mytilaster lineatus, existing in a two-tier biotope – of a soft-bottom and of a Chara algaes developing on it. The epiphyton macrofauna quantitatively dominated the benthic macroinfauna. A total of 102 species and 7 superspecies taxa of the macrozoobenthos were registered in the identified biocoenosis. That increases the overall level of the macrozoobenthos representation up to 171 species and 9 superspecies taxa in Donuzlav for the period since 1981. In meiobenthos 11 taxa in the rank of type were recorded. The abundance and biomass of the macrozoobenthos averaged 34.658±1.655 ind./m2 and 316±93 g/m2 respectively, that is comparable with the previous studies. The average abundance of meiobenthos in the bottom biotope reached 247.2×103 ind./m2. Nematodes were the dominant group in meiobenthos, followed by harpacticids, with a combined share of 81 % in total meiobenthos abundance. The local impact of the discharging finely dispersed soil fractions to the benthic fauna of the southern part of the Donuzlav Lake was revealed. There was a 12, 3.5 and 2-fold decrease in abundance, biomass and number of macrozoobenthos species respectively and a 3.2-fold decrease in meiobenthos abundance, in the discharging area compared to the neighboring water areas of the Lake.
ВВЕДЕНИЕ
Озеро Донузлав является одним из уголков, на карте Крыма, приковывающих к себе внимание с точки зрения уникальности своих размеров (самое большое озеро в Крыму) и широтой пока не в полной мере реализованных перспектив использования в социально-экономической инфраструктуре региона. Существующий в настоящее время морской тип экосистемы озера имеет относительно недавнее «рукотворное» происхождение. До 1961 года оно входило в Тарханкутскую группу минеральных озёр Крыма (Курнаков и др., 1936). После прорытия в 1961 году судоходного канала, соединяющего озеро с морем, шириной 400 м и средней глубиной 12 м, уже к 1971 году произошло снижение ранее существовавшей озёрной солёности 90–95 ‰ до нормальной черноморской 17,9–18,2 ‰ (Зуев, Болтачев, 1999; Еремеев, Болтачев, 2005; Жугайло и др., 2018). В верховье озера наблюдается некоторое распреснение из-за подпитки речными стоками и подземными выходами пресных вод (Иванютин, 2019). В 1960–1980-е годы основное использование фактически образовавшегося «залива» (в дальнейшем мы будем использовать устоявшееся географическое название озеро Донузлав) на разных участках акватории складывалось: в нижней части – из промышленной добычи песка и начавшей формироваться для его обеспечения инфраструктуре Евпаторийского торгового порта (Зуев, Болтачев, 1999, Иванютин, 2019), в средней части – функционирования военно-морской базы (1976–2014 гг.), в средней части и верховье – развития марикультурной, природоохранной и рекреационной тематик (Еремеев, Болтачев, 2005, Золотницкий и др. 2008). С 1947 года вершинный северо-восточный участок озера Донузлав был объявлен памятником природы, с 1980 года – это ландшафтный заказник местного значения (Ена и др., 2013), а с 2015 года – ландшафтно-рекреационный парк регионального значения Республики Крым «Донузлав».
Во второй половине 1990-х годов, в связи с отказом от строительства перегрузочного терминала, антропогенный пресс в озере несколько снизился (Золотницкий и др., 2008). Среди основных факторов, негативно влияющих на состояние его экосистемы, стала рассматриваться промышленная добыча строительного песка, ведущаяся с 1963 года на юго-восточном, а с 2000 года – на северо-западном месторождениях (Себах и др., 2006). До 2014 года основными добывающими организациями со своими зонами ответственности и суммарной производительностью от несколько сот тыс. до млн. т в год (Еремеев, Болтачев, 2005), были Евпаторийский морской торговый порт, ЗАО «Южная Инвестиционная Компания», ООО «СэндИнтерМарин» и Строительное управление Черноморского флота России с суммарным плановым на 2006 год объёмом добычи строительного песка около 950 тыс. тонн (Себах и др., 2006). С 2016 года добычу песка с перспективой изъятия до 150 тыс. тонн в год ведёт только ООО «Яхтстройсервис» (водный участок площадью 88,5 гектара, прилегающий к Южной косе).
Параллельно с этим, всё более активно стали вырисовываться перспективы использования акватории Донузлава как центра рыбоводства, марикультуры, рекреации и экотуризма (Самышев и др., 2001; Еремеев, Болтачев, 2005). Уже в начале 2000-х годов специалистами ЮгНИРО и ИнБЮМ было отмечено восстановление популяции черноморской устрицы в средней части лимана (Болтачева и др., 2003; Золотницкий и др., 2008), к 2005 году в Донузлаве были официально зарегистрированы 4 мидийно-устричных хозяйства (Еремеев, Болтачев, 2005). В береговой зоне происходило строительство коттеджей, пансионатов.
Информация о состоянии донной макрофауны озера Донузлав датируется тремя бентосными съёмками 23–40 летней давности (1981, 1990 и 1997 гг.) (Михайлова, 1992; Чухчин, 1992; Болтачёва и др., 2002) и одной недавней, выполненной в 2017 году (Алёмов и др., 2020). При столь ограниченной общей интенсивности исследований бентоса озера, явной оказывается и пространственная неравномерность распределения исследовательских усилий. Большая часть из 144 бентосных станций, выполненных в 1981 году, приходилась на южный участок озера (включающий зоны добычи песка), на средний и верхний – соответственно только 5 и 4 (Чухчин, 1992). В 1990 году бентосные исследования включали 22 станции, относительно равномерно охватившие по длине всю акваторию озера; в его южной части было выполнено только 6 станций (две по фарватеру и 4 – на северо-западном участке побережья) (Михайлова, 1992). В 1997 году выполнено 29 станций в его нижней части (северо-западный и юго-восточный участки) (Болтачёва и др., 2003) и в 2017 году – всего 4 (все – на северо-западном участке приустьевой зоны озера) (Алёмов и др., 2020). Таким образом оказывается, что относительное детальное исследование макрозообентоса нижней юго-восточной части Донузлава проводилось более двадцати лет назад.
Информация по мейобентосу озера ограничена всего двумя работами, из которых одна, наиболее подробная, датируется периодом почти 30-летней давности (Сергеева, 1997), а вторая (Алёмов и др., 2020) основана на материалах четырёх прибрежных бентосных станций северо-западного участка озера.
Целью настоящей работы была оценка состояния донной фауны озера Донузлав на его южном приустьевом участке, включающем зону современной промышленной добычи песка.
МАТЕРИАЛ И МЕТОДЫ
Полевая часть работ. Бентосный материал собран в июле (станции 1–5) и октябре (станции 7–11) 2019 года на южном участке озера Донузлав по сетке станций, представленных на схеме (рис. 1). При планировании работ нами учитывались результаты, полученные ранее (май 2019 г.), согласно которым в юго-восточной части озера был зафиксирован абсолютный максимум концентрации общего взвешенного вещества, связанный с разрушением дна в ходе
Рис. 1. Спутниковые фотографии озера Донузлав (Yandex map)
1–11 – станции отбора бентосных проб. Ф – оголовок сброса илистых фракций грунта, О – облако взвеси.
добычи песка и сбросом возвратных вод, содержащих значительное количество взвеси (Ломакин и др., 2021). Глубины в точках отбора проб составляли 2–3 м. Положение оголовка сброса взвеси в период исследования бентоса соответствовало представленному на спутниковом снимке (см. рис. 1).
Поверхностный грунт на выполненных станциях представлен рыхлым илом с зарослями харовых водорослей. Проективное покрытие дна водорослями на всех станциях, кроме первой (где были отмечены редкие невысокие талломы водорослей, запорошенные илом), составляло 95–100 %. В пробах грунта, взятых на станциях 1–3, 5, 8, 11, где высота слоя рыхлого ила превышала 5 см, отмечен стойкий запах сероводорода.
В работе использовано разделение зообентоса на две размерные группы: макро- (организмы крупнее 1 мм) и мейобентос (менее 1 мм). Отбор проб макро- и мейобентоса выполнен в двух повторностях. Макрозообентос отбирали ручным водолазным дночерпателем (площадь захвата S=0,04 м2; вшитый в него мешок из мельничного газа имел диаметр ячеи фильтрации 0,5 мм), мейобентос – с помощью мейобентосных трубок (S=18 см2). Дночерпательная проба макробентоса включала собственно грунт и расположенный над ним ярус макрофитов. Её промывку вели через сито с ячеёй фильтрации 0,5 мм с последующей фиксацией промытого материала в 4 % нейтрализованном формалине. Пробы мейобентоса фиксировали в 75 % спирте.
Работа в лаборатории. Мейобентосные пробы промывали через мельничный газ диаметром 64 µм. Разборку и идентификацию макро- и мейобентоса проводили под бинокуляром с использованием определителей (Определитель фауны, 1968, 1969, 1972). Названия всех таксонов приведены в соответствие с современной редакцией WoRMS Editorial Board (2021). Определение сырой массы (W) организмов выполнено на электронных весах AD200 с точностью до 0,001 г. Взвешивание двустворчатых моллюсков проводили после удаления мантийной жидкости.
В наших сборах некоторые представители Gromiida превышали линейные размеры мейобентоса, принятые при классификации бентосных группировок (Mare, 1942). Их мы рассматривали в составе макро- и мейобентоса.
Статистическая обработка данных. При описании количественного развития макрозообентоса использованы параметры численности, сырой биомассы и индекса функционального обилия видов в выражении:
ИФО = Ni0,25 Bi0,75, где Ni – численность (экз./м2); Bi – сырая биомасса (г/м2) вида i.
Оценка структурной (биоценотической) организации бентоса выполнена на основе алгоритмов многомерной статистики в пакете PRIMER (MDS, SIMPER анализы) (Clarke, 1993; Clarke, Gorley, 2001). В матрице данных по макрозообентосу использованы таксоны видового ранга, по мейобентосу – крупные таксономические единицы надвидового уровня. В пробах по макрозообентосу представители ряда таксонов высокого ранга (Nemertea, Porifera, Oligoсhaeta, Xenacoelomorpha, Turbellaria, Gromiida) до вида не идетифицированы и в статистических расчётах приняты как моновидовые. При биоценотической ординации (MDS анализ) использована presence/absence трансформация численности таксонов. Мерой сходства станций являлся коэффициент сходства Брея-Куртиса. Определение лидирующих таксонов в биоценотических комплексах макрозоо- и мейобентоса (SIMPER анализ) выполнено на основе оценки их вклада во внутрикомплексное сходство по нетрансформированным значениям численности. Расчёт индексов видового богатства (Margalef species richness) и выровненности (Pielou’s evenness) видов макрозообентоса выполнен в программе DIVERSE пакета PRIMER.
Основным элементом ландшафта дна на исследованных илисто-песчаных участках акватории озера являлись обширные заросли макрофитов, среди которых преобладали водоросли порядка Charales, с проективным покрытием до 100 %. С точки зрения структурной организации биоценоза, формирующегося непосредственно в биотопе рыхлых грунтов, харовые водоросли, наряду с зооэпи- и инфауной, являются его флористической составляющей. Однако, сами водоросли также являются местообитанием организмов сессильной и вагильной фауны зарослевых сообществ. Подобная ярусность местообитаний, определяющая развитие специфической фауны, даёт основание к выделению первичного (собственно дно) и вторичного (зарослевого) биотопов, которые в данной работе мы анализируем суммарно.
Характеристика метода добычи песка. В настоящее время технология процесса добычи песка, используемая ООО «Яхтстройсервис», характеризуется несколькими особенностями. Так, горный отвод находится в прибрежной зоне с глубинами, не превышающими двух метров. Добыча песка предусматривает использование земснаряда для подводного разрыхления и всасывания песка и воды в соотношении 1:8, последующую доставку (рефулирование) пульпы по трубам на берег, укладку пород на карту намыва и обратный возврат воды с мелкодисперсной взвесью в район добычи песка. Данная технология добычи песка в озере была применена впервые и позиционировалась как более экологичная. Добыча песка в карьере проводится в весенне-летний период.
РЕЗУЛЬТАТЫ
Таксономическое богатство и количественное развитие макробентоса. Суммарно на всех станциях полигона, включая результаты качественных сборов (береговой участок в районе ст. 11) и дополнения по видовой диагностики полихет из мейобентосной пробы (ст. 7), обнаружено 102 вида макрозообентоса, принадлежащих к типу Mollusca (Bivalvia – 16, Gastropoda – 12, Polyplacophora – 1 вид), Arthropoda (24 вида, в том числе класс Malacostraca – 22), Polychaeta (35), Ascidiacea (2), Bryozoa (2), Cnidaria (5), Echinodermata (2), Chaetognata (1) и Insecta (larvae) (1) (табл. 1).
Таблица 1
Таксономический состав макрозообентоса озера Донузлав (1981–2019 гг.)
|
CERCOZOA (GROMIIDA) g. sp. |
|
|
**XENACOELOMORPHA g. sp. |
|
|
CNIDARIA |
|
| **Actinia equina (Linnaeus,1758) | **Orthopyxis integra (MacGillivray, 1842) |
| Cylista undata (Müller, 1778) | **Sarsia tubulosa (M. Sars, 1835) |
| Hydroidea g. sp. | |
|
*Platyhelminthes g. sp |
OLIGOCHAETA g. sp. |
|
ANNELIDA (Polychaeta) |
|
| Alitta succinea (Leuckart, 1847) | **Microphthalmus fragilis Bobretzky, 1870 |
| Amphitritides gracilis (Grube, 1860) | Microspio mecznikowianus (Claparède, 1869) |
| *Capitella capitata (Fabricius, 1780) | *Mysta picta (Quatrefages, 1865) |
| **Chaetozone caputesocis (Saint-Joseph, 1894) | **Neodexiospira pseudocorrugata (Bush, 1905) |
| **Cirriformia tentaculata (Montagu, 1808) | Nephtys cirrosa Ehlers, 1868 |
| Euclymene collaris (Claparède, 1869) | *Nephtys hombergii Savigny in Lamarck, 1818 |
| *Eulalia viridis (Linnaeus, 1767) | Nereiphylla pusilla (Claparède, 1870) |
| **Eunice vittata (Delle Chiaje, 1828) | *Nereis zonata Malmgren, 1867 |
| *Exogone naidina Örsted, 1845 | *Nudisyllis pulligera (Krohn, 1852) |
| **Fabricia stellaris (Müller, 1774) | Perinereis cultrifera (Grube, 1840) |
| Ficopomatus enigmaticus (Fauvel, 1923) | *Pholoe inornata Johnston, 1839 |
| *Genetyllis tuberculata (Bobretzky, 1868) | Phyllodoce maculata (Linnaeus, 1767) |
| *Glycera alba (O.F. Müller, 1776) | Phyllodoce mucosa Örsted, 1843 |
| *Glycera tridactyla Schmarda, 1861 | *Pileolaria militaris Claparède, 1870 |
| Goniadella bobrezkii (Annenkova, 1929) | *Platynereis dumerilii (Audouin et Milne–Edwards, 1834) |
| Harmothoe extenuata (Grube, 1840) | Polydora cornuta Bosc, 1802 |
| *Harmothoe imbricata (Linnaeus, 1767) | *Prionospio cirrifera Wirén, 1883 |
| Harmothoe reticulata (Claparède, 1870) | Prionospio malmgreni Claparède, 1869 |
| *Hediste diversicolor (O.F. Müller, 1776) | *Protodorvillea kefersteini (McIntosh, 1869) |
| *Heteromastus filiformis (Claparède, 1864) | **Pterocirrus macroceros (Grube, 1860) |
| **Hydroides dianthus (Verrill, 1873) | Pygospio elegans Claparède, 1863 |
| *Janua heterostropha (Montagu, 1803) | *Salvatoria clavata (Claparède, 1863) |
| *Lagis neapolitana (Claparède, 1869) | Salvatoria limbata (Claparède, 1868) |
| Laonice cirrata (M. Sars, 1851) | *Schistomeringos rudolphi (Delle Chiaje, 1828) |
| Leiochone leiopygos (Grube, 1860) | Syllides longocirratus (Örsted, 1845) |
| **Lindrilus flavocapitatus (Uljanin, 1877) | *Sphaerosyllis bulbosa Southern, 1914 |
| *Maldanidae g. sp. | Sphaerosyllis hystrix Claparède, 1863 |
| Megadrilus purpureus (Schneider, 1868) | *Spio decorata Bobretzky, 1870 |
| Melinna palmata Grube, 1870 | Spirobranchus triqueter (Linnaeus, 1758) |
| **Micronephthys longicornis (Perejaslavtseva, 1891) | Syllis prolifera Krohn, 1852 |
| *NEMERTEA g. sp. | ENTOPROCTА g. sp. |
|
ARTHROPODA |
|
| **Acari g. sp. | Hippolyte leptocerus (Heller, 1863) |
| *Ampelisca diadema (Costa, 1853) | Idotea balthica (Pallas, 1772) |
| *Amphibalanus improvisus (Darwin, 1854) | Idotea ostroumovi Sowinsky, 1895 |
| *Ampithoe ramondi Audouin, 1826 | Iphinoe maeotica Sowinskyi, 1893 |
| **Ampithoe sp. | Iphinoe elisae Băcescu, 1950 |
| *Apherusa bispinosa (Spence Bate, 1857) | **Iphinoe tenella Sars, 1878 |
| Apseudopsis ostroumovi Bacescu & Carausu, 1947 | Lekanesphaera hookeri (Leach, 1814) |
| **Athanas nitescens (Leach, 1813) | *Microdeutopus gryllotalpa Costa, 1853 |
| Biancolina algicola Della Valle, 1893 | *Microdeutopus sp. |
| Canuella perplexa Scott T. & Scott A., 1893 | *Monocorophium acherusicum (Costa, 1853) |
| *Caprella acanthifera Leach, 1814 | **Nannastacus euxinicus Băcescu, 1951 |
| **Carcinus aestuarii Nardo, 1847 | Nototropis guttatus Costa, 1853 |
| Cardiophilus baeri G.O. Sars, 1896 | **Orchestia gammarellus (Pallas, 1766) |
| *Chondrochelia savignyi (Kroyer, 1842) | **Pachygrapsus marmoratus (Fabricius, 1787) |
| Clibanarius erythropus (Latreille, 1818) | **Paramysis (Longidentia) kroyeri (Czerniavsky, 1882) |
| Crassicorophium bonellii (H. Milne Edwards, 1830) | Palaemon adspersus Rathke, 1836 |
| *Cumella (Cumella) limicola Sars, 1879 | Perioculodes longimanus (Spence Bate & Westwood, 1868) |
| *Dexamine spinosa (Montagu, 1813) | Plumulojassa ocia (Spence Bate, 1862) |
| Diogenes pugilator (P. Roux, 1829) | Sphaeroma serratum (J. C. Fabricius, 1787) |
| Diamysis bahirensis (G.O. Sars, 1877) | *Stenosoma capito (Rathke, 1837) |
| **Echinogammarus foxi (Schellenberg, 1928) | Stenothoe monoculoides (Montagu, 1813) |
| *Ericthonius difformis H. Milne Edwards, 1830 | **Ostracoda g. sp. |
| Eurydice spinigera Hansen, 1890 | *Xantho poressa (Olivi, 1792) |
| *Gammarus insensibilis Stock, 1966 | Upogebia pusilla (Petagna, 1792) |
| Hyale pontica Rathke, 1836 | *Chironomus salinarius (Kieffer, 1921) |
|
MOLLUSCA |
|
| **Acanthochitona fascicularis (Linnaeus, 1767) | *Parvicardium exiguum (Gmelin, 1791) |
| Abra alba (W. Wood, 1802) | *Pitar rudis (Poli, 1795) |
| Abra nitida (O. F. Müller, 1776) | *Polititapes aureus (Gmelin, 1791) |
| *Abra segmentum (Récluz, 1843) | *Bittium reticulatum (da Costa, 1778) |
| Barnea candida (Linnaeus, 1758) | Brachystomia eulimoides (Hanley, 1844) |
| *Cerastoderma glaucum (Bruguière, 1789) | Cerithiopsis tubercularis (Montagu, 1803) |
| Chamelea gallina (Linnaeus, 1758) | *Cytharella costulata (Dunker, 1860) |
| **Crassostrea gigas (Thunberg, 1793) | *Hydrobia acuta (Draparnaud, 1805) |
| Donacilla cornea (Poli, 1791) | Mangelia costata (Pennant, 1777) |
| Fabulina fabula (Gmelin, 1791) | Monophorus perversus (Linnaeus, 1758) |
| *Flexopecten glaber (Linnaeus, 1758) | Parthenina terebellum (Philippi, 1844) |
| *Gastrana fragilis (Linnaeus, 1758) | *Rapana venosa (Valenciennes, 1846) |
| *Gouldia minima (Montagu, 1803) | *Retusa truncatula (Bruguière, 1792) |
| Irus irus (Linnaeus, 1758) | **Retusa umbilicata (Montagu, 1803) |
| *Kurtiella bidentata (Montagu, 1803) | *Rissoa membranacea (J. Adams, 1800) |
| Lentidium mediterraneum (O.G. Costa, 1830) | *R. parva (da Costa, 1778) |
| *Loripes orbiculatus Poli, 1795 | *R. splendida Eichwald, 1830 |
| Lucinella divaricata (Linnaeus, 1758) | Setia valvatoides (Milaschewitsch, 1909) |
| Macomangulus tenuis (da Costa, 1778) | Tritia neritea (Linnaeus, 1758) |
| *Modiolus adriaticus Lamarck, 1819 | *T. pellucida (Risso, 1826) |
| *Modiolula phaseolina (Philippi, 1844) | *T. reticulata (Linnaeus, 1758) |
|
Moerella donacina (Linnaeus, 1758) |
*Tricolia pullus (Linnaeus, 1758) |
| *Mytilaster lineatus (Gmelin, 1791) | Turbonilla acuta (Donovan, 1804) |
| *Mytilus galloprovincialis Lamarck, 1819 | Nudibranchia g. sp. |
| *Ostrea edulis Linnaeus, 1758 | |
|
CHAETOGNATHA |
PHORONIDA |
| **Spadella cephaloptera (Busch, 1851) | *Phoronis psammophila Cori, 1889 |
|
ECHINODERMATA |
BRYOZOA |
| **Leptosynapta inhaerens (O.Muller, 1776) | * Cryptosula pallasiana (Moll, 1803) |
| **Stereoderma kirschbergii (Heller, 1868) Panning, 1949 | **Ctenostomatida g. sp. |
|
CHORDATA (Ascidiacea) |
|
| Ascidiella aspersa (Müller, 1776) | Ctenicella appendiculata (Heller, 1877) |
| *Botryllus schlosseri (Pallas, 1766) | **Molgula euprocta (Drasche, 1884) |
Примечание к таблице. * – таксоны, обнаруженные в 2019 году, ** – таксоны, впервые обнаруженные в озере в 2019 году.
На всем полигоне, кроме станции 1, обнаружены несколько видов харовых водорослей (пор. Charales) с преобладанием Lamprothamnium papulosum (K.Wallroth) J.Groves, 1916. На станциях с 7 по 11 возрастал процент покрытия дна водорослями и высота покрова. У северного побережья озера на станциях 10 и 11 наблюдали сомкнутые заросли харовых (100 % покрытия), причём высота талломов водорослей достигала 1 м. На станциях, удалённых от оголовка сброса, биомасса водорослей составляла 1087–42423 г/м2 и была близка к максимальным для Чёрного моря значениям биомассы макрофитов в ассоциации харовых водорослей – 18500 г/м2 (Королесова, 2015).
По результатам исследований, выполненных в 2019 году, последняя сводка состава макрофауны свободноживущих беспозвоночных озера Донузлав (Болтачева и др., 2002), может быть дополнена по классу Polychaeta – 10 видами, по классу Malacostraca – 10 видами, тремя видами по типу Mollusca, двумя видами из класса Hydrozoa и типов Echinodermata и Bryozoa и по одному виду из классов Ascidiacea, Anthozoa и типа Chaetognata. Кроме этого, отмечены не идентифицированные нами до вида представители типов Xenacoelomorpha и Cercozoa (отряд Gromiida).
Отмечены виды – недавние вселенцы в Чёрное море – полихеты P. cornuta, H. dianthus, моллюски R. venoza, C. gigas и виды, занесённые в красные книги Крыма и Севастополя – двустворчатые моллюски F. glaber, G. fragilis и O. edulis.
С учётом всех ранее выполненных исследований, к настоящему времени в акватории озера Донузлав известно обитание 171 вида и 9 малоисследованных надвидовых таксонов донной макрофауны (табл. 2).
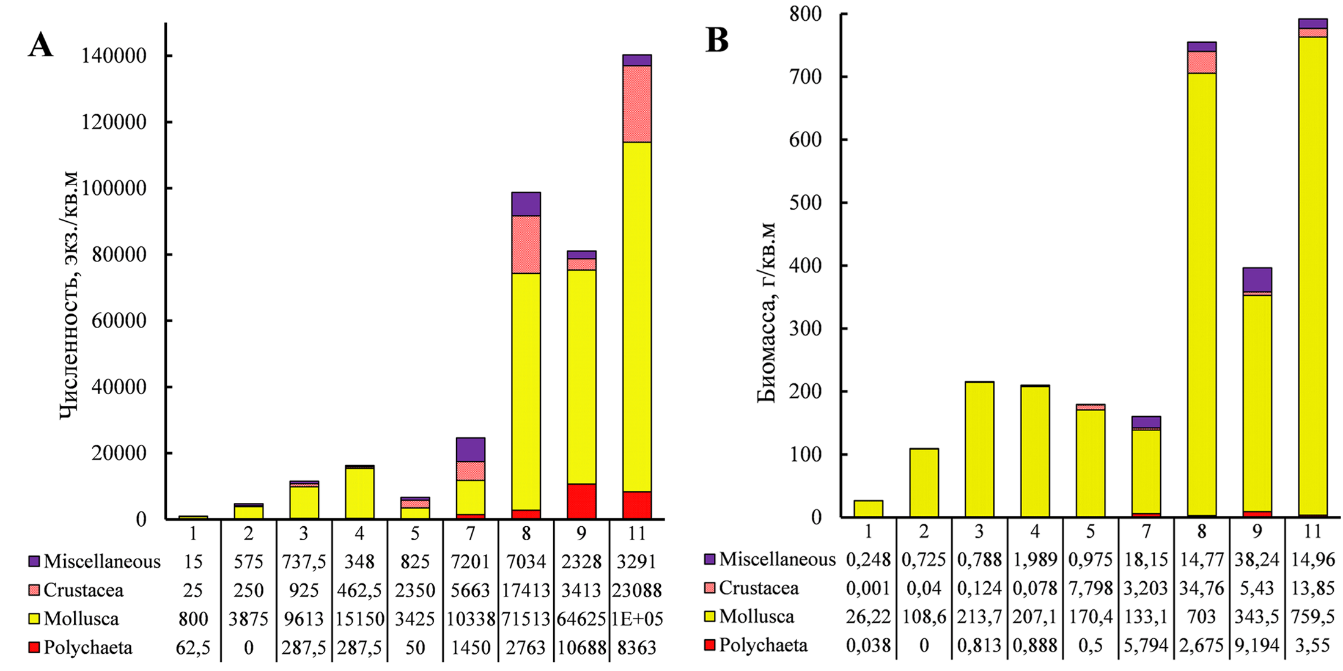
Численность макрозообентоса на отдельных станциях полигона варьировала в пределах 903–140291 экз./м2 и в среднем составляла 34658±16565 экз./м2 (Mean ± St.Err) Аналогичные параметры биомассы составляли соответственно 27–792 г/м2 и 316±93 г/м2 (табл. 3)
Среди крупных таксонов наиболее многочисленны моллюски (рис. 2). Их численная и весовая доли на полигоне варьировали в пределах, соответственно, 42–93 % и 83–99 %, в среднем составляя 74 и 94 %.
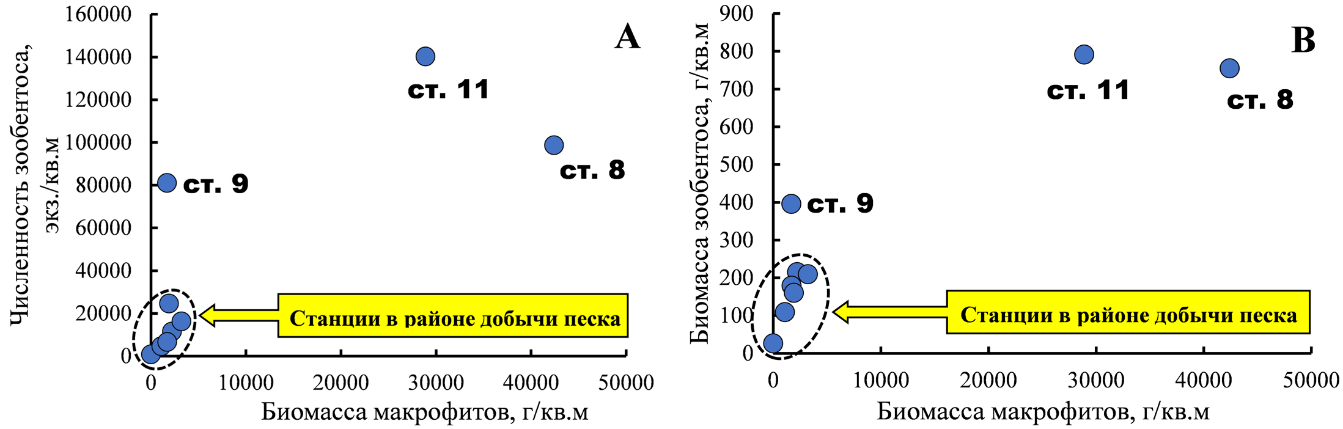
С увеличением станционной биомассы водорослей возрастали численность и биомасса беспозвоночных (рис. 3). Зарослевый биотоп харовых водорослей оказался благоприятным местом для развития фитофильных форм ракообразных – Ch. savignyi, C. acantifera и M. gryllotalpa, моллюсков рода Rissoa, а также молоди Mytilidae, в особенности M. lineatus и полихет сем. Nereididae. Основу же биомассы зооперифитона харовых формировали митилястер и риссои.
Пять видов макрозообентоса встречены на всех девяти выполненных станциях. Это моллюски B. reticulatum, R. membranacea, R. parva, M. lineatus и рак Ch. savignyi.
Таксономическое богатство и количественное развитие мейобентоса. Мейобентос рыхлых грунтов представлен 11 таксономическими типами животных: Arthropoda (включая Acari, Ostracoda, Harpacticoida, Insecta (семейство Chironomidae), Amphipoda и науплии Decapoda, Cirripedia), Mollusca (классы Bivalvia, Gastropoda), Annelida (класс Polychaeta и Oligochaeta), Nematoda, Cnidaria (класс Hydrozoa), Foraminifera (мягкораковинные и твёрдораковинные), Cercozoa (отряд Gromiida), Kinorhyncha, Platyhelminthes, Ciliophora, Rotifera. На отдельных станциях встречено от 7 до 10 типов животных.
Таблица 2
Состав макрофауны свободноживущих беспозвоночных озера Донузлав
|
Группа |
Число видов |
||||
|
11981 |
21990 |
31997 |
2019 наши данные |
5всего |
|
|
Mollusca |
23 |
25 |
34 |
29 |
47 |
| Bivalvia |
14 |
17 |
16 |
16* |
26 |
| Gastropoda |
9 |
8 |
17 |
12 |
20 |
| Polyplacophora |
– |
– |
– |
1 |
1 |
| Nudibranchia |
– |
– |
+ |
– |
+ |
|
Polychaeta |
+ |
20 |
36 |
36** |
61 |
|
Oligochaeta |
– |
– |
+ |
+ |
+ |
|
Xenacoelomorpha |
+ |
+ |
|||
|
Crustacea |
3 |
15 |
28 |
26* |
48 |
|
Acari |
– |
– |
– |
+ |
+ |
|
Phoronida |
– |
1 |
1 |
– |
1 |
|
Insecta (larvae) |
– |
– |
1 |
1 |
1 |
|
Porifera |
+ |
– |
+ |
+ |
+ |
|
Anthozoa |
– |
1 |
+ |
1 |
2 |
|
Hydrozoa |
2 |
2 |
|||
|
Platyhelminthes |
+ |
– |
+ |
+ |
+ |
|
Nemertea |
– |
– |
+ |
+ |
+ |
|
Bryozoa |
– |
– |
+ |
2 |
2 |
|
Ascidiacea |
1 |
2 |
2 |
4 |
|
|
Echinodermata |
2 |
2 |
|||
|
Chaetognatha |
1 |
1 |
|||
|
Cercozoa |
+ |
+ |
|||
|
Entoprocta |
+ |
||||
|
4ВСЕГО |
27 (30) |
64 |
100 (107) |
102 (109) |
171 (180) |
Примечание к таблице. 1 – из Чухчин, 1992; 2 – из Михайлова, 1992 с дополнениями из Сергеева, 1997; 3 – из Болтачева и др., 2002; 4 – в скобках указано количество с учётом надвидовых таксонов, условно принятых за моновидовые; 5 – с учётом данных из Алёмов и др., 2020; «–» – данные отсутствуют; «+» – до вида не идентифицированы; * – с учётом качественных проб, ** – с учётом мейобентосных проб.
Таблица 3
Основные характеристики развития макробентоса на станциях
|
Станция |
Кол—во видов |
Численность зообентоса, экз./м2 |
Биомасса зообентоса, г/м2 |
Биомасса макрофитов, г/м2 |
Биотические индексы |
|
|
d |
J’ |
|||||
|
1 |
15 |
903 |
27 |
– |
2,470 |
0,813 |
|
2 |
13 |
4700 |
109 |
1087 |
1,625 |
0,676 |
|
3 |
25 |
11563 |
215 |
2218 |
2,685 |
0,518 |
|
4 |
26 |
16248 |
210 |
3221 |
2,803 |
0,440 |
|
5 |
17 |
6650 |
180 |
1707 |
2,001 |
0,790 |
|
7 |
40 |
24651 |
160 |
1914 |
4,154 |
0,580 |
|
8 |
33 |
98721 |
755 |
42423 |
3,151 |
0,340 |
|
9 |
53 |
8191 |
396 |
1693 |
6,912 |
0,326 |
|
11 |
38 |
140291 |
792 |
28903 |
4,119 |
0,341 |
Примечание к таблице. Представлены биотические индексы (d – видового богатства Маргалефа, J‘ – выровненности Пиелоу) на основе численности.
Численность мейобентоса варьировала в пределах 68,4×103 – 815,6×103 экз./м2 (в среднем 247,2×103 экз./м2) и была максимальна на станциях 4 и 9. Наиболее многочисленны нематоды, составившие от 37 до 87 % (в среднем по полигону – 69 %) общей численности мейобентоса (табл. 4). Следующими наиболее многочисленными таксонами – более 10000 экз./м2 – являлись представители Arthropoda, Mollusca и Ciliophora. Наименее представлены Cnidaria, Kinorhyncha и Rotifera, отмеченные лишь на одной-двух станциях со средней численностью по полигону – до 100 экз./м2.
Рис. 2. Численность (A) и биомасса (B) основных групп зообентоса на станциях (№ 1–11) полигона
Рис. 3. Зависимость численности (А) и биомассы (В) макрозообентоса от биомассы макрофитов
Таблица 4
Численность основных таксонов мейобентоса в ранге типов по станциям
|
Таксон |
Станция |
||||||||
|
1 |
2 |
3 |
4 |
5 |
7 |
8 |
9 |
11 |
|
| Arthropoda |
5520 |
11868 |
7176 |
36708 |
5796 |
63204 |
26772 |
134136 |
21528 |
| Mollusca |
828 |
276 |
828 |
1932 |
1104 |
552 |
10764 |
120888 |
2484 |
| Annelida |
552 |
5520 |
1932 |
8832 |
4692 |
1656 |
1104 |
28428 |
1932 |
| Nematoda |
81144 |
40296 |
104604 |
441876 |
106536 |
195132 |
25392 |
502044 |
45264 |
| Cnidaria |
276 |
0 |
0 |
0 |
0 |
0 |
0 |
552 |
0 |
| Foraminifera |
5796 |
1104 |
2208 |
5796 |
828 |
2760 |
2484 |
11868 |
4416 |
| Gromiida |
1380 |
0 |
276 |
552 |
0 |
276 |
0 |
3864 |
0 |
| Kinorhyncha |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
828 |
0 |
| Platyhelminthes |
1932 |
3036 |
1380 |
4968 |
1380 |
6348 |
1656 |
10212 |
828 |
| Ciliophora |
1932 |
6072 |
1932 |
28428 |
37812 |
9384 |
276 |
1656 |
7176 |
| Rotifera |
0 |
0 |
0 |
0 |
0 |
0 |
276 |
0 |
0 |
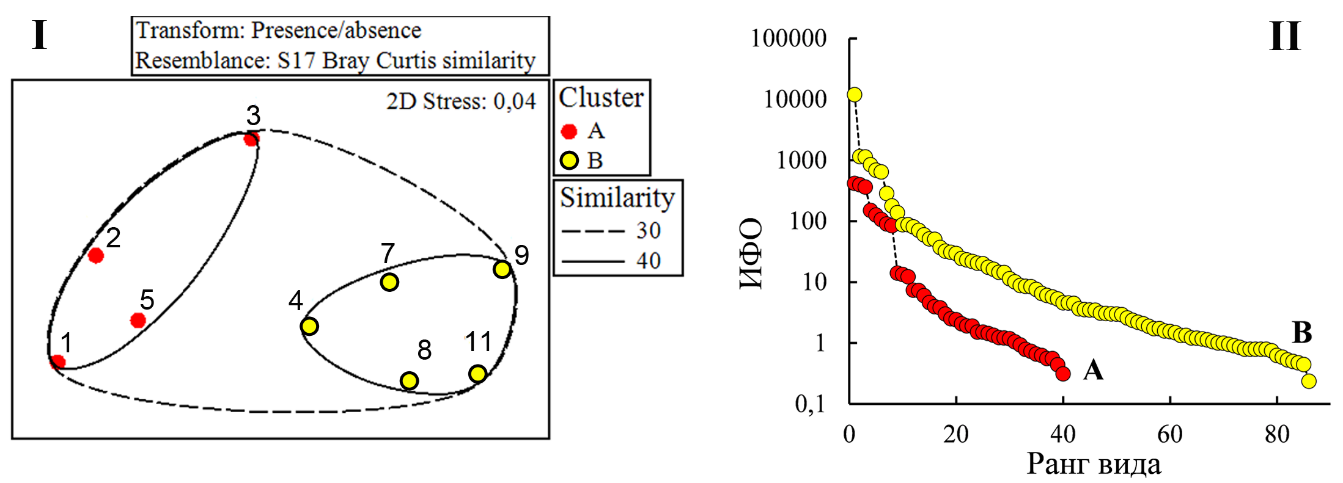
Биоценотическая ординация бентоса. Макробентос. Результаты ординационного анализа указывают на присутствие на исследованном полигоне относительно однородной (в биоценотическом плане) донной макрофауны с коэффициентом межстанционного сходства более 30 % (рис. 4 I). Среди 10-ти наиболее значимых видов первые шесть – обитатели зарослевого сообщества (развиваются на талломах харовых водорослей), оставшиеся четыре – представители фауны рыхлых грунтов (табл. 5). Превалирование развития первых позволило классифицировать донный биоценоз, как биоценоз хары с митилястером.
Рис. 4. Ординация станций макрозообентоса (I) и ранговое распределение видов макрозообентоса (II) в комплексах станций А и В, выделенных по результатам ординационного анализа
Таблица 5
Основные виды макрозообентоса на полигоне в целом по их вкладу в межстанционное сходство, рассчитанному на основе ИФО
|
Вид |
ИФО |
i |
i/SD(i) |
i % |
Cum, i % |
| Mytilaster lineatus |
6821 |
11,28 |
0,68 |
41,83 |
41,83 |
| Bittium reticulatum |
826 |
6,55 |
1,20 |
24,30 |
66,12 |
| Rissoa parva |
696 |
2,93 |
1,12 |
10,88 |
77,01 |
| Rissoa membranacea |
438 |
1,94 |
0,94 |
7,19 |
84,20 |
| Chironomidae lar. |
398 |
1,14 |
0,59 |
4,22 |
88,41 |
| Chondrochelia savignyi |
506 |
0,95 |
0,70 |
3,51 |
91,93 |
| Loripes orbiculatus |
173 |
0,85 |
0,37 |
3,15 |
95,08 |
| Abra segmentum |
52 |
0,40 |
0,24 |
1,49 |
96,57 |
| Parvicardium exiguum |
51 |
0,22 |
0,58 |
0,82 |
97,38 |
| Platynereis dumerilii |
78 |
0,11 |
0,61 |
0,42 |
97,81 |
Примечание к таблице. ИФО – среднее значение индекса функционального обилия; i – абсолютный и i % – относительный вклады вида «i» в среднее сходство Брэя–Куртиса внутри биоценоза; SD – стандартное отклонение.
На уровне 40 % сходства все станции полигона подразделены на два основных комплекса (А и В). Станции комплекса А формируют ближнее окружение точки сброса (ст. 1, 2, 5 – на север, вдоль восточного побережья, ст. 3 – на запад, вдоль южной косы). В комплекс В вошли станции, как наиболее удалённые от точки сброса (ст. 8, 9, 11), так и располагающиеся ближе к фарватеру (ст. 4, 7) – вне основной зоны вдольберегового переноса мутьевых потоков от точки сброса (см. рис. 1).
Ядрами комплексов А и В, как и в выделенном биоценозе хары с митилястером, продолжают оставаться фитофильные формы (табл. 6). Однако, в комплексе А, наиболее подверженном фактору сброса мелкодисперсной фракции грунта, комплексообразующее лидерство переходит к B. reticulatum, что определяет данный вид как более устойчивый к заилению, чем фильтратор-сестонофаг M. lineatus.
По всем параметрам количественного развития макрозообентоса отмечено превосходство биоценотического комплекса В над А: по количеству регистрируемых видов – в 2 раза, по численности – в 12 раз, по биомассе – в 3,5 раз и по интегральному параметру количественного развития на основе ИФО – в 9,8 раз (табл. 7). Наиболее высокая выровненность (J‘=0,7±0,07) ранжированного ряда видов макрозообентоса по ИФО, как и меньшие значения индекса видового богатства Маргалефа (d=2,2±0,24) отмечена в зоне комплекса A (рис. 4 II). В комплексе B показатель выровненности ниже, а индекс видового богатства выше (J‘=0,4±0,05; d=4,2±0,72).
Таблица 6
Основные виды макрозообентоса донных комплексов по их вкладу в межстанционное сходство, рассчитанному на основе ИФО
|
Вид |
ИФО |
i |
i/SD(i) |
i % |
Cum, i % |
|
Комплекс A. Среднее сходство: 28,43 |
|||||
| Bittium reticulatum |
418 |
9,68 |
1,32 |
34,05 |
34,05 |
| Rissoa parva |
151 |
4,33 |
1,01 |
15,24 |
49,29 |
| Loripes lacteus |
363 |
3,93 |
0,86 |
13,82 |
63,10 |
| Rissoa membranacea |
126 |
2,42 |
2,32 |
8,52 |
71,62 |
| Chironomidae lar. |
90 |
2,34 |
0,86 |
8,25 |
79,86 |
| Mytilaster lineatus |
396 |
2,07 |
0,50 |
7,28 |
87,15 |
| Abra segmentum |
106 |
1,96 |
0,50 |
6,91 |
94,06 |
|
Комплекс B. Среднее сходство: 44,64 |
|||||
| Mytilaster lineatus |
11961 |
28,85 |
1,38 |
64,62 |
64,62 |
| Bittium reticulatum |
1153 |
5,93 |
2,14 |
13,29 |
77,91 |
| Rissoa parva |
1132 |
3,42 |
1,93 |
7,67 |
85,58 |
| Rissoa membranacea |
688 |
1,97 |
1,67 |
4,42 |
90,00 |
| Chondrochelia savignyi |
843 |
1,19 |
0,75 |
2,68 |
92,67 |
Примечание к таблице. ИФО – среднее значение индекса функционального обилия; i – абсолютный и i % – относительный вклады вида «i» в среднее сходство Брэя–Куртиса внутри биоценоза; SD – стандартное отклонение.
Таблица 7
Параметры развития макрозообентоса в различных комплексах станций по численности (N, экз./м2), биомассе (B, г/м2) и ИФО
|
Комплекс |
Число видов |
Исследуемый параметр |
Среднее ± станд. ошибка |
|
A |
40 |
N |
5951±2221 |
|
B |
133±42 |
||
|
ИФО |
1837±689 |
||
|
B |
86 |
N |
72218±23255 |
|
B |
463±133 |
||
|
ИФО |
17981±5623 |
Мейобентос. Многомерный анализ структуры фауны полигона с использованием надвидовой таксономической диагностики не дал основания к выделению отдельных фаунистических «мейобентических» комплексов. Фаунистическое сходство всех станций (Bray—Curtis similarity) превышало 87 % (уровень типов) и 76 % (немногим более дробный уровень, обычно используемый при мейобентосных исследованиях общего характера (Сергеева, 1997 и др.)).
Доминирующей группой по численности и по вкладу во внутрикомплексное сходство в мейобентосе полигона являются нематоды, на втором месте – гарпактициды (табл. 8). Их суммарная доля в численности мейобентоса в пределах 71–91 % (в среднем 81 %).
Таблица 8
Основные таксоны мейобентоса по их вкладу в межстанционное сходство, рассчитанному на основе нетрансформированных значений их численности (N, экз./м2)
|
Таксон |
N |
i |
i/SD(i) |
i % |
Cum, i % |
| Nematoda |
171365 |
34,46 |
1,88 |
74,43 |
74,43 |
| Harpacticoida |
30023 |
6,14 |
1,19 |
13,26 |
87,69 |
| Ciliophora |
10519 |
1,85 |
0,85 |
3,99 |
91,68 |
| Turbellaria |
3527 |
0,95 |
1,72 |
2,04 |
93,72 |
| Foraminifera (soft-shelled) |
3496 |
0,91 |
1,03 |
1,96 |
95,68 |
| Foraminifera (hard-shelled) |
644 |
0,18 |
0,86 |
0,39 |
99,01 |
| Polychaeta |
5765 |
0,84 |
1,11 |
1,81 |
97,49 |
| Bivalvia |
14628 |
0,33 |
0,58 |
0,71 |
98,20 |
| Gastropoda |
889 |
0,20 |
1,02 |
0,42 |
98,63 |
| Nauplius Decapoda |
3312 |
0,14 |
0,50 |
0,30 |
99,32 |
| Ostracoda |
736 |
0,12 |
0,86 |
0,26 |
99,58 |
| Oligochaeta |
307 |
0,08 |
0,69 |
0,17 |
99,74 |
| Acari |
491 |
0,06 |
0,44 |
0,12 |
99,87 |
| Gromiida |
705 |
0,04 |
0,50 |
0,08 |
99,95 |
| Chironomidae (larv.) |
123 |
0,01 |
0,25 |
0,03 |
99,98 |
Примечание к таблице. N – среднее значение численности; i – абсолютный и i % – относительный вклады таксона «i» в среднее сходство Брэя–Куртиса внутри комплекса; SD – стандартное отклонение.
Несмотря на отсутствие выраженного фаунистического подразделения мейобентоса, мы отмечаем существенное различие его количественного развития в выделенных для макрозообентоса биоценотических комплексах. Так, при сохранении позиций основных комплексообразующих таксонов (табл. 9) средняя численность мейобентоса в комплексе А (ст. 1–3, 5) оказалась в 3,2 раза ниже, чем в комплексе В (ст. 4, 7–9, 11) (соответственно 111573 vs. 355709 экз./м2). На этом фоне весьма показательно выглядит часто используемый для оценки условий среды обитания гидробионтов нематодно/копеподный (=нематодно/гарпактикоидный) коэффициент (Warwick, 1981; Amjad, Gray, 1983; Lee et al., 2001; Rubal et al., 2009). Его более высокие значения (11,93) на станциях комплекса А в сравнении со станциями комплекса B (4,99), как и более низкие общие показатели развития мейобентоса на станциях комплекса A, могут указывать на менее благоприятные условия для мейофауны в зоне, наиболее подверженной фактору сброса мелкодисперсной фракции грунта.
Таблица 9
Основные таксоны мейобентоса по их вкладу в межстанционное сходство в биоценотических комплексах, выделенных по результатам ординационного анализа макрозообентоса
|
Таксон |
N |
i |
i/SD(i) |
i % |
Cum, i % |
|
Комплекс A. Среднее сходство: 68,31 |
|||||
| Nematoda |
83145 |
56,38 |
3,38 |
82,54 |
82,54 |
| Harpacticoida |
6969 |
5,01 |
5,07 |
7,34 |
89,88 |
| Ciliophora |
11937 |
2,39 |
1,60 |
3,50 |
93,38 |
|
Комплекс B. Среднее сходство: 40,58 |
|||||
| Nematoda |
241942 |
26,12 |
1,34 |
64,37 |
64,37 |
| Harpacticoida |
48466 |
9,68 |
1,43 |
23,85 |
88,22 |
| Ciliophora |
9384 |
1,02 |
0,75 |
2,51 |
90,73 |
Примечание к таблице. N – среднее значение численности; i – абсолютный и i % – относительный вклады таксона «i» в среднее сходство Брэя–Куртиса внутри комплекса; SD – стандартное отклонение. Расчет выполнен по нетрансформированным значениям численности таксонов (N, экз./м2).
ОБСУЖДЕНИЕ
Таксономическое богатство. Макрозообентос. Считается, что процесс понтизации фауны бывшего гиперсолёного озера Донузлав после прорытия в 1961 году канала, соединяющего его с морем, в целом завершился уже к 1997 году (Болтачева и др., 2002). Современный состав донной фауны озера ещё недостаточно полно изучен, но уже можно констатировать, что он не сильно уступает другим исследованным акваториям на северном участке шельфа Чёрного моря. Зарегистрированное в 2019 году количество видовых и надвидовых (не диагностированных до ранга вида) таксонов донной макрофауны в озере Донузлав (109) сопоставимо с таковым в относительно закрытых от интенсивного волнового воздействия акваториях бухт Стрелецкой и Севастопольской (соответственно 86 (Киселева и др., 1997) и 153 (Revkov et al., 2008) видов), открытыми прибрежными зонами ЮЗ Крыма (районы бухты Ласпи – 131 видов (Ревков, Николаенко, 2002), ЮВ Крыма (Карадаг – 101 вид по (Ревков, Николаенко, 200)), Егорлыцким заливом, Днестровско-Дунайским районом и Керченским проливом (соответственно 96, 100 и 111 видов (Black Sea, 1998). Как показывает опыт, интенсификация исследований акваторий приводит к росту регистрации более редких для фауны регионов таксонов бентоса. Более чем вековой период исследований позволил, например, выявить в акватории Севастопольской бухты 358 видов макрозообентоса (Revkov et al., 2008). Аналогичное накопление информации по озеру Донузлав уже привело к регистрации 171 вида и 9 мало исследованных надвидовых таксонов донной макрофауны.
Существует мнение, что условия среды в биотопе харовых водорослей «настолько своеобразны, что только сравнительно небольшая группа животных входит в состав этого биоценоза» (Морозова-Водяницкая, 1959). На самих водорослях у западного побережья Крыма зарегистрировано действительно меньше видов макробентоса (29), чем на других видах макрофитов (Маккавеева, 1979), однако в биоценозе харовых Тендровского залива с учётом фауны рыхлых грунтов обнаружен 41 вид макробентоса (при этом не были определены эррантные полихеты) (Королесова, Черняков, 2012; Королесова, 2015). Обнаружение нами более 102 видов макробентоса при небольшом количестве выполненных сборов свидетельствует об относительно высоком уровне богатства фауны в ассоциации харовых водорослей.
Мейозообентос. Современное таксономическое разнообразие мейобентоса озера находится на уровне его обычной представленности в биотопе рыхлых грунтов у берегов Крыма, где основными группами надвидовой идентификации являются Foraminifera, Nematoda, Oligochaeta, Polychaeta, Turbellaria, Kinorhyncha, Nemertea, Bivalvia, Gastropoda, Harpacticoida, Ostracoda, Cumacea, Amphipoda и Acari (Revkov, Sergeeva, 2004). В 1990 году в мейобентосе Донузлава зарегистрировано 13 крупных таксонов (Сергеева, 1997). Кроме обозначенных выше, здесь отмечены также представители Tanaidacea и Chironomidae. В совокупности же, все перечисленные группы представляют 8 таксонов уровня типа. В наших исследованиях дополнительно отмечены ещё четыре таксономических типа: Cnidaria (класс Hydrozoa), Cercozoa (отряд Gromiida), Ciliophora и Rotifera.
Суммарно (с учётом макрозообентоса) состав донной фауны озера Донузлав представлен 20 таксономическими типами животных: Chordata (класс Ascidiacea), Arthropoda (кл. Malacostraca, Ostracoda, Insecta (larv.), п/кл. Acari, п/кл. Copepoda, инфракласс Cirripedia), Mollusca (классы Bivalvia, Gastropoda, Polyplacophora), Annelida (класс Polychaeta, п/кл. Oligochaeta), Nematoda, Cnidaria (класс Anthozoa, Hydrozoa), Kinorhyncha, Xenacoelomorpha, Platyhelminthes, Ciliophora, Rotifera, Phoronida, Porifera, Nemertea, Bryozoa, Echinodermata, Chaetognatha, Foraminifera (мягкораковинные и твёрдораковинные), Cercozoa (отряд Gromiida) и Entoprocta.
В целом, выявленные характеристики разнообразия состава и количественного развития донной фауны озера Донузлав не являются исключительными. Они сопоставимы с таковыми для других акваторий у берегов Крыма.
Количественное развитие. Макрозообентос. В 1990 году в зарослях макрофитов, представленных в основном харой, рдестом и зостерой и располагавшихся на вдольбереговых прибрежных участках, численность и биомасса макрозообентоса составляли в среднем 7487 экз./м2 и 649 г/м2, аналогичные значения в биотопе песка, занимавшем основную часть озера, составляли 481 экз./м2 и 498,5 г/м2, на илах, ранее представленных в приустьевой части озера – 505 экз./м2 и 470,45 г/м2 (Михайлова, 1992). В 1997 году в западной приустьевой части озера, включающей участок добычи песка и заросли морских трав, средняя численность макрозообентоса была 1211 экз./м2, а биомасса – 373 г/м2 (Болтачева и др., 2003). Наши исследования 2019 года показали наибольшую для озера Донузлав численность макрозообентоса в зарослевом биоценозе хары с митилястером – 34658±16565 экз./м2. Учитывая различие методики определения сырой биомассы двустворчатых моллюсков (в нашей работе вес мантийной жидкости не учитывался) и применяя переводные коэффициенты (Revkov et al., 2018), современная биомасса макрозообентоса, при сопоставимом с периодом 1990-х годов способе её определения, может оцениваться в 393±117 г/м2. Полученная таким образом величина оказывается ниже биомассы макрозообентоса 1990 года, но сопоставима с таковой 1997 года. Наши данные намного превышают известные средние показатели развития зообентоса (3552 экз/м2 и 146,28 г/м2) в биоценозе харовых водорослей в Тендровском и Ягорлыцком заливах (Королесова, 2015).
Мейозообентос. Полученное нами среднее значение плотности поселения мейобентоса (247,2×103±86,7×103 экз./м2) оказалось в 2 раза ниже аналогичных данных (503,6×103 экз./м2) для «нижнего» участка района озера Донузлав в 1990 году (Сергеева, 1997), но находилось в пределах варьирования средних значений данного параметра (43,4×103 – 596,2×103 экз./м2) у берегов Крыма (Revkov, Sergeeva, 2004). При снижении плотности мейобентоса в 2019 году отмечено также сокращение доли нематод в общей численности мейобентоса озера с 93,7 до 69 %.
Биоценотическая организация донной фауны. Ранее (1981 г.) в нижней части озера были выделены донные биоценозы песка с харой (водоросли пор. Charales), хары, венуса, абры, зостеры и ракушечника. Доминирующее положение принадлежало биоценозу песка с харой, занимающему около 3/4 общей площади дна (Чухчин, 1992). По результатам исследований 1997 года отмечено замещение харовых водорослей морскими травами, рдестом и руппией, и в качестве причины этого рассматривалось заиление дна в связи с разработкой песчаного карьера (Болтачева и др., 2003). Однако, данная причина, по-видимому, не являлась единственной (или определяющей), поскольку, начиная с середины 1990-х годов, деградация зарослей хары наблюдалась практически во всех заливах и лиманах северо-западной части Чёрного моря. Позже, в 2010–2014 годах, в Тендровском и Ягорлыцком заливах было отмечено возобновление харофитов, однако они не формировали описанных ранее мощных сомкнутых зарослей, и их средняя биомасса составляла всего 125,15 г/м2 (Королесова, 2015).
В наших исследованиях 2019 года харовые водоросли обнаружены на всем обследованном полигоне, кроме станции 1. Среди представленных нескольких видов пор. Charales преобладает Lamprothamnium papulosum (K. Wallroth) J. Groves, 1916. Биомасса макрофитов достигала 42423 г/м2, средняя – 9241 г/м2 (см. табл. 3), при этом доля харофитов составляла не менее 90 %. Следует отметить, что харовые водоросли уникальны тем, что выносят малую прозрачность воды, почти полное отсутствие кислорода и содержание некоторого количества сероводорода в воде (Морозова-Водяницкая, 1959).
В озере вновь отмечено формирование обширного биоценоза хары (с митилястером) в том числе на участках, близких к зоне добычи песка и интенсивного заиления грунта. Однако, этим мы не склонны утверждать, что заиление грунтов, как факт, не влияет на развитие зарослей харовых. Визуальные наблюдения на станциях с хорошим (как минимум более 30 см) слоем илистых отложений, но расположенных на разном удалении от источника сброса илистых фракций (например, ст. 2 и 11 нашего полигона) дают разную картину мощности (высоты) развития растительного покрова. В зоне, примыкающей к факелу сброса, на растительном контуре идёт продолжительное оседание первично сбрасываемой тонкой фракции, угнетающей фотосинтез и рост фитомассы (водоросли запорошены, высота таллома 15–20 см). Макрофиты на участках, удалённых от точки сброса (ст. 11), чистые (не запорошены), высотой около 1 м. Однако и здесь поверхностный слой донного субстрата (более 30 см) представлен рыхлым наилком, динамика которого, вероятно, может регулироваться сезонными ветро-волновыми процессами, определяющими вторичный перенос тонких илистых фракций грунта и их распределение в донных отложениях озера.
Реакции бентоса на технологический сброс илистых фракций грунта. Негативные последствия для экосистемы в результате техногенного заиления дна отмечены в озере Донузлав ещё в 1997 году. Была выявлена деградация донных сообществ (Болтачева и др., 2003), связанная с крупномасштабной перестройкой ландшафтов (Тихоненкова, Иванютин, 2008) в результате переотложения илистых фракций мутьевых потоков, образующихся при добыче песка. В тех местах, где в 1980-е годы картировались пески, стала преобладать (от 50 до 80%) илистая фракция (<0,05 мм) грунта (Тихоненкова, Иванютин, 2008), с соответствующей сменой псаммофильного сообщества на пелофильное. Устричник, как биотоп, сформировавшийся здесь до 1981 года, на участках, прилегающих к юго-восточному и северо-западному карьерам добычи песка в устьевой зоне озера, к 2003 году, в результате полного заиления – прекратил своё существование (Болтачева и др., 2003). По оценочным данным (Себах и др., 2006) ущерб биологическим ресурсам озера Донузлав от разработки месторождения строительных песков в 2006 году составил 16150 грн. (≈ 3198 $).
В наших исследованиях на участке акватории, наиболее подверженном влиянию сброса мелкодисперсных фракций грунта, отмечено угнетение развития макрозообентоса, по численности, биомассе и количеству обнаруженных видов соответственно в 12, 3,5 и 2 раза и мейобентоса по численности в 3,2 раза. Аналогичный вывод можно сделать и в отношении фитоценотической составляющей. Высота слоя макрофитов и их биомасса – наименьшие в зоне сброса тонкодисперсной фракции грунта. Исключением является ст. 9, где более низкие параметры развития харовых связаны с характером субстрата, представленного плотным заиленным ракушечником.
В данной работе мы не ставили задачу детального раскрытия механизмов влияния сбрасываемых мелкодисперсных фракций грунта на донную фауну. Однако укажем как на известную общую прямую зависимость смены псаммофильной фауны на пелофильную в зоне заиления песчаных грунтов (Ревков и др., 1992, Киселева, Просвиров, 2006, Терентьев, 2009, 2010 и др.), так и на возможные гидрохимические последствия данного явления. При определённых условиях (летнее повышение температуры, устойчивая стратификация вод, высокий трофический статус акватории) возникает высокая вероятность заморных явлений в результате формирования кислород-дефицитных условий в зоне контакта вода-дно (Зайцев, 2006; Заика и др., 2011; Гулин и др., 2018). Косвенным признаком этого в районе наших исследований может являться органолептическая регистрация в дночерпательных пробах (станции 1–5, 7), захватывающих грунт на глубину до 15–20 см, стойкого запаха сероводорода и обнаружение разлагающихся тел моллюсков (рис. 5). Для окончательных выводов по данному вопросу необходимы специальные разносезонные исследования гидрохимии придонных горизонтов в зонах накопления мелкодисперсных фракций грунта, сбрасываемых в акваторию в процессе добычи песка.
ЗАКЛЮЧЕНИЕ
Современный состав донных беспозвоночных озера Донузлав представлен 20 таксономическими типами, обычными для берегов Крыма. Из них видовая диагностика только трёх (Arthropoda, Mollusca, Annelida (класс Polychaeta)) может быть признана удовлетворительной. Основной пробел знаний относится к слабой изученности фауны мелких мейобентосных форм, включая такие многочисленные для Чёрного моря группы как Nematoda, Oligochaeta и Nemertea. В составе фауны обнаружены два вида голотурий – представителей типа Echinodermata, ранее не отмеченного в озере. Всего к настоящему времени в озере Донузлав зарегистрировано 171 вид и 9 мало исследованных надвидовых таксонов донной макрофауны.
Рис. 5. Loripes orbiculatus из пробы (ст. 3, 11.07.19), видны полуразложившиеся
тела моллюсков
В донной фауне озера отмечено формирование обширного биоценоза харовых водорослей с митилястером. Последний существует в двухярусном биотопе (рыхлый донный субстрат и развивающийся на нём водорослевый субстрат из харовых). Биоценоз отличается относительно высоким уровнем видового богатства и количественного развития. Лидирующие позиции в сформированном биоценозе, по параметрам количественного развития, принадлежат представителям фауны зарослевых сообществ, донная макрофауна развита в меньшей степени.
Полученные результаты указывают на существование локального воздействия сброса вод, содержащих илистые фракции грунта, на донную экосистему южной части озера Донузлав. На участке акватории, прилегающем к точке сброса отмечено угнетение развития макрозообентоса, по численности, биомассе и количеству обнаруженных видов соответственно в 12, 3,5 и 2 раза и мейобентоса по численности в 3,2 раза. Обнаружено также заиление поверхности талломов макрофитов, угнетение их развития вплоть до полного исчезновения макрофитов в точке, ближайшей к оголовку сброса.
Для более полной оценки негативного влияния добычи песка на экосистему озера необходимы более детальные исследования бентоса и сезонной динамики гидрохимических показателей узкого придонного горизонта воды и верхнего слоя грунта.
Благодарности. Авторы выражают большую признательность коллегам – В. И. Рябушко за содействие в выполнении работы и Е. А. Колесниковой за определение водорослей, а также Н. Г. Сергеевой, С. В. Алёмову и А. С. Терентьеву за ценные замечания в процессе подготовки рукописи.
Работа выполнена в рамках государственных заданий ФГБУН ИМБИ, № 121030100028-0, 121030300149-0 и по Контракту № 2018/9 с ООО «ЯХТСТРОЙСЕРВИС».
REFERENCES
Алёмов С. В., Бурдиян Н. В., Витер Т. В., Гусева Е. В., Короткова А. В. Бентос северо-западной части озера Донузлав в 2017 году // Экосистемы. – 2020. – Вып. 22. – С. 15–28.
Болтачева Н. А., Колесникова Е. А., Ревков Н. К. Фауна макрозообентоса лимана Донузлав (Черное море) // Экология моря. – 2002. – Вып. 62. – С. 10–15.
Болтачева Н. А., Колесникова Е. А., Мазлумян С. А., Ревков Н. К. Влияние добычи песка на разнообразие макрозообентоса лимана Донузлав (западное побережье Крыма) / Современное состояние биоразнообразия прибрежных вод Крыма (Черноморский сектор). – Севастополь, 2003. – С. 283–288.
Гулин М. Б., Масберг И. В., Иванова Е. А. Масштабное развитие гипоксии морской бентали в геоморфологически подобных заливах-фьордах Крыма с различной техногенной нагрузкой // Юг России: экология, развитие. – 2018. – Т. 13, №3. – C. 55–70. DOI: 10.18470/1992-1098-2018-3-55-70.
Ена В. Г., Ена Ал. В., Ена Ан. В. Заповедные ландшафты Тавриды. – Симферополь: Бизнес-Информ, 2013. – 428 с.
Еремеев В. Н., Болтачев А. Р. Потенциальные перспективы Донузлава в качестве центра сохранения биоразнообразия, марикультуры, рекреации и экотуризма // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. – 2005. – № 13. – С. 151–158.
Жугайло С. С., Авдеева Т. М., Пугач М. Н., Аджиумеров Э. Н. Состояние качества водной среды и донных отложений озера Донузлав в современный период // Водные биоресурсы и среда обитания. – 2018. – Т. 1, № 1. – С. 32–38. https://celestra.ru/uploads/files/32_38__N1_2018.pdf
Заика В. Е., Коновалов С. К., Сергеева Н. Г. Локальные и сезонные явления гипоксии на дне Севастопольской бухты и их влияние на макробентос // Морской экологический журнал. – 2011. – Т. 10, № 3. – С. 15–25.
Зайцев Ю. П. Введение в экологию Чёрного моря. – Одесса: Эвен, 2006. – 224 с.
Золотницкий А. П., Орленко А. Н., Крючков В. Г., Сытник Н. А. К вопросу организации крупномасштабного культивирования устриц в озере Донузлав // Труды ЮгНИРО. – 2008. – Т. 46. – С. 48–54.
Зуев Г. В., Болтачев А. Р. Влияние подводной добычи песка на экосистему лимана Донузлав // Экология моря. – 1999. – Вып. 48. – С. 5–9.
Иванютин Н. М. Современное экологическое состояние озера Донузлав // Вода и экология: проблемы и решения. – 2019. – № 3 (79). – С. 47–58.
Киселева М. И., Ревков Н. К., Копытов Ю. П. Современное состояние и многолетние изменения зообентоса Стрелецкой бухты (район Севастополя) // Гидробиологический журнал. – 1997. – Т. 33, № 1. – С. 3–13.
Киселева М. И., Просвиров Ю. В. Изменение структуры бентосного сообщества на полигоне в районе Балаклавы (Крым, Черное море) // Экология моря. – 2006. – Вып. 72. – С. 14–20. https://repository.marine-research.org/handle/299011/4739
Королесова Д. Д. Биоценоз харовых водорослей как важный элемент прибрежных экосистем (на примере Тендровского и Ягорлыцкого заливов Чёрного моря) // Вісник ОНУ. Серія: Географічні та геологічні науки. – 2015. – Т. 20, вип. 1. – С. 134–148.
Королесова Д. Д., Черняков Д. А. Изменения в структуре макрозообентоса Тендровского залива в связи с деградацией зарослей харовых водорослей // Природничий альманах. – 2012. – Серія: Біологичні науки. – С. 55–62.
Курнаков Н. С., Кузнецов В. Г., Дзенс-Литовский А. И. и др. Соленые озера Крыма. – Москва, 1936. – 278 с.
Ломакин П. Д., Рябушко В. И., Чепыженко А. И., Щуров С. В. Контроль системы течений и полей концентрации общего взвешенного и растворенного органического веществ в озере Донузлав в мае 2019 года // Системы контроля окружающей среды. – 2021. – № 1 (43). – С. 87–94. DOI: 10.33075/2220-5861-2021-1-87-94.
Маккавеева Е. Б. Беспозвоночные зарослей макрофитов Чёрного моря. – Киев: Наукова думка, 1979. – 227 c.
Михайлова Т. В. Макробентос озера Донузлав // Экология моря. – 1992. – Вып. 42. – С. 16–20.
Морозова-Водяницкая Н. В. Растительные ассоциации в Черном море // Труды Севастопольской биологической станции. – 1959. – Т. ХI. – C. 3–28.
Определитель фауны Чёрного и Азовского морей. Т. 1, 2, 3. – Киев: Наукова думка, 1968. – 437 с; 1969. – 536 с; 1972. – 340 с.
Ревков Н. К., Просвиров Ю. В., Логачёв В. С. Распределение и состояние бентоса под влиянием сброса шламовых вод (район Балаклавы, глубина 25–88 м). – 1992. – Часть 2. Депонированная рукопись № 585–В92 20.02.1992 https://repository.marine-research.org/handle/299011/5836
Ревков Н. К., Николаенко Т. В. Биоразнообразие зообентоса прибрежной зоны южного берега Крыма (район бухты Ласпи) // Биология моря. – 2002. – Т. 28, № 3. – С. 170–180.
Самышев Э. З., Сеничкина Л. Г., Сергеева Н. Г., Михайлова Т. В., Панкратова Т. М. Структура и функционирование сообществ планктона и бентоса оз. Донузлав в условиях антропогенного загрязнения и оценка перспектив его рыбохозяйственного использования // Системы контроля окружающей среды: сб. науч. тр. Севастополь: Изд-во МГИ. – 2001. – Вып. 11. – С. 301–325.
Себах Л. К., Петренко О. А., Жугайло С. С., Цынтарюк Е. А. Влияние промышленной разработки месторождений песка на состояние экосистемы озера Донузлав. – Современные проблемы экологии Азово-Черноморского бассейна: Материалы II Международной конференции, 26–27 июня 2006 г., Керчь, ЮгНИРО. – Керчь: Изд-во ЮгНИРО, 2006. – С. 71–79.
Сергеева Н. Г. Мейобентос озера Донузлав // Гидробиологический Журнал. – 1997. – 33 (4). – C. 32–44.
Терентьев А. С. Трансформация биоценозов Керченского предпроливья Черного моря под влиянием заиления // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. – 2009. – № 18. – С. 272–295.
Терентьев А. С. Изменение площади донных биоценозов в результате заиления Керченского предпроливья Черного моря // Труды Южного научно-исследовательского института рыбного хозяйства и океанографии. – 2010. – Т. 48. – С. 15–23.
Тихоненкова Е. Г., Иванютин Н. М. Влияние антропогенной деятельности на экологическое состояние геологической среды и геохимические ландшафты озера Донузлав // Ученые записки Таврического национального университета имени В. И. Вернадского. Серия: География. – 2008. – Т. 21 (60), № 3. – С. 359–365.
Чухчин В. Д. Формирование донных биоценозов в оз. Донузлав после соединения с морем / Многолетние изменения зообентоса Черного моря. – Киев: Наук. думка, 1992. – С. 217–225.
Amjad S., Gray J. S. Use of the nematode-copepod ratio as an index of organic pollution // Marine Pollution Bulletin. – 1983. – 14. – P. 178–181.
Black Sea biological diversity. Ukrainian national report // Black Sea Environmental Series. United Nations Publication. New York. – 1998. – Vol. 7. – 351 p.
Clarke K. R. Non-parametric multivariate analyses of changes in community structure // Australian Journal of Ecology. –1993. – 18. – Р. 117–143.
Clarke K. R., Gorley R. M. PRIMER v5: User Manual / Tutorial. Primer–E: Plymoith, 2001. – 92 p.
Lee M. R., Correa J. A., Castilla J. C. An assessment of the potential use of the Nematode to Copepod ratio in the monitoring of metals pollution. The Chañaral case // Marine Pollution Bulletin. – 2001. – 42 (8). – P. 696–701.
Mare M. F. A Study of a Marine Benthic Community with Special Reference to the Microorganisms. // Marine Biological Association of the United Kingdom. – 1942. – 25 (3). – P. 517–554. https://doi.org/10.1017/S0025315400055132
Revkov N. K., Sergeeva N. G. Current state of the zoobenthos at the Crimean shores of the Black Sea. // In Proceedings: International Workshop on Black Sea Benthos, 2004. – P. 189–217.
Revkov N. K., Petrov A. N., Kolesnikova E. A., Dobrotina G. A. Comparative analysis of long-term alterations in structural organization of zoobenthos under permanent anthropogenic impact (Case study: Sevastopol Bay, Crimea) // Морской экологический журнал. – 2008. – Т. 7, N 3. – С. 37–49.
Revkov N. K., Boltacheva N. A., Timofeev V. A., Bondarev I. P. & Bondarenko L. V. Macrozoobenthos of the Zernov’s Phyllophora Field. Northwestern Black sea: species richness, quantitative representation and long-term variations // Nature Conservation Research. – 2018. – 3 (4). – P. 32–43. Accessed at: http://dx.doi.org/10.24189/ncr.2018.045.
Rubal M., Veiga P. & Besteiro C. Nematode/Copepod index: importance of sedimentary parameters, sampling methodology and baseline values // Thalassas, An International Journal of Marine Sciences. – 2009. – 25 (1). – P. 9–18.
Warwick R. M. The Nematode/Copepod ratio and its use in pollution ecology // Marine Pollution Bulletin. – 1981. – 12. – P. 329–333.
WoRMS Editorial Board (2021). World Register of Marine Species. Available from http://www.marinespecies.org at VLIZ. Accessed 2021.05.12.