SHELL MITES (ACARIFORMES, ORIBATIDA) INTRA-MOUNTAIN DAGESTAN (GUNIB DISTRICT)
JOURNAL: «EKOSISTEMY», Issue 25, 2021
Publication text (PDF): Download
UDK: 595.423(470.67):574.472
AUTHOR AND PUBLICATION INFORMATION
AUTHORS: Davudova E. Z., Institute of Ecology and Sustainable Development of the Dagestan State University, Makhachkala, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-25-105-113
PAGES: from 105 to 113
STATUS: Published
LANGUAGE: Russian
KEYWORDS: carapace mites, diversity of species, Republic of Dagestan, Gunib district.
ABSTRACT (ENGLISH):
Carapace mites are important regulators of the mineralization of organic residues and the immobilization of various biogens in the soil. In the course of the research conducted on the territory of the Gunib district of the Republic of Dagestan, only 89 species of shell mites belonging to 61 genera and 41 families were identified. New data have been obtained that complement the list of species of shell mites in the Caucasus as a whole. Recently described Liacarus (Dorycranosus) musaevi, and two endemics of the Caucasus – Xenillus sculptrus and Suctobelba cornigera – were noted for region. Among other groups of soil microfauna, shell mites occupy a leading position, both in terms of their number and abundance of species. In studies conducted in mountain systems, it was found that the General pattern is a decrease in the number of microarthropods with an increase in absolute height. Very often, the pattern of changes in the taxonomic richness and population density of the microarthropod complex is diamond-shaped, characterized by maxima in the zone with the most favorable microclimate for a large group of species. From top to bottom, the microarthropod population density and taxonomic richness decrease along the mountain profile. As a result of the study, the maximum population density and abundance of oribatid species is observed in the soil of a birch forest and its gradual decrease as it transitions to grasslands, which is explained by changes in the hydrothermal conditions of soil horizons, both due to an increase in height and due to a change in the nature of vegetation to treeless.
ВВЕДЕНИЕ
Панцирные клещи или орибатиды (Acariformes: Oribatida) – это эволюционно древняя, разнообразная в таксономическом и экологическом отношении группа клещей; в мировой фауне описано около 13497 (Subías, 2020) видов; на Кавказе зарегистрировано 1053 видов (Штанчаева, Субиас, 2010). Эти клещи составляют ядро почвенной мезофауны, и им принадлежит руководящая роль в плодородии почвы. На долю рибатид приходится около 2 % энергии, проходящей через экосистемы (Криволуцкий, 1977). На своих покровах они переносят споры и гифы грибов, бактерий, распространяя их и, таким образом, существенно влияя на микробоценоз почв (Behan-Pelletier, 1999). Являясь важной частью детритного звена экосистем, орибатиды способствуют скорейшему высвобождению элементов и возвращению их в круговорот (Стриганова, 1980). Наряду с другими представителями микроартропод, они могут оставаться активными под снегом в течение зимнего периода, выполняя свою экологическую роль в течение всего года (Криволуцкий, 1971). Практически повсеместное распространение орибатид привлекало и привлекает по сей день внимание к ним всех исследователей почвенной фауны. Изучение закономерностей пространственного распределения почвенной биоты в градиентах высотной поясности представляет большой научный интерес. На относительно небольшом протяжении закономерно изменяются многие условия среды обитания, такие как растительность, экспозиция и крутизна склонов, типы почв и другие параметры, создавая возможность для формирования уникальных фаунистических комплексов.
Пространственная экология почвенных животных позволяет решать широкий круг задач, направленных на выяснения закономерностей структуры и функционирования почвенной биоты в естественных условиях и при антропогенном воздействии (Штирц и др. 2013). Важная роль орибатид в наземных биоценозах, их исключительное видовое разнообразие и широта диапазона экологических ниш привлекают внимание исследователей к изучению систематики и функциональной морфологии клещей этой группы. Неоднородность размещения почвенных животных в пространстве была отмечена давно, однако анализ пространственного распределения беспозвоночных начался лишь во второй половине XX века (Покаржевский и др., 2007). Важность знания закономерностей пространственного распределения беспозвоночных на сельхозугодьях была продемонстрирована в работах С. Зиса и Т. Чрантке (Thies, Tschrantke, 1999), Ф. Хендрикса (Henrdrickx et al., 2007) и других. Биоразнообразие почв важно для поддержания стабильности агроэкосистем (Brussaard et al., 2007). Мозаичность пространственного распределения орибатидных клещей и коллембол в пахотных почвах была отмечена в работах Н. М. Черновой (1982).
Вертикально-поясное распределение орибатид в горах имеет свои характерные особенности. В лесах гор встречается наибольшее количество видов с высокой численностью, но по мере возрастания абсолютной высоты обилие видов и численность клещей резко сокращаются. Высокое видовое разнообразие орибатид в горно-лесном поясе объясняется наличием здесь благоприятных условий для существования панцирных клещей и разнообразием их экологических ниш. Следует отметить, что в ландшафтах луговой степи и горной степи, которые располагаются ниже лесного пояса, видовое богатство и плотность населения панцирных клещей постепенно снижается (Баяртогтох, 1997).
На формирование фаунистических комплексов микроартропод влияет пестрота условий их обитания, структура растительного покрова. Основной средообразующий фактор орибатид является соотношение тепла и влаги (Газалиев, 2014). Немаловажную роль играют экспозиция и крутизна склонов, так как северные и южные склоны гор имеют различную влаго и теплообеспеченность (Атаев, 2006, Керимханов, 1973). Все вышеперечисленные параметры создают выраженную пространственную мозаичность среды.
Богатая и разнообразная фауна Дагестана издавна привлекала и по сей день привлекает исследователей различных областей науки.
Цель работы – изучить панцирных клещей (Acariformes, Oribatida) Гунибского района Республики Дагестан.
МАТЕРИАЛ И МЕТОДЫ
Основу работы составляет зоологический материал, а именно панцирные клещи Гунибского района Республики Дагестан (рис. 1), извлеченные из почвенных проб осенью и весной согласно методике количественных учетов (Гиляров, 1965; Криволуцкий и др., 1995).
Рис. 1. Панцирные клещи (Acariformes: Oribatida)
Извлечение микроартропод из почвенных образцов осуществлялось с помощью термоэклектора Берлезе-Тульгрена. Применение светового эклектора при извлечении мелких почвенных организмов основано на использовании отрицательной фототаксии почвенных организмов. В лабораторных условиях это были стационарные эклекторы с электрическими лампочками 40 Вт, закрепленными на высоте 20 см над уровнем образца, помещенного в металлическое сито. В полевых условиях были использованы разборные переносные эклекторы и генератор.
Выборка и их определение осуществлялись под микроскопом. Математическая обработка данных, построение графиков и диаграмм проведена в программе Microsoft Office Excel 2010.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
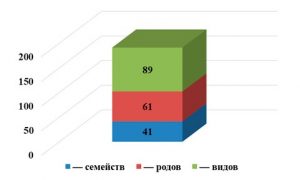
В ходе проведенных исследований выявлено таксономическое разнообразие фауны панцирных клещей Гунибского района (табл. 1), а именно: 89 видов орибатид относящиеся к 61 родам и 41 семействам (рис. 2).
Таблица 1
Таксономическое разнообразие фауны орибатид Гунибского района Республики Дагестан
| Семейство | Род | Вид |
| 1 | 2 | 3 |
| Hypochthoniidae Berlese, 1910 | Hypochthonius Koch, 1835 | Hypochthonius luteus (Oudemans, 1917) |
| Eniochthoniidae Grandjean, 1947 | Hypochthoniella Berlese, 1910 | Hypochthoniella minutissima (Berlese, 1904) |
| Brachychthoniidae Thor, 1934 | Liochthonius Hammen, 1959 | Liochthonius lapponicus (Trägårdh, 1910) |
| Liochthonius muscorum (Forsslund, 1964) | ||
| Poecilochthonius Balogh, 1943 | Poecilochthonius italicus (Berlese, 1910) | |
| Sellnickochthonius Krivolutsky, 1964 | Sellnickochthonius rostratus (Jacоt, 1936) | |
| Eulohmanniidae Grandjean, 1931 | Eulohmannia Berlese, 1910 | Eulohmannia ribagai (Berlese, 1910) |
| Epilohmanniidae Oudemans, 1923 | Epilohmannia Berlese, 1910 | Epilohmannia cylindrica cylindrica (Berlese, 1904) |
| Oribotritiidae Grandjean, 1954 | Oribotritia Jacot, 1924 | Oribotritia hermanni (Grandjean, 1967) |
| Euphthiracaridae Jacot, 1930 | Acrotritia Jacot, 1923 | Acrotritia ardua ardua (Koch, 1841) |
| Phthiracaridae Perty, 1841 | Atropacarus Ewing, 1917 | Atropacarus sp. |
| Atropacarus phyllophorus (Berlese, 1904) | ||
| Atropacarus striculus (Koch, 1835) | ||
| Notophthiracarus Ramsay, 1966 | Notophthiracarus meridionalis (Sergienko, 1992) | |
| Phthiracarus (Phthiracarus) Perty, 1841 | Phthiracarus (P.) longulus (Koch, 1841) | |
| Phthiracarus (Archiphthiracarus) Balogh et Mahunka, 1979 | Phthiracarus (A.) globosus (Koch, 1841) | |
| Steganacarus (Tropacarus) Ewing, 1917 | Steganacarus (T.) lucidus (Sergienko, 1994) | |
| Trhypochthoniidae Willmann, 1931 | Trhypochthonius Berlese, 1904 | Trhypochthonius tectorum (Berlese, 1896) |
| Nothridae Berlese, 1896 | Nothrus Koch, 1836 | Nothrus borussicus (Sellnick, 1928) |
| Nothrus palustris (Koch, 1839) | ||
| Nothrus pratensis (Sellnick, 1928) |
Таблица 1(продолжение)
| 1 | 2 | 3 |
| Crotoniidae Thorell, 1876 | Heminothrus (Platynothrus) Berlese, 1913 | Heminothrus (P.) peltifer (Koch, 1839) |
| Hermanniidae Sellnick, 1928 | Hermannia Nicolet, 1855 | Hermannia gibba (Koch, 1839) |
| Hermanniellidae Grandjean, 1934 | Hermanniella Berlese, 1908 | Hermanniella serrata Sitnikova, 1973 |
| Damaeidae Berlese, 1896 | Damaeus (Damaeus) Koch, 1835 | Damaeus (D.) crispatus (Kulczynski, 1902) |
| Damaeus (D.) maximus (Mihelčič, 1957) | ||
| Metabelba (Metabelba) Grandjean, 1936 | Metabelba (M.) pulverulenta (Koch, 1839) | |
| Compactozetidae Luxton, 1988 | Cepheus Koch, 1835 | Cepheus dentatus (Michael, 1888) |
| Cepheus latus (Koch, 1835) | ||
| Zetorchestidae Michael, 1898 | Zetorchestes Berlese, 1888 | Zetorchestes micronychus (Berlese, 1883) |
| Ceratoppiidae Kunst, 1971 | Ceratoppia Berlese, 1908 | Ceratoppia quadridentata (Haller, 1882) |
| GustaviidaeOudemans, 1900 | Gustavia Kramer, 1879 | Gustavia fusifer (Koch, 1841) |
| Liacaridae Sellnick, 1928 | Liacarus (Liacarus) Michael, 1898 | Liacarus (L.) xylariae xylariae (Schrank. 1803) |
| Liacarus (Dorycranosus) Woolley, 1969 | Liacarus (D.) musaevi (Shtanchaeva, 2008) | |
| Liacarus (D.) zachvatkini (Kulijev, 1962) | ||
| Xenillidae Woolley et Higgins, 196 | Xenillus Robineau-Desvoidy, 1839 | Xenillus discrepans (Grandjean, 1936) |
| Xenillus sculptrus (Kulijev, 1963) | ||
| Eremaeidae Oudemans, 1900 | Eremaeus Koch, 1835 | Eremaeus hepaticus cordiformis (Grandjean, 1934) |
| Damaeolidae Grandjean, 1965 | Damaeolus Paoli, 1908 | Damaeolus ornatissimus (Csiszár, 1962) |
| Fosseremus Grandjean, 1954 | Fosseremus laciniatus (Berlese, 1905) | |
| Oribellidae Kunst, 1971 | Pantelozetes Grandjean, 1953 | Pantelozetes paolii (Oudemans, 1913) |
| Multioppiinae Balogh, 1983 | Ramusella (Ramusella) Hammer, 1962 | Ramusella (R.) puertomonttensis (Hammer, 1962) |
| Medioppiinae Subías et Mínguez, 1985 | Microppia Balogh, 1983 | Microppia minus minus (Paoli, 1908) |
| Rhinoppia Balogh, 1983 | Rhinoppia bulanovae bulanovae (Kulijev, 1962) | |
| Rhinoppia obsoleta obsoleta (Paoli, 1908) | ||
| Rhinoppia subpectinata (Oudemans, 1900) | ||
| Oppiellinae Seniczak, 1975 | Berniniella Balogh, 1983 | Berniniella inornata (Mihelčič, 1957) |
| Berniniella silvatica (Vasiliu & Calugar, 1976) | ||
| Moritzoppia (Moritzoppia) Subías et Rodríguez, 1988 | Moritzoppia (M.) keilbachi (Moritz, 1969) | |
| Moritzoppia (M.) unicarinata unicarinata (Paoli, 1908) | ||
| Oppiella (Oppiella) Jacot, 1937 | Oppiella (O.) nova (Oudemans, 1902) | |
| Oxyoppiinae Subías, 1989 | Oxyoppia Balogh et Mahunka, 1969 | Oxyoppia dubia (Kulijev, 1966) |
| Quadroppiidae Balogh, 1983 | Quadroppia (Quadroppia) Jacot, 1939 | Quadroppia (Q.) quadricarinata (Michael, 1885) |
| Quadroppia (Coronoquadroppia) Ohkubo, 1995 | Quadroppia (C.) michaeli (Mahunka, 1977) |
Таблица 1 (продолжение)
| 1 | 2 | 3 |
| Suctobelbidae Jacot, 1938 | Suctobelba Paoli, 1908 | Suctobelba cornigera (Shtanchaeva et Subías, 2009) |
| Suctobelba granulata granulata (Hammen, 1952) | ||
| Suctobelbella (Suctobelbella) Jacot, 1937 | Suctobelbella (S.) acutidens acutidens (Forsslund, 1941) | |
| Suctobelbella (S.) acutidens duplex (Strenzke, 1950) | ||
| Suctobelbella (S.) opistodentata (Golosova, 1970) | ||
| Suctobelbella (S.) subcornigera subcornigera (Forsslund, 1941) | ||
| Suctobelbella (S.) subtrigona (Oudemans, 1900) | ||
| Suctobelbella (Flagrosuctobelba) Hammer, 1979 | Suctobelbella (F.) alloenasuta (Moritz, 1971) | |
| Suctobelbella (F.) forsslundi (Strenzke, 1950) | ||
| Suctobelbella (F.) nasalis (Forsslund, 1941) | ||
| Tectocepheidae Grandjean, 1954 | Tectocepheus Berlese, 1896 | Tectocepheus velatus (Michael, 1880) |
| Phenopelopidae Petrunkevitch, 1955 | Eupelops Ewing, 1917 | Eupelops tardus (Koch, 1835) |
| Eupelops torulosus torulosus (Koch, 1839) | ||
| Peloptulus Berlese, 1908 | Peloptulus gibbus (Mihelčič, 1957) | |
| Peloptulus phaeonotus (Koch, 1844) | ||
| Achipteriidae Thor, 1929 | Achipteria Berlese, 1885 | Achipteria italica (Oudemans, 1914) |
| Tegoribatidae Grandjean, 1954 | Scutozetes Hammer, 1952 | Scutozetes lanceolatus (Hammer, 1952) |
| Ceratozetidae Jacot, 1925 | Ceratozetella Shaldybina, 1966 | Ceratozetella cuspidodenticulata (Kulijev, 1962) |
| Ceratozetella sellnicki (Rajski, 1958) | ||
| Trichoribates (Trichoribates) Berlese, 1910 | Trichoribates (T.) novus novus (Sellnick, 1928) | |
| Chamobatidae Thor, 1937 | Chamobates (Chamobates) Hull, 1916 | Chamobates (C.) subglobulus (Oudemans, 1900) |
| Punctoribatidae Thor, 1937 | Minunthozetes Hull, 1916 | Minunthozetes pseudofusiger (Schweizer, 1922) |
| Punctoribates (Punctoribates) Berlese, 1908 | Punctoribates (P.) mundus (Shaldybina, 1973) | |
| Liebstadiidae J. et P. Balogh, 1984 | Liebstadia (Liebstadia) Oudemans, 1906 | Liebstadia (L.) pannonica pannonica (Willmann, 1951) |
| Liebstadia (L.) similis similis (Michael, 1888) | ||
| Scheloribatidae Jacot, 1935 | Perscheloribates Hammer, 1973 | Perscheloribates sp. |
| Scheloribates Berlese, 1908 | Scheloribates laevigatus laevigatus (Koch, 1835) | |
| Scheloribates pallidulus pallidulus (Koch, 1841) | ||
| Protoribatidae J. et P. Balogh, 1984 | Protoribates (Protoribates) Berlese, 1908 | Protoribates (P.) capucinus (Berlese, 1908) |
| Protoribates (P.) lophothrichus (Berlese, 1904) | ||
| Protoribates (Triaungius) Kulijev, 1978 | Protoribates (Triaungius) sp. |
Таблица 1 (продолжение)
| 1 | 2 | 3 |
| Lauritzenia Hammer, 1958 | Lauritzenia (Incabates) Hammer, 1961 | Lauritzenia (Incabates) elegans (Kunst, 1977) |
| Lauritzenia (Incabates) tenuifusus (Berlese, 1916) | ||
| Galumnidae Jacot, 1925 | Galumna Heyden, 1826 | Galumna lanceata (Oudemans, 1900) |
| Pilogalumna Grandjean, 1956 | Pilogalumna tenuiclava tenuiclava (Berlese, 1908) | |
| Всего семейств – 41 | Родов – 61 | Видов – 89 |
Вышеперечисленный список включает в себя данные, дополняющие список видов панцирных клещей Кавказа в целом:
– недавно описанный как новый для науки вид – Liacarus (D.) musaevi, обнаруженный в Гунибе (Штанчаева, 2004);
– эндемичные виды Кавказа – Xenillus sculptrus, Suctobelba cornigera.
Рис. 2. Эколого-фаунистический состав панцирных клещей Гунибского района Республики Дагестан
Микроартроподы являются эколого-таксономически размерной группой почвенных беспозвоночных, включающая большое число таксонов мелких членистоногих и многочисленными почти во всех типах почв и влияющие на большое число их параметров (Леонов, Рахлеева, 2011). Соответственно высока плотность и численность обсуждаемой фауны. В ходе исследований, проведенных в горных системах, установлено, что общей закономерностью является уменьшение численности микроартропод с увеличением абсолютной высоты (Работнов, 1987). Очень часто картина изменения таксономического богатства и плотности населения комплекса микроартропод имеет ромбовидный характер, характеризуясь максимумами в поясе с наиболее благоприятным микроклиматом для большой группы видов. Сверху вниз, по профилю горы плотность населения микроартропод и таксономическое богатство снижаются. Данные закономерности уменьшения таксономического богатства и плотности населения комплекса микроартропод могут нарушаться, но картина численности и обилия видов в основном носит отмеченный характер.
Численность панцирных клещей березового леса района исследования составила 74,7 тыс./м2, а обилие видов всего 58. С переходом леса в послелесной разнотравный луг наблюдается постепенное снижение численности, соответственно и плотности орибатид: всего обнаружено 31 видов, а плотность составила 41 тыс./м2. Не сильно различаются показатели численности и плотности субальпийского злаково-разнотравного луга: обнаружено всего 29 видов, с плотностью равной 40 тыс./м2 (рис. 3).
Рис. 3. Численность и плотность панцирных клещей Гунибского района Республики Дагестан
В результате исследования максимальная плотность населения и обилие видов орибатид наблюдается в почве березового леса, и плавное ее снижение по мере перехода к разнотравным лугам. Такая закономерность объясняется изменением гидротермических условий почвенных горизонтов, как вследствие увеличения высоты, так и вследствие смены характера растительности на безлесную.
На рассматриваемых биотопах Гунибского района РД панцирные клещи занимают доминирующее положение среди прочих групп микроартропод. В целом их доля составляет около 70 %, на участке березового леса, а доля их в структуре доминирования составила более 73 %, на разнотравных лугах – 66 %.
Среди сообществ панцирных клещей рассматриваемого района выделяются многочисленные, малочисленные и редкие.
Так, доминирующими в комплексе орибатид березового леса выделены всего 4 вида: H. minutissima, F. laciniatus, A. ardua ardua, O. nova; субдоминантами представлены такие два вида как – A. striculus, S. subcornigera subcornigera.
Послелесной разнотравный луг представлен следующими тремя видами доминантами: M. minus minus, E. cylindrica cylindrica, S. pallidulus pallidulus; представителями субдоминантов являются следующие два вида: H. peltifer, S. laevigatus laevigatus;
Субальпийский злаково-разнотравный луг включает два доминирующих вида: T. velatus velatus, P. capucinus; и один малочисленный вид – P. lophothrichus.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований в Гунибском районе Республики Дагестан, получены новые данные, дополняющие список видов панцирных клещей Кавказа в целом.
Обнаружен недавно описанный вид – Liacarus (Dorycranosus) musaevi; отмечены два эндемичных вида Кавказа: Xenillus sculptrus, Suctobelba cornigera.
Доминирующее положение орибатид среди прочих групп микроартропод следующая: доля их в структуре доминирования составила более 73 %, на участке березового леса – 70 %, на разнотравных лугах – 66 %. Среди комплексов орибатид рассматриваемого района встречаются многочисленные, малочисленные и редкие.
Представителями доминантов березового леса являются следующие 4 вида: H. minutissima, F. laciniatus, A. ardua ardua, O. nova; субдоминантами представлены такие два вида как – A. striculus, S. subcornigera subcornigera.
Послелесной разнотравный луг представлен следующими тремя видами доминантами: M. minus minus, E. cylindrica cylindrica, S. pallidulus pallidulus; представителями субдоминантов являются следующие два вида: H. peltifer, S. laevigatus laevigatus.
Субальпийский злаково-разнотравный луг включает два доминирующих вида: T. velatus velatus, P. capucinus; и один малочисленный вид – P. lophothrichus.
В ходе проведенных исследований максимальная плотность населения и обилие видов орибатид наблюдается в почве березового леса и плавное ее снижение по мере перехода к разнотравным лугам, что объясняется изменением гидротермических условий почвенных горизонтов как вследствие увеличения высоты, так и вследствие смены характера растительности на безлесную.
Благодарности. Автор выражает признательность к. б. н. У. Я. Штанчаевой (Университет Комплутенсе, г. Мадрид) за предоставленную информацию о панцирных клещах.
REFERENCES
Атаев З. В. Морфометрические и морфологические особенности хребтов Высокогорного Дагестана // Труды Географического общества Республики Дагестан. – 2006. – Вып. XXXIV. – С. 48–52.
Баяртогтох Б. Зональное распределение панцирных клещей (Acari: Oribatei) Монголии // Ученые записки Монгольского государственного университета. – 1997. – 123 (4). – С. 30–47.
Газалиев Н. А. Особенности распространения панцирных клещей (Oribatei) в горной части бассейна реки Самур // Известия Дагестанского государственного педагогического университета. Биологические науки. – 2014. – № 2. – С. 34–36.
Гиляров М. С. Зоологический метод диагностики почв. – М.: Наука, 1965. – 278 с.
Керимханов С. У. О влиянии экспозиции склонов на размещение почв в горном Дагестане // Почвоведение. – 1973. – № 2. – С. 23–28.
Криволуцкий Д. А. Население панцирных клещей в почвах полупустынь северного Прикаспия и его изменение под влиянием искусственного лесоразведения // Животные искусственных лесных насаждений в глинистой полупустыне. – М.: Наука, 1971. – С. 13–23.
Криволуцкий Д. А., В. А. Красилов. Панцирные клещи в отложениях верхней юры СССР. Морфология и диагностика клещей. – Л.: Наука, 1976. – С. 16–24.
Панцирные клещи: Морфология, развитие, филогения, экология, методы, исследования, характеристика модельного вида Nothrus palustris C. L. Koch, 1839 / [Ред. А. Д. Криволуцкий]. – М.: Наука, 1995. – 224 с.
Леонов В. Д., Рахлеева А. А. Состав и распределение сообществ микроартропод в ландшафтно-экологическом профиле высотной поясности горы Вудъяврчорр (Мурманская область, Хибинские горы) // Известия ПГПУ им. В. Г. Белинского. – 2011. – № 25. – C. 372–378.
Покаржевский А. Д. Пространственная экология почвенных животных. – М.: Товарищество научных изданий «КМК», 2007. – 174 с.
Работнов Т. А. Биогеоценозы альпийских пустошей (на примере Северо-Западного Кавказа). – М.: Наука, 1987. – 679 с.
Стриганова Б. Р. Питание почвенных сапрофагов. – М. 1980. – 123 с.
Чернова Н. М. Распределение микроартропод в пахотной почве // Антропогенное воздействие на фауну почв. – М.: Изд-во МГПУ. – 1982. – С. 3–10.
Штанчаева У. Я. Flexa – горный род панцирных клещей (Acariformes, Oribatida, Carabodidae) // Зоологический журнал. – 2004. – Т. 83, № 6. – С. 679–692.
Штанчаева У. Я., Субиас Л. С. Каталог панцирных клещей Кавказа. – Махачкала: ДНЦ РАН, 2010. – 276 с.
Штирц А. Д., Задорожная Г А., Кунах О.Н., Жуков А. В. Пространственная организация сообщества панцирных клещей (Acari: Oribatida) в почве сельскохозяйственного поля в условиях степной зоны Украины // Известия Харьковского энтомологического общества. – 2013. – Т. XXI, выпуск 1. – С. 49–60.
Behan-Pelletier V. M. Oribatid mite fauna of northern ecosystems: a product of evolutionary adaptations or physiological constraints // Acarology IX. – 1999. – Vol. 2. – P. 87–105.
Brussaard L., de Ruiter P. C., Brown G. G. Soil biodiversity for agricultural sustainability // Agriculture, Ecosystems and Environment. – 2007. – Vol. 121. – P. 233–244.
Henrdrickx F., Maelfait J., Wingerden W. How landscape structure, land-use intensity and habitat diversity affect components of total arthropod diversity in agricultural landscapes // Journal of Applied Ecology – 2007. – Vol. 44. – P. 340–351.
Subías L. S. (Publicado originalmente en Graellsia, 60 (número extraordinario): 3-305 (2004). Actualizado en junio de 2006, en abril de 2007, en mayo de 2008, en abril de 2009, en julio de 2010, en febrero de 2011, en abril de 2012, en mayo de 2013, en febrero de 2014, en marzo de 2015, en febrero de 2016, en febrero de 2017, en enero de 2018, en marzo de 2019 y en enero de 2020).
Thies С., Tschrantke T. Landscape structure and biological control in agroecosystems // Science. – 1999. – Vol. 285. – P. 893–895.