EVALUATION OF THE INFLUENCE OF ARBUSCULAR MYCORRHIZAL FUNGI ON ECONOMICALLY VALUABLE INDICATORS OF ONION
JOURNAL: «EKOSISTEMY», Issue 21, 2020
Publication text (PDF):Download
UDK: 579.6:635.04:635.25
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
- Abdurashytov S. F., Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia
- Nemtinov V. I., Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia
- Puzanova E. V., Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia; V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
- Gritsevich K. S., Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia
- Belova I. V., Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia
- Grunina E. N., Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia
- Abdurashytova E. R., Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia
- Klimchuk A. V. Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2020-21-101-108
PAGES: from 101 to 108
STATUS: Published
LANGUAGE: Russian
KEYWORDS: onion, AM fungi associations, mycorrhizal colonization, productivity, biochemical composition of bulbs.
ABSTRACT (ENGLISH):
Allium cepa L. is one of the main vegetable crops. It is actively used in food industry and medicine. The biochemical composition of plants, both bulbs and green leaves, in different periods of growth changes depending on the variety, environmental and agrotechnical conditions of plant cultivation. Representatives of the genus Allium are highly sensitive to the presence of arbuscular mycorrhiza (AM) in soil due to root development features. The aim of our work was to identify effective associations of AM fungi to increase the productivity and quality of onions in the conditions of southern chernozem. Pot and field experiments were carried out with associations of AM fungi and onion varieties from the collection of the Research Institute of Agriculture of Crimea. The initial assessment of the AM fungi collection was conducted in the pot with a sterile substrate under artificial lighting conditions according to the intensity of mycorrhizal colonization and the accumulation of phytomass of the storage plant. Field studies were carried out on southern carbonate chernozem in 2019. It is established that the AM fungi association M9 significantly exceeds the referent in the arbuscules abundance by 13.3 %. Association 1–16 showed the most considerable abundance of vesicles, which was 11.1–13.3 % higher than other variants of this experiment. The dry mass of onion shoots had a significant increase of 11.719.7 mg per plant (38.865.8 %) from inoculation by associations AM S1-4, 1-16 and M9. The positive effect of the AM fungi association 1-16 on the accumulation of phytomass in the onset phase of bulb formation and onion productivity of the onion variety Yaltinskiy plus and line 11A with an increase by 0.690.8 g / plant (31.351.7 %) and 1.11.3 t / ha (14.114.9 %), respectively, and an increase in the content of ascorbic acid by 18.524.4 % to the variant without treatment are shown.
ВВЕДЕНИЕ
Основой развития современного аграрного производства является разработка и использование технологий по его биологизации, обеспечение высокой продуктивности сельскохозяйственных культур и качества продукции при минимизации экономических затрат. В связи с этим вопросы минерального питания растений, их водообеспечения, улучшения иммунного статуса и защиты от различных форм стресс-факторов без значительной нагрузки на окружающую среду являются чрезвычайно актуальными. Нормальный рост и развитие почти всех растений зависит от развития в почвах гиф, образованных грибами арбускулярной микоризы.
Арбускулярная микориза (АМ) или эндомикориза – наиболее распространенная разновидность симбиоза растений и микроорганизмов, образована грибами из отдела Glomeromycota (Schüßler et al., 2001; Brundrett, 2009). Более 80 % видов изученных растений вступают в мутуалистические отношения с грибами АМ. Они широко представлены в почвах и способствуют улучшению минерального питания макросимбионтов (Harrison, 2002). В этой ассоциации гриб получает продукты фотосинтеза в форме углеводов и жирных кислот, а для растений АМ повышает доступность неподвижных или труднорастворимых форм комплексных соединений азота, фосфора и других необходимых элементов с такими катионами как железо, алюминий и кальций (Dreyer et.al., 2019; Jiang et al., 2017; Keymer et al., 2017). AM образуют обширную гифальную сеть, экстрарадикальный мицелий гриба поглощает питательные вещества из почвы, переносит их во внутрирадикальный мицелий корня хозяина и обменивает на углерод от хозяина (Bücking, Kafle, 2015; Bücking et al., 2016).
Грибы АМ теоретически не обладают специфичностью установления симбиотических отношений с растениями, но на практике есть различия по эффективности взаимодействия между различными видами, сортами и изолятами макро- и микросимбионтов (Mycorrhizal…, 2002; Smith, Read, 2008). Также отмечено, что выделенные из различных биотопов штаммы грибов АМ, применяемые на растениях совместно, способны лучше осваиваться в новых условиях и повышать продуктивность инокулированных растений, особенно в стрессовых условиях (Martínez-García et al., 2015).
Лук Allium cepa L. – одна из основных овощных культур, активно используется в пищевой промышленности и современной медицине (Борисенкова, 1993; Водянова, Алпысбаева, 2004). Зеленые листья лука являются источником минеральных элементов, попадающих в организм человека в виде ионов в сбалансированных концентрациях. Почва и другие многофакторные условия, сопровождающие процесс роста лука, влияют на его минеральный состав (Голубкина и др., 2009; Голубкина и др., 2015). Биохимический состав, как луковиц, так и его зеленых листьев в разные периоды роста изменяется в зависимости от сорта, экологических и агротехнических условий возделывания растений (Ананьина, Глухова, 1988; Kielak et al., 2006; Дудченко, 2009). Новые сорта и гибриды должны обладать ранним созреванием, высокой урожайностью, устойчивостью к болезням, хорошей сохранностью и небольшой изменчивостью морфологических признаков при концентрации сухих веществ в луковицах 710 % для салатных сортов и 1118 % для острых (Nemtinov, Bondar, 2006).
Лук содержит витамины А, В1, В2, С, никотиновую и пантотеновую кислоты, является богатым источником диетических флавоноидов, а так же F, P, Са, Fe, Al, Cu, Zn, Mn. Лук обладает высокой антиоксидантной активностью, содержит эндогенные метаболиты, имеющие защитные эффекты против развития сердечно-сосудистых и неврологических заболеваний, рака и др., которые вызваны окислительным стрессом (Upadhyay, 2016; Miri, Roughani, 2018; Asemani et al., 2019).
Среди различных растений представители рода Allium обладают повышенной чувствительностью к наличию в почве микоризы в связи с особенностями развития корней (Deressa, Schenk, 2008; Mengel, Kirkby, 2011; Карузо и др., 2018). Многочисленные исследования по инокуляции растений семейства Луковых грибами АМ выявили высокую эффективность, проявляющуюся в повышении продуктивности растений, как в обычных условиях, так и при воздействии стрессовых факторов (Jaime et al., 2008; Balandnazar, 2009; Galvan et al., 2011). В условиях чернозема южного таких исследований еще не проводили.
Цель настоящих исследований – выявление эффективных изолятов арбускулярно-микоризных грибов для повышения продуктивности и качества лука.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. Два сортообразца Allium cepa селекции ФГБУН «НИИСХ Крыма» селекционная линия 11А (желтой окраски) и сорт Ялтинский Плюс фиолетовой окраски, ассоциации грибов АМ S1-4 (использовали как референтный, эталон), 1-16, М-9, М-14.
Вегетационный опыт проводили в пластиковых сосудах объемом 0,5 л (Методические…, 1981; Лабутова, 2000). Субстратом была стерильная смесь песка и вермикулита (1:1 по объему) с добавлением ортофосфата кальция (1 г на кг субстрата), полив осуществляли питательным раствором Прянишникова. Семена высевали по 25 штук на сосуд. Инокулюм грибов АМ с нагрузкой не менее чем 20 колонизирующих единиц на семя вносили на 1 см глубже уровня семян. Растения выращивались в условиях искусственного освещения 20 кЛюкс с фотопериодом 16/8 часов (день/ночь). Оценку микоризации и влияния на морфометрические данные растений проводили через 80 суток после получения всходов. Повторность пятикратная.
Полевой опыт. Почвы экспериментальной и производственной базы ФГБУН «НИИСХ Крыма» представлены южным карбонатным черноземом. Агрохимические характеристики почвенного слоя 20 см до выращивания растений лука были следующими: содержание гумуса по Тюрину – 5,4 %, реакция рН 8,1, минерального азота N-NO3 – 6,3 мг/100 г почвы, содержание подвижного фосфора P2O5 (по Мачигину) – 18,4 мг/100 г почвы, содержание обменного калия К2О (по Мачигину) – 73,0 мг/100 г почвы. Растения лука выращивались на чистых (фоновых) почвах.
Инокулюм грибов АМ с нагрузкой не менее чем 20 колонизирующих единиц на семя вносили в борозды до посева семян. Семена высевались 15 марта в два ряда, с расстоянием 68 см вдоль рядов, которые были размещены 40 см друг от друга и 80 см между смежными рядами. Размещение делянок рендомизированное в 3-х повторениях, площадь каждой делянки 2,04 м2.
Лук выращивали на орошении с помощью системы капельного полива с поддержанием 70 % влажности от полной влагоемкости почвы. Под посадку лука вносили минеральные удобрения из расчета кг/га по действующему веществу: N 80, P2O5 120 и К2О 45 под зяблевую вспашку и N 80, P2O5 60 и К2О 20 при подкормках во время вегетации через систему капельного полива. Луковицы убирали при созревании, когда у 50 % растений наблюдалось полегание пера, при этом листья подсыхали.
Погодные условия. Температура и значения осадков, выраженные в виде среднего показателя, были следующими: в 3-й декаде марта +4,5 С, в апреле максимальная температура в пределах 15,425,6 С при минимальных показателях от 0,0 до –1,1 С и средней 17,5 °С, осадков в мае 13 мм при 17,3 °С; в июне 70 мм при 23,3 °С и 20,7 мм в июле при 22,7 °С.
Лабораторные и статистические анализы. Для визуализации развития микоризы отрезки корней лука окрашивали черными чернилами (Vierheilig et al., 1998). Оценка микоризации проводилась под стереомикроскопом количественно по методике Травло (Trouvelot et al., 1986). Содержания сухого вещества в луковицах определяли по ГОСТу (33977-2016), общих сахаров и аскорбиновой кислоты: по Ермакову (Методы…, 1987). Математическая обработка данных проводилась по Доспехову (1985) с использованием пакета программ Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование влияния инокуляции ассоциациями грибов АМ лука репчатого сорта Ялтинский плюс на установление симбиоза и эффективность взаимодействия показало, что новые выделенные в 2016 году ассоциации обладают сравнимой с ассоциацией-референтом Funneliformis mosseae S1-4 встречаемостью и интенсивностью микоризной колонизации (МК) в пределах 70,785,9 % и 44,757,2 %/см корня соответственно (рис. 1). При этом ассоциация М-9 значительно превосходит референт по обилию арбускул на 13,3 %, а 1-16 – по обилию везикул на 13,3 % все остальные варианты. Так как субстрат и семена растений были стерильны, в контроле без обработки микоризы не образовалось. Также не выявлено МК при внесении ассоциаций М-3, М-10 и М-13, которые далее не оценивались.
Измерение воздушно-сухой массы корней показало значительное увеличение во всех вариантах с ассоциациями грибов АМ по сравнению с неинокулированным контролем на 6,59,6 мг (50,674,8 %) (рис. 2). Сухая масса побегов лука в вариантах с грибами АМ S1-4, 1-16 и М-9 имела существенную прибавку 38,865,8 % (11,719,7 мг/растение). Растениям лука из-за их относительно редкой неразветвленной корневой системы с минимальными количеством корневых волосков (Miri, Roughani, 2018) очень необходим симбиоз с АМ. Микоризация способствовала увеличению массы корней при обработке исследуемыми ассоциациями, что является преимуществом при создании накопительной культуры на основе растений лука.
Ассоциация 1-16 была использована нами для оценки влияния внесения арбускулярно-микоризных грибов на хозяйственно ценные показатели лука репчатого в условиях полевого опыта по существенно большему накоплению везикул за период времени 80 суток от всходов семян растения-накопителя по сравнению с другими ассоциациями.
Исследование в полевом опыте в фазу начала формирования луковицы выявило наличие МК во всех вариантах с частотой встречаемости МК 65,283,9 % и интенсивностью МК 30,441,7 %/см корня (рис. 3). При этом значительные изменения выявлены только у лука линии 11А, где с внесением ассоциации грибов АМ 1-16 повысилась частота встречаемости МК на 17,5 % по сравнению с необработанным контролем. Также отмечено, что сорт Ялтинский плюс в условиях этого года лучше микоризовался относительно второго исследуемого сорта, согласно данных по интенсивности МК и обилию арбускул.
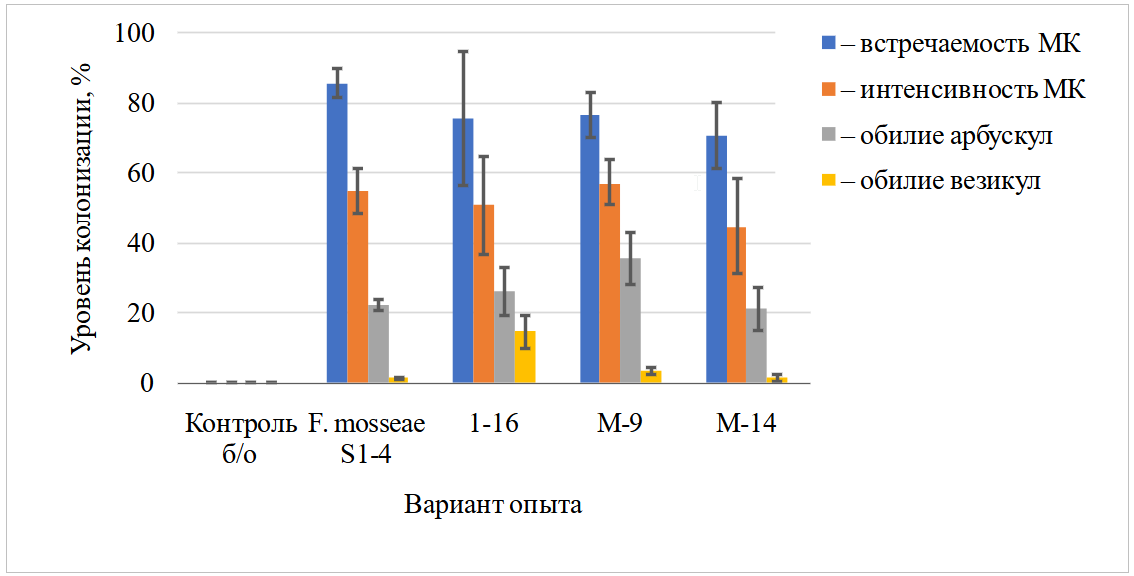
Рис. 1. Влияние обработки новыми ассоциациями грибов АМ на колонизацию корней Allium cepа (вегетационный опыт, стерильный песок + вермикулит)
МК – микоризная колонизация.
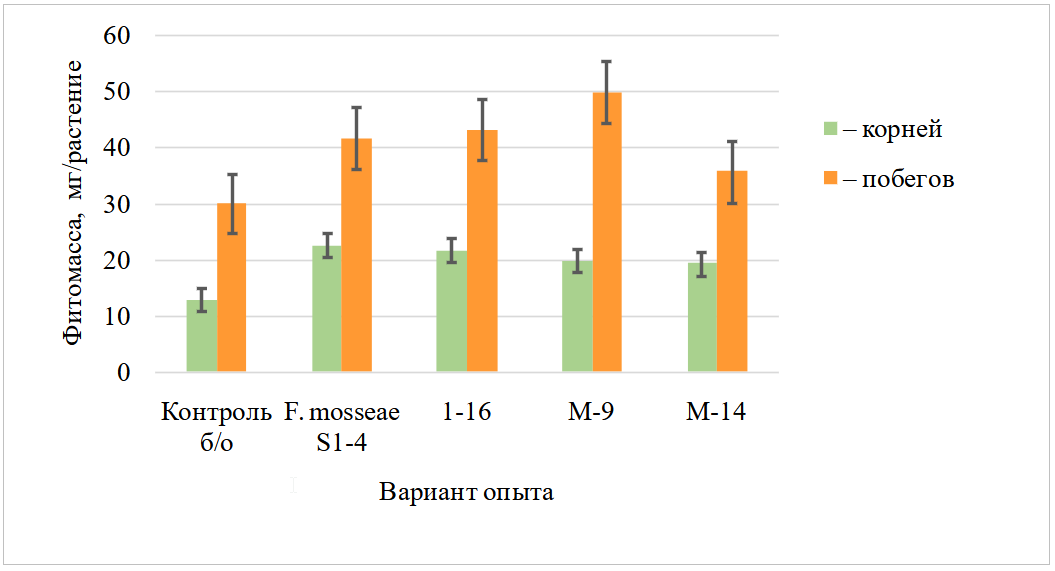
Рис. 2. Влияние обработки новыми ассоциациями грибов АМ на массу корней и побегов Allium cepa (вегетационный опыт, стерильный песок + вермикулит)
Внесение ассоциации 1-16 способствовало получению прибавки как надземной массы побегов A. cepa в фазу начала формирования луковицы («лук на перо»), так и при сборе урожая (табл. 1). В целом, у обоих сортов повышалась высота побегов на 3,355,16
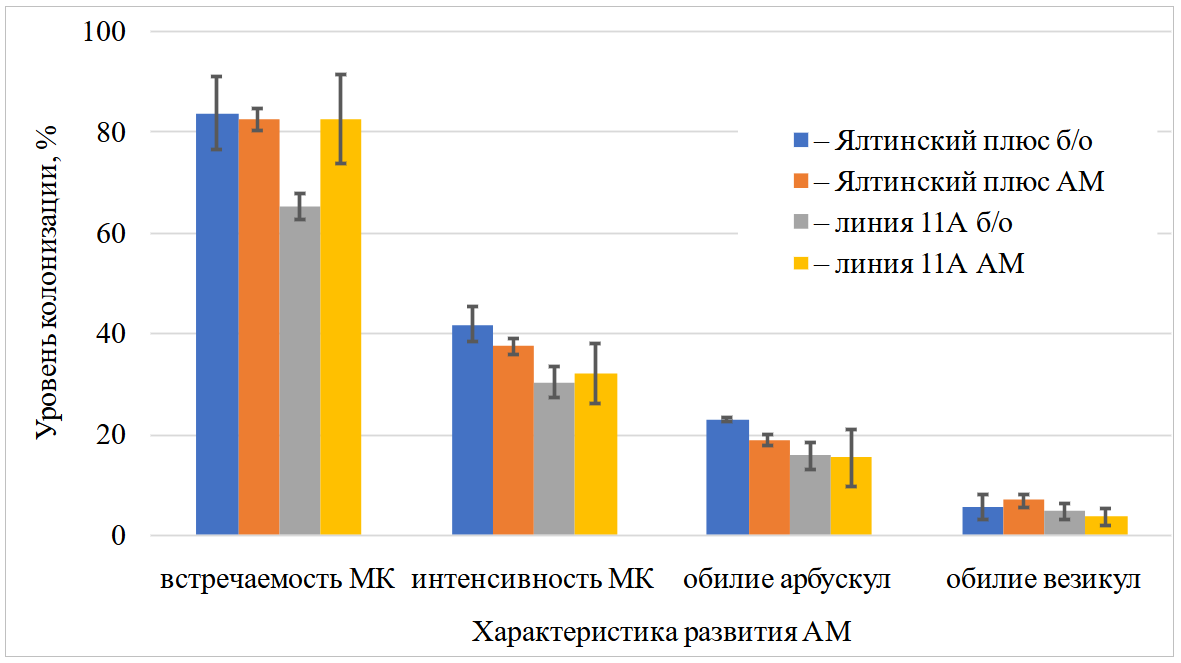
Рис. 3. Уровень микоризной колонизации лука репчатого разных сортов при внесении ассоциации грибов АМ 1-16 (фаза начала формирования луковицы, полевой опыт, чернозем южный карбонатный, 2019)
АМ ассоциация АМ грибов; б/о без обработки, МК – микоризная колонизация.
Таблица 1
Влияние обработки ассоциацией грибов АМ 1-16 на продуктивность растений лука репчатого (фаза начала формирования луковицы, полевой опыт, чернозем южный карбонатный, 2019 год)
|
Вариант опыта |
Ялтинский плюс |
Линия 11А |
||
|
Высота побегов, см/растение |
Сырая/сухая фитомасса, г/растение |
Высота побегов, см/растение |
Сырая/сухая фитомасса, г/растение |
|
|
Контроль без обработки |
47,93 |
45,27/1,55 |
50,52 |
44,97/2,21 |
|
Внесение АМ грибов |
53,09 |
61,68/2,35 |
53,87 |
54,94/2,90 |
|
НСР05 |
3,74 |
12,12/0,58 |
3,13 |
8,52/0,60 |
см/растение (6,610,8 %), сырая фитомасса на 9,9716,14 г/растение (22,236,3 %), сухая фитомасса на 0,690,8 г/растение (31,351,7 %).
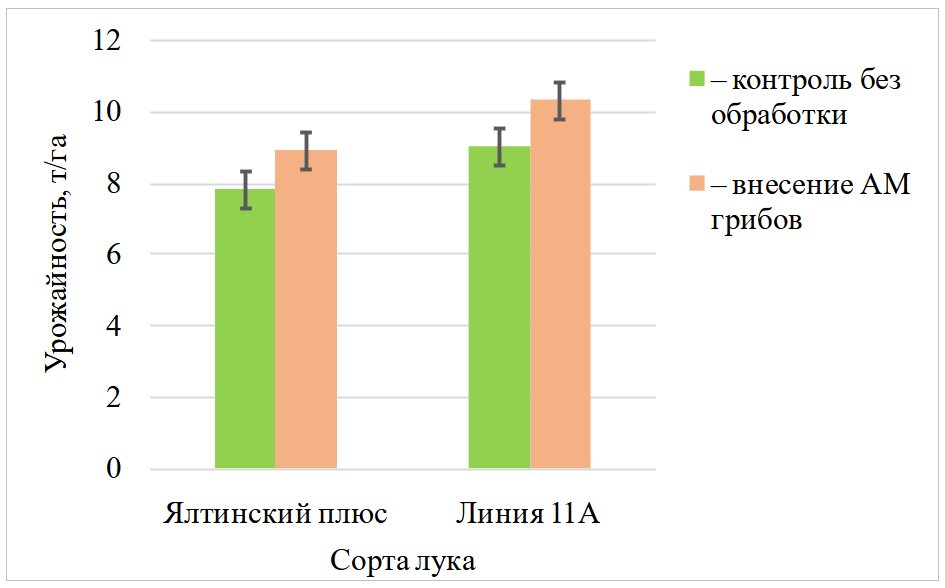
Урожайность лука увеличилась в результате внесения ассоциации грибов АМ по двум сортам: у Ялтинского плюс на 1,1 т/га (14,1 %), линии 11 А на 1,3 т/га (14,9 %) (рис. 4).
Анализ полученных луковиц по среднему диаметру и высоте, индексу их формы, количеству и толщине в них сочных чешуй и количеству зачатков выявлял незначительные тенденции либо к увеличению либо к снижению показателей по сравнению с контролем. Стоит отдельно остановиться на некоторых показателях биохимического состава собранных луковиц, отраженных в таблице 2. Сорта имели разную реакцию на эти показатели. Содержание сухого вещества хоть и не значительно, но уменьшилось у сорта Ялтинский плюс на 0,55 %, а у линии 11А, наоборот, возросло на 1,40 % при внесении грибов АМ. Содержание общих сахаров имело противоположные значения: повышалось на 0,45 % при внесении микоризных грибов под сорт с фиолетовой окраской и существенно снижалось у другого на0,94 %. При этом растения обоих сортов, инокулированные микросимбионтами, аккумулировали значительно больше аскорбиновой кислоты в луковицах на 18,524,4 %
Рис. 4. Влияние ассоциации 1-16 на урожайность лука репчатого различных сортов
(фаза спелости, полевой опыт, чернозем южный карбонатный, 2019 год)
Таблица 2
Влияние обработки ассоциацией грибов АМ 1-16 на содержание сахаров и аскорбиновой кислоты в луковицах (фаза спелости, полевой опыт, чернозем южный карбонатный, 2019 год)
|
Вариант опыта |
Ялтинский плюс |
Линия 11А |
||||
|
Сухое вещество, % |
Содержание общих сахаров, % |
Содержание аскорбиновой кислоты, мг/100 г |
Сухое вещество, % |
Содержание общих сахаров, % |
Содержание аскорбиновой кислоты, мг/100 г |
|
|
Контроль без обработки |
9,25 |
8,43 |
6,85 |
10,05 |
9,49 |
8,80 |
|
Внесение АМ грибов |
8,70 |
8,88 |
8,12 |
11,45 |
8,55 |
10,95 |
|
НСР05 |
0,76 |
1,00 |
0,90 |
1,70 |
0,67 |
0,65 |
(1,272,15 мг/100 г). Следовательно повышалась пищевая ценность лука по этому показателю. Некоторые исследователи не получили изменений от внесения Glomus intraradices BEG140 в содержании аскорбиновой кислоты в луке, объясняя это малой общей концентрацией этого вещества (Mollavali et al., 2015). Однако, L. Nedorost и R. Pokluda (2012) проводя исследования влияния штаммов G. mosseae BEG95 и G. intraradices BEG140 на томатах выявили значительное увеличение уровня витамина С при солевом стрессе, которое отсутствовало в нормальных условиях.
ЗАКЛЮЧЕНИЕ
Определено, что ассоциации грибов АМ активно колонизируют корни лука репчатого и значительно превосходят референт F. mosseae S1-4: М-9 – по обилию арбускул на 13,3 %,
1-16 – по обилию везикул на 13,3 %. При этом сухая масса корней увеличивается на 50,674,8 % (6,59,6 мг) по сравнению с контролем. Ассоциация 1-16 выбрана для дальнейших исследований по способности образовывать большее количество везикул по сравнению с другими исследованными ассоциациями.
Показано положительное влияние ассоциации грибов АМ 1-16 на накопление фитомассы в фазу начала формирования луковицы и урожайность лука репчатого сортов Ялтинский плюс и линия 11А с прибавкой 0,69–0,8 г/растение (31,351,7 %) и 1,11,3 т/га (14,114,9 %) соответственно в отличие от необработанного контроля. Установлено увеличение содержания аскорбиновой кислоты в луковицах обоих сортов лука при внесении АМГ на 1,272,15 мг/100 г (18,524,4 %) к варианту без обработки. Интенсивность микоризации при этом оставалась на уровне контроля.
Работа выполнена в рамках государственного задания № 0834-2019-0006.
REFERENCES
Ананьина М. Н., Глухова В. М. Особенности химического состава различных структур частей луковицы Allium cepa L. // Научно-техн. бюл. ВНИИ растениеводства им. Н. И. Вавилова. – 1988. – Вып. 180. – С. 50–57.
Борисенкова Л. С. Лук и чеснок. – СПб, 1993. – 54 с.
Водянова, О. С., Алпысбаева В. О. Репчатый лук. – Алматы: Изд-во Алейрон, 2004. – 40 с.
Голубкина Н. А., Надежкин С. М., Агафонов А. Ф. Содержание железа, марганца, цинка и меди в луке репчатом коллекции ВНИИССОК // Вестник Ульяновской государственной сельхозакадемии. – 2015. – № 3. – С. 11–16.
Голубкина Н. А., Агафонов А. Ф., Дудченко Н. С. Содержание микроэлементов в многолетних луках // Гавриш. – 2009. – № 5. – С. 18–21.
Доспехов Б. А. Методика полевого опыта. – М.: Агропромиздат, 1985. – 352 с.
Дудченко Н. С. Разработка элементов технологии для селекции на повышенное накопление химических элементов в овощной продукции многолетних луков: автореф. дисс. на соискание научн. степени канд. с.-х. наук: спец. 06.01.05 «Селекция и семеноводство сельскохозяйственных растений». – М., 2009. – 27 с.
Дудченко Н. С., Голубкина Н. А., Агафонов А. Ф. Содержание микроэлементов в многолетних луках // Гавриш. – 2009. – № 5. – С. 18–21.
Карузо Д., Голубкина Н. А., Середин Т. М., Селлитто В. Л. Использование арбускулярных микоризных грибов при выращивании луковых культур // Овощи России. – 2018. – Вып. 3 (41). – С. 93–98.
Лабутова Н. М. Методы исследования арбускулярных микоризных грибов. – СПб.: Инновационный центр защиты растений ВИЗР, 2000. – 24 с.
Методические рекомендации для курсов повышения квалификации научных сотрудников по сельскохозяйственной микробиологии. – Л., 1981. – 48 с.
Методы биохимического исследования растений [Ред. А. И. Ермакова]. – Л.: Агропромиздат, 1987. – 430с.
Продукты переработки фруктов и овощей. Методы определения общего содержания сухих веществ: ГОСТ 33977-2016. – [Введен 2016.10.25]. – М.: Стандартинформ, 2017. – 11 с.
Asemani Y., Zamani N., Bayat M., Amirghofran Z. Allium vegetables for possible future of cancer treatment // Phytotherapy Research.2019. P. 1–21.
Bolandnazar S. The effect of mycorrhizal fungi on onion (Allium cepa L.) growth and yield under three irrigation intervals at field condition // Journal of Food, Agriculture and Environment. 2009. Vol. 7 (2). P. 360–362.
Brundrett M. C. Mycorrhizal associations and other means of nutrition of vascular plants: understanding the global diversity of host plants by resolving conflicting information and developing reliable means of diagnosis // Plant and Soil. – 2009. – Vol. 320. – P. 37–77.
Bücking H., Kafle A. Role of Arbuscular Mycorrhizal Fungi in the Nitrogen Uptake of Plants // Current Knowledge and Research Gaps Agronomy. 2015. Vol. 5. P. 587–612.
Bücking H., Mensah J. A., Fellbaum C. R. Common mycorrhizal networks and their effect on the bargaining power of the fungal partner in the arbuscular mycorrhizal symbiosis // Сommunicative & Integrative biology. 2016. Vol. 9 (1). e1107684 (4 pages).
Deressa T. G., Schenk M. K. Contribution of roots and hyphae to phosphorus up-take of mycorrhizal onion (Allium cepa L.) – a mechanistic modeling approach // Journal of Plant Nutrition and Soil Science. 2008. Vol. 171. P. 810–820.
Dreyer I., Spitz O., Kanonenberg K., Montag K., Handrich M. R., Ahmad S., Schott-Verdugo S., Navarro-Retamal C., Rubio-Meléndez M. E., Gomez-Porras J. L., Riedelsberger J., Molina-Montenegro M. A., Succurro A., Zuccaro A., Gould S. B., Bauer P., Schmitt L., Gohlke H. Nutrient exchange in arbuscular mycorrhizal symbiosis from a thermodynamic point of view // New Phytologist. 2019. Vol. 222. P. 1043–1053.
Galvân G. A., Kuyper T. W., Burger K. Genetic analysis of the interaction between Allium species and arbuscular mycorrhizal fungi // Theoretical and Applied Genetics. 2011. Vol. 122 (5). P. 947–960.
Harrison M. J., Dewbre G.R., Liu J. A phosphate transporter from Medicago truncatula involved in the acquisition of phosphate released by arbuscular mycorrhizal fungi // Plant Cell. – 2002. – Vol. 14. – P. 2413–2429.
Jaime M. D. L. A., Hsiang T., Mcdonald M. R. Effects of Glomus intraradices and onion cultivar on Allium white rot development in organic soils in Ontario // Canadian Journal of Plant Pathology. 2008. Vol. 30. P. 543–553.
Jiang Y. Wang W., Xie Q., Liu N., Liu L., Wang D., Zhang X., Yang C., Chen X., Tang D., Wang E. Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi // Science. 2017. Vol. 356. P. 1172–1175.
Keymer A., Pimprikar P., Wewer V., Huber C., Brands M., Bucerius S. L., Delaux P. M., Klingl V., Röpenack-Lahaye E., Wang T. L., Eisenreich W., Dörmann P., Parniske M., Gutjahr C. Lipid transfer from plants to arbuscular mycorrhiza fungi // eLife.29107. – 2017. – Vol. 6.
Kielak E., Grzegorzewska M., Gawronska H. Levels of abscisic acid in onion during storage and bulb storability as influenced by weather conditions during growing season and bulb maturity at harvest // Vegetable crops research bulletin. Research inst. of vegetable crops. 2006. Vol. 64. P. 51–65.
Martínez-García L. B., Ochoa-Hueso R., Manrique E., Pugnaire F. I. Different mycorrhizal fungal strains determine plant community response to nitrogen and water availability // Journal of Plant Nutrition and Soil Science. 2015. Vol. 78 (1). P. 146–154.
Mengel K., Kirkby E. A. Review: Beneficial Effects of the Mycorrhizal Fungi for Plant Growth // Journal of Applied Environmental and Biological Sciences. 2011. Vol. 1 (9). P. 310–319.
Miri S. M., Roughani A. Allium species growing in Iran: Chemical compositions and pharmacological activity // Conference: The First National Congress and International Fair of Medicinal Plants and Strategies for Persian Medicine that Affect Diabetes. Mashhad, 2018.
Mollavali M., Bolandnazar S., Nazemieh H., Zare F., Aliasgharzad N. The effect of mycorrhizal fungi on antioxidant activity of various cultivars of onion (Allium cepa L) // International Journal of Biosciences. 2015. Vol. 6 (1). P. 66–79.
Mycorrhizal Technology in agriculture: from genes to bioproducts. Ed. by Gianinazzi S., Schupp H., Barea J. M., Hasalwandter K. Bazel: Springer, 2002. 296 р.
Nedorost L., Pokluda R. Effects of arbuscular mycorrhizal fungi on tomato yield and nutrient uptake under different fertilization levels // Acta universitatis agriculturae et silviculturae mendelianae brunensis. 2012. Vol. LX (8). P. 181–186.
Nemtinov V., Bondar A. Yaltinskyi Mestnyi old onion variety with therapentic properties // Vegetable Crops Research Bulletin. Poland, 2006. Vol. 64. P. 201–205.
Schüßler A., Schwarzott D., Walker C. A new fungal phylum, the Glomeromycota: phylogeny and evolution // Mycology. – 2001. – Vol. 105. – P. 1413–1297.
Smith S. E., Read D. J. Mycorrhizal symbiosis [3d ed.]. London: Academic Press, 2008. 815 р.
Trouvelot A., Kough J. L., Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methodes d’estimation ayant une signification fonctionnelle // Physiological and genetical aspects of mycorrhizae (eds. Gianinazzi-Pearson V., Gianinazzi S.). 1986. P. 217–221.
Upadhyay R. K. Nutraceutical, pharmaceutical and therapeutic uses of Allium cepa: A review // International Journal of Green Pharmacy. 2016. Vol. 10 (1). P. 46–64.
Vierheilig H., Coughlan A. P., Wyss U., Piché Y. Ink and Vinegar, a Simple Staining Technique for Arbuscular-Mycorrhizal Fungi // Applied and Environmental Microbiology American Society for Microbiology. 1998. Vol. 64 (12). P. 5004–5007.